Альдегиды.
реклама

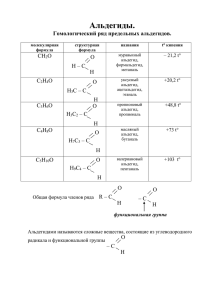
Альдегиды Альдегиды - карбонильные соединения, в которых углеродный атом карбонильной группы связан с водородом и углеводородным радикалом R (в формальдегиде R = H). Гомологический ряд СnН2n –СОН,n>0 Н-СОН - метаналь (муравьиный альдегид) СН3–СОН - этаналь (уксусный альдегид) С2Н5-СОН – пропаналь (пропионовый альдегид) С3Н7-СОН – бутаналь (масляный альдегид) С4Н9–СОН – пентаналь (валериановый альдегид) С5Н11-СОН – гексаналь (капроновый альдегид) С6Н13-СОН – гептаналь (энантовый) С7Н15-СОН – октаналь С8Н17-СОН – нональ С9Н19-СОН – деканаль Изомерия и номенклатура Структурно любой альдегид можно изобразить таким образом, что изомерию, обусловленную положением альдегидной группы в углеродной цепи, можно представить как изомерию углеводородного радикала.Тривиальные названия альдегидов повторяют тривиальные названия карбоновых кислот. По правилам ИЮПАК у альдегидов к названию углеводородного радикала необходимо добавить на конце суффикс аль. Изомерия углеродного скелета CH3-CH2–CH2-CH2-COH СН3-СН2-СН-СОН I СН3 СН3-СН-СН2-СОН I СН3 пентаналь 2-метилбутаналь 3-метилбутаналь Изомерия с кетонами СН3-СН2-СОН СН3-С-СН3 II О пропаналь пропанон (диметилкетон,ацетон) Физические свойства Температуры кипения альдегидов значительно меньше температур кипения спиртов, но больше, чем у углеводородов, если сравнивать вещества с одинаковым числом углеродных атомов. Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8-12 атомов «С»,-душистые вещества. Альдегиды с 1-3 атомами «С» хорошо растворяются в воде; с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях. Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему. Химические свойства 1. Реакции присоединения а)гидрирование НСОН+Н-Н СН3ОН (Метанол) б)присоединение спиртов (с образованием полуацеталей) СН3СОН+С 2Н5ОН СН3СОН(ОС2Н5)Н 1-этоксиэтанол-1 в)присоединение гидросульфата натрия СН3СОН+NaHSO3CH3CSO3NaHOH этаналя гидросульфатное производное 2.Реакции окисления а)взаимодействие с аммиачным раствором оксида серебра(I)- «реакция серебряного зеркала» CH3COH+Ag2OCH3COOH+2Ag этаналь этановая кислота б)взаимодействие с гидроксидом меди (II) C2H5COH+2Cu(OH)2C2H5COOH+Cu2O+2H 2O пропаналь пропановая кислота Получение 1.Общие методы получения а)дегидрированием первичных спиртов: C2H5OHCH 3COH+H2 б)окислением первичных спиртов: 2CH3OH+O22HCOH+2H2O в)гидролиз дигалогеналканов CH3CHCl2+H2OCH 3COH+2HCl 2.Специфические методы получения а)каталитическое окисление метана: CH4+O2HCOH+H2O б)реакцией Кучерова: C2H2+H2OCH3COH Применение Формальдегид применяется для дубления кож, протравливания семян. Ацетальдегид используется для получения уксусной кислоты, уксусноэтилового эфира. Бензальдегид находит применение при синтезе красителей. При действии на альдегиды алкоголятов алюминия в неводной среде происходит как бы их диспропорционирование на спирт и кислоту, которые сразу же дают сложный эфир. Такую же реакцию окислениявосстановления претерпевает формальдегид щелочной среде (реакция Канниццаро): в результате получаются метиловый спирт и муравьинокислый калий.Формальдегид легко полимеризуется с образованием циклических и линейных полимеров. Так, полиформальдегид при обычных температурах не растворяется ни в одном растворителе и применяется для изготовления синтетического волокна и разнообразных изделий (труб, листов и т.д.). В водных растворах формальдегид образует полимер, называемый полиформом. Наибольшее значение в промышленности приобрели реакции поликонденсации формальдегида с мочевиной с образованием карбамидных смол и с фенолом с образованием фенолформальдегидных смол. Смесь фенола и формальдегида в присутствии катализатора нагревается в стальном реакторе. После окончания реакции воду отгоняют, а жидкая смола поступает для литья из нее различных изделий.