Карбоновые кислоты. Сложные эфиры
реклама
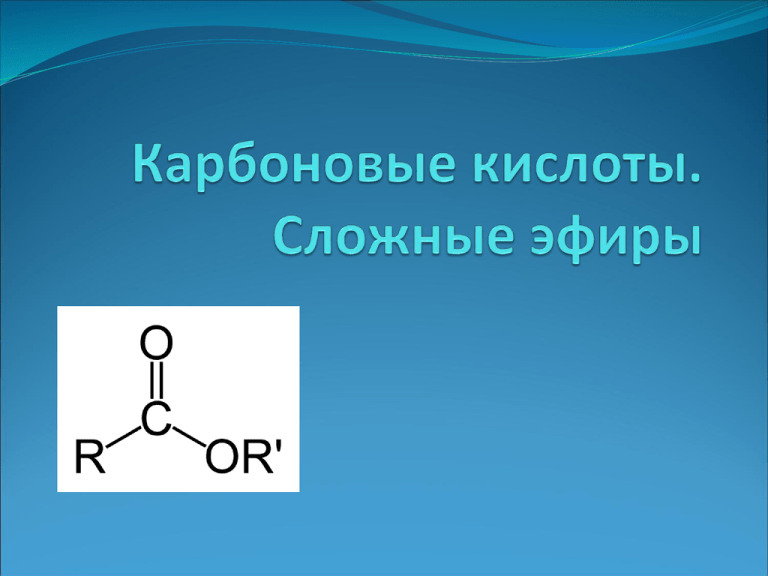
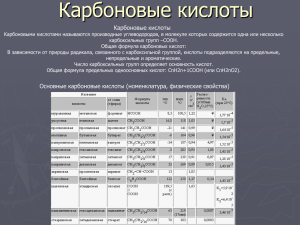
Карбоновые кислоты Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75×10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые. Кислотными свойствами могут обладать некоторые другие классы органических соединений, например фенолы. Тривиальные названия Муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, валериановая кислота, капроновая кислота, пальмитиновая кислота, стеариновая кислота, акриловая кислота, олеиновая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, адипиновая кислота, лимонная кислота, яблочная кислота, винная кислота, молочная кислота. Классификация В зависимости от радикала, связанного с карбоксилом, различают алифатические (предельные и непредельные), алициклические, ароматические и гетероциклические карбоновые кислоты. По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, NH2 и др.) образуются окси-, кето, аминокислоты и другие классы соединений. Физические свойства Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота. Характерные химические реакции Наиболее важные химические свойства, характерные для большинства карбоновых кислот: 1) Карбоновые кислоты при реакции с металлами или их осно́вными гидроксидами дают соли соответствующих металлов: Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например: 2) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации): 3) При нагревании аммонийных солей карбоновых кислот образуются их амиды: 4) Под действием карбоновые кислоты превращаются в соответствующие хлорангидриды. Сложные эфиры Сложные эфиры — производные оксокислот (как карбоновых так и минеральных) RkE(=O)l(OH)m, (l ≠ 0), формально являющиеся продуктами замещения атомов водородагидроксилов -OH кислотной функции на углеводородный остаток (алифатический, алкенильный, ароматический или гетероароматический); рассматриваются также как ацилпроизводные спиртов. В номенклатуре IUPAC к сложным эфирам относят также ацилпроизводные халькогенидных аналогов спиртов (тиолов, селенолов и теллуролов). Отличаются от простых эфиров, в которых два углеводородных радикала соединены атомом кислорода (R1O-R2). Сложные эфиры карбоновых кислот В случае эфиров карбоновых кислот выделяются два класса сложных эфиров: собственно сложные эфиры карбоновых кислот общей формулы R1-COO-R2, где R1 и R2 — углеводородные радикалы. ортоэфиры карбоновых кислот общей формулы R1-C(OR2)3, где R1 и R2 — углеводородные радикалы. Ортоэфиры карбоновых кислот являются функциональными аналогами кеталей и ацеталей общей формулы R-C(OR')2-R" — продуктов присоединения спиртов к карбонильной группе кетонов или альдегидов. Циклические сложные эфиры оксикислот называются лактонами и выделяются в отдельную группу соединений. Сложные эфиры минеральных кислот Бораты Нитраты Нитроглицерин Нитроцеллюлоза Нитриты Получение Основные методы получения сложных эфиров: Этерификация — взаимодействие кислот и спиртов в условиях кислотного катализа, например получение этилацетата из уксусной кислоты и этилового спирта:СН3COOH + C2H5OH = СН3COOC2H5 + H2OЧастным случаем реакции этерификации является реакция переэтерификации сложных эфиров спиртами, карбоновыми кислотами или другими сложными эфирами:R'COOR'' + R'''OH = R'COOR''' + R''OHR'COOR'' + R'''COOH = R'''COOR'' + R'COOHR'COOR'' + R'''COOR'''' = R'COOR'''' + R'''COOR'‘ Реакции этерификации и переэтерификации обратимы, сдвиг равновесия в сторону образования целевых продуктов достигается удалением одного из продуктов из реакционной смеси (чаще всего — отгонкой более летучих спирта, эфира, кислоты или воды; в последнем случае при относительно низких температурах кипения исходных веществ используется отгонка воды в составе азеотропных смесей). взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например получение этилацетата из уксусного ангидрида и этилового спирта:(CH3CO)2O + 2 C2H5OH = 2 СН3COOC2H5 + H2O взаимодействие солей кислот с алкилгалогенидами RCOOMe + R'Hal = RCOOR' + MeHal Присоединение спиртов к алкенам в условиях кислотного катализа (в том числе и кислотами Льюиса):RCOOH + R'CH=CHR'' = RCOOCHR'CH2R'' Алкоголиз нитрилов в присутствии кислот:RCN + H+ RC+=NHRC+=NH + R’OH RC(OR')=N+H2RC(OR')=N+H2 + H2O RCOOR' + +NH4 Применение и свойства. Эфиры муравьиной кислоты Эфиры муравьиной кислоты HCOOCH3 — метилформиат, tкип = 32 °C; растворитель жиров, минеральных и растительных масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида. HCOOC2H5 — этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E. HCOOCH2CH(CH3)2 — изобутилформиат несколько напоминает запах ягод малины. HCOOCH2CH2CH(CH3)2 — изоамилформиат (изопентилформиат) растворитель смол и нитроцеллюлозы. HCOOCH2C6H5 — бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как растворитель лаков и красителей. HCOOCH2CH2C6H5 — 2-фенилэтилформиат имеет запах хризантем. Эфиры уксусной кислоты CH3COOCH3 — метилацетат, tкип = 58 °C; по растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель, однако он обладает большей токсичностью, чем ацетон. CH3COOC2H5 — этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести). CH3COOC3H7 — н-пропилацетат, tкип = 102 °C; по растворяющей способности подобен этилацетату. CH3COOCH(CH3)2 — изопропилацетат, tкип = 88 °C; по растворяющим свойствам занимает промежуточное положение между этил- и пропилацетатом. CH3COOC5H11 — н-амилацетат (н-пентилацетат), tкип = 148 °C; напоминает по запаху грушу, применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат. CH3COOCH2CH2CH(CH3)2 — изоамилацетат (изопентилацетат), используется как компонент грушовой и банановой эссенции. CH3COOC8H17 — н-октилацетат имеет запах апельсинов. Эфиры масляной кислоты Эфиры масляной кислоты C3H7COOCH3 — метилбутират, tкип = 102,5 °C; по запаху напоминает ранет. C3H7COOC2H5 — этилбутират, tкип = 121,5 °C; имеет характерный запах ананасов. C3H7COOC4H9 — бутилбутират, tкип = 166,4 °C; C3H7COOC5H11 — н-амилбутират (нпентилбутират) и C3H7COOCH2CH2CH(CH3)2 — изоамилбутират (изопентилбутират) имеют запах груш, а также служат растворителями в лаках для ногтей. Применение в медицине сложных эфиров В конце XIX — начале XX века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами. Список литературы http://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0% B1%D0%BE%D0%BD%D0%BE%D0%B2%D1%8B%D0%B5_%D 0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B http://ru.wikipedia.org/wiki/%D0%A1%D0%BB%D0%BE%D0% B6%D0%BD%D1%8B%D0%B5_%D1%8D%D1%84%D0%B8%D1 %80%D1%8B http://ru.wikipedia.org/wiki/%D0%9C%D1%83%D1%80%D0%B 0%D0%B2%D1%8C%D0%B8%D0%BD%D0%B0%D1%8F_%D0 %BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0 http://ru.wikipedia.org/wiki/%D0%A3%D0%BA%D1%81%D1%8 3%D1%81%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1% 81%D0%BB%D0%BE%D1%82%D0%B0 http://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D1%81%D0% BB%D1%8F%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1 %81%D0%BB%D0%BE%D1%82%D0%B0