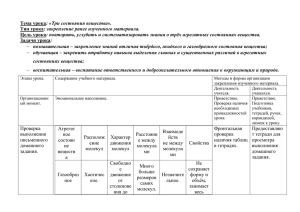
АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА ФИЗИЧЕСКАЯ ХИМИЯ. ЛЕКЦИЯ 1.
реклама

АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА ФИЗИЧЕСКАЯ ХИМИЯ. ЛЕКЦИЯ 1. СТРУКТУРА КУРСА ФИЗИЧЕСКОЙ ХИМИИ RAR0571 Füüsikaline keemia 6 EAP 4-0-1, экзамен 64 часа лекций, 16 часов упражнений классные контрольные работы домашние работы RAR0572 Füüsikaline keemia – praktikum, 3 EAP, в неделю, всего 32 часа, зачет (без оценки) 2 Лекция 1. Згуро А.А. 07.05.2016 2 часа ПРЕДМЕТ ФИЗИЧЕСКОЙ ХИМИИ Физическая химия – наука, которая изучает взаимосвязи химических процессов и физических явлений, которые их сопровождают; устанавливает закономерности между химическим составом, строением вещества и его свойствами; исследует механизм и скорость химических реакций в зависимости от условий их протекания. Физическая химия изучает химические свойства веществ на основе физических свойств составляющих их атомов и молекул. 3 Лекция 1. Згуро А.А. 07.05.2016 ОБЪЕКТЫ ИЗУЧЕНИЯ ФИЗИЧЕСКОЙ ХИМИИ Объектами изучения физической химии являются любые системы, в которых могут протекать химические превращения. Основная задача физической химии – изучить и объяснить закономерности протекания химических процессов, определить их направленность, изучить влияние на них среды, примесей, а также условия получения максимального выхода продуктов. Теоретической основой физической химии являются общие законы физики. 4 Лекция 1. Згуро А.А. 07.05.2016 ОСНОВНЫЕ РАЗДЕЛЫ ФИЗИЧЕСКОЙ ХИМИИ ТЕРМОДИНАМИКА – изучает вопросы энергетики химических процессов, определяет условия протекания химических реакций и равновесных состояний, которых они достигают СТАТИСТИЧЕСКАЯ МЕХАНИКА – изучает свойства и поведение макроскопических физических тел, состоящих из большого числа частиц (атомов, молекул, ионов, электронов и др.) К таким телам или системам относятся газы, жидкости, твердые тела, плазма, полимеры КВАНТОВАЯ ХИМИЯ – раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействия и превращения в химических реакциях рассматриваются на основе представлений и с помощью методов квантовой механики. КИНЕТИКА – изучает механизмы химических превращений и влияние на них и на скорость превращения внутренних и внешних параметров 5 Лекция 1. Згуро А.А. 07.05.2016 СОДЕРЖАНИЕ КУРСА Учение об агрегатных состояниях вещества Химическая термодинамика Учение о растворах Электрохимия Химическая кинетика Коллоидная химия 6 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.1 Введение Агрегатное состояние вещества – форма существования вещества, зависящая от расстояния между частицами и взаимодействия между ними. Газообразное, жидкое, твердое, плазма Для любого вещества – одна форма газообразного состояния и одна форма жидкого состояния Твердому состоянию вещества могут отвечать несколько форм (модификаций), отличающихся по строению и свойствам – полиморфизм. Полиморфные состояния простых веществ называются аллотропными модификациями. 7 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.1 Введение Фазовый переход – переход вещества из одного агрегатного состояния в другое Ж-Г парообразование (испарение) Т-Г возгонка (сублимация) Г-Ж сжижение (конденсация) твердое и жидкое Г-Т десублимация (конденсация) состояние - конденсированное Т-Ж плавление Ж-Т отвердевание (замерзание) Фазовые переходы сопровождаются поглощением или выделением теплоты 8 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества 1.2.1. Основные понятия Газ – агрегатное состояние вещества, в котором составляющие его частицы (атомы, молекулы, ионы) не связаны или связаны очень слабо силами взаимодействия, движутся свободно, заполняя весь предоставленный им объем. Основные характеристики газов: 9 имеют низкую плотность, т.к. частицы далеко отстоят друг от друга не имеют ни собственной формы, ни собственного объема; они полностью заполняют сосуд, в котором находятся, и принимают его форму легко сжимаются. Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Идеальный газ: частицы газа (атомы, молекулы, ионы) принимаются за материальные точки (т.е. не имеют объема) между частицами отсутствуют силы взаимного притяжения (межмолекулярные силы) взаимодействие между молекулами сводится к абсолютно упругим ударам (т.е. ударам, при которых кинетическая энергия полностью переносится с одного объекта на другой) Реальный газ: частицы газа (атомы, молекулы, ионы) имеют объем частицы газа связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между частицами соударения между молекулами не являются абсолютно упругими Реальный газ похож на идеальный при сильном разрежении и при обычных температурах 10 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества 1.2.2. Газовые законы Состояние газа полностью характеризуется его температурой, давлением, объемом, массой и молярной массой. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) – соотношение, связывающее между собой значения давления, объема и температуры: Газ, подчиняющийся этому закону, называется идеальным. 11 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Закон Бойля-Мариотта pV = const, при Т= const и m=const При постоянной температуре и массе объем газа обратно пропорционален его давлению Закон описывает изотермический процесс 12 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Закон Гей-Люссака V/T = const при p= const и m=const Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре Закон описывает изобарный процесс 13 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Закон Шарля p/T = const Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре Закон описывает изохорный процесс 14 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Уравнение Клапейрона или объединенный газовый закон pV/T = const Объединяет три предыдущих частных закона Дает возможность менять более одной переменной за один раз 15 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Закон Бойля-Мариотта pV = const Закон Гей-Люссака – Шарля V/T = const Закон Шарля p/T = const Уравнение Клапейрона или объединенный газовый закон pV/T = const 16 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества 1.2.3. Смеси идеальных газов Подчиняются тем же законам, что и чистые газы Компоненты смеси – газы, составляющие смесь Парциальное (частичное) давление компонента смеси – это то давление, которое оказывал бы данный компонент, если бы он один занимал весь объем при температуре смеси (т.е. при отсутствии других компонентов газа) Закон Дальтона: сумма парциальных давлений компонентов равна общему давлению смеси газов , 17 следовательно Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества 1.2.4. Кинетическая теория газов Молекулярно-кинетическая теория (МКТ). Р. Клаузиус Основные положения: Молекулы – материальные точки с определенной массой. Размеры молекул ничтожно малы по сравнению с расстоянием между ними. Молекулы газа находятся в состоянии непрерывного и беспорядочного движения. Между столкновениями они движутся прямолинейно. Движение равновероятно по всем направлениям. Между молекулами нет ни сил притяжения, ни сил отталкивания. При столкновении молекулы ведут себя, как упругие шары. Средняя кинетическая энергия газа пропорциональна его температуре. Скорости молекул могут быть любыми: от 0 до ∞. 18 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Основное уравнение МКТ Выражает связь давления газа со средней кинетической энергией поступательного движения молекул Мерой кинетической энергии молекул идеального газа является абсолютная температура. Кинетическая энергия молекулы газа прямо пропорциональна температуре: - постоянная Больцмана, Газы, находящиеся при одинаковой температуре, обладают одинаковой кинетической энергией молекул. 19 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Средняя квадратичная скорость молекул при данной температуре При постоянной температуре сумма энергий молекул постоянна, но энергии различных молекул неодинаковы и непрерывно изменяются. Распределение молекул газа по скоростям (энергиям)подчиняется закону Максвелла Чем выше температура, тем больше средняя скорость молекул, но при этом число молекул, имеющих среднюю скорость, уменьшается, а распределение молекул по скоростям становится более широким. Чем тяжелее молекула, тем медленнее она движется: молекулы водорода (н.у.) – 1840 м/с молекулы кислорода (н.у.) – 480 м/с атомы ртути (пары, н.у.) – 170 м/с 20 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Идеальные газы обладают одинаковым мольным объемом. При н. у. = 22,4140 При других температурах и давлениях эта величина будет другой! 21 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества 1.2.5. Реальные газы Не подчиняются законам идеальных газов. Основными причинами отклонений являются взаимное притяжение молекул газа и наличие у них собственного объема Характеристикой отклонений может служить мольный объем 22 Газ Мольный объем при 0°С и 1 атм, л H₂ 22,43 He 22,43 N₂ 22,40 CH₄ 22,36 CO₂ 22,26 SO₂ 22,89 C₄H₁₀ 21,50 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Отклонения газа от идеального состояния характеризуется фактором сжимаемости Для идеального газа z=1 При низких давлениях реальные газы могут быть более сжимаемыми (z<1), чем идеальный газ, а при высоких – менее (z>1). Зависимость фактора сжимаемости некоторых газов от давления при 298К 23 Зависимость фактора сжимаемости азота от давления при разных температурах Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Реальные газы не подчиняются уравнению Менделеева –Клапейрона. Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) для одного моля для n молей а – учитывает межмолекулярные взаимодействия; b – учитывает собственный объем молекул. Коэффициенты а и b для разных газов различны, поэтому уравнение Ван-дер-Ваальса не является универсальным. При низких давлениях и высоких температурах уравнение Ван-дерВаальса переходит в уравнение состояния идеального газа. 24 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Уравнение Диттеричи Вириальное уравнение или уравнение с вириальными коэффициентами B, C, D и т.д. – второй, третий, четвертый и т.д. вириальные коэффициенты. Они зависят от природы газа, температуры и вычисляются из экспериментальных значений p,V, T. В большинстве случаев используют уравнение только со вторым вириальным коэффициентом. 25 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества Наибольшее применение в технологических расчетах получило уравнение состояния реальных газов где z – коэффициент сжимаемости газа 26 Лекция 1. Згуро А.А. 07.05.2016 1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества При значительном разрежении к газам хорошо применимы законы идеальных газов, но некоторые свойства газов при этом существенно меняются. Например, с разрежением газа увеличивается длина свободного пробега молекул, в результате сильно уменьшается теплопроводность газов. Это явление используется в термосах, сосудах Дьюара. При высоких давлениях (1000 атм и выше) средние расстояния между молекулами становятся соизмеримыми с собственными размерами молекул, и по различным свойствам газ становится похож на жидкость. При высоких температурах в газе образуются свободные атомы, радикалы и ионы. При очень высоких температурах газ переходит в состояние плазмы. 27 Лекция 1. Згуро А.А. 07.05.2016