Внутренняя энергия идеального газа
реклама

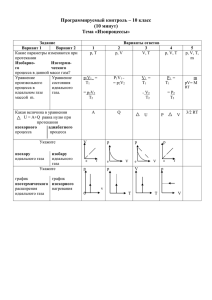
ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ. Термодинамика – это раздел физики, в котором изучаются общие свойства макроскопических систем, находящихся в состоянии теплового равновесия, и процессы перехода между этими состояниями. Основная задача термодинамикиопределение состояния термодинамической системы, которое задается параметрами состояния – совокупностью физических величин – давлением, объемом и температурой. Внутренняя энергия термодинамической системы U – энергия хаотического теплового движения микрочастиц системы ( молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия частиц. Внутренняя энергия – однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает определенной внутренней энергией ( она не зависит от того, как система пришла в данное состояние). Внутренняя энергия зависит только от термодинамической температуры. 2 Определение: Число степеней свободы – число независимых параметров, полностью определяющих положение молекул. Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия. kT i 2 y x z 3m U моль RT 2 Внутренняя энергия одноатомного идеального газа для произвольной массы Двухатомный газ – это газ, который состоит из двух жестко связанных атомов. Молекулы двухатомного газа при движении совершают поступательное и вращательное движения, которые происходят вокруг двух взаимно перпендикулярных осей. y x z 5m U моль RT 2 Внутренняя энергия двухатомного идеального газа для произвольной массы Многоатомный газ – это газ, в котором молекулы содержат три или больше атомов Внутренняя энергия многоатомного газа в два раза больше, чем у одноатомного при той же температуре. Вращение молекулы вокруг трех взаимно перпендикулярных осей вносит в энергию теплового движения такой же вклад, как поступательное движение молекулы по трем взаимно перпендикулярным направлениям. y x z m U моль 3 RT Внутренняя энергия многоатомного идеального газа для произвольной массы Одним из способов изменения внутренней энергии является совершение механической работы. Например, вдвигая поршень в цилиндр, в котором находится газ, мы этот газ сжимаем совершаем работу), в результате чего его температура повышается, то есть увеличивается внутренняя энергия газа. Другим способом изменения внутренней энергии является теплообмен. Определение: Теплообмен – самопроизвольный необратимый процесс передачи энергии от более нагретого тела к менее нагретому без совершения работы. Теплообмен осуществляется путем теплопроводности, конвекции и температурного излучения. Определение: Конвекция – обмен энергией между движущимися неравномерно нагретыми частями газов или жидкостей. Температурное излучение – универсальный вид теплообмена, всегда наблюдающийся при наличии разности температур между любыми телами и внутри каждого тела. РАБОТА ГАЗА ПРИ ИЗОБАРНОМ ИЗМЕНЕНИИ ЕГО ОБЪЕМА Сжатый газ в процессе своего расширения может выполнять работу. Приборы и агрегаты, действия которых основано на этом свойстве, называют пневматическими. Рассмотрим цилиндр с подвижным поршнем, заполненный газом. Давление внутри цилиндра и окружающего воздуха одинаковы, поршень неподвижен. ∆l • • • • • • • • • • • • • • • • • • • S • F р• • • • • • • • • • • • • • • • • 1 F 2 Будем медленно нагревать газ в цилиндре. Газ при этом начинает изобарно расширяться ( внешнее давление остается постоянным), и поршень переместится из положения 1 в положение 2 на расстояние ∆l. При этом газ совершит работу против сил внешней силы. F pS , A Fl , или A pSl A pV , A pV2 V1 При изохорном процессе работа газа равна нулю, так как никакого изменения объема, занятого газом в этом случае не происходит. ВЫВОД: Газ выполняет работу только в процессе изменения объема, т.е. при V≠0. При расширении газа работа положительна - ∆V>0; при сжатии газа работа отрицательна- ∆V<0. Физический смысл молярной постоянной Выясним физический смысл молярной газовой постоянной R. Применяя формулу для работы газа при изобарном изменении объема, получим Aмоль pVмоль Из уравнения Клайперона – Менделеева для одного моля газа можно записать pVм ол ь1 RT1, pVм ол ь2 RT2 pVм ол ь2 Vм ол ь1 RT2 T1 , pV RT , учитывая(1), получим R Aм ол ь / T Молярная газовая постоянная численно равна работе, совершаемой одним молем идеального газа при его изобарном нагревании на 1 кельвин. Ответьте на вопросы: 1.Почему климат островов умереннее и ровнее, чем климат материков? Ответьте на вопросы: 2. Почему в пустынях температура днем поднимается очень высоко, а ночью опускается ниже нуля? Ответьте на вопросы: 3. Как изменится внутренняя энергия 240 г кислорода при охлаждении его на 100 К? Ответьте на вопросы: 4. Объясните физический смысл газовой постоянной. Ответьте на вопросы: 5. Как изменится внутренняя энергия 4 молей одноатомного идеального газа при уменьшении его температуры на 200 К?