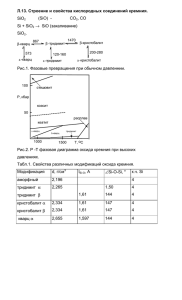
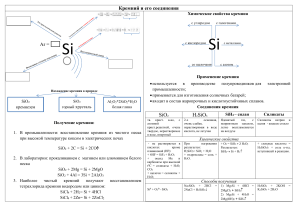
Кремний и его соединения
реклама

• 1. Обладает полупроводниковыми свойствами. • 2. Горит в кислороде: Si + O2 = SiO2+ Q • 1. В промышленности восстановлением оксида кремния (IV) углеродом: SiO2 + 2C = Si + 2CO • 2. В лаборатории порошком магния: SiO2 + 2Mg = Si + 2MgO • 1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. • 2. В воде не растворяется и с водой не реагирует. • 3. Как кислотный оксид взаимодействует с: а) щелочами SiO2 + 2NaOH = Na2SiO3 + H2O б) с основными оксидами SiO2 + CaO = CaSiO3 • 4. Вытесняет и солей летучие кислоты (реакции, лежащие в основе «варки» стекла): SiO2 + Na2CO3 = Na2SiO3 + CO2 SiO2 + CaCO3 = CaSiO3 + CO2 Кремниевая кислота H SiO 2 3 • 1. Очень слабая двухосновная нерастворимая в воде кислота состава mSiO2 * nH2O (H2SiO3) • 2. Разлагается уже при несильном нагревании: H2SiO3 = SiO2 + H2O • 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: • 4Na + 2SiO3 + 2H2O 4Na + Si2O5 +2OH 2SiO3 + 2H2O Si2O5 + 2OH Действие кислот на растворимые силикаты: Na2SiO3 + 2HCl = 2NaCl + H2SiO3 полупроводниковая и электронная техника производство Электротехника Жаропрочных и Кислоупорных сталей изоляторы из керамических материалов, используемые электростанциями и трансформаторным и подстанциями Силикатная промышленность Солнечные батареи и Si фотоэлементы Кремний Адсорбенты Оптическая SiO2 промышленность Оксид кремния (IV) Производство керамических изделий