СЕРА Работа Григорьевой Екатерины
реклама

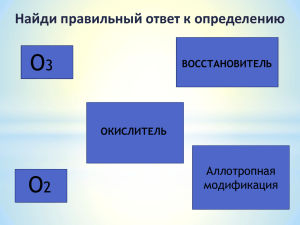
СЕРА Работа Григорьевой Екатерины Сера-пятнадцатый по химической распространённости элемент(седьмой среди неметаллов).Встречается в свободном(самородном) и связанном виде. Шестой элемент по содержанию в природных водах. . Физические свойства Сера-твёрдое кристаллическое вещество жёлтого цвета. Не проводит ток. В воде не растворяется и не тонет. Она существует в нескольких аллотропных модификациях:ромбическая (t пл=113 градуса С),моноклинная (t пл=119 градуса С) Наиболее устойчивой модификацией является ромбическая сера,молекулы которой состоят из восьми атомов , t кип=444,6 градуса С Сера в природе В природе встречается самородная сера. Сера широко распространена в природе. На серу приходится около 0,05% массы земной коры. Сера входит в состав минералов сульфидов (железный колчедан, свинцовый блеск, киновари) сульфатов (мирабилит). В организмах животных и растений имеются белки, содержащие серу. Природные модификации Самая устойчивая модификация кристаллической серыромбическая. Она присутствует в самородной сере. ПОЛУЧЕНИЕ 1.Промышленный метод-выплавление из руды с помощью водяного пара. 2.Неполное окисление сероводорода: 2H2S+O2=2S +2H2O(недостаток O2) 3.Реакция Вакенродера: 2H2S +SO2==3S+2H2O Химические свойства 1.Окислительные свойства сера проявляет при взаимодействии с металлами: 2Al+3S=Al2 S 3 (сульфид алюминия ) Hg + S=HgS (комнатная t) С водородом Н2+S=Н2S (сероводород) Химические свойства 2.Восстановительные свойства сера проявляет в реакциях с сильными окислителями: S +O =SO2 S +2H2 SO4 (конц)=3SO2 +2H2O S +6HNO3 (конц)=H2SO4 +6NO2 +2H2 O Химические свойства 3.Взаимодействие с щелочами Реакция диспропорционирования: 3S+6KOH=K2SO3 +2K2S+3H2O Химические свойства 4.Сера растворяется в концентрированном водном растворе сульфита натрия: S+Na2SO3=Na2S2O3 ( тиосульфат натрия) Применение серы 1)В борьбе с вредителями и заболеваниями растений. 2)Для вулканизации каучука. 3)В производстве сероуглерода. 4)В медицине для приготовления мазей. 5)В производстве серной кислоты 6)В производстве спичек.