Антитромботическая профилактика и терапия в
реклама

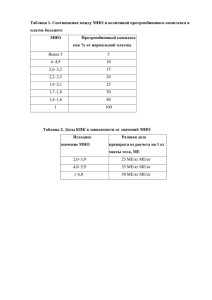
ФГБУ ННИИПК им. акад. Е.Н.Мешалкина, Новосибирск АНТИТРОМБОТИЧЕСКАЯ ПРОФИЛАКТИКА И ТЕРАПИЯ В ОНКОЛОГИИ. СОВРЕМЕННЫЕ АСПЕКТЫ. д.м.н. А.Н.Шилова Armand Trousseau was born on October 14, 1801, in Tours, France, where he studied medicine as a leading pupil of Bretonneau, who retained his lifelong mentor. During his professorship at the Hôtel Dieu in Paris Trousseau developed a reputation as an outstanding clinician and teacher. Among several “signs” he described, coagulationists especially remember him for describing “Trousseau’s phenomenon” – thrombophlebitis (phlegmasia alba dolens) reflecting gastric or visceral carcinoma. Ironecally, Truosseau experienced thrombophlebitis of the left leg in January 1867 and recognized the prognosis of his malady. He died on June 23, 1867. • Тромбоэмболизм – раннее проявление рака (синдром Труссо) • Состояние тромботической готовности выявляется у большинства онкологических больных даже при отсутствии клинических признаков тромбоза, о чем говорит персистирующее образование тромбина • Образование эндогенного тромбина и фибрина – постоянный спутник злокачественных опухолей, повышающий риск тромбоэмболий Хирургические вмешательства у больных с различными видами рака осложняются ВТЭ в 2-3 раза чаще, а смертельной ТЭЛА в 4 раза чаще, чем аналогичные операции у неонкологических больных. Современная химиотерапия опухолей, особенно в сочетании с гормональной терапией также значительно увеличивает частоту ВТЭ/ТЭЛА. Первым глобальным анализом проблемы тромбозов в онкологии было исследование FRONTLINE, проводившееся в форме анкетирования врачей. Анализ показал, что по мнению специалистов: 1) более всего из злокачественных заболеваний повышают риск ТЭО опухоли центральной нервной системы и поджелудочной железы; 2) использование ЦВК ассоциировано с высоким риском ТЭО; 3) более 50% хирургов-онкологов рутинно применяют тромбопрофилактику; 4) 1/5 части онкологов с целью профилактики назначают аспирин, хотя его эффективность при ТЭО не доказана; 5) многие специалисты являются сторонниками длительного назначения антикоагулянтнов с целью предотвращения рецидива послеоперационного тромбоза. Рак и тромбоз – комплексная связь Fundamental Research in Oncology and Thrombosis • Рак может увеличивать риск тромбоза по множеству механизмов1 – Тумор-индуцированная гиперкоагуляция, прямая и путем экспрессии тканевого фактора2 – Повреждение эндотелия – Венозный стаз, обусловленный иммобилизацией или сдавлением опухолью • Идиопатический (причина не известна) венозный тромбоэмболизм (ВТЭ) может быть признаком скрытой злокачественной опухоли3 • ВТЭ чаще рецидивируют у раковых больных, по сравнению с пациентами без злокачественной опухоли4 1Prandoni et al (1999) et al (1995) 3Prandoni et al (1992) 4Levitan et al (1999) 2Kakkar Частота выявления злокачественных новообразований у больных с венозными тромбоэмболиями Частота выявления рака в течение 2-х лет наблюдения (%) p=0.008 20 17,1 18 16 14 12 p=0.043 10 7,6 8 6 4 2 1,9 0 Вторичный венозный тромбоз (n=105) Идиопатический венозный тромбоз (n=145) Рецидивирующий венозный тромбоз (n=35) Prandoni et al (1999) Риск развития тромбоза при опухолях различной локализации Частота/10,000 больных 140 120 120 100 117 Яичники 110 Мозг 98 81 80 Пожелуд. железа 76 61 60 Лимфома Лейкоз 40 Толстая кишка 20 Легкие 0 Частота тромбозов при разной локализации опухоли Levitan et al (1999) Маркеры тромбинемии • • • • • • Фибринопептид А D-димер Фрагменты протромбина 1+2 Комплекс тромбин-антитромбин III Растворимый фибрин (РФМК) Фибрин-мономер Активация свертывающей системы крови у онкобольных Контроль (n=72) Тканевой фактор (pg/mL) 600 p=0.0006 Фактор VIIa (mU/mL) 120 500 100 400 80 300 Онкобольные (n=104) p=0.0002 РФ (мг%) TAT* (g/L) 10 17,5 p=0.0001 8 14,0 6 10,5 4 7,0 2 3,5 0 0,0 p=0.0001 60 200 40 100 20 0 0 *ТАТ = тромбин-антитромбин Kakkar et al (1995) Баркаган и др. (2001-2007) Частота фатальной ТЭЛА у оперированных больных Частота фатальной ТЭЛА(%) 1,8 1,6 1,6 p=0.05 1,4 увеличение в 4 раза 1,2 1,0 0,8 0,6 0,4 0,4 0,2 0,0 Онкобольные (n=491) Больные с другими заболеваниями (n=1585) International Multicentre Trial (1975) Rahr and Sorensen (1992) Исследование ФГБУ ННИИПК им. Е.Н. Мешалкина Изучен ряд параметров сосудистотромбоцитарного и коагуляционного гемостаза у 364 онкологических больных в возрасте от 50 до 80 лет. Среди них рак простаты был обнаружен у 172 больных, рак матки у 87, рак легкого у 57, рак молочной железы у 28, глиобластома у 20. Нормальные параметры системы гемостаза были определены при обследовании 100 практически здоровых людей. Исследование ФГБУ ННИИПК им. Е.Н. Мешалкина Было выявлено наличие персистирующей тромбинемии. Повышение растворимого фибрина у 77,5% больных. Повышение уровня D-димера у 46,2% пациентов. У 26,1% пациентов была выявлена гиперфибриногенемия, у 3,0% – тромбоцитоз. Дефицит протеина С был обнаружен у 0,8%. Повышение агрегации тромбоцитов на адреналин- и АДФ-индукторы было выявлено у 50,1% пациентов. Кроме того, было выявлено повышение ристомицин-агрегации у 15,4% пациентов, что свидетельствует об изменении антитромботического потенциала сосудистой стенки на тромбогенный. Изменения в системе гемостаза были однотипными у больных раком простаты, легкого, матки, молочной железы, мозга по исследуемым показателям. • Активация свертывания крови при раке – комплексный феномен, связанный с взаимодействием клеток опухоли с коагуляционным каскадом, клетками крови и эндотелием. • Нарушения в системе гемостаза у онкологических больных не только предопределяют развитие коагулопатических синдромов, но и существенно влияют на прогрессирование опухолевого процесса, интенсивность ангиогенеза в опухоли и на ее метастазирование. • Антитромботические средства необходимы не только для профилактики и терапии онкогенных сосудистокоагуляционных катастроф, но и для купирования или торможения самого опухолевого процесса. Антитромботические воздействия, используемые в онкологии, преследуют следующие цели: 1) предупреждение развития ВТЭ и ДВС-синдрома; 2) профилактику послеоперационных ВТЭ и ДВС-синдромов; 3) устранение побочных влияний на гемостаз лучевой и химиотерапии опухолей; 4) предупреждение рецидивов тромбоэмболий у онкобольных; 5) борьба с ангиогенезом и метастазированием опухолей путем устранения стимулирующего влияния на эти процессы активированной системы гемостаза. АНТИАГРЕГАНТЫ ПРОБЛЕМА «Аспиринорезистентность» Контроль функции тромбоцитов Современные требования к антикоагулянтам Возможность амбулаторного использования Отсутствие необходимости лабораторного контроля Отсутствие необходимости участия медперсонала Доказанная эффективность Безопасность при длительном использовании ПРЕПАРАТЫ ГЕПАРИНОВ Обычный гепарин Фракционированный гепарин (фрагмин, фраксипарин, клексан) м.м. 3.000-30.000 м.м. 3.000-7.000 Механизм действия Преимущественно анти-IIа-действие (антитромбиновое) Преимущественно анти-Xа-действие СРАВНЕНИЕ НМГ И НГ ПРЕИМУЩЕСТВА НМГ Предсказуемый клинический ответ • • • • 90% биодоступность Предсказуемая зависимость от дозы Назначение в фиксированных дозах Отсутствие необходимости лабораторного контроля • Эквивалентная или более низкая частота кровотечений • Более низкий риск гепарининдуцированной тромбоцитопении (ТИГ) – более безопасны при повторном и длительном применении Hirsch. Circulation. 1998;98:1575-1582 Соотношение анти Ха/ анти IIа активности гепаринов in vitro 200 4 3 2.5 120 2 80 1.5 Соотношение 160 1 40 A. Padilla, E. Gray, D.S. 1992 0 эноксапарин (4,3 кД) дальтепаринn (6,3 кД) тинзапарин (6,7 кД) 0 надропарин (5,2 кД) 0.5 НФГ Международные ед./мг - IU/mg 3.5 Aнти-Xa (IU/mg) Aнти-IIa (IU/mg) Соотношение Cкорость всасывания минимальных доз трех НМГ при подкожном введении КЛЕКСАН2000 МЕанти-Ха(20мг) 4 p<0,001 p<0,001 ФРАКСИПАРИН 2850МЕанти-Ха(0,3мл) ФРАГМИН 2500 МЕ анти-Ха часы 2 0 клексан фракси фрагмин Время всасывания КЛЕКСАНА при подкожном введении короче, чем у других НМГ Collignon F. et al. Thromb Haemost 1995 73(4)^630-640 Сравнение периода полувыведения трех НМГ период полувыведения (анти-Ха активность) p<0,001 4 часы p<0,001 клексан фракси фрагмин КЛЕКСАН 2000 IUанти-Ха(20мг) 2 ФРАКСИПАРИН 2850 IUанти-Ха(0,3мл) 0 клексан фракси фрагмин ФРАГМИН 2500 IU анти-Ха Период полувыведения КЛЕКСАНА больше в сравнении с фрагмином и фраксипарином Collignon F. et al. Thromb Haemost 1995 73(4)^630-640 Фармакологические преимущества Клексана • Действует 24 часа в сутки после однократной инъекции • Быстрый и предсказуемый эффект (быстрое всасывание при п/к введении) • Высокая антикоагуляционная активность без увеличения риска осложнений (анти Ха-активность выше по сравнению с надропарном, фрагмином) • Простота подбора дозы, не зависит от массы тела пациента • Эффективен при продленной профилактике Planes et al. Lancet 1996;348:224-228, Bergqvist et al. N Engl J Med 1996;335:696-700, Bergqvist В et al. N Eng J Med 2002, 346:975-980 GAZZANIGA G.M.,, International Surgery 1993; 78: 271-275, ENOXACAN Study Group, Bergqvist D., British J.of Surgery, 1997, 84, 1099-1103, Planes A et al. Thromb Haemostasis, 1988, 60(3):407-410 Как долго сохраняется риск ВТЭО в хирургии • Ретроспективный анализ всех хирургических больных в Malmö (Швеция) с ТЭЛА, обнаруженной на аутопсии Кол-во пациентов Интервал между операцией и смертью от ТЭЛА 100 90 80 70 60 50 40 30 20 10 0 <5 6–10 11–15 Bergqvist D, Lindblad B. Br J Surg. 1985;72:105-8. 16–20 21–25 26–30 Дни после операции > 30 ENOXACAN II Продленная профилактика ТГВ при хирургических вмешательствах в онкологии Клексан 40 мг п/к х 8 + 2 д Рандомизация Плацебо Клексан 40 мг п/к х 21 д Билатеральная венография (28+3д) 3-месячное динамическое наблюдение ENOXACAN II Продленная профилактика ТГВ при хирургических вмешательствах в онкологии % событий 15 10 P = 0.01 Оценка по данным венографии 12 Плацебо -60% Клексан 5 1,8 4,8 0,6 0 Все ТГВ Проксимальные ТГВ 0,6 0 ТЭЛА Применение Клексана в течение 4 недель снижает частоту ТГВ на 60 % по сравнению с краткосрочной профилактикой (1 неделя) Это соотношение сохраняется в течение 3 месяцев Bergqvist В et al. N Eng J Med 2002, 346:975-980 Продолжительность введения антикоагулянтов Умеренный риск До полной активизации пациента, но не менее 7 дней Высокий риск До полной активизации пациента При онкологических заболеваниях, ВТЭО в анамнезе Не менее 4-х недель Российские клинические рекомендации по диагностике, профилактике и лечению ВТЭО, 2009 Антикоагуляция в остром периоде ТЭЛА Антикоагулянты играют ключевую роль в лечении больных с острой ТЭЛА. Цель антикоагулянтной терапии – профилактика ранней смерти и рецидивирования клинически выраженного или фатального ВТЭ при приемлемой частоте геморрагических осложнений! Антикоагулянтная терапия Быстрая антикоагуляция может быть достигнута только при парентеральном введении антикоагулянтов: Внутривенная инфузия нефракционированного гепарина (НФГ); П/к инъекции низкомолекулярных гепаринов (НМГ); П/к инъекции фондапаринукса (5 мг для пациентов с массой тела менее 50 кг, 7,5 мг для пациентов с массой тела 50 – 100 кг, 10 мг для пациентов с массой тела более 100 кг). НМГ и фондапаринукс натрия (арикстра), разрешенные к применению для лечения острой ТЭЛА Дозировка Интервал Эноксапарин 1,0 мг/кг 1,5 мг/кг Каждые 12 часов Один раз в сутки Тинзапарин 175 Ед./кг Один раз в сутки Дальтепарин 100 МЕ/кг 200 МЕ/кг Каждые 12 часов Один раз в сутки Надропарин 86 МЕ/кг 171 МЕ/кг Каждые 12 часов Один раз в сутки Фондапаринукс натрия 5 мг (масса тела менее 50 кг) 10 мг (масса тела 50 – 100 кг) 10 мг (масса тела > 100 кг) Один раз в сутки Гепарин-индуцированная тромбоцитопения (ГИТ) - развивается у 1-5% больных - в 30% случаев осложняется рикошетными тромбозами 1.Ранняя ГИТ-1 – возникает в первые 3-4 дня применения препарата, как правило, умеренная и бессимптомная, не требует отмены гепарина, нужен более тщательный контроль за динамикой тромбоцитов. 2.Иммунная ГИТ-2 – обусловлена выработкой аутоантител к комплексу «гепарин-тромбоцитарный фактор 4», возникает на 6-14 день от начала применения гепарина, требует немедленного отказа от дальнейших введений гепарина и перехода на другие методы антитромботической терапии (арикстра, сулодексид и др.). Антикоагулянтная терапия Фондапаринукс – селективный ингибитор Xа фактора – альтернатива НФГ, НМГ при ГИТ! Период полувыведения 15 -20 часов – назначается 1 раз в сутки. Противопоказание - больные с тяжелой почечной недостаточностью ( клиренс креатинина < 20 мл/м) При клиренсе креатинина 30 -50 мл/ мин вводится половинная доза препарата. Рекомендации по длительности антикоагуяции после ТЭЛА Онкологическим пациентам назначают НМГ, как более безопасное и эффективное лечение в сравнении с варфарином, как минимум 3-6 месяцев. У пациентов с ТЭЛА и злокачественными новообразованиями следует рассмотреть возможность продленной антикоагуляции (после первых 3-6 месяцев) в течение неопределенно долгого времени, или пока новообразование не будет излечено. ОСОБЕННОСТИ ПРИМЕНЕНИЯ АНТИКОАГУЛЯНТОВ НЕПРЯМОГО ДЕЙСТВИЯ • Возможность длительного непрерывного приема для профилактики и лечения тромбозов (при обязательном лабораторном контроле) • Относительная дешевизна препаратов (в сравнении с низкомолекулярными гепаринами) • Необходимость внимательного лабораторного контроля для предотвращения кровотечений РАСЧЕТ РЕЗУЛЬТАТОВ ПРОТРОМБИНОВОГО ТЕСТА ( ПВ больного в секундах МНО = нормальное ПВ в секундах ) МИЧ МНО = Международное нормализованное отношение МИЧ = Международный индекс чувствительности Устаревший вариант ПТИ = Нормальное ПВ в секундах x 100 (%) ПВ больного в секундах ВАРФАРИН: ГЛАВНЫЙ ПОБОЧНЫЙ ЭФФЕКТ КРОВОТЕЧЕНИЕ • Факторы, которые могут вызвать риск кровотечения: - Интенсивное воздействие антикоагулянтов - Сопутствующие заболевания - Применение других препаратов - Неточное следование инструкции по применению Система протеина С (РС) РС–естественный антикоагулянт (витамин К-зависимый гликопротеин), синтезируется в печени в неактивной форме Активированный PC(APC) –сериновая протеаза Основная функция протеина С состоит в инактивации основных неферментных факторов свертывания V, VIII), а также в активации фибринолиза Дефицит протеина С • Аутосомно-доминантное наследование • 1/200 –500 • тромбозы у 2 –5% • нарушения в системе протеина С встречается у 10,6% больных раком ЖКТ Варфарин-индуцированные некрозы кожи Skinmed 2003 Medskape МЕТОДИКА ПЕРЕХОДА С ГЕПАРИНОВ НА ВАРФАРИН 1. Лечение варфарином можно начинать параллельно с гепаринотерапией. 2. В первые 4-5 дней больной должен принимать варфарин одновременно с продолжающимся введением гепарина (пик антитромботического эффекта варфарина – через 96 часов). 3. Гепарин отменяют одномоментно, когда МНО достигает необходимых терапевтических значений. АЛГОРИТМ АНТИТРОМБОТИЧЕСКОЙ ПРОФИЛАКТИКИ Фоновое исследование системы гемостаза (до операции) Назначение НМГ за 12 часов до операции, затем 1-2 раза в сутки с исследованием системы гемостаза на 9-13 день после операции Тромбинемия, нет тромбоцитопении, отсутствие возможности систематического лабораторного контроля за уровнем МНО Продолжить введение НМГ до полного купирования тромбинемии, с ежемесячным определением РФ Тромбинемия при отсутствии депрессии в системе протеина С и S, возможность систематического лабораторного контроля за уровнем МНО Назначение варфарина с подбором дозы по МНО (стандартная схема)+ ежемесячное определение РФ, до полного купирования тромбинемии Купирование тромбинемии Отмена НМГ Повышение агрегационной функции тромбоцитов Назначение антиагрегантов с 68-го дня после операции (аспирин) с контролем агрегации на 5-7-ой день от начала приема, затем ежемесячно Выявление «аспиринорезистентности» Замена препарата на другие антиагреганты Клиническое наблюдение Пациентка, 58 лет поступила в отделение реанимации ФГБУ ННИИПК им. акад. Е.Н. Мешалкина 22.11.2012г. в тяжелом состоянии. Тяжесть состояния обусловлена явлениями дыхательной и сердечной недостаточности. Клиническое наблюдение В анамнезе 23.10.12г. была выполнена операция: гистерэктомия с придатками с обеих сторон в связи с раком тела матки Т2NхM0П2. Со слов пациентки осложнений в послеоперационном периоде не было. Терапии, направленной на профилактику ВТЭ в раннем послеоперационном периоде, не получала. Через три недели после операции (с 14.11.12г.) стала отмечать болезненность по ходу вен на правой нижней конечности. 19.11.12г. поступила на лучевую терапию в радиологическое отделение городской клинической больницы №1. По данным УЗДС вен нижних конечностей выявлен острый восходящий тромбофлебит ствола большой подкожной вены (БПВ) справа. 20.11.12г. была выполнена операция тромбэктомия из общей бедренной вены (ОБВ), кросэктомия справа. В ночь с 20.11.12г. на 21.11.12г. внезапно возникла выраженная слабость, одышка в покое, головокружение. По данным МСКТА ЛА диагностирована массивная ТЭЛА. Клиническое наблюдение • Соматический статус при поступлении: температура: 36,6°С, ЧДД: 20 в мин, на инсуфляции кислорода, ЧСС: 92 в мин., Пульс: 92 уд./мин., Дефицит пульса: 0 уд./мин. АД – 120/80 мм.рт.ст. Состояние тяжелое. Телосложение правильное. Повышенного питания. Кожные покровы и слизистые бледные. Акроцианоз. Лимфатические узлы не увеличены, подвижны, безболезненны при пальпации. Перкуторно – ясный лёгочный звук, нижние границы лёгких соответствуют возрастным нормам. Дыхание жесткое, проводится во все отделы лёгких. Хрипов нет. Границы сердца не расширены. Сердечные тоны приглушены, ритмичные. Клиническое наблюдение • Status Loсalis: над лобком, по передней поверхности передней брюшной стенки поперечный послеоперационный шов длиной до 6 см, заживший первичным натяжением. Живот увеличен за счет подкожно-жировой клетчатки. При пальпации он мягкий, безболезненный. Нижний край печени безболезненный, эластической консистенции, соответствует рёберной дуге. Симптом Пастернацкого отрицательный с двух сторон. Отмечается пастозность голеней и стоп с обеих сторон с некоторым увеличением подкожной венозной сети. Клиническое наблюдение • При поступлении было проведено обследование: в общем анализе крови без патологии. При исследовании полиморфизмов генов системы гемостаза было зафиксировано носительство полиморфизмов генов F7 – GA, F13 – GT, FGB – АА, ITGA2 – СТ, SERPINE1 (PAI-1) – 4G5G. • Исследование системы гемостаза: активированное парциальное тромбопластиновое время (АПТВ) – 26,7 с (норма 29-40); протромбиновое время – 11,7 с (норма 9,812,1); тромбиновое время – 17,5 с (15-19); фибриноген – 3,6 г/л (норма 1,8-3,6); антитромбин-III – 93,1% (норма 75125); плазминоген – 154,1% (норма 75-150); протеин С – 132,6% (норма 70-140); Д-димер – 9,66 мг/л FEU (норма менее 0,5); степень агрегации на адреналин-индуктор – 55% (норма 50-70); степень агрегации на АДФ-индуктор – 38% (норма 55-70). Клиническое наблюдение • Инструментальные исследования при поступлении: • Эхокардиография от 22.11.2012г.: Расширена полость обоих предсердий, больше правого и правого желудочка (ПЖ). Сократительная способность миокарда левого желудочка не снижена. Нарушений локальной сократимости миокарда левого желудочка (ЛЖ) не выявлено. Отмечается выраженная гипертрофия миокарда ЛЖ. Уплотнение корня и стенок аорты. Митральная и трикуспидальная регургитация I степени, незначительная по объему. Расчетное давление в легочной артерии 53 мм.рт.ст. Диастолическая дисфункция миокарда ЛЖ по I типу. • Дуплексное сканирование вен правой нижней конечности от 22.11.2012г.: тромбоз лигированной большой подкожной вены. Дуплексное сканирование вен левой нижней конечности от 22.11.2012г.: окклюзионый тромбоз левой подколенной вены, икроножных синусов. Клиническое наблюдение • Инструментальные исследования при поступлении: • Рентгенография грудной клетки от 22.11.2012г. Легкие на доступных обзору участках расправлены, пневматизация их не нарушена. Застойные изменения в малом круге кровообращения от незначительных к умеренным в корнях и в прикорневых отделах легких с преобладанием сосудистого компонента. Положение диафрагмы – справа купол несколько приподнят. Свободные воздух и жидкость в плевральных полостях не выявляются. СЛК=57%. Заключение: Воспалительных изменений и объемных образований в легких не выявлено. Клиническое наблюдение • В результате обследования был выставлен диагноз: Острая массивная ТЭЛА. Умеренная легочная гипертензия. ОДН III. Артериальная гипертензия 3 ст. риск 4. ХСН II А ст. ФК III (NYHA).Острый восходящий тромбофлебит в системе БПВ справа. Состояние после операции 20.11.2012г.: Тромбэктомия из ОБВ, кросэктомия справа. Флеботромбоз подколенно – берцового сегмента слева. С-г тела матки Т2NхM0П2. Состояние после операции 23.10.2012г.: Гистерэктомия с придатками с обеих сторон. Носитель полиморфизмов генов: F7 – GA, F13 – GT, FGB – АА, ITGA2 – СТ, SERPINE1 – 4G5G. Состояние тромботической готовности. Клиническое наблюдение • В рентгеноперационной при поступлении была выполнена ангиопульмонография: справа – в устье среднедолевой артерии окклюзирующий дефект наполнения, в нижнедолевой и верхнедолевой артериях отмечаются субокклюзирующие дефекты наполнения. Слева определяются окклюзирующие дефекты наполнения в устье артерии язычкового сегмента, нижнедолевой артерии, субокклюзирующие дефекты наполнения в верхнедолевой артерии. Индекс Миллера составил 26 баллов. Прямое давление в ЛА 55/20 torr, а ПЖ 42/2 torr, в ПП 13/-6 torr при системном 156/100 torr. Затем была проведена катетерная фрагментация тромбоэмболов катетером Pigtail Schmitz-Rode, дополненная тромболитической терапией путем внутритромбального введения проурокиназы рекомбинантной (пуролазы) в дозе 2 млн. Ед. Клиническое наблюдение • Тромболитическая терапия была продолжена в условиях реанимационного отделения введением в периферическое русло пуролазы в дозе 4 млн. Ед. После завершения тромболизиса в течение 24 часов продолжалась инфузия гепарина натрия со скоростью 1000 Ед./час под контролем АПТВ. Эффективность введения гепарина натрия оценивалась по увеличению АПТВ в 1,5 – 2 раза выше нормы. • Критериями эффективности проведенного лечения считали: положительную динамику в клиническом статусе (купирование одышки, тахикардии), снижение ФК СН (NYHA), снижение давления в ЛА по данным Эхо-КГ и/или зондирования сердца, снижение индекса перфузионного дефицита (индекс Миллера). Клиническое наблюдение • На вторые сутки после оперативного лечения был назначен низкомолекулярный гепарин, на третьи сутки к терапии добавлен антикоагулянт непрямого действия – варфарин натрия под контролем международного нормализованного отношения (МНО). При достижении МНО более 2,0 надропарин кальция был отменен. • Через год после выполнения оперативного лечения по данным эхокардиографии от 20.12.13г. отмечалась нормализация уровня давления в ЛА. Сохраняется некоторое расширение полостей обоих предсердий и правого желудочка. Сократительная способность миокарда левого и правого желудочка не изменена. Давление в ЛА максимальное 27 мм.рт.ст., среднее 23 мм.рт.ст. • Варфарин натрия был отменен через 2 года после операции при нормализации уровня Д-димера. Клиническое наблюдение • В настоящее время пациентка находиться на однокомпонентной дезагрегационной терапии (ацетилсалициловая кислота 125 мг), проводится динамический контроль за показателями системы гемостаза. • Приведенный пример наглядно иллюстрирует, что применение антикоагулянтов в послеоперационном периоде у онкологических больных должно быть длительным до 1 года и более, что подчеркивается всеми экспертами по данной проблеме. Исследованиями последних лет установлено, что эффект антикоагулянтной терапии может считаться достигнутым лишь в том случае если у больного была устранена тромбинемия, то есть для определения достаточности проведенной терапии тромбозов необходимо удостовериться, что в результате предпринятых воздействий удалось устранить образование новых порций тромбина в крови пациента. Благодарю за внимание!