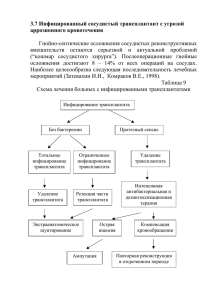
Применение метода «молекулярного микроскопа» для улучшения стратификации риска при раннем антитело-
реклама

H- 14: Острое отторжение Применение метода «молекулярного микроскопа» для улучшения стратификации риска при раннем антителоопосредованном отторжении почечного трансплантата Alexandre Loupy, Carmen Lefaucheur, Dewi Vernerey, Jessica Chang, Luis G. Hidalgo, Thibaut Beuscart, Jerome Verine, Olivier Aubert, Sébastien Dubleumortier, Jean-Paul Duong van Huyen, Xavier Jouven, Denis Glotz, Christophe Legendre and Philip F. Halloran JASN October 2014 vol. 25 no. 10 2267-2277 + Сведения о принадлежности авторов 1. * 2. ‡ 3. † 4. § 5. ‖ 6. ¶ 7. §§ 8. ** 9. †† Paris Descartes University and Hôpital Necker and Hôpital Saint Louis, Assistance Publique–Hôpitaux de Paris, Paris, France; Paris Translational Research Center for Organ Transplantation, Institut National de la Santé et de la Recherche Médicale, Unité Mixte de Recherche-S970, Paris, France; Unit 3181, University Hospital of Besançon, France; Alberta Transplant Applied Genomics Centre, Edmonton, Alberta, Canada; Department of Laboratory Medicine and Pathology and Department of Medicine, Division of Nephrology and Transplant Immunology, University of Alberta, Edmonton, Alberta, Canada; Department of Pathology, Saint Louis Hospital, Paris, France; Pateforme Centres de Resources Biologiques, Institut Gustave Roussy, Villejuif, France; and 10. ‡‡Department of Pathology, Necker Hospital, Paris, France Адрес для корреспонденции: Dr. Philip F. Halloran, Department of Medicine, University of Alberta, 250 Heritage Medical Research Center, Edmonton, AB T6G 2S2, Canada. Email: [email protected] РЕЗЮМЕ Авторы исследовали, действительно ли определение экспрессии генов в дополнение к стандартным методам может использоваться как «молекулярный микроскоп» для выявления в почках признаков антитело-опосредованного отторжения (АОО), при котором существует высокий риск нарушения функции трансплантата. Мы изучили сведения о 939 последовательно включенных в исследование реципиентов почечного трансплантата из госпиталя Неккер (Necker Hospital) (2004–2010 гг.; основная когорта) и 321 реципиента почечного трансплантата из госпиталя г. Сент-Луис (Saint Louis Hospital) (2006–2010 гг.; группа валидации) и проанализировали данные пациентов с АОО через 1 год после трансплантации. Помимо стандартных показателей, мы с помощью микрочипов оценили экспрессию генов в биоптатах почки, используя соответствующие молекулярные характеристики: молекулярную оценку АОО и эндотелиальные донор-специфические антитело-селективные транскрипты (ДСА). Основными исходами являлись потеря почечного трансплантата и прогрессирование с развитием хронического отторжения трансплантата. В основной группе было выявлено 74 пациента с АОО, а в группе валидации – 54 пациента. Традиционными признаками, независимо ассоциированными с нарушением функции, были возраст донора, а также гуморальный и гистологический балл (g+ptc+v+cg+C4d). С поправкой на стандартные показатели молекулярный балл АОО (отношение рисков [ОР] 2,22; 95% доверительный интервал [95% ДИ] 1,37-3,58; P=0,001) и эндотелиальный ДСАселективный транскрипт (ОР 3,02; 95% ДИ 1,00-9,16; P<0,05) были независимо ассоциированы с повышенным риском потери трансплантата. Результаты воспроизводились в независимой группе валидации. Включение оценки экспрессии генов в стандартную модель расчета риска улучшило стратификацию больных по риску нарушения функции трансплантата (улучшение непрерывной повторной оценки 1,01; 95% ДИ 0,57-1,46; P<0,001; улучшение интегральной разрешающей способности 0,16; P<0,001). По сравнению со стандартным анализом дополнительная оценка экспрессии генов в трансплантате почки с АОО улучшает стратификацию пациентов с высоким риском потери трансплантата. КОММЕНТАРИИ Оценка нового метода прогноза (и лечения) антетило-опосредованного отторжения (АОО) трансплантата почки. Ключевое значение биопсии трансплантированной почки заключается в диагностике отторжения (в частности, АОО), которое является ведущей причиной нарушения функции трансплантата. При АОО стандартная оценка, основанная на патогистологических изменениях, несмотря на ее клиническое использование, имеет серьезные ограничения с точки зрения точности диагностики и прогнозирования риска. Ограничения стандартных тестов могут объясняться введением методов «молекулярной биопсии», разработанных с использованием хорошо описанных когорт при терапии рака. В трансплантологии стратегии определения молекулярного профиля с помощью микрочипов оказались перспективными в качестве нового измерения биоптатов трансплантата. Файлы с результатами исследования с помощью микрочипов 126 биоптатов были обработаны с помощью Robust Multiarray Analysis в программе Bioconductor. Для описания молекулярных характеристик биоптатов использовались наборы патогенетически-обусловленных транскриптов (ПОТ), которые характеризовали биологические процессы, участвующие в патогенезе почечного воспаления и повреждения в трансплантате. Авторы использовали следующие наборы ПОТ: молекулярную оценку АОО и эндотелиальные ДСА-селективные транскрипты. В данном исследовании авторы применили систему «молекулярного микроскопа» в дополнение к стандартным клинико-гистологическим и иммунологическим показателям, чтобы оценить потенциальное влияние этого подхода на прогнозирование риска потери трансплантата и прогрессирования заболевания. Из 939 пациентов, которым трансплантация почки была выполнена в госпитале Неккер (Necker Hospital) в период с 2004 по 2010 гг., 472 больным было выполнено 583 биопсии в течение первого года после операции. Морфологически подтвержденное АОО в течение первого года было диагностировано у 101 из 939 больных, что соответствовало частоте, равной 10,7%. Их этих 101 больного с АОО 74 пациента (73,3%) имели подходящий материал для молекулярного анализа и были включены в исследование. На момент трансплантации у 68 больных из 74 (91,9%) определялись донорспецифическе антитела (ДСА): у 44 пациентов (64,7%) имелись ДСА одного типа, а у 24 (35,3%) – ДСА ≥2 типов (диапазон 2-4). Иммунодоминантная средняя интенсивность флуоресценции ДСА (DSA MFImax) была класса I у 25 из 68 больных (36,8%) и класса II у 43 из 68 пациентов (63,2%), а средняя DSA MFImax составила 5548±562. Медиана времени наблюдения после трансплантации составила 59,3 месяцев (МКР = 47-79). Молекулярная оценка АОО и эндотелиальные ДСА-селективные транскрипты достоверно коррелировали друг с другом (r=0,74, P<0,001) и транскриптами NK-клеток (естественных киллеров, r=0,84, P<0,001). Молекулярная оценка АОО коррелировала с уровнем циркулирующих ДСА на момент диагностики АОО (r=0,44, P=0,01) и с депозитами C4d в перитубулярных капиллярах (r=0,33, P=0,01). Эндотелиальные ДСАселективные транскрипты коррелировали со степенью трансплантационной гломерулопатии (cg) (r=0,24, P=0,04) и расширением мезангиального матрикса (r=0,29, P=0,04). Молекулярная оценка АОО и эндотелиальные ДСА-селективные транскрипты отражают активное ремоделирование микроциркуляции, обусловленное относительно недавним антитело-опосредованным повреждением, предполагающим действие антител и их эффекторного механизма, и, таким образом, могут быть использованы как дополнение к стандартным (патогистологическим) показателям. Это исследование подтверждает мнение, что классические критерии гистологической активности (в том числе гломеруллит, капиллярит, депозиты C4d и эндартериит), которые являются частью диагностических критериев АОО, возможно, не настолько точны, чтобы стратифицировать риск внутри нозологии. Выводы авторов: Оценка экспрессии генов при отторжении почечного трансплантата, по-видимому, полезна для идентификации пациентов с высоким риском нарушения функции трансплантата. Метод «молекулярной микроскопии» дает возможность получить более полную информацию по сравнению с классическим гистологическим подходом и позволяет стратифицировать риск, который может определять тактику клинического ведения и клинических исследований в трансплантологии. Жак Шанар (Jacques CHANARD) Профессор нефрологии