ФОРМУЛЫ физики для подготовки к ЕГЭ МКТ и ТЕРМОДИНАМИКА ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
реклама

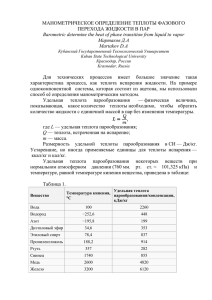
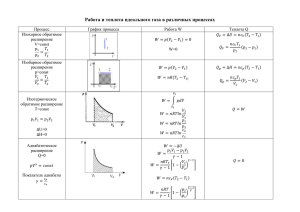
ФОРМУЛЫ физики для подготовки к ЕГЭ МКТ и ТЕРМОДИНАМИКА Формула Название формулы Физические величины ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ 𝑚 𝑁 = 𝑀 𝑁𝐴 𝑁 𝑛= 𝑉 𝜈= 𝑣⃗ = √ 𝑝= 3𝑘𝑇 3𝑅𝑇 =√ 𝑚0 𝑀 1 2 𝑚0 𝑛𝑣⃗ 2 = 𝑛𝑘𝑇 = 𝑛𝐸 3 3 1 2 𝑝 = 𝜌𝑣⃗ 3 𝑝пар 𝜌пар 𝜑= = 𝑝нас 𝜌нас 3 𝐸 = 𝑘𝑇 2 𝑃1 𝑉1 𝑃2 𝑉2 = 𝑇1 𝑇2 𝑇 = 𝑡 + 2730C 𝑃𝑉 = 𝑚 𝑅𝑇 𝑀 𝜌= 𝑚 𝑉 𝑝1 𝑉1 = 𝑝2 𝑉2 Количество вещества 𝜈 - Количество вещества (моль) n - Концентрация частиц Концентрация частиц (1/м3) 𝑣⃗ - Средняя квадратичная Средняя квадратичная скорость скорость (м/с) 𝜑 - Относительная влажность воздуха (%) 𝑉 – объем сосуда (м3) Давление идеального газа 𝑚 − масса вещества (кг) M – молярная масса Давление (кг/моль) N – количество частиц в Относительная влажность воздуха объеме вещества T – температура Средняя кинетическая энергия (К, Кельвин) поступательного движения частиц 𝑚0 - масса одной молекулы (кг) Е – энергия (Дж, Джоуль) Закон Гей-Люссака 𝑝пар - давление пара (Па, Паскаль) Связь температуры по Кельвину и 𝑝нас - Давление насыщенного пара температуры по Цельсию 𝜌нас - плотность Уравнение Менделеева-Клапейрона насыщенного пара (кг/м3) 𝑘 – постоянная Больцмана (1,38·10-23Дж/К) NA – постоянная Авогадро Плотность вещества (6·1023моль-1) R – универсальная газовая постоянная (8,31Дж/(моль·К)) Закон Бойля-Мариотта m, T = const, изотермический процесс Т › T 2 1 Р изотерма Т2 Т1 V 𝑝1 𝑝2 = 𝑇1 𝑇2 m, V = const, изохорный процесс Закон Шарля изохора V1 V2 > V1 Р V2 Т m, p = const, изобарный процесс Закон Гей-Люссака 𝑉1 𝑉2 = 𝑇1 𝑇2 изобара V р2 > р1 р1 р2 T ОСНОВЫ ТЕРМОДИНАМИКИ ±𝛥𝑈 = ±𝛥𝐴 ± 𝛥𝑄 Q = qm Q = ±λm Теплота плавления - « знак +», отвердевания (кристаллизации) «знак -» Q = ±Lm Теплота парообразования «знак +», конденсации «знак -» Количество теплоты («знак +» нагревание вещества, «знак -» охлаждение вещества) Q = ±cm∆T ±𝛥𝑈 = 3𝑚 3 3 𝑁 Внутренняя энергия («знак +» 𝑅𝑇 = 𝜈𝑅𝑇 = 𝑅𝑇 увеличивается, «знак -» 2𝑀 2 2 𝑁𝐴 𝐴 = ±𝑃Δ𝑉 = 𝜂= Первый закон термодинамики Теплота сгорания 𝑚 𝑀 𝑅𝑇 Тн − Тх 𝑄н − 𝑄х 𝐴 = = Тн 𝑄н 𝑄н 𝑄отд = 𝑄пол уменьшается) Работа («знак +» - объем уменьшается или над газом совершается работа, «знак -» - объем увеличивается или над газом совершается работа) КПД теплового двигателя Уравнение теплового баланса Q – Количество теплоты (Дж, Джоуль) U – Внутренняя энергия (Дж, Джоуль) A – Работа (Дж, Джоуль) L – удельная теплота парообразования (Дж/кг) q – удельная теплота сгорания (Дж/кг) λ - удельная теплота плавления(Дж/кг) c – удельная теплоемкость вещества (Дж/кг·К) Тн - температура нагревателя (К, Кельвин) Тх - температура холодильника (К, Кельвин) 𝑸отд – теплота, отданная одними частями системы (Дж, Джоуль) 𝑸пол – теплота, полученная другими частными системы (Дж, Джоуль)