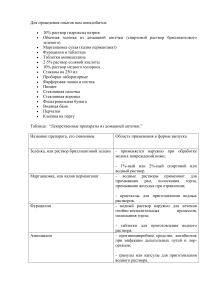
Лабораторная работа №3: Стандартизация раствора.
реклама

Лабораторная работа №3: Стандартизация раствора. Цель: стандартизировать полученный раствор кислоты по тетраборату натрия. Оборудование и реактивы: 2 колбы, бюретка, груша, 0,08н соляная кислота, аналитические весы, раствор тетрабората натрия. Экспериментальная часть: Нормальность 0,08 н. раствора кислоты устанавливают по 0,1н раствору тетрабората натрия. Для этого точную навеску( 19,068 г на 1 л) взвесили в бюксе на квадратных весах с точностью до десятичного знака. Затем бюкс перенесли на аналитические весы и взвешивают до четвертого десятичного знака. Взвесив тетраборат, осторожно пересыпали через сухую воронку с широкой и короткой трубкой в мерную колбу с сухим горлом. В колбу добавили горячей дистиллированной воды. Затем содержимое колбы осторожно перемешали плавными вращательными движениями. После того, как весь тетраборат растворился в воде, колбу охладили до комнатной температуры и довели объем полученного раствора холодной дистиллированной водой до метки. Приготовленный раствор тщательно перемешали, закрыв колбу пробкой. Взяли пипеткой по 10 мл раствора тетрабората натрия параллельно в две колбы, добавили 2-3 капли метилового оранжевого. Раствор приобретает желтую окраску. Титровали 0,08 н. раствором кислоты до появления розового окрашивания. Чтобы раствор окрасился в розовый цвет мы затратили 33,2 и 27,2мл. Провели необходимые вычисления. V1=33,2мл V2=27,2мл VA= NHCl= 33,2+27,2 2 𝑉𝐵 ∙𝑁𝐵 𝑉𝐴 = 10∙0,1 30,4 𝑁(практ)𝐻𝐶𝑙 = 30,4мл = 0,0329н 0,0329 KHCl= 𝑁 = 0,1 = 0,329 (теор)𝐻𝐶𝑙 THCl= 𝑁𝐻𝐶𝑙 ∙Э𝐻𝐶𝑙 1000 = 0,329 ∙ 36,46 1000 = 0,011995 г/мл Вывод: стандартизировали кислоту по тетраборату натрия. Вычислили нормальность и титр с учетом поправочного коэффициента полученного раствора.