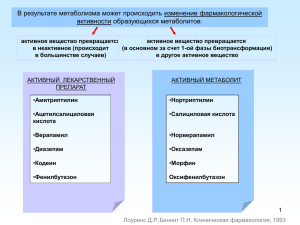
Лекарственные растения in vitro как источники
реклама

Лекарственные растения in vitro как источники фармакологически ценных вторичных метаболитов: преимущества и недостатки В настоящее время получение фармакологически ценных соединений в промышленных масштабах достигается в основном путем их экстрагирования из тканей дикорастущих и/или плантационных растений, часто относящихся к редким видам. Однако, интенсивный сбор растений в дикой природе представляет опасность для сохранения и биоразнообразия видов, а плантационное выращивание часто нерентабельно, поскольку качество получаемого сырья может существенно отличаться от дикорастущего. Отсюда возобновление источников биологически активных веществ растительного происхождения является существенной проблемой, решение которой связывают с развитием новых направлений биотехнологии и биоинженерии с использованием культуры растительных клеток и тканей. В настоящее время, приблизительно 80% населения в мире в качестве первичной медико-санитарной помощи используют фитотерапию, в соответствии с Всемирной организацией здравоохранения. Структурное многообразие и широкий спектр биологической активности вторичных метаболитов делает их незаменимой основой многих лекарственных препаратов. Это приводит к значительному давлению на многие виды диких растений. Во всем мире примерно две трети от общего числа 50,000-70,000 видов растений, используемых в лечебных целях, собраны в дикой природе, и даже в Европе только 10% видов лекарственных растений, используюемых в коммерческих целях, выращивается специально. К сожалению, ограниченное количество активных метаболитов в растении, медленные темпы роста и разрушение активных веществ при хранении, являются природными проблемами, возникающими при использовании растений для медицинских нужд. Таким образом, альтернативные и возобновляемые источники производственных систем необходимы для защиты и сохранения разнообразия растений. Последние два десятилетия характеризуются выдающимися достижениями биотехнологии, являющейся междисциплинарной областью знаний, базирующейся на микробиологии, биохимии, молекулярной биологии, биоорганической химии, биофизике, вирусологии, иммунологии, генетике, инженерных науках и электронике. Культуры клеток и тканей исследуются как потенциально более эффективные альтернативы для коммерческого производства биомассы и биологически активных веществ. В основе перспективного развития биотехнологического направления в получении веществ растительного происхождения лежат: 1. Независимость от влияния климатических, сезонных и географических условий; 2. Решение проблем дефицита исходного сырья, особенно ценных исчезающих видов растений, не поддающихся плантационному культивированию; 3. Возможно получение фитомассы, полностью свободной от гербицидов, пестицидов, тяжелых металлов и др.; 4. Использование культуры клеток для биотрансформации конечного продукта и получения новых веществ, не синтезируемых соответствующим целевым растением; 5. Управление биосинтезом конечных продуктов за счет условий культивирования, состава питательной среды и другими способами; 6. Имеется возможность индустриализации и удешевления производства некоторых БАВ, синтез которых пока не разработан или очень дорог и т.д. Перспективность новых технологий получения биомасс лекарственных растений в виде каллусных и суспензионных культур заложена в их неоспоримых преимуществах, таких как: стандартность в содержании накапливаемого продукта; сокращение сроков культивирования для накопления растительной биомассы (вместо месяцев и недель дни и часы); возможность промышленного производства биомасс экзотических тропических и субтропических лекарственных растений; использование разных технологических режимов (периодический, полунепрерывный и непрерывный), если нарастание биомассы коррелирует с синтезом вторичных метаболитов; использование методов иммобилизации и биотрансформации для повышения выхода продуктов вторичного метаболизма применительно к растительным клеткам. За 25-летний период с 1981 по 2006 гг. в общей сложности 1184 новых химических веществ было утвержден в качестве лекарственных средств, из которых 52% имеют естественное происхождение. Интересно отметить, что 52% всех противовоспалительных препаратов и 51% всех противоопухолевых препаратов до сих пор прямо или косвенно получают из природных источников. В общей сложности 24 уникальных природных продукта, открытых за последние 35 лет, выделены из почвенных микроорганизмов (79%) и растений (21%). Производство метаболитов в клеточных культурах дает возможности для оптимизации производства, независимо от климатических или экологических последствий. Во многих случаях уровень производства вторичных метаболитов в недифференцированных клеточных культурах являются очень низкими и часто вторичный метаболизм тесно связан с клеточной дифференцировкой. Кроме того, стабильность темпов синтеза в недифференцированных клеточных культурах оставляет желать лучшего. Отчасти это связано с сомаклональной изменчивость и отбором клеток в течение длительного алкалоидов пересева. винкристин и Например, винбластин производство до сих пор терпеноида не были индольных успешными в недифференцированных клеток и признается, что окончательное димеризация vindoline и catharantine требует клеточной дифференцировки. По сравнению с микроорганизмов, клетки растений больше по размеру и имеют жесткую клеточную стенку, что делает их более чувствительными в процессе культивирования в биореакторе и перемешивания. Кроме того, медленная скорость размножения клеток растений ограничивает скорость накопления продуктов. Методы повышения урожайности растений вторичных метаболитов и рекомбинантных белков, полученных по системам клеточной культуре включают скрининг и отбор высокопродуктивных линий клеток, предшественников питания, оптимизация питательной среды и выращивание параметров, выявление и иммобилизации. Однако при этом организованное на основе клеточных культур растений производство должно быть способным выдержать конкуренцию с альтернативными системами получения продукта - использованием традиционного растительного сырья. Как известно, содержание и развития организма и определяется активностью их синтеза и деградации на клеточном уровне, а также эффективностью экскреции. Процессы вторичного метаболизма характерны для дифференцированных клеток и тканей и реализуются с максимальной эффективностью при оптимальных внешних условиях в соответствии с таксономической специфичностью. Культивируемые клетки тотипотентны, поэтому любое вещество, синтезируемое в интактном растении, в принципе, можно получить и в культуре клеток. Однако в быстро растущих недифференцированных клеточных культурах синтез продуктов вторичного метаболизма, обладающих фармакологической активностью, чаще всего не происходит на характерном для интактных растений уровне. В связи с этим особенно важным является получение клеточных культур – суперпродуцентов вторичных метаболитов и оптимизация условий их культивирования. Благодаря существованию множества стратегий для увеличения производства вторичных метаболитов, культура клеток и тканей может предложить лучший синтез желаемых биологически активных продуктов лекарственных растений. Биотехнологическое производство лекарственных средств на основе растительных клеточных культур Термин «культура клеток, органов, тканей» применяется к выращиваемым в асептических условиях на искусственных питательных средах различным частям растений. К ним относят: 1. каллусные ткани на агаризованной среде; 2. суспензионные культуры клеток в жидкой среде; 3. культуры протопластов; 4. изолированные органы растений, позволяющие получать от одной меристемы сотни тысяч побегов. Как правило, вторичные вещества получают из каллусной ткани, выращенные на твердой (агаразованной) или жидкой (суспензионная культура) питательной среде. Суспензионные культуры состоят из отдельных клеток, имеющих различную форму и размеры, и неоднородных многоклеточных агрегатов. Соотношение отдельных клеток и таких агрегатов в суспензии зависит от видовой принадлежности растения и условий культивирования. Глубинное культивирование осуществляют в колбах на качалках при частоте вращения 100-120 об/мин. В лабораторных условиях используют сосуды объемом 100-250 мл с небольшим объемом питательной среды. Для синхронизации клеточных культур используют методы индукции, когда происходит остановка клеточного цикла в определенном периоде под воздействием химических (тимидин, 5-аминоурацил, оксимочевина) или физических факторов (создание условий «голодания» по одному из компонентов питательной среды). Промышленное выращивание клеточных культур и преимущества их использования Промышленное производство может эффективно работать, реализуя возможность накопления промышленного сырья путем выращивания клеток и тканей растений, используя каллусные и суспензионные культуры (помня, что суспензионные культуры получают из каллусных). Для производства биологически активных веществ (БАВ) используют каллусную ткань, которую получают твердофазной ферментацией и глубинным суспензионнным культивированием. Преимуществами каллусных культур в технологии получения растительного сырья являются надежность и стабильность по выходу биомассы и продуктов вторичного метаболизма, а также возможность использования каллусной биотрансформации. К системы серьезным применения ручного труда. для иммобилизации недостаткам следует и последующей отнести необходимость Если сравнивать преимущества каллусных и суспензионных культур между собой, то оказывается, что выход продуктов вторичного метаболизма выше у первых, но управление процессом культивирования легче осуществлять при работе со вторыми. Культуральные системы, функционирующие непрерывно, разделяют на полупроточные и проточные. При полупроточном режиме выращивания через определенные интервалы времени производится отбор части суспензии и разбавление оставшейся суспензии свежей средой. Проточный режим культивирования позволяет осуществлять непрерывное снабжение культуральной системы, свежей средой с удалением равного объема клеточной суспензии. Для синтеза вторичных метаболитов весьма существенным является внесение в питательную среду известных предшественников, стимулирующих определенные ферментативные пути метаболизма. Например, внесение фенилаланина в среду для культивирования клеток увеличивает выход диосгенина на 100%. Накопление вторичных метаболитов также зависит от температуры, рН, а при суспензионном культивировании от аэрации, перемешивания, скорости вращения сосудов, от газового состава и т.д. Таким образом, для гарантированного получения фармакологически ценных продуктов, необходимо знать генотипически-обусловленные особенности и этапы их биосинтеза и создавать наиболее благоприятные условия на стадии роста и синтеза вторичных метаболитов для каждой культуры клеток растений.