Me_pol
реклама

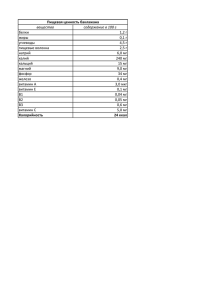
МЭ и свободно-радикальные реакции Инфекции и травмы вызывают воспалительный стресс у больных, сопровождающийся генерацией свободных радикалов кислорода. В процессе инициации цепи ПОЛ (перекисного окисления липидов) переходные металлы играют значительную роль (Cu, Zn, Mn, Со, Pb, Cr, Fe). При активации нейтрофилов и макрофагов и экзоцитозе железосодержащего белка лактоферрина происходит индукция цикла Хабер-Уейса и реакции Фентона, в которых генерируются свободные радикалы кислорода. ПОЛ и свободные радикалы имеют фундаментальное значение в биологических и иммунобиологических процессах. Доказана роль ПОЛ: 1. В процессах обновления липидов клеточных мембран, старения клеток, тканей, органов и организма. 2. В генотоксических процессах, ведущих к кумуляции соматических мутаций и повышающих риск возникновения опухолей и раннего старения. 3. Патогенетическая роль в модификации липопротеинов крови, индукции дегенеративных изменений при атеросклерозе, аутоиммунных и воспалительных заболеваниях. 4. В направляемой иммунной системой клетки элиминации чужеродных антигенов, паразитов, бактерий, вирусов и т.п., а также модифицированных эндогенных белков, нуклеиновых кислот и целых клеток. Баланс системы индукции перекисных процессов и антиоксидантных систем организма играет значительную роль в различных иммунобиологических и патогенетических процессах. В настоящее время доказана эссенциальная роль эндогенных и экзогенных антиоксидантов в предотвращении канцерогенеза, в промоции здоровья и активного долголетия [Лю и др., 1991]. Антиоксиданты весьма разнообразны по своей химической структуре, механизму действия и происхождению. Классификация антиоксидантов I. Эндогенные: 1) Ферменты: супероксиддисмутаза (СОД) — Zn, Mn-зависимая. Глутатионтрансфераза, глутатион-пероксидаза (6 изоформ, включая Se-зависимую), церулоплазмин («экстрацеллюлярная СОД» — Cu-содержащий белок), супероксиддисмутазная активность цитохромов [Лю, 1991], каталаза (Fe-содержащий фермент). 2) Метаболиты: глутатион — GSH, глутатионовый цикл клетки, убихинон Q10. II. Экзогенные: 1) Витамины и провитамины: Р, β-каротины, витамин А, ретиноиды, α-токоферол (витамин Е), филлохинон (витамин К), аскорбиновая кислота (витамин С), рутин. 2) Антиоксиданты растительного и животного происхождения: растительные вещества: кверцетин, полифенольные соединения (адаптогены), катехины, хлорофиллы, пигментные комплексы, гликозиды, эфирные масла, биофлавоноиды; животные вещества: церебролизин, актовегин. 3) Кофакторы антиоксидантов: рибофлавин, пантотеновая кислота, омега-3полиненасыщенные жирные кислоты из рыбопродуктов. 4) Микроэлементы: селен, цинк, кобальт, марганец. 5) Лекарственные препараты: с антиоксидантами: галаскорбин (10% мазь на ланолине и пероральная форма), применяется для лечения лучевых энтеритов, гепатитов, лучевых циститов, лучевых трофических язв; биоселен, Витамин Е, МагнеВ6, биомагний; поливитаминные препараты: поливитаминные и полимикроэлементные комплексы, многочисленные зарубежные и отечественные поливитаминные препараты: ундевит, гендевит, ревит, аэвит, алликор, эссенциале, кальция панганат, кверцетин, жидкий экстракт водяного перца (содержит рутин, кверцетин и флавоноиды), аскорутин, декамевит, каратолин, липостабил, облепиховое масло, плоды рябины, шиповника, черной смородины и др.; невитаминные препараты: цитохром С, сок подорожника (флавоноиды), карнитина хлорид, катерген, эмоксипин, ацетил-цистеин; адаптогены (индукторы синтеза эндогенных антиоксидантов): экстракт элеутерококка, настойка китайского лимонника, сапарал, пантокрин, рантарин, настойка родиолы розовой; Использование антиоксидантов предусмотрено рекомендациями Европейского общества по диагностике и лечению обструктивных заболеваний легких [Siafakas et al., 1995], но следует отметить, что эта терапия не решила проблемы бронхиальной астмы, назначается она в межприступном периоде. Витамин Е обладает также иммунокорригирующим действием [Плецитий, 1995]. Он подавляет генерацию антиген-неспецифических и антиген-специфических супрессоров, что ведет к стимуляции клеточного и гуморального иммунных ответов. Комплексное применение витамина Е и лизоцима при затяжном течении шигеллеза оказывает положительный эффект на функцию макрофагов и поэтому, патогенетически оправдано [Ющук и др.,,-1992]. Препараты растительного (кокосовое, арахисовое, кукурузное масла) и животного (церебролизин) происхождения с высоким содержанием ганглиозидов также подавляют ПОЛ. Московским научно-исследовательским институтом онкологии им. П.А. Герцена разработан препарат «Лапрот», который проходит в настоящее время первую фазу клинических испытаний по разрешению Фармакологического комитета России. Это препарат на основе лактофсррииа женского молока, предназначенный для купирования токсикозов различного генеза. Обладает антиоксидантными, детоксицирующнми (сорбирует ионы тяжелых металлов) и противовоспалительными свойствами. Проявляет бактериостатический эффект в отношении ряда грам-отрицательных и грамположительных микроорганизмов. Применяется в виде растворов для внутривенных инъекций. Очевидно, что в будущем будет открыты и иммуномодулирующие свойства лапрота. Различные МЭ (Cu, Zn, Co, Сr) обладают сложным действием на ПОЛ. Металлы могут не только инициировать цепь реакций ПОЛ, но и обрывать ее. Этот эффект дозозависим [Барабой и др., 1991]. МЭ, как отмечалось выше, способны индуцировать синтез микросомальных ферментов — изоформ цитохрома Р-450, играющего важнейшую роль в элиминации из организма путем гидроксилирования и экскреции, различных ксенобиотиков. Число изоформ Р-450 очень велико, ввиду того, что в молекуле этого фермента, подобно иммуноглобулинам, находятся константные и вариабельные участки [Арчаков, 1982]. Такая гетерогенность позволяет организму адаптироваться к поступлению постоянно изменяющихся экзогенных ксенобиотиков. Усилия многих лабораторий сосредоточены в настоящее время на изучение вопроса регуляции экспрессии изоформ Р-450 с избирательным их синтезом под действием различных пищевых веществ (каротиноиды, Cr, Zn, Fe, фитосубстанции и т.д.). Например, сок грейпфрута увеличивает поглощение лекарственных препаратов (блокаторов кальциевых каналов, иммунодепрессантов, седативных средств и препаратов против СПИДа на основе ингибиторов протеаз) путем индукции изоформы CYP3A4, которая присутствует в печени и тонком кишечнике и ответственна за модификацию лекарственных препаратов в организме [Erbpr, 1998]. Результаты исследований показывают, что потребление сока грейпфрута позволяет выравнивать содержание CYP3A4 у разных индивидуумов и стандартизовать дозовый прием лекарственных препаратов. Интересны исследования влияния дефицита селена (Se) на активность ферментов печени, участвующих в метаболизме ксенобиотиков. Селен не вызывал изменения активности цитозольных ферментов (каталазы, СОД, лактат-дегидрогеназы). Наблюдалось значительное снижение активности Se-зависимой GSH-пероксидазы с компенсаторным усилением экспрессии Se-независимой глутатион-З-трансферазы, значительно возрастала активность микросомальной эпоксидгидролазы, роль которой очень важна в инактивации реактивных эпоксидных метаболитов. Дефицит селена вызывал увеличение концентрации эндогенных хинонов, которые конъюгируются УДФ-глюкуронилтрансферазой или сульфотрансферазой. Активность последних также возрастала в Se-дефицитных моделях [Сатра, 1999; Olsson et al., 1993; Medina, Morrison, 1988; Arthur et al., 1980; Reddy et al., 1982]. Интересно, что низкий уровень потребления селена у людей связан с повышенным риском развития раковых опухолей в различных тканях. Однако, в экспериментальных моделях опухолей, индуцированных химическими или вирусными агентами, дефицит селена не был связан с высокой частотой опухолей. Результаты исследований в клеточных моделях показывают, что селен защищает клетки от вирусов-онкогенов и химических канцерогенов. При этом, именно нормальный уровень селена способен защитить клетку, не влияя на уровень экспрессии микросомальных энзимов, а повышенное потребление МЭ не оказывает протективное действие, стимулируя экспрессию микросомальных ферментов. Таким образом, именно адекватный физиологический уровень эндогенного селена способствует антиканцерогенензу. Многоцентровые, плацебо-контролируемые исследования этой проблемы позволят верифицировать и уточнить роль селена в антиоксидантных механизмах [Olsson et al., 1993]. Данная схема показывает роль физиологического порога нормальной концентрации селена в организме. Очевидно, низкое потребление Se людьми не означает его полное отсутствие в рационе. Этих микроконцентраций Se достаточно для сохранения активности микросомальных ферментов, но недостаточно для реализации антиоксидантных функций на уровне цитоплазматических мембран, что вызывает увеличение частоты опухолей. Более значительная нехватка селена вызывает изменение активности ферментов микросом с компенсаторным усилением синтеза Se-независимых антиоксидантных ферментов, что не способствует возрастанию частоты возникновения опухолей, так как происходит повышенная элиминация канцерогенов. Избыток селена активирует Se-зависимые и, как предполагается, угнетает Se-независимые микросомальные ферменты. Так как Seнезависимая глутатион-З-трансфераза участвует в элиминации более широкого спектра ксенобиотиков, то возможно даже увеличение частоты опухолей. Эти данные дискутабельны и требуют дальнейших исследований. В частности, опухоли являются «ловушкой» антиоксидантов. Однако, накопление этих веществ в опухолевых клетках связано не только с формированием протекгивных механизмов в отношении свободно-радикальных интермедиатов иммунной системы, но и с повышенной элиминацией антиоксидантов под действием микросомальных ферментов, что способствует, в конечном счете, к истощению антиоксидантного фонда организма и иммунодепрессии [Лю, 1991]. Автор свободнорадикальной теории старения Д. Хартман назвал антиоксиданты «мощными геропротекторами». Витамин Е Поскольку витамин Е не синтезируется в организме, его поступление (не менее 30 ME в сутки) с пищей является облигатным. Наиболее богаты витамином: клевер, салат, шпинат, петрушка, зародыши пшеницы, соевое, арахисовое, хлопковое, кукурузное и льняное масла, яичный желток, печень и сливочное масло. Мы рекомендуем применение витамина Е в комплексных курсах с витамином А, препаратами селена и энтеросорбетнами (хлорелла, полипефан) не менее 4 раз в год (каждые 3 месяца) по 1 месяцу в дозе 10, 20, 30 капель масляного раствора или по 1 капсуле 3 раза в сутки при иммунодефицитах, хронических воспалительных и дегенеративных заболеваниях, а также при дисбактериозах, пищевой аллергии. Подобные курсы необходимы и больным с гормонозависимыми формами заболеваний (бронхиальная астма, лимфолейкозы, болезнь Крона, саркоидоз и др.), поскольку витамин Е предотвращает развитие резистентности к глюкокортикоидам. Витамины группы В Рибофлавин (витамин B2) является ведущим кофактором, обеспечивающим достаточную активность глутатион-редуктазы эритроцитов и лейкоцитов. Обнаружен синергизм рибофлавина с цинком, селеном. Клинически дефицит В2, проявляется явлениями хейлоза, ангулярного стоматита, атрофией сосочков языка, дерматитом в области половых органов и себорейным фолликулярным кератозом в области носогубных складок носа и лба, слезотечением и конъюнктивитами. Для лечения арибофлавиноза применяются дозы 5-10 мг в сутки внутрь, подкожно или внутримышечно. Витамины В необходимы для синтеза коферментов ФАД, никотинамида, пиридоксальфосфата и т.д. Витамин В6 — пиридоксина гидрохлорид — обеспечивает содружественную с ИЛ-3 роль поддержания эритропоэза. Низкий уровень пиридоксальфосфата в крови (особенно при лечении изониазидом и пеницилламином) является фактором риска развития атеросклероза и анемии [Bitsch, 1993]. Витамин В6 выступает синергистом цинка в регуляции аминокислотного обмена. Витамин В12 — это группа Со-содержащих корриноидов, выполняющих важнейшую роль в реакциях трансметилирования. Ведущими реакциями трансметилирования, происходящими с участием В12, является синтез тимидина (синтез ДНК) и метионина из гомоцистеина. Метионин необходим для превращения фолиевой кислоты в фолиновую, последняя же, обеспечивает нормобластический тип кроветворения. Кроме того, В12 обеспечивает синтез липопротеинов в миелиновой ткани, глутатиона. Поэтому дефицит В12 сопровождается развитием мегалобластической анемии, неврологических расстройств (фуникулярный мислоз), нейтропении. Иммунодефицит при недостаточности В связан с образованием гиперсегментированных нейтрофилов, малоустойчивых к «дыхательному взрыву», который необходим для уничтожения внутриклеточных бактерий и вирусов. Цианкобаламин в дозе 200-1000 мкг вводят внутримышечно в течение 2-3 недель для восполнения депо витамина В12 в печени. Для коррекции иммунодефицитов применяются витаминоподобные соединения: B8 (инозит), витамин В11 (карнитин), липоевая кислота, витамин U (метилметионинсульфония хлорид), витамин В13 (оротовая кислота) и холин. Все эти вещества проявляют синергизм с эссенциальными МЭ: Zn, Co, Mn, Cu, Fe и др. Витамин С Витамин С (аскорбиновая кислота) является водорастворимым витамином, который необходим для защиты организма от вирусных и бактериальных инфекций, синтеза стероидных гормонов, нейромедиаторов, коллагена и карнитина, всасывания железа, стимуляции марофагов, ЕКК, индукции эндогенного интерферона. Реализация антиоксидантных свойств витамина С возможна лишь при значительных дозах препарата (6-10 г в день). В целях иммунокоррекции витамин С назначается онкологическим больным, получающим стандартную химиотерапию, по 5 г ежедневно в течение 8 недель, после чего отмечается резкое повышение иммунореактивности и улучшение общего состояния. Если в естественных условиях многие металлы (Fe, Co, Мn, Сu) разрушают аскорбиновую кислоту, то в условиях клетки МЭ (Fe, Se, Zn, Сu) и витамин С выступают синергистами. Здоровым взрослым и детям с целью профилактики вирусных, бактериальных и микоплазменных инфекций назначается курс витамина С: первые 4 дня — 4 г препарата в сутки в 3-4 приема; последующие 3 дня — 3 г в сутки; затем в течение 6-8 дней — 1-2 г в сутки; поддерживающая доза — 0,25 мг/день в течение 5 дней. Указанный режим применения обеспечивает проявление антиоксидантных и иммунопрофилактических свойств витамина С. Для защиты от ионизирующей радиации доза витамина С должна быть не менее 10 г/сут, такая же доза обеспечивает резистентность к раковым заболеваниям и инфекционным процессам. Витамин С в комбинации с препаратами Se и витаминами А, Е выступает эссенциальным антиоксидантным энтеросорбентом, т.е. обеспечивает элиминацию СРК, продуцируемых микрофлорой кишечника. Нормальное содержание аскорбиновой кислоты: в плазме составляет 17-85 мкмоль/л; в крови — 28 мкмоль/л; в тканях — 17-85 мкмоль/л. Пограничный дефицит витамина С составляет 11-17 мкмоль /л в крови, а выраженный дефицит возникает при концентрациях ниже указанных величин [Maiani et al., 1993]. Многоцентровыми эпидемиологическими исследованиями доказана роль аскорбиновой кислоты в предотвращении рака и ишемической болезни сердца [Gey et al., 1987]. Применение витаминов А, Е, С тормозит развитие эмфиземы у курильщиков [Brawn et al., 1993]. Показано также, что маркером метаболизма аскорбиновой кислоты в организме является ее концентрация в лейкоцитах [Maiani et al., 1993]. Это связано с тем, что концентрации витамина С в плазме весьма лабильны даже в течение суток, в то время как в лейкоцитах формируется более стабильный пул витамина. Кофактором витамина С являются различные растительные галокатехины и биофлавоноиды, которые содержатся в значительных количествах в шиповнике, цитрусовых, горохе, капусте, грецких орехах, зеленом чае, красном перце, винограде и гречихе (рутин). Совокупность биофлавоноидов называют витамином Р. Данный фактор значительно уменьшает потребление эндогенных антиоксидантов и способствует иммуностимуляции и укреплению коллагена. Доказана роль витамина Р в формировании здорового и активного долголетия. В заключении хотелось бы отметить, что монотерапия витаминами не эффективна и бессмысленна. Кроме того, краткосрочное назначение поливитаминных препаратов не способствует повышению уровня иммунного ответа и приравнивается к эффекту плацебо [Chavance et al., 1993]. В многоцентровых исследованиях свою иммуностимулирующую способность показала лишь монотерапия с применением витаминов С, А и Е. Курсы витамино- и МЭ-терапии должны быть по длительности гораздо больше 4 месяцев. Только тогда возникает высокий протективный эффект в отношении инфекционных и опухолевых заболеваний. Препараты должны включать много ингредиентов в наиболее оптимальных соотношениях для индукции потенциирования и синергизма в условиях in vivo. В некоторых случаях высокие дозы витаминов способны стимулировать опухолевый рост [Дзюбко и др., 1987]. Однако, эти данные являются спорными и требуют дальнейшего экспериментального подтверждения. При оценке весомости вклада витаминов и МЭ в иммунный ответ, чашка весов, несомненно, склоняется в пользу долгосрочных оптимизированных и индивидуализированных курсов иммунотерапии МЭ и витаминов. Источник: Кудрин А.В., Скальный А.В., Жаворонков Иммунофармакология микроэлементов. М, 2000.-537 С. А.А. и др.