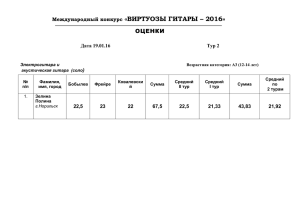
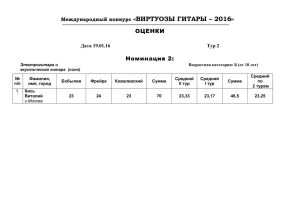
doc, 43 кб - Брянский Государственный Университет имени
реклама

Брянский государственный университет имени академика И.Г.Петровского Четвертая Брянская корпоративная региональная олимпиада учащейся молодежи ХИМИЯ Заочный тур 2012 г. Особенности проведения корпоративной олимпиады по химии 1. Олимпиада проводится в два тура. 2. Первый тур проходит в форме заочного письменного задания. 3. В каждом классе учащимся для решения предлагается по восемь заданий, из которых одно представляет собой домашний эксперимент, который необходимо выполнить, описать наблюдаемые явления и предложить им объяснение. 4. Общая сумма баллов: «40» – в 8 классе, «42» – в 9 классе, «44» – в 10 классе, «42» – в 11 классе. 5. Ответы на задания предоставляются в печатном или письменном виде (почерк четкий и понятный). 6. Второй тур проводится на базе Брянского государственного университета. 7. Ко второму туру допускаются до 15 участников первого тура, превысивших квалификационный минимум (не менее 50 % от общего числа баллов) и набравших наибольшее количество баллов. 8. Второй тур проводится в один этап. 9. Абитуриенты выполняют пять заданий со свободным ответом. Общая сумма баллов – 30. 10. На выполнение работы участникам отводится 150 минут. 11. Выявляются лучшие участники в ряде номинаций. 12. Победителями и призерами олимпиады считаются участники, набравшие наибольшее суммарное количество баллов и награждаются дипломами 1, 2 и 3 степени. Количество победителей не может превышать 45 % от количества участников второго тура. Брянский государственный университет имени академика И.Г.Петровского Четвертая Брянская корпоративная региональная олимпиада учащейся молодежи ХИМИЯ Заочный тур. 2012 г. 9 класс 9-1 Английский химик Генри Кавендиш в 1785 году поместил смесь воздуха и кислорода вместе с небольшим количеством раствором поташа над поверхностью ртути в перевёрнутой U-образной трубке. А затем в течение двух недель с помощью электрофорной машины пропускал через столбик газа искры. Под действием разрядов азот образовывал окислы, которые поглощались раствором поташа. Также раствор поташа поглощал и примесь углекислоты. Смесь воздуха с кислородом постепенно уменьшалась в объёме. После прекращения уменьшения объёма он удалил из остатка кислород, пропуская его над раскалённой медью. Кавендиш заметил, что остаётся небольшой пузырёк газа. Природу этого газа Кавендиш понять не мог. а) Какова природа полученного Кавендишем газа? б) 110 лет спустя результаты эксперимента Кавендиша были объяснены. Кто и как это сделал? в) Запишите уравнения реакций, протекающих в опыте Кавендиша. (7 баллов) 9-2 Домашний эксперимент: При выполнении опытов пользуйтесь термостойкой посудой! Не наливайте кипяток в стеклянный стакан или другую стеклянную посуду, которая может лопнуть! Берегите глаза, не заглядывайте в посуду, где протекает химическая реакция! Внесите ложку питьевой соды: а) в стакан кипятка, б) в стакан с газированной водой, в) в стакан с уксусной кислотой. Что наблюдается? Объясните причины наблюдаемых явлений в каждом случае. (6 баллов) 9-3 170 лет назад в одном из популярных журналов был опубликован очень интересный рецепт: "Раствори серебро в селитряной кислоте и, обмакнув кисточку в сей раствор, нарисуй цветы или другие какие-нибудь украшения на белой шелковой материи и положи ее под стеклянный колокол, под которым, посредством сожжения серы, в атмосферном воздухе образуется газ..." Что будет наблюдаться? Какие химические процессы лежат в основе наблюдаемых явлений? Запишите уравнения протекающих реакций. (4 балла) 9-4 При восстановлении нитрита натрия амальгамой натрия в водном растворе образуется соль «Х». При обработке эфирного раствора этой соли хлороводородом образуются бесцветные кристаллы кислоты «У». Безводная серная кислота дегидратирует эту кислоту с образованием оксида азота (I). Таким образом оксид азота (I) формально можно рассматривать как ангидрид кислоты «У». а) Что такое амальгама натрия? Как её получают? Почему именно её используют в качестве восстановителя нитрита натрия при получении соли «Х»? б) Запишите уравнения реакций, о которых идёт речь в задаче. в) Назовите соль «Х» и кислоту «У». г) Составьте структурные формулы кислоты «У» и оксида азота (I). д) Почему оксид азота (I) ангидридом этой кислоты можно считать только формально? (10 баллов) 9-5 Два газа находятся в закрытом сосуде в объёмном соотношении 2:1. После реакции между ними в сосуде обнаружился только водный раствор плавиковой кислоты. а) Какие газы находились в сосуде? б) Запишите уравнение протекающей реакции; составьте электронный баланс. в) рассчитайте массовую долю плавиковой кислоты в полученном растворе. (5 баллов) 9-6 Индивидуальное газообразное вещество находится в сосуде объёмом 5,6 л при н.у. и имеет массу 11 г? Приведите примеры газов, удовлетворяющих условию задачи. (3 балла) 9-7 8 г оксида меди (II) некоторое время восстанавливали в токе водорода. Полученный твёрдый остаток обработали раствором серной кислоты. Масса полученной соли составила 8 г. Вычислите массу не растворившегося в кислоте вещества. (4 балла) 9-8 Однажды шведский химик Карл Эгли открыл банку с имеющимися на дне слежавшимися крупными кристаллами цианида калия и сделал глубокий вдох, наклонившись над горлышком банки. В результате он потерял сознание и его едва удалось спасти. а) В чём причина произошедшего? б) Какое правило техники безопасности было нарушено? (3 балла)