электрокаталитическая активность полианилин металлических
реклама

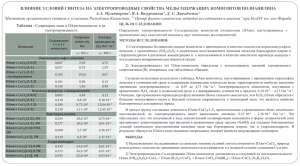
ЭЛЕКТРОКАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ КОМПОЗИТОВ ПОЛИАНИЛИНА, ДОПИРОВАННОГО ХЛОРИДАМИ МЕТАЛЛОВ Е.А. Соболева, к.х.н., Н.М. Иванова, д.х.н., профессор, Я.А. Висурханова, магистрант КарГУ им. Е.А. Букетова Институт органического синтеза и углехимии РК 100000, Казахстан, г. Караганда, ул. Алиханова, д.1 Е-mail: [email protected] В последнее время большое внимание уделяется получению новых типов электродных материалов. Проводятся интенсивные исследования в области полимер-металлических композитов, применяемых для модификации поверхности электродов [1]. В качестве полимерной основы для модифицирующих металлсодержащих пленок часто используют полианилин (ПАни), обладающий окислительно-восстановительной активностью, электронной и ионной проводимостью, парамагнитными и другими важными в практическом отношении свойствами. Следует отметить, что первый источник тока с проводящим полимером был создан на основе полианилина [2]. Целью данной работы является получение эффективных электрокатализаторов на основе ПАни, допированного хлоридами таких металлов, как никель, медь и кобальт, а также исследование их активности в процессах электрокаталитического гидрирования пнитроанилина (п-НА). Основным продуктом электрокаталитического гидрирования п-НА на катоде, активированном скелетным никелем, является п-фенилендиамин (п-ФДА) [3], имеющий широкое практическое применение, например, как реагент в производстве красителей, полиамидов, полиуретанов и др. Полианилин был синтезирован по методике окислительной полимеризации анилина с применением в качестве окислителя пероксидисульфата аммония в солянокислой среде [4], в результате был получен ПАни в виде его солянокислой соли темно-зеленого цвета. Металлсодержащие композиты ПАни были получены введением хлоридов металлов в процессе полимеризации анилина, т.е. методом in situ, с исходным соотношением соль металла:анилин, равным 1:1 и 1:2. Содержание металла в синтезированных композитах было рассчитано по разности исходно взятого количества металла в соли и определенного в фильтрате методом комплексонометрического титрования (с применением трилона Б и индикатора мурексида) [5]. Эксперименты по гидрированию п-НА проводили в электрокаталитической ячейке, разделенной на катодную и анодную части мембранной диафрагмой. На медный катод с видимой поверхностью 5·10-4 м2 наносили 1г синтезированного металлсодержащего ПАникомпозита. В качестве анолита использовали 50 мл 20 %-ного раствора NaOH, католита – 30 мл 2%-ного NaOH с добавлением 15 мл этилового спирта для лучшего растворения п-НА. Концентрация п-НА в католите составляла 0,066 моль/л. Гидрирование п-НА проводили при силе тока 1,5А и температуре 300С. Результаты электрокаталитического гидрирования п-НА на металлсодержащих ПАни-композитах представлены в табл. 1, в которой даны значения средней скорости гидрирования (W) и коэффициент использования водорода (η) за период превращения п-НА, равный 25%, степень превращения п-НА (α), а также результаты хроматографических анализов продуктов гидрирования после их экстракции этилацетатом из католита. Последние были выполнены на газовом хроматографе «Кристалл 5000.1» с пламенно-ионизационным детектором, кварцевой капиллярной колонкой ZB-50 длиной 30 м, диаметром 0,25 мм; температура колонки 3150С, испарителя 3500С, детектора 3500С. Как следует из табличных данных, электрохимическое восстановление п-НА на Cu катоде в указанных условиях проходит со средней скоростью гидрирования 3,5 мл Н2/мин и неполным поглощением водорода. Активация катода гидрохлоридом ПАни процесс гидрирования почти не ускоряет, но приводит к повышению конверсии гидрируемого вещества. При применении композитов ПАни с хлоридом никеля скорость гидрирования пНА немного повышается и заметно возрастает его степень превращения. Ещё более существенно возрастают все рассмотренные характеристики данного процесса в случае активации катода Cu-содержащими ПАни-композитами. При этом большее содержание меди в композите ПАни+CuCl2(1:2) оказывает заметное влияние только на скорость гидрирования п-НА. Высокие выходы п-ФДА подтверждаются хроматографическими анализами (табл.1). Таблица 1. Электрокаталитическое гидрирование п-НА на композитах ПАни + МеCl2 Композиты Сu-катод ПАни∙HCl ПАни + NiCl2 (1:1) ПАни + NiCl2 (1:2) ПАни + CuCl2 (1:1) ПАни + CuCl2 (1:2) ПАни + CoCl2 (1:1) ПАни + CoCl2 (1:2) Содержание металла в 1 г композита 0,059 0,151 0,054 0,174 0,068 0,147 W, мл Н2/мин (α= 0,25) 3,5 3,6 4,1 4,3 5,8 6,3 2,7 2,6 η, % α, % (α=0,25) 31,7 33,3 38,1 41,0 55,2 60,4 25,0 25,0 Состав экстракта %-п-ФДА %- п-НА 63,2 73,9 81,3 86,7 95,2 95,6 41,2 59,3 36,8 26,1 18,7 13,3 4,8 4,4 58,8 40,7 64,4 76,4 82,6 87,7 96,3 96,5 62,7 79,4 W, мл Н2 /мин Обратная картина наблюдается при применении композитов ПАни, допированного хлоридом кобальта: снижаются как скорость гидрирования п-НА, так и его конверсия по сравнению с электрохимическим процессом восстановления. Кроме того, происходит перепоглощение водорода, что показывают хроматографические исследования, свидетельствующее о прохождении побочных процессов, включающих и разрушение полианилина. Для более наглядного сравнения процессов гидрирования п-НА с использованием композитов ПАни + МеCl2 (1:2) на рис. 1 приведены зависимости скорости процессов от объема поглощенного водорода Vо. 8 7 6 5 4 3 1 2 4 2 1 0 0 3 50 100 150 200 Vo, мл Н2 1 – Cu, 2 – Ni, 3 – Cu-катод, 4 - Co Рис. 1. Электрокаталитическое гидрирование п-НА на композитах ПАни + МеCl2 (1:2) Из приведённых данных (табл.1 и рис.1) следует, что каталитическая активность синтезированных композитов ПАни+МeCl2 в процессе электрогидрирования п-нитроанилина уменьшается в следующем ряду металлов: Сu>Ni >Co. Для объяснения обнаруженного каталитического эффекта при применении для активации катода композитов ПАни+хлорид металла были изучены их фазовые составы до и после процессов гидрирования на рентгеновском дифрактометре Дрон-2. Полученные дифрактограммы для ПАни-композитов приведены на рисунках 2-4 (d – межплоскостные расстояния в кристаллических фазах веществ). б) а) Рис. 2. Рентгеновские дифрактограммы композита ПАни+NiCl2(1:2) до (а) и после (б) процесса гидрирования б) а) Рис. 3. Рентгеновские дифрактограммы композита ПАни+ CuCl2(1:2) до (а) и после (б) гидрирования б) а) Рис.4. Рентгеновские дифрактограммы композита ПАни+CoCl2(1:2) до (а) и после (б) гидрирования Согласно приведённым рентгеновским дифрактограммам, в композите ПАни+СuCl2 после гидрирования (рис.3,б) присутствуют кристаллические фазы меди, образующиеся при восстановлении катионов этого металла из его хлорида, взаимодействующих с полимерной матрицей ПАни. Следовательно, обнаруженный каталитический эффект Cu-содержащих ПАни-композитов можно объяснить присутствием металлических частиц в этих композитах, образование которых, как показали исследования, происходит ещё на стадии насыщения водородом наносимых на катод композитов-катализаторов. В Ni- и Co-содержащих ПАникомпозитах после гидрирования металлические фазы отсутствуют, однако имеются кристаллические фазы гидроксидов никеля и кобальта (рис. 2, б и 3,б), которые образуются при взаимодействии с водно-щелочным раствором католита. Возможно, сравнительно слабая каталитическая активность композитов ПАни+NiCl2, наряду с самим полианилином (табл. 1), обусловлена образованием нерастворимого осадка Ni(OH)2. Это предположение подтверждается недавно опубликованной работой [6], в которой выполнены исследования электрокаталитической активности никелевого электрода, модифицированного гидроксидом никеля (Ni(OH)2/Ni-электрод) в процессах окисления формальдегида и этанола. В то же время, гидроксид кобальта каталитическую активность в исследуемом процессе гидрирования п-НА не проявил. Таким образом, при применении композитов полианилин+соль металла для активации катода в электрогидрировании п-нитроанилина зафиксирован каталитический эффект композитов ПАни+NiCl2 и особенно ПАни+СuCl2, обусловленный, согласно рентгенофазовому анализу (рис. 2 и 3), появлением кристаллических фаз металла в случае Cu-содержащих ПАни-композитов и предположительно гидроксида никеля для Niсодержащих ПАни-композитов. Список литературы 1. Подловченко Б.И., Андреев В.Н. Электрокатализ на модифицированных полимерами электродах // Успехи химии. – 2002. – Т.71, №10. – С.950-966. 2. Электрохимия полимеров / М.Р. Тарасевич, С.Б. Орлов, Е.И. Школьников и др. – М.: Наука, 1990. – 238 с. 3. Соболева Е.А., Иванова Н.М., Малышев В.П., Кирилюс И.В. Электрокаталитическое восстановление нитроанилинов // Вестник КазНУ. Серия хим. – 2010. - № 1 (57). – С.79-84. 4. Stejskal J., Gilbert R.G. Polyaniline. Preparation of a conducting polymer // Pure Appl. Chem. – 2002. – Vol. 74, №5. – P.857-867. 5. Коренман И.М. Методы количественного химического анализа. – М.: Химия, 1989. – 128 с. 6. Жан Ю., Шангуан Л., Шуан Ш., Дон Ч. Электрокаталитическое окисление формальдегида и метанола на Ni(OH)2/Ni-электроде // Электрохимия. – 2013. – Т.49, №9. – С.992-998.