Ответы и решения к задачам занятия 7
реклама

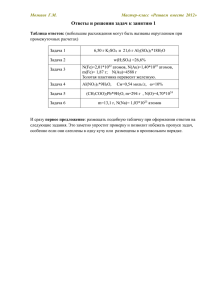
Можаев Г.М. Мастер-класс «Решаем вместе 2012» Ответы и решения задач к занятию 7 Таблица ответов: (небольшие расхождения могут быть вызваны округлением при промежуточных расчетах) Задача 1 Масса пластины уменьшилась на 3,37 г (∆m= –3,37г) w(FeCl3 ост.) = 4,25%; w(FeCl2) = 4,41%; w(CuCl2) = 2,34%; Задача 2 Ошибка условия, возможны варианты Задача 3 w(Al) = 2,35%; Задача 4 Hg2(NO3)2*2H2O Задача 5 w1(Bi(NO3)3) = 14,8%; w2(Mn(NO3)2) = 10,6% Задача 6 m= 21,76 г Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 1. Медную пластину опустили в 10%-ный раствор хлорида железа(III) массой 300 г. Когда спустя некоторое время пластину вынули из раствора, оказалось, что суммарная массовая доля веществ в растворе равна 11%. Определите изменение массы пластины и массовые доли солей в растворе. Особенностью задачи явилось то, что соль железа оказалась способной окислять такой малоактивный металл, как медь. Дело в том, что железо восстанавливалось здесь не до металла, а только для степени окисления +2. Окислительновосстановительный потенциал этой реакции E(Fe /Fe ) = 0,77В, что больше потенциала реакции окисления меди E(Cu2+/Cu) = 0,34В, что и обуславливает возможность протекания этой реакции. 3+ 2+ Схему этой реакции предложила команда «Тугодумы»: К сожалению, дальнейшее решение задачи было не вполне удачным. А вот пример правильного решения от команды «Великолепная пятерка»: Можаев Г.М. Мастер-класс «Решаем вместе 2012» Подобным образом, через составление алгебраического уравнения, задачу решали многие команды. Но есть и более простой способ. Масса воды в ходе реакции не меняется, и если сначала ее массовая доля была равна 90%, и, следовательно, масса 270 г, то к моменту окончания эта масса составляла 89% от массы раствора. Отсюда, m(p2) = 270/0,89 = 303,37 г. Очевидно, что увеличение массы раствора равно такому же уменьшению массы пластинки, отсюда ответ на один из вопросов задачи : Δm = -3,37 г. С другой стороны, это не вполне задача «на пластинку», здесь идет только растворение меди и Δm равно массе меди вступившей в реакцию. Далее находим количество вещества меди, и ведем все расчеты по уравнению реакции. Похожее решение предложила только одна команда, команда «Колботрясы»: Минусом этого решения стали большие ошибки округления (n(Cu)=3,37/64=0,05266 моль и т.д.) Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 2. В раствор нитрата серебра объемом 300 мл с концентрацией 0,1 моль/л опустили пластинку массой 30 г из неизвестного металла, для которого характерна степень окисления +3. Когда спустя некоторое время пластинку вынули, промыли и взвесили, оказалось, что ее масса возросла на 4,98%. К полученному раствору прилили избыток раствора хлорида натрия, выпавший осадок также высушили и взвесили. Его масса оказалась равной 3 г. Определите неизвестный металл. Вот схема превращения фаз к этой задаче, также составленной в команде «Тугодумы»: К сожалению, эта задача также содержала ошибку. Часть команд обнаружила ее, придя к отрицательному результату, например, как команда «СО2» Не может масса серебра быть меньше привеса пластины Δm, поскольку серебром этот привес и обеспечивается. Команды нашедшие ошибку получили свои заслуженные 5 баллов. Другие команды пошли дальше, и нашли способ исправить условие. Принцип здесь простой, надо либо уменьшить ее привес Δm, либо увеличить массу серебра, осевшего на пластине Первый вариант от команды «ХИМИК.14»: Все команды, предложившие свой вариант изменения условия задачи получили дополнительный призовой балл. Второй вариант от команды «Великолепная пятерка»: Можаев Г.М. Мастер-класс «Решаем вместе 2012» Наконец, третья группа команд не заметила ошибку условия, т.е. по сути дела допустила ту же ошибку, что и составитель задачи. Такие команды получили 4 и менее баллов. В заключение отмечу, что эта задача показала, что многие команды не умеют вести точные расчеты с маленькими числами, допускают многочисленные ошибки округления, что привело к большому разнообразию найденных металлов от La (A=139) до W(A=183). Можно еще посоветовать в случае маленьких количеств вести расчет в миллимолях, может тогда будет понятней, что 0,00245 это 2,45 ммоль, и округлять их до 0,02 моль как то не хорошо. Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 3. Для освобождения медного порошка от примеси алюминиевого, его обработали избытком раствора хлорида меди (II), промыли и высушили. Оказалось, что в ходе этой операции масса порошка увеличилась на 6%. Определить массовую долю примеси в исходном порошке. Задача не вызвала больших затруднений. Пример решения от команды «СО2» и от команды «Gold»: Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 4. Для определения состава кристаллогидрата нитрата ртути(I), его навеску массой 5,903 г растворили в воде. К полученному раствору добавили 20 г гранул цинка и оставили до полного окончания реакции. Затем раствор слили с металлического осадка, осадок промыли водой и высушили. Масса его оказалась равной 23,54 г. Определите формулу кристаллогидрата. При решении этой задачи надо было учесть особенность ртути(I): и в узлах кристаллической решетки, и в растворах содержатся ионы Hg22+, поэтому истинная формула нитрата ртути(I): Hg2(NO3)2. Команды, дававшие в принципе правильное решение, но исходя из простейшей формулы соли, получили 4 балла. Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 5. Пластинку из марганца массой погрузили в 80 г раствора нитрата висмута(III). После полного окончания реакции оказалось, что масса раствора уменьшилась на 4,75%. Определите состав раствора до и после реакции (массовые доли). Особенность задачи в том, что дано не изменение массы пластинки, как обычно, а изменение массы раствора. Однако это равные величины, что и позволяет решить задачу. Помогает этому и условие полного протекания реакции. Команда «Химические элементы»: Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 6. Железную пластинку массой 20 г поместили в 12%-ный раствор нитрата серебра массой 80 г. Через некоторое время пластинку вынули, высушили и взвесили. Рассчитайте, какова должна быть масса пластинки после реакции, если массовая доля нитрата серебра в растворе уменьшилась до 8 %. Вот решение команды «Солнечная энергия»: Подобное решение предлагали и другие команды. Однако возможно и другое решение. Здесь опять стоит вспомнить, что железо может быть в степени окисления и +2 и +3, и снова обратиться к окислительно-восстановительным потенциалам. E(Fe3+/Fe2+) = 0,77В, а E(Ag+/Ag) = 0,80В. Разница невелика, но она говорит, что ионы серебра могут окислять железо до степени 3+. Можаев Г.М. Мастер-класс «Решаем вместе 2012» Поэтому более правильным будет решение предложенное командой «Энергия»: Безусловно ошибочны следующие действия: Нельзя складывать и вычитать массовые доли относящиеся к разным растворам: Не имеет массовая доля 0,08 никакого отношения к массе исходного раствора Можаев Г.М. Мастер-класс «Решаем вместе 2012» Это последнее занятие мастер-класса. Желаю всем командам успехов в наступающем 2013 году, интересных задач и удачных решений! Можаев Г.М. Сайт КонТрен – http://kontren.narod.ru