Ответы и решения задач занятия 4
реклама

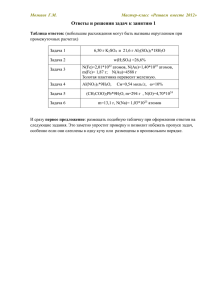
Можаев Г.М. Мастер-класс «Решаем вместе 2012» Ответы и решения задач к занятию 4 Таблица ответов: (небольшие расхождения могут быть вызваны округлением при промежуточных расчетах) Задача 1 w(HNO3)= 1,91% Задача 2 φ(Cl2) = 19,6% Задача 3 w(HNO3) = 52,2%; w(Cu(NO3)2) = 8,62% Задача 4 w(NaCl)=9,19%; w(Na[Cr(OH)4]=2,26% Задача 5 w(CaCl2)=10,7% Задача 6 V(раствора) = 108 мл Задача 1. Для осаждения серебра из 5%-ного раствора нитрата серебра, через раствор пропускали сероводород до прекращения выпадения осадка. Определите качественный и количественный (массовые доли) состав полученного раствора. Задача в интенсивных величинах, для решения можно выбрать любую удобную порцию вещества. Команда «О2» выбрало 1 моль нитрата серебра, что облегчило расчеты по уравнению реакции: Можаев Г.М. Мастер-класс «Решаем вместе 2012» Но можно было взять и 100 г раствора: А вот частая ошибка в работе одной из команд: Написана правильная формула, количество вещества равно массе, деленной на молярную массу вещества. Но при расчетах, в нее непонятно почему подставляется и коэффициент из уравнения реакции! Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 2. Смесь хлора с избытком водорода общим объемом 2 л (н.у.) поместили в толстостенный сосуд и воспламенили электрической искрой. Продукты реакции пропустили через 120 мл 5,6%-ного раствора гидроксида калия (плотность 1,05 г/мл), после чего массовая доля щелочи в растворе оказалась равной 4%. Определите объемную долю хлора в исходной газовой смеси. Схемы к данной задаче от команды «На химической волне»: А вот выбор неизвестной величины, на мой взгляд, не очень удачен, усложняет выражения Решение команды «ХИМИК.14»: Можаев Г.М. Мастер-класс «Решаем вместе 2012» Ошибка: Так считать массу раствора нельзя (вычитая массу КОН мы вычитаем массу элементов, которые из раствора не уходят (кислород) что приводит к заниженной массе раствора). А здесь ошибка округления: количество вещества посчитано до 2-х значащих цифр, что привело к завышенному результату. Совершенно нелогично считать потом объем с точностью до 4-х цифр Еще одна ошибка: составляется пропорция в которой участвуют массовые доли вещества в разных растворах – до и после реакции. Т.к. эти растворы имеют разную массу, то никакой пропорциональности здесь нет. Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 3. Медную пластину массой 2 г растворили в 50 мл 63%-ной азотной кислоты (плотность 1,38 г/мл). Определите массовые доли веществ, содержащихся в полученном синем растворе. В решении команды «Великолепная пятерка» не очень удачна схема, не показано, что образовавшийся раствор может содержать избыток кислоты: Еще менее удачная схема – полученный раствор не показан, только соль – как твердое вещество: А вот здесь, может и не вполне аккуратно, но верно передана суть протекающего процесса и составы фаз (ХИМИК.14): Можаев Г.М. Мастер-класс «Решаем вместе 2012» Удобна Табличная форма расчетов по уравнению реакции от команды «Тугодумы», но вот точность расчетов могла быть побольше (0,031 – только две значащих цифры) Задача 4. К 12%-ному раствору хлорида хрома (III) прилили в два раза меньшую по массе порцию 20%-ного раствора гидроксида натрия и тщательно перемешали. Исследование раствора, полученного в ходе реакции, показало, что он содержит только однозарядные ионы. Определите массовые доли веществ в этом растворе. Решая эту задачу, многие команды не учли амфотерность гидроксида хрома. Один из вариантов правильного решения в работе команды «Протон»: Можаев Г.М. Мастер-класс «Решаем вместе 2012» Недостаток решения: низкая точность расчетов, ошибки округления. Можаев Г.М. Мастер-класс «Решаем вместе 2012» Задача 5. Гидрид кальция внесли в избыток раствора соляной кислоты (масса раствора кислоты 150 г, массовая доля HCl 20%). При этом выделилось 6,72 л (н.у.) водорода. Рассчитайте массовую долю хлорида кальция в полученном растворе. Удачную схему процесса и грамотное решение дает команда «Факел»: Задача 6. Какой объем 30%-ного раствора аммиака (ρ = 0,892г/мл) необходимо добавить к 200 мл 40%-ного раствора соляной кислоты (ρ =1,198 г/мл), чтобы массовая доля кислоты уменьшилась вчетверо? Несколько команд допустили ошибку при анализе условия этой задачи, поставив знак равенства между понятиями «раствор аммиака» и «раствор гидроксида аммония». Относительно последнего следует сказать следующее: хотя название устоялось, но реально вещества с такой формулой не существует. В растворе аммиак находится в основном в виде гидратированных молекул NH3*H2O. И лишь небольшая часть, около 1% в форме ионов NH4+ и OH-. Поэтому, хотя формулу NH4OH удобно использовать в уравнениях реакций обмена, но когда речь идет о растворе аммиака, массовая доля 30% относится к аммиаку. Можаев Г.М. Мастер-класс «Решаем вместе 2012» Пример правильного решения от команды «Химические элементы»: Ответ, разумеется стоило округлить до трех, максимум четырех цифр. Ошибки: попытка определить массу раствора «изнутри», из его состава. Но не учтено, что раствор будет содержать и полученную при реакции соль. Возможно, схема превращения фаз помогла бы избежать этой ошибки. Можаев Г.М. Мастер-класс «Решаем вместе 2012» Невнимательное отношение к единицам измерения и отсутствие осмысления ответа: как это может быть 120 грамм и 140 – целая бочка – литров? Самыми легкими задачами четвертого занятия оказались задачи 1 и и 5 (средний балл 4,68). Наиболее трудной стала задача 5 (3,50), в основном из-за своего химического содержания. Если остались вопросы по решению или оцениванию отдельных задач – их можно обсудить на форуме. Можаев Г.М. Сайт КонТрен – http://kontren.narod.ru