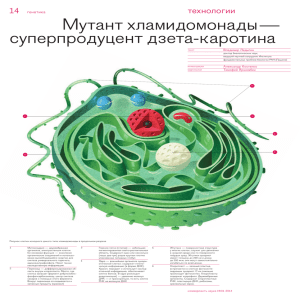
ОПД.Ф.13 Биология кл-ки биохимия и молек. биология
реклама

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Мурманский государственный гуманитарный университет» (ФГБОУ ВПО «МГГУ») УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС ДИСЦИПЛИНЫ ОПД.Ф.13 БИОЛОГИЯ КЛЕТКИ: БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ Основная образовательная программа подготовки специалиста по специальности (специальностям) 020201.65 Биология (код и наименование специальности/тей) Утверждено на заседании кафедры естественных наук факультета ЕФКиБЖД (протокол № 2 от 20 сентября 2012 г.) Зав. кафедрой ________________Е.Г. Митина РАЗДЕЛ 1. Программа учебной дисциплины. 1.1 Авторы программы: Меньшакова М. Ю., к.б.н., доцент кафедры естественных наук МГГУ, Икко Н.В., к.б.н., доцент кафедры естественных наук МГГУ 1.2 Рецензенты: Воскобойников Г.М., д.б.н., профессор, зав. лабораторией альгологии ММБИ КНЦ РАН Митина Е.Г., к.б.н., доцент кафедры биологии и химии МГГУ 1.3 Пояснительная записка: Цели дисциплины: дать знания о строении и свойствах химических соединений, входящих в состав живой материи, их взаимных превращениях, о значении биохимических процессов с их участием для понимания физико-химических основ жизни, молекулярных механизмов наследственности; сформировать понимание единства метаболических процессов в организме и их регуляции на молекулярном, клеточном и организменном уровнях. Задачи: формирование у студентов представлений о предмете, целях и методах современной биохимии и молекулярной биологии; формирование представлений о строении молекул, свойствах и функциях основных групп органических соединений, входящих в состав живых организмов; формирование представлений об обмене веществ, о сходстве и различиях метаболизма у различных систематических и экологических групп живых организмов; формирование умений выполнения лабораторных экспериментов по обнаружению органических веществ и исследованию их свойств; формирование представлений о принципах структурной организации нуклеиновых кислот, молекулярных механизмах синтеза нуклеиновых кислот и белковых молекул в клетках прокариот и эукариот; формирование представлений о строении генов и структуре геномов прокариот и эукариот. Место курса в общей системе подготовки специалиста; Дисциплина «Биология клетки: биохимия и молекулярная биология» входит в федеральный компонент дисциплин общепрофессионального цикла, призвана дать правильное объяснение биологических явлений с использованием данных физикохимических исследований и требует для своего изучения знания курсов органической, неорганической и физической химии, основ биологии. Является основой для изучения дисциплин «Физиология растений», «Микробиология», «Генетика». Читается в 7 и 8 семестрах. Требования к уровню освоения содержания дисциплины (должны знать, должны уметь); В результате освоения дисциплины студент должен знать: современные биохимические и молекулярно-биологические методы исследований; строение, свойства и функции химических веществ, входящих в состав живых организмов; основные пути синтеза и распада этих химических веществ в живых организмах, регуляцию их метаболизма; молекулярные основы наследственности; механизмы хранения, передачи и реализации генетической информации; молекулярные механизмы возникновения мутаций; молекулярные механизмы рекомбинационных процессов; молекулярные механизмы регуляции экспрессии генов прокариот и эукариот; уметь: объяснять, как связаны функции вещества с его строением, какие факторы влияют на его синтез и распад; решать ситуационные задачи по биохимии и молекулярной биологии; применять полученные знания для планировании экспериментальной работы; использовать полученные знания при изучении других биологических дисциплин; интерпретировать экспериментальные результаты с целью выяснения молекулярных механизмов биохимических процессов владеть: основными понятиями и терминологией биохимии и молекулярной биологии; современными биохимическими и молекулярно-биологическими методами исследования; компьютерными технологиями применительно к биохимическим и молекулярнобиологическим экспериментам. Ссылки на авторов и программы, которые использовались в подготовке Программа составлена в соответствии с Государственным стандартом высшего профессионального образования и на основании программ дисциплин «МОЛЕКУЛЯРНАЯ БИОЛОГИЯ» (АВТОРЫ – д.б.н., проф. Ю.Б. Филиппович, д.б.н., проф. А.С. Коничев, к.б.н., проф. Г.А. Севастьянова) и «БИОХИМИЯ» (авторы – Ю.Б.Филиппович, А.С.Коничев) Московского государственного педагогического университета. 1.4 Извлечение из ГОС ВПО специальности (направления), содержащее требования к обязательному минимуму содержания дисциплины и общее количество часов (выписка). Индекс Наименование дисциплин и их основные разделы Всег о часов ОПД.Ф.0 3 Биология клетки (гистология, цитология, биофизика, биохимия и молекулярная биология) Строение и принципы жизнедеятельности клетки, единство и разнообразие клеточных типов, воспроизведение и специализация; ткани, их происхождение в индивидуальном и историческом развитии; субклеточные компоненты, их биохимические характеристики; структура и свойства белков, нуклеиновых кислот, углеводов, пути биосинтеза макромолекул, энергетика клеток растений и животных, структура и функции биомембран, принципы регуляции метаболизма; радиобиология; методы световой микроскопии, культуры клеток и тканей, выделения и исследования субклеточных структур, потенции фотометрии, приемы изучения ферментативной активности, изотопный анализ. Практикумы. 400 1.5 Объем дисциплины и виды учебной работы (для всех специальностей, на которых читается данная дисциплина): Виды учебной работы в часах № п/ п Шифр и наименование специальности 1 020201 Биология Кур с Семест р 4 7, 8 Трудоемкост ь Всег о аудит . Л К ПР Сам. / ЛБ работ С а М 140 104 74 10 20 36 Вид итогового контроля (форма отчетност и) экзамен 1.6 Содержание дисциплины. 1.6.1 Разделы дисциплины и виды занятий (в часах). Примерное распределение учебного времени: № п/п Количество часов Наименование раздела, темы Всего ауд. Л К ПР / С М Л Б 2 2 0 0 2 2 0 0 4 2 0 2 2 4 2 0 2 2 6 4 0 2 2 4 2 0 2 2 4 2 0 2 2 6 4 2 0 2 6 4 2 0 2 6 4 2 0 2 2 0 0 4 2 2 0 4 2 2 0 2 2 0 0 Сам. раб. Модуль1 «Биохимия» 1. 2. 3. 4. 5. 6. Введение: предмет, задачи, история развития биохимии, методы биохимических исследований Химический состав организмов Структура, физико-химические свойства и биологическая роль углеводов Структура, физико-химические свойства и биологическая роль липидов Структура, физико-химические свойства и биологическая роль белков Ферменты 8. Витамины и некоторые другие биологические активные соединения Обмен углеводов 9. Обмен липидов 10. Обмен аминокислот и нуклеотидов 11. Водно-солевой обмен 12. Взаимосвязь и регуляция обмена веществ 13. Гормоны и их роль в обмене веществ 14. Основы биоэнергетики 7. 2 2 Всего: 10 10 10 18 10 Модуль 2 «Молекулярная биология» 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Введение: предмет, задачи, история развития молекулярной биологии Методы молекулярной биологии 2 2 0 6 4 2 4 6 6 0 2 6 4 2 2 6 4 2 2 2 2 0 4 2 2 2 2 0 7 6 1 2 2 2 0 2 5 4 1 2 Всего: 10 10 10 Итого: 104 74 Доказательства генетической роли нуклеиновых кислот. Структура, физико-химические свойства и функции нуклеиновых кислот. Структурно-функциональная организация геномов прокариот и эукариот Репликация ДНК, ее особенности у прокариот и эукариот Репарация ДНК Молекулярные основы рекомбинации Обратная транскрипция генетической Транскрипция, ее регуляция у прокариот и эукариот Процессинг первичных транскриптов у прокариот и эукариот Трансляция – биосинтез белка на рибосомах 10 20 2 18 36 1.6.2 Содержание разделов дисциплины. Модуль 1 «Биохимия» Введение. Биохимия – наука о качественном составе, количественном содержании и преобразованиях в процессе жизнедеятельности соединений, образующих живую материю. История развития биохимии. Методы химических исследований. Биохимические методы мониторинга окружающей среды. Раздел 1. Введение в статическую биохимию. Тема 1. Химический состав организмов. Постоянно и иногда встречающиеся элементы в составе живой материи. Понятие о главных биогенных элементах. Макро – и микроэлементы. Закономерности распространения элементов в живой природе. Потребность организмов в химических элементах. Биологически активные соединения, их роль в жизни человека, животных и растений. Тема 2. Структура, физико-химические свойства и биологическая роль углеводов. Классификация углеводов. Моносахариды. Изомерия моносахаридов. Физические свойства моносахаридов. Химические свойства моносахаридов. Олигосахариды и полисахариды. Глюкозидная связь. Важнейшие олигосахариды. Физические и химические свойства олигосахаридов. Биологическая роль олигосахаридов. Полисахариды (гомо- и гетерополисахариды, линейные и разветвленные молекулы полисахаридов) Важнейшие полисахариды (крахмал, пектины, гемицеллюлозы, целлюлоза, хитин, муреин), их биологическая роль. Тема 3. Структура, физико-химические свойства и биологическая роль липидов. Понятия «липиды» и «липидоподобные вещества». Жирные кислоты. Строение молекулы жирных кислот, насыщенные и ненасыщенные жирные кислоты. Содержание различных жирных кислот в организмах разных систематических групп. Важнейшие жирные кислоты (капроновая, каприловая, каприновая, лауриновая, миристиновая, пальмитиновая, стеариновая, арахиновая, бегеновая, олеиновая, линолевая, линоленовая, арахидоновая, эруковая).Физические свойства жирных кислот. Химические свойства жирных кислот. Классификация липидов ( глицериды и воска, фосфолипиды, стероиды, гликолипиды). Биологическая роль липидов. Тема 4. Структура, физико-химические свойства и биологическая роль белков. Амины и аминокислоты. Общая формула аминокислот. Классификация аминокислот. Химические свойства аминокислот: амфотерность, реакции по карбоксильной и аминогруппе. Взаимодействие аминокислот друг с другом. Пептидная связь. Биологическая роль аминокислот. Белки. Уровни организации белковой молекулы. Понятие о структурной организации белковой молекулы. Первичная структура белка. Особенности первичной структуры. Вторичная структура белка (ά- спираль, β-конформация), водородные связи как фактор поддержания вторичной структуры. Третичная структура белка, факторы, обеспечивающие ее поддержание. Четвертичная структура белка. Классификация и биологическая роль белков. Классификация по выполняемым функциям (каталитические белки, запасные белки, белки-ингибиторы ферментов, белкирегуляторы активности генов, защитные белки, транспортные белки, белки мембран, токсические белки, сократительные белки, рецепторные белки, гормоны белковой и пептидной природы, белки вирусных капсидов, белки клеточной стенки растений). Классификация по составу (простые белки и сложные белки Биологическая роль белков Тема 5. Ферменты. Особенности ферментативного катализа. Физические и химические свойства ферментов. Структура молекулы ферментов. Механизм ферментативного катализа. Мультиферментные комплексы. Изозимы. Факторы, влияющие на активность ферментов. Классификация и номенклатура ферментов (оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы). Тема 6. Витамины и некоторые другие биологические активные соединения. История открытия витаминов. Роль витаминов в питании человека и животных. Авитаминозы, гиповитаминозы, гипервитиминозы. Соотношение витаминов и коферментов. Понятия «витамины», «витаминоподобные вещества», «антивитамины». Водорастворимые витамины, их роль. Витамин В1. Витамин В2 – сложный комплекс веществ (рибофлавин, пантотеновая кислота, фолиевая кислота, никотиновая кислота и никотинамид. Витамин В6 (пиридоксин), Витамин В 12 (цианкобаламин), Витамин С , Витамин Н (биотин). Жирорастворимые витамины и их роль в обмене веществ. Витамин А (ретинол), . β-каротин- провитамин А. Витамин Д (кальциферол), Витамин Е (токоферол), Витамин К. Витаминоподобные вещества и антивитамины. Понятие «витаминоподобные вещества». Витамин Р – сложный комплекс веществ со сходными функциями : катехины, халконы, флавины, флавононы, изофлавоны, флавонолы). Убихинон. Биологическая роль, пути синтеза в организме человека, симптомы недостатка. Коэнзим Q, Аналоги парааминобензойной кислоты – сульфаниламиды. Пангамовая кислота (витамин В15). Инозит, его роль в поддержании фукционирования печени. источники инозитола. Роль инозитола в метаболизме растений. Пирролохинолинохинон, предполагаемая биологическая роль. Витамин U. Липоевая кислота, ее роль в энергетическом обмене. Антивитамины. Основные направления исследования. Раздел 2. Динамическая биохимия Общая характеристика обмена веществ и энергии в живых системах. Тема 7. Метаболизм углеводов. Переваривание и всасывание углеводов. Гликолиз и гликогенолиз. Брожение. Цикл Кребса. Пентозофосфатный путь. Взаимосвязь различных путей утилизации углеводов. Синтез углеводов. Глюконеогенез. Роль печени, мышц, кишечника и других органов в обмене углеводов. Нарушения обмена углеводов. Тема 8. Метаболизм липидов. Переваривание и всасывание липидов. Желчные кислоты, их роль в переваривании жиров. Расщепление жирных кислот. β-окисление жирных кислот в митохондриях. Образование и обезвреживание кетоновых тел. Перекисное окисление липидов. Биосинтез жирных кислот. Биосинтез глицеридов и фосфолипидов. Особенности биосинтеза простагландинов и лейкотриенов. Тема 9. Обмен аминокислот и нуклеотидов. Белковый обмен: общие сведения. Расщепление тканевых и пищевых белков. Метаболизм аминокислот (декарбоксилирование, дезаминирование, переаминирование, прямое аминирование, синтез и распад аминокислот). Цикл мочевины. Метаболизм порфиринов. Биосинтез гемма, деградация порфиринов. Метаболизм пуриновых и пиримидиновых нуклеотидов. Нарушения азотного обмена. Тема 10. Водно-солевой обмен. Понятие о гомеостазе. Водный баланс организмов. Роль почек, легких, кожи, пищеварительной системы и эндокринных желез в водном обмене. Положительный и отрицательный эффект гидратации ионов на степень структурирования воды. Регуляция водного обмена. Роль минеральных веществ в питании. Соотношение между отдельными химическими элементами. Функции макро-, микро- и ультраэлементов в организме. Участие минеральных веществ в формировании третичной и четвертичной структуры биополимеров. Ферменты-металлопротеиды. Становление ферментовмультимеров в присутствии ионов Мg2+, Мn2+, Zn2+ и Са2+. Ионы металлов и возникновение фермент-субстратных комплексов. Минеральные соединения и обмен нуклеиновых кислот. Роль минеральных элементов в обмене белков. Участие минеральных элементов в обмене белков. Участие минеральных соединений в обмене углеводов и липидов. Обмен минеральных веществ и его регуляция. Тема 11. Взаимосвязь и регуляция обмена веществ. Общие представления о взаимосвязи обмена веществ в клетке. Понятие о ключевых метаболитах. Взаимосвязь белкового и нуклеинового обмена, значение регуляторных белков. Взаимосвязь углеводного и белкового обмена. Роль пировиноградной кислоты и цикла Кребса в этой взаимосвязи. Взаимосвязь обмена углеводов и липидов. Уровни регуляции обмена веществ: клеточный, организменный и популяционный. Тема 12. Гормоны и их роль в обмене веществ. Биологическая роль гормонов. Химическая природа гормонов. Механизм взаимодействия гормона с рецептором. Гормоны гипоталамуса, строение молекул, биологическая роль, пути синтеза (кортикотропин, лютропин, фоллитропин, тиреотропин, пролактины, липотропины). Гормоны гипоталамуса (вазопрессин, окситоцин, рилизинггормоны). Гормоны щитовидной железы. Гормоны вилочковой железы. Гормоны надпочечников (мозгового и коркового вещества). Гормоны поджелудочной железы. Гормоны гонад. Нарушения гормонального баланса, причины и методы лечения. Тема 13. Основы биоэнергетики. Биологическое окисление. Субстратное и окислительное фосфорилирование. Дыхательная цепь. Механизмы образования и использования АТФ в живых системах. Модуль 2 «Молекулярная биология» Введение. Молекулярная биология – наука о механизмах хранения, воспроизведения, передачи и реализации генетической информации, о структуре и функции нуклеиновых кислот и белков. Роль биохимии, цитологии и генетики в становлении молекулярной биологии. Основные этапы развития молекулярной биологии. Современные теоретические и практические задачи, перспективы развития молекулярной биологии. Тема 1. Молекулярно-биологические методы анализа генома. Принципы молекулярно-биологических подходов, положивших начало молекулярной биологии гена: электрофорез в ПАА и агарозном гелях, в пульсирующем электрическом поле; молекулярная гибридизация, блот-гибридизация, энзиматическое введение метки в ДНК, рестрикционное картирование и секвенирование ДНК (метод Максама и Гилберта, метод Сэнгера, секвенирование с использованием микрочиповых технологий, пиросеквенирование и полони-секвенирование, секвенирование с помощью нанопор), молекулярное клонирование, амплификация ДНК in vitro ― ПЦР. Решаемые этими подходами задачи. Создание банков данных нуклеотидных последовательностей геномов разных организмов. Возникновение геномики, биоинформатики, функциональной геномики (транскриптомики, протеомики) и сопровождающих их технологий. Тема 2. Структура, физико-химические свойства и функции нуклеиновых кислот. Доказательства генетической функции нуклеиновых кислот. Химический состав нуклеиновых кислот. Пуриновые и пиримидиновые основания: строение, физико-химические свойства. Углеводный компонент. Нуклеозиды и нуклеотиды: строение и номенклатура, физико-химические свойства. Анти- и синконформации нуклеозидов и нуклеотидов. Минорные компоненты нуклеиновых кислот. Первичная структура нуклеиновых кислот. Фосфодиэфирная связь. Нуклеотидный состав ДНК и РНК. Вторичная структура ДНК. Модель Уотсона-Крика. Принцип комплементарности. Правила Э. Чаргаффа. Характеристика В, А, С, D, E-форм ДНК. Неканонические формы ДНК (Z, H, кресты, Р). Биологическое значение разных форм ДНК. Третичная структура ДНК. Сверхспирализация. Отрицательная и положительная суперспирализация Топоизомеразы I и II типа про- и эукариот, свойства, функции и механизм действия. Физико-химические свойства ДНК. Денатурация и ренатурация ДНК. Рибонуклеиновые кислоты, их классификация (тРНК, рРНК, иРНК, яРНК, вРНК). Сравнительная характеристика видов РНК по молекулярной массе, нуклеотидному составу, локализации и функциям. Вторичная и третичная структуры рибонуклеиновых кислот. Канонические и неканонические функции РНК, концепция «Мир РНК». Тема 3. Структурно-функциональная организация геномов прокариот и эукариот. Бактериальный геном. Характеристика геномной ДНК. Компактизация ДНК бактерий. Суперспирализованные петли нуклеоида. ДНК-связывающие белки петель, структура и функции. Роль доменной организации в функционировании бактериального генома. Геном эукариот. Структурные элементы генома: полипуриновые и полипиримидиновые блоки, обращённые повторы, сателлитная ДНК, умеренно повторяющиеся и уникальные последовательности. Функции структурных элементов генома. Основные свойства генома эукариот: избыточность, компактность, компартментализация и нестабильность. Отличия генома эукариот от генома прокариот. Структура хроматина. Основные компоненты хроматина (ДНК, гистоны, негистоновые белки, РНК): структура и функции. Уровни компактизации ДНК хроматина. Концепция нуклеосомной организации ДНК в хроматине. Высшие уровни организации хроматина: доменно-петлевой (60―80 нм) и фибрилла 100―130 нм, интерфазный хроматин, хромосома. Динамика хроматина и регуляция его компактизации. Фазирование нуклеосом. Подвижность (скольжение) нуклеосом. Основные пути формирования высших уровней организации хроматина: посттрансляционные модификации гистонов, гистоновый код, синтез различных форм линкерного гистона Н1 и степень связывания с элементами ядерного матрикса. Необходимость декомпактизации хроматина для протекания матричных процессов. Роль интерферирующих РНК в структурных перестройках хроматина и системном распространении сайленсинга. Пластичность (непостоянство) геномов. Явление транспозиции. Открытие транспозиции у бактерий. Перемещающиеся (мобильные) элементы бактерий (IS, Tn, эписомы, μ-подобные фаги), их характеристика, особенности. Функция транспозазы и резольвазы. Молекулярные механизмы транспозиции (репликативная и нерепликативная транспозиция). Мобильные элементы эукариот. Ретротранспозоны: ретровирусы и ретропозоны вирусного суперсемейства (Ty-элемент дрожжей, copia D. melanogaster, LINEs млекопитающих); их характеристика; механизм транспозиции. Ретропозоны невирусного суперсемейства SINE: В1, В2, Alu и процессированные псевдогены; их характеристика; механизм транспозиции. Мобильные элементы, ограниченные инвертированными повторами: Р-элемент дрозофилы и Ac-элемент кукурузы; механизм их транспозиции. Функции мобильных элементов генома. Возможная роль в эволюции. Тема 4. Репликация ДНК. Биосинтез ДНК у про- и эукариот. Полуконсервативный механизм репликации ДНК, предложенный Дж. Уотсоном и Ф. Криком. Компоненты реплицирующего аппарата клетки. ДНК-полимеразы I, II, III прокариот. Хеликазы. Топоизомераза I и II. Эукариотические ДНК-полимеразы:α, β, γ, отличия от ДНК-полимераз прокариот. ДНКлигаза. Механизм ДНК-полимеразной реакции. Этапы биосинтеза ДНК. Инициация репликации. Образование репликативного комплекса ферментов и белковых факторов. Формирование репликативной вилки. Праймосома: компоненты праймосомы. Праймаза, образование праймера. Ведущая и запаздывающая цепи ДНК. Синтез запаздывающей цепи прерывистым способом. Фрагменты Оказаки в про- и эукариотических клетках. Элонгация репликации. Терминация репликации. Биосинтез ДНК на РНК-матрице. РНКзависимая ДНК-полимераза. Точность процесса репликации. Тема 5. Репарация ДНК. Типы повреждений ДНК. Прямая репарация тиминовых димеров и метилированного гуанина. Гликозилазы. Урацилгликозилаза. Эксцизионная репарация, ферменты. Механизм преимущественной репарации транскрибируемых генов. Болезни, обусловленные дефектами репарации. Механизм репарации неспаренных нуклеотидов. Роль метилирования. SOS-репарация. Тема 6. Молекулярные основы генетической рекомбинации. Понятие об общей (гомологичной) и сайтспецифической рекомбинации. Различие молекулярных механизмов общей и сайтспецифической рекомбинации. Роль рекомбинации в пострепликативной репарации. Структуры Холлидея в модели рекомбинации. Миграция ветви, гетеродуплексы, разрешение структур Холлидея (ферменты). Энзимология рекомбинации у Е.соli. RесВCD комплекс. RесА белок. Пресинаптический филамент, параметры его молекулярной структуры. Обмен нитями при синапсе. Особенности миграции ветви. Рекомбинация у высших эукариот. Метод "нокаута" генов. Генная конверсия, асимметричность генной конверсии. Сайтспецифическая рекомбинация. Типы хромосомных перестроек, осуществляемых при сайтспецифической рекомбинации. Молекулярный механизм действия "рекомбиназ". Роль сайтспецифической рекомбинации в экспрессии генов у фагов. Интеграция фага λ. Сайтспецифическая рекомбинация двунитевой плазмиды дрожжей. Использование этой системы при анализе генов в развитии многоклеточных эукариот. Особенности рекомбинации при образовании генов иммуноглобулинов и рецепторов Т-клеток. Сигналы рекомбинации. Молекулярные механизмы "программированных ошибок" при слиянии вариабельных и константных участков гена. Матричные и нематричные механизмы достройки сшиваемых фрагментов. Тема 7. Обратная транскрипция. Роль обратной транскрипции в эволюции и изменчивости генома. Ретротранспозоны, их типы. Роль в поддержании интактности теломер. Ретротранспозоны, содержащие длинные концевые повторы. Ту-элемент дрожжей. Псевдогены. Возможные источники обратной транскриптазы. Тема 8. Транскрипция. Биосинтез РНК. Промоторы: особенности их нуклеотидных последовательностей. ДНК-зависимая РНК-полимераза Е.coli: субъединичная структура. Роль σ-фактора в транскрипции. РНК-полимеразы А, В и С эукариотических клеток: внутриядерная локализация. Асимметричность считывания с цепей ДНК. Этапы транскрипции: инициация, элонгация и терминация. Зависимая и независимая от ρ-фактора терминация транскрипции. Особенности транскрипции у эукариот. Регуляция экспрессии генов на уровне транскрипции. Работы Жакоба и Моно. Белки-регуляторы (активаторы и репрессоры). Регуляция экспрессии лактозного оперона: негативная регуляция, позитивная регуляция комплексом сАМР-БАК (белок-активатор катаболизма). Тема 9. Процессинг первичных транскриптов в про- и эукариотных клетках. Определение процессинга. Интроны, сплайсинг. Классификация интронов. Интроны группы 1. Особенности структуры и механизмы сплайсинга. Рибозимы, их специфичность. Возможности применения для "нокаута" мРНК и химиотерапии. Интроны группы 2, механизм сплайсинга. Интроны групп 1 и 2 у разных организмов (эволюционные связи). Сплайсинг пре-мРНК в ядре. Роль малых ядерных РНК и белковых факторов. Сплайсосома. Особенности процессинга тРНК и рРНК у бактерий. Особенности процессинга рРНК в ядрышке. РНКаза Р как рибозим. Транс-сплайсинг, его распространение. Альтернативный сплайсинг, примеры. Биологические последствия альтернативного сплайсинга. Редактирование РНК. Молекулярные механизмы. Типы редактирования (примеры). Редактирование и проблема установления биологического кода. Тема 10. Трансляция (биосинтез белка). Генетический код: основные характеристики. Биосинтез белка. Белоксинтезирующий аппарат клетки. Синтез белка в прокариотических клетках. Активирование аминокислот. Характеристика аминоацилтРНК-синтетаз. Строение рибосом, формирование функциональных центров. Инициация трансляции. Белковые факторы инициации. Образование функционально активной 70Sрибосомы. Элонгация трансляции. Белковые факторы элонгации. Последовательность событий в процессе элонгации. Элонгация – циклический процесс. Терминация трансляции. Белковые факторы терминации. Точность процесса трансляции. Энергетические затраты на синтез белка. Ингибиторы трансляции. Посттрансляционное сворачивание белковой молекулы. Роль шаперонов в этом процессе. Посттрансляционная модификация белков. 1.6.3 Темы для самостоятельного изучения. № п/п Наименование раздела дисциплины. Тема. Форма самостоятельной работы Колво часов Форма контроля выполнения самостоятельной работы 1. 2. 3. 4. 5. 6. 7. Раздел «Статическая Тесты для самоконтроля биохимия» знаний, расчетнографические задания, рефераты Раздел «Динамическая Тесты для самоконтроля биохимия знаний, расчетнографические задания, рефераты Тема «Биологически Тесты для самоконтроля активные вещества» знаний, расчетнографические задания, рефераты Методы молекулярной вопросы для биологии самостоятельного изучения Структура Контрольная работа нуклеиновых кислот, репликация, рекомбинация Транскрипция; Контрольная работа генетический код, его свойства; трансляция Структурновопросы для функциональная самостоятельного организация геномов изучения прокариот и эукариот 8 Проверка выполнения тестов, РГЗ, рефератов 6 Проверка выполнения тестов, РГЗ, рефератов 4 Проверка выполнения тестов, РГЗ, рефератов 4 Семинар 6 Проверка контрольной работы 6 Проверка контрольной работы 2 Семинар 1.7 Методические рекомендации по организации изучения дисциплины. 1.7.1 Тематика и планы аудиторной работы студентов по изученному материалу (планы последовательного проведения занятий: ПР, СМ, ЛБ) по предлагаемой схеме: тема; план; вопросы для коллективного обсуждения; задания для самостоятельной работы; литература (основная, дополнительная). Модуль «Биохимия» Лабораторные занятия Лабораторная работа №1 Реакции в растворах белков Опыт 1. Высаливание белков. Ход работы: к коллоидному раствору желатина или белка куриного яйца добавьте несколько кристаллов хлорида натрия. Наблюдается выпадение хлопьев белка (осаждение). Добавьте несколько миллилитров воды до исчезновения хлопьев. Объясните причину выпадения и исчезновения хлопьев белка. Опыт 2. Определение изоэлектрической точки желатина по коагуляции Ход работы: в три пробирки налейте по 0,5 мл буферных растворов (или растворов соляной кислоты) с рН равной 3,7; 4,7; 5,7. В каждую пробирку добавьте по 0,5 мл раствора желатина. Коагуляции не происходит, так как желатин – гидрофильный белок, обладающий двумя факторами устойчивости: зарядом молекулы и гидрофильной оболочкой. Затем во все пробирки прилейте по 1 мл 96% этилового спирта. В одной из пробирок должна произойти коагуляция. Объясните, почему без добавления спирта коагуляции не наблюдается, а после – выпадают хлопья белка. Опыт 3. Обнаружение белков и пептидов в растворах биуретовой реакцией Ход работы: к 1 мл раствора белка куриного яйца добавить 1 мл свежеосажденного Cu(ОН)2 ( для этого смешать в отдельной пробирке 1 мл 10% р-ра NaOH и две капли 1% р-ра CuSO4). При необходимости подогреть на спиртовке. Постепенно появляется розовофиолетовое окрашивание. Запишите уравнение реакции : Вопросы для коллективного обсуждения: Аминокислоты: строение молекулы, физические и химические свойства Амфотерность аминокислот Опыт 4. Обнаружение в белке аминокислот с циклическим радикалом с помощью ксантопротеиновой реакции. К 1 мл р-ра белка куриного яйца добавить 5-6 капель концентрированной азотной кислоты. Пробирку осторожно нагрейте в пламени спиртовки. Появляется желтое окрашивание за счет нитрования бензольного кольца. Запишите уравнение реакции нитрования на примере тирозина: Опыт 5. Обнаружение в белке аминокислот, содержащих серу с помощью реакции Фоля. В пробирку налейте 1 мл р-ра белка куриного яйца, добавьте 5 капель 30% р-ра NaOH и 1 каплю 5% р-ра уксуснокислого свинца. Нагревайте содержимое пробирки в пламени спиртовки в течение нескольких минут. Наблюдается появление черного осадка сернистого свинца. Запишите уравнение реакции Фоля, происходящей в две стадии: Отщепление SH-групп аминокислот и переход серы из органического соединения в неорганическое: Образование сульфида свинца. Лабораторная работа № 2по теме «Липиды» Опыт 1. Обнаружение непредельных жирных кислот В пробирку поместите 8-10 капель бромной воды, добавьте 2-3 капли растительного масла. Пробирку встряхните. Наблюдается обесцвечивание бромной воды, так как бром присоединяется по месту двойной вязи в остатке жирной кислоты. Запишите реакцию взаимодействия олеиновой кислоты с бромной водой. Опыт 2. Омыление жиров В фарфоровую чашку поместите 0.5 мл касторового масла и 4-5 капель 35% раствора гидроксида натрия. Поставьте чашку на электрическую плитку при небольшом нагреве, постоянно помешивая содержимое стеклянной палочкой, пока не появится однородная, прозрачная, желтоватая жикость. Добавьте 2 мл дистиллированной воды и продолжайте помешивать до полного упаривания воды, после чего снимите с плитки. Запишите уравнение реакции омыления на примере триглицерида, образованного двумя остатками пальмитиновой и одним остатком олеиновой кислоты Опыт 3. Окрашивание запасных жиров семянки подсолнечника реактивом Судан III Семя подсолнечника раздавите между двумя предметными стеклами, нанесите каплю раствора реактива Судан III. Липиды окрашиваются в розовый цвет Вопросы для коллективного обсуждения: Классификация липидов Жирные кислоты (строение молекулы). Написать на доске структурные формулы капроновой, пальмитиновой, стеариновой, олеиновой, линолевой, линоленовой Гидрогенизация жирных кислот. Написать на доске уравнение реакции гидрогенизации любой непредельной жирной кислоты. Функции дипидов (глицеридов и восков, фосфолипидов, гликолипидов, стероидов) Вопросы для самостоятельной работы: Сравнить физические свойства олеиновой и арахидоновой кислоты Лабораторная работа №3 Решение задач Составить структурную формулу трипептида, состоящего из указанных аминокислот и определить его суммарный заряд (+ или -) 1. серин, аланин, цистеин 2. метионин, глицин, лейцин 3. аланин, фенилаланин, глицин 4. глутаминовая кислота, серин, глицин 5. аргинин, глицин, аланин 6. глутамин, аспарагин, серин 7. цистеин, глицин, аланин 8. треонин, аланин, метионин 9. Валин, лейцин, серин 10. глицин, лейцин, глутаминовая кислота 11. глутамин, аланин, лейцин 12. Валин, цистеин, аланин Вопросы для коллективного обсуждения: Уровни организации белковых молекул: первичный, вторичный, третичный, четвертичный. Связи, обеспечивающие поддержание эти структур. Денатурация белка: обратимая и необратимая. Классификация белков в связи с выполняемыми функциями Классификация белков по химическому составу (простые и сложные, примеры) Природные пептиды, примеры, функции. Классификация ферментов по катализируемой реакции Лабораторная работа № 4 Качественные реакции на углеводы Опыт 1. Реакция Троммера В пробирку поместите 1 мл 1% раствора глюкозыи несколько капель раствора свежеосажденного гидроксида меди ( к 1-2 мл раствора NaOH прилейте несколько капель раствора CuSO4). Подогрейте пробирку на спиртовке. Происходит образование осадка закиси меди оранжево-красного цвета. Глюкоза окисляется до глюконовой кислоты. Запишите уравнение реакции (глюкоза в виде линейной молекулы) Опыт 2. Реакция серебряного зеркала В чистую пробирку поместите 5 капель 0,2 н. раствора AgNO3, 5 капель 2 н. NaOH и несколько капель (до растворения осадка) NH4OH. Образуется аммиачный раствор оксида серебра Ag2O. К полученному раствору добавьте 4-5 капель 1% раствора глюкозы и слегка нагрейте в пламени спиртовки. В результате образуется осадок металлического серебра, выпадающий на дно или оседающий на стенках пробирки в виде серебряного зеркала. Глюкоза окисляется до глюконовой кислоты Запишите уравнение реакции взаимодействия глюкозы (в линейной форме) с оксидом серебра Опыт 3. Обнаружение восстанавливающих сахаров с помощью реактива Фелинга В пробирку поместите по 1 мл раствора Фелинга I и II, добавьте несколько капель 1% раствора глюкозы, нагрейте в пламени спиртовки. Выпадает красный осадок Cu2O. Глюкоза восстанавливается с образованием многоатомного спирта сорбита Вопросы для коллективного обсуждения: 1. Строение и изомерия моносахаридов 2. Классификация углеводов 3. Химические свойства моносахаридов 4. Значение углеводов Лабораторная работа № 5 Витамины Опыт 1 Восстановление рибофлавина В пробирку налейте 1 мл раствора рибофлавина, добавьте 1 мл концентрированной серной кислоты и несколько цинковых стружек. Раствор сначала окрашивается в розовый цвет, а затем обесцвечивается. В ходе реакции выделяется водород. Определите, какое вещество является восстановителем рибофлавина в этой реакции. Опыт 2. Реакция на витамин РР В пробирку поместите несколько кристаллов сухого витамина РР ( или 1-2 мл раствора витамина в 10% уксусной кислоте), нагрейте до кипения и добавьте 1-2 мл 5% раствора ацетата меди. Жидкость становится мутной, затем окрашивается в голубой цвет, а при стоянии выпадает синий осадок медной соли никотиновой кислоты. Запишите формулу медной соли никотиновой кислоты. Опыт 3. Реакция на пиридоксин В пробирку налейте 1 мл водного раствора пиридоксина, добавьте 2 капли 5% раствора хлорида железа III, пробирку встряхните. Происходит окрашивание жидкости в красный цвет вследствие образования комплексной соли фенолята железа. Запишите формулу фенолята железа. Вопросы для коллективного обсуждения 1. Каковы источники водорастворимых витаминов? 2. Какова биологическая роль витаминов? 3. Антиоксидантная функция витаминов Вопросы для самостоятельного изучения Устойчивость витаминов в процессе кулинарной обработки продуктов Потери витаминов при хранении продуктов Лабораторная работа №6 Количественное определение витаминов Опыт 1. Количественное определение аскорбиновой кислоты йодиметрическим титрованием в овощах и фруктах 2 г растительного материала тщательно измельчите в ступке с небольшим количеством битого стекла или натрите на терке, добавьте 10 мл 2% раствора соляной кислоты. Полученную массу отфильтровать в колбу на 50-100 мл через бумажный фильтр в стеклянной воронке, добавляя на фильтр небольшими порциями воду. В фильтрат прилить 1 мл 0,5% раствора крахмала и титровать рабочим раствором 0,003 н. I2 до появления синего окрашивания. Рассчитайте содержание витамина С по формуле М=( н*Э/1000) *V, где н – молярная концентрация эквивалента йода Э – молярная масса эквивалента аскорбиновой кислоты, равная в данном случае 88 г V – объем использованного н6а титрование йода в мл. Для перерасчета на содержание витамина С в 100 г продукта используйте формулу Х = (М*1000)/2 Сравните результаты, полученные с различным растительным сырьем (сырой и вареный картофель, яблоки, апельсины, другие фрукты и овощи) Лабораторная работа №7 Липиды Опыт 1. Получение масляного экстракта каротинов Измельчите на мелкой терке 20 г растительного материала, поместите в делительную воронку, прилейте 50 мл воды и 20 мл растительного масла. Встряхивайте делительную воронку в течение минуты. Дайте смеси отстояться, после чего отделите масляный экстракт. Для опыта можно использовать свежие и замороженные овощи и фрукты (морковь, сладкий перец, тыкву, помидоры), а также пюре и соки с мякотью Опыт 2. Определение йодного числа растительных масел В коническую колбу на 50-100 мл налейте 5 мл 10% раствора растительного масла в хлороформе, добавьте 1-2 капли 2% раствора крахмала. Оттитруйте смесь 0,05% раствором йода до появления синей окраски. Рассчитайте йодное число – количество йода в граммах, присоединяющегося к 100г масла. Практические занятия Тема: ОБМЕН ЛИПИДОВ Контрольные вопросы: 1. Какие железы пищеварительного тракта выделяют ферменты, действующие на липиды? 1. Напишите реакцию гидролиза нейтрального жира и лецитина. 2. Какова роль желчи в переваривании и всасывании липидов? 3. Чем отличается жир, синтезированный в стенке кишечника, от пищевого жира? 4. Каким путем транспортируется жир от стенки кишечника к тканям? 5. Какие ткани являются жировыми депо? 6. Какие ферменты производят гидролитическое расщепление липидов в органах и тканях? 7. -окисления на примере капроновой кислоты. 8. Какова судьба водорода, отщепленного дегидрогеназами от жирных кислот в -окисления? -окислении жирных кислот? 10. Какие продукты неполного окисления жирных кислот могут накапливаться в крови и выделяться с мочой и в каких случаях это бывает? 11. Какие железы внутренней секреции участвуют в регуляции липидного обмена? Тема: ОБМЕН БЕЛКОВ Контрольные вопросы: 1. Какие железы пищеварительного тракта выделяют ферменты, действующие на белки? 2. Какова роль соляной кислоты желудочного сока в переваривании белков? 3. Где и в результате каких превращений образуются токсические продукты – фенол, крезол, индол, скатол, аммиак? Каким образом и где происходит их обезвреживание в организме? 4. Назовите основные реакции промежуточного обмена аминокислот. 5. Какие гормоны образуются в организме из аминокислот? 6. Как определить азотистый баланс и вычислить, какое количество белка распалось в организме? Тема: БИОХИМИЧЕСКАЯ АДАПТАЦИЯ ОРГАНИЗМА К МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ Контрольные вопросы: 1. В чем состоит сущность процессов адаптации организма к физическим нагрузкам? 2. На какие два этапа подразделяют адаптацию организма к физическим нагрузкам? Дайте характеристику каждого этапа. 3. Как изменяется соотношение интенсивности анаэробных и аэробных процессов: а) в состоянии покоя; б) в начале мышечной работы; в) при дальнейшей деятельности; г) в период отдыха? 4. Почему МПК спринтера меньше МПК лыжника? Приведите схему последовательного включения различных механизмов ресинтеза АТФ в организме спринтера и лыжника в период тренировочного процесса. 5. Как можно объяснить состояние утомления с точки зрения биохимических процессов, протекающих в мышцах? 6. На примере восстановления запасов креатинфосфата в мышцах в период отдыха объясните явление суперкомпенсации. Тема: БИОХИМИЧЕСКИЕ ОСНОВЫ И ПРИНЦИПЫ СПОРТИВНОЙ ТРЕНИРОВКИ Контрольные вопросы: Каковы основные принципы спортивной тренировки? Как они согласуются с процессами адаптации организма к мышечной нагрузке? Каковы правила выбора момента повторения работы на основании явления суперкомпенсации? В чем заключается специфичность биохимической адаптации организма в процессе тренировки? Приведите примеры. По каким биохимическим показателям отличается тренированный организм от нетренированного? Каковы основные принципы питания спортсменов? Используя формулу сбалансированного питания спортсменов, рассчитайте количество (в г) белков, жиров и углеводов в суточном рационе: а) лыжника; б) велогонщика; в) хоккеиста; г) боксера. Модуль «Молекулярная биология» Лабораторные занятия Лабораторная работа № 1. Идентификация патогенных бактерий с использованием полимеразной цепной реакции (виртуальная лаборатория). План работы: 1. Выделение тотальной бактериальной ДНК из образцов проб крови пациентов. 2. Амплификация фрагментов ДНК, кодирующих 16S рРНК. 3. Секвенирование фрагментов ДНК. 4. Анализ полученных последовательностей ДНК и идентификация бактерий. Вопросы для коллективного обсуждения: 1. Как осуществляется полимеразная цепная реакция? Для чего ее используют? 2. Как отделить фрагменты ДНК, необходимые для данного анализа, от других фрагментов ДНК? 3. Как работает ДНК-секвенсор? Лабораторная работа № 2. Синтез РНК и белка. План работы: решение задач по теме. Вопросы для коллективного обсуждения: Отличительные особенности транскрипции у прокариот и эукариот. Регуляция транскрипции. Свойства генетического кода. Этапы синтеза белка в клетке. Регуляция трансляции у прокариот и эукариот. Лабораторная работа № 3. Репликация. Механизмы репарации. План работы: решение задач по теме. Вопросы для коллективного обсуждения: Белки и ферменты, участвующие в репликации ДНК. Принципы репликации. Обратная транскрипция. Типы репарации ДНК. Лабораторная работа № 4. Механизмы генетической рекомбинации. План работы: решение задач по теме. Вопросы для коллективного обсуждения: Типы генетической рекомбинации. Молекулярный механизм гомологической рекомбинации. Сайт-специфическая рекомбинация. Конверсия генов. Лабораторная работа № 5. Вирусы, плазмиды и транспозоны. План работы: решение задач по теме. Вопросы для коллективного обсуждения: 1. Типы генетического материала и механизм его репликации у разных вирусов. 2. Типы взаимодействия вируса с клеткой-хозяином. 3. Бактериальные плазмиды и эписомы. 4. Подвижные генетические элементы бактерий и эукариот. 1.8 Учебно-методическое обеспечение дисциплины. 1.8.1 Рекомендуемая литература учебные издания: учебники и учебные пособия, включая (при наличии) их электронные версии: основная: Биологическая химия: метод. пособие / Федер. агентство по образованию, Мурм. гос. пед. ун-т; сост. И.А. Ерохина. - Мурманск: МГПУ, 2008. - 62 с. Кнорре Д.Г. Биологическая химия: Учебник для вузов / Д.Г. Кнорре, С.Д. Мызина. - 3.изд.,испр. - М.: Высшая школа, 2003. - 479 с. Кнорре Д.Г. Биологическая химия: Учебник для студ. хим., биол. и мед. спец. вузов / Д.Г. Кнорре, С.Д. Мызина. - 3.изд., испр. - М.: Высшая школа, 2002. - 479 с. Комов В. П. Биохимия: учебник для студ. вузов / В.П. Комов, В.Н. Шведова. - М.: Дрофа, 2004. - 638 с. Костюк В.А. Биорадикалы и биоантиоксиданты / В.А. Костюк, А.И. Потапович. Минск: БГУ, 2004. - 179 с. Кнорре Д.Г. Биологическая химия: Учебник для хим., биол. и мед. спец. вузов / Д.Г. Кнорре, С.Д. Мызина. - 3.изд., испр. - М.: Высшая школа, 2000. - 479 с. Коничев А.С. Молекулярная биология: Учебник для вузов / А.С. Коничев, Г.А. Севастьянова. - М.: Академия, 2003. - 400 с. Коничев А.С. Молекулярная биология: учебник для студ. вузов, обуч. по спец. 032400 "Биология" / А.С. Коничев, Г.А. Севастьянова. - 2-е изд., испр. - М.: Академия, 2005. - 400 с. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. ― М.: Высшая школа, 1990 Плотникова С.В. Основные биоорганические соединения, рассматриваемые в курсе биохимии и молекулярной биологии: Учебно-метод. пособие: В 2 ч. / С.В. Плотникова; М-во образования РФ, МГПИ. - Мурманск, 2001. - 25 с. Похольченко Л. А. Медицинская биохимия: учеб. пособие для студ. вузов, обуч. по спец. 020201.65 "Биология" / Л.А. Похольченко; Федер. агентство по рыболовству, ФГОУВПО "Мурм. гос. техн. ун-т". - Мурманск, 2008. - 122 с. Проскурина И. К. Биохимия : Учеб. пособие для студ.вузов / Проскурина И. К. - М. : ВЛАДОС-ПРЕСС, 2003. - 240 с. Рогожин В. В. Практикум по биологической химии: учеб.-метод. пособие / В.В. Рогожин. - СПб.: Лань, 2006. - 256 с. Степанов В.М. Молекулярная биология. Структура и функции белков. ― М.: Высшая школа, 1996 дополнительная. 1. Албертс Б., Брей Д, Льюис Ж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология клетки. Т. 1-3. М.: Мир, 1994 2. Ашмарин И.П. Молекулярная биология. Л.: Изд-во ЛГУ, 1977 3. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.:Наука, 1987 4. Биотехнология / Отв. ред. А.А.Баев. ― М.: Наука, 1984 5. Браунштейн А.Е. На стыке химии и биологии. М.: Высшая школа. 1994 6. Диксон М., Уэбб Э. Ферменты. М.: Мир.1982 7. Зенгбуш П. Молекулярная и клеточная биология. ― М.: Мир, 1982. ― Т. 1-3 8. Кантор Ч., Ширмер Р. Принципы структурной организации белков. М.: Мир, 1982 9. Кнорре Д.Г., Мызина С.Д. Биологическая химия, М. : «Высшая школа» 2000 г. 10. Коротяев И., Лищенко Н.Н. Молекулярная биология и медицина. ― М.: Медицина, 1987. 11. Ленинджер А. Основы биохимии.Т. 1-3. М.: «Мир». 1986 г 12. Льюин Б. Гены. – М.: «Мир», 1987. 13. Методы анализа белков и нуклеиновых кислот в тканях и органах насекомых: Методические разработки / Под ред. Ю.Б.Филипповича, Г.А. Севастьяновой. - Ч. 1. - М.: МГПИ им. В.И. Ленина, 1980. 14. Мецлер Д. Биохимия . Т. 1-3. М.: Мир. 1980 г. 15. Молекулярная биология клетки / Б.Альбертс и др. ― М.: Мир, 1994. ― Т. 1-3 16. Мусил Я., Новакова О., Кунц К. Современная биохимии в схемах . М.: Мир.1984. 436 с. 17. Овчинников Ю.А. Биоорганическая химия . М.:Просвещение. 1987 327 с. 18. Патрушев Л.И. Экспрессия генов. – М.: Наука, 2000. 19. Практикум по биохимии / Под ред. С.Е.Северина, Г.А.Соловьевой. ― М.: Изд-во МГУ, 1989. 20. Проблемы и перспективы молекулярной генетики. Том 1 / Отв. ред. Е.Д. Свердлов – М.: Наука, 2003. 21. Программируемая клеточная гибель/ Под ред. В.С.Новикова. ― СПб.: Наука, 1996. 22. Пустовалова Л.М. Практические работы по биохимии. Ростов на Дону.: «Феникс» 2004 г. 319 с. 23. Роллер Э. Открытие основных законов жизни. ― М., 1978. 24. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. 25. Телитненко М.М., Остроумов С.А. Введение в проблемы биохимической экологии. ― М.: Наука, 1990. 26. Филиппович Ю.Б. Основы биохимии. М.: Высшая школа.1994 27. Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. ― М.: Просвещение, 1982. 28. Уотсон Дж., Туз Дж., Курц Д. Рекомбинантые ДНК. ― М.: Мир, 1986. 1.9 Материально-техническое обеспечение дисциплины (учебные и учебнометодические средства дистанционного обучения: специализированные учебники с мультимедийными сопровождениями, электронные учебно-методические комплексы, включающие электронные учебники, учебные пособия, тренинговые компьютерные программы, компьютерные лабораторные практикумы, контрольно-теститирующие комплекты, учебные видеофильмы, аудиозаписи, иные материалы, предназначенные для передачи по телекоммуникационным каналам связи). 1.9.1 Перечень используемых технических средств. Используется мультимедийный проектор, компьютер, фотоэлектрокалориметр, весы 1.9.2 Перечень используемых пособий. 1.9.3 Перечень видео- и аудиоматериалов программного обеспечения. Мультимедийные презентации по темам: «Обмен азота», «Углеводы», «Водораствормые витамины», «Жирорастворимые витамины»; CD “Holiday Lectures on Science CD-ROM” (Virtual Bacterial ID Lab). 1.10 Примерные зачетные тестовые задания. Модуль «Биохимия» Тестовые задания по теме «Аминокислоты и белки» 1. Реакция с азотнокислым свинцом используется для обнаружения а дикарбоновых кислот б аминокислот, имеющих гидроксогруппу в диаминокислот г аминокислот, содержащих серу 2. К аминокислотам с гидрофобным радикам относятся а валин и аланин б серин и лейцин в валин и аргинин г глутаминовая кислота и серин 3. Отрицательно заряженный радикал имеется у а фенилаланин б тирозин в аспарагиновая кислота г серин 4. К фибриллярным белкам можно отнести а коллаген б альбумины крови в глобулины крови г белки плазмы крови 5. К гетероциклическим соединениям относится а метионин б тирозин в гистидин г цистеин 6. Участок белковой молекулы длиной 15, 3 нм состоит из а 100 аминокислотных остатков б 102 аминокислотных остатков в 112 аминокислотных остатков г 200 аминокислотных остатков 7. Глобин (белковый компонент гемоглобина включает в себя а ά- и β- цепи б только β- цепи в ά- цепи г ά- и β- цепи, а также участки с неупорядоченной структурой 8. Изоэлектрическая точка это а участок аминокислотной цепочки б определенное значение рН в температура, при которой происходит денатурация белков г температура, при которой происходит ренатурация белков 9. К сложным белкам относятся а коллаген б оксидоредуктазы в актин г миозин 10. Белковую часть ферментов называют а коферментом б кофактором в апоферментом г протомером Модуль «Молекулярная биология» 1. Произошла мутация в кодирующей последовательности 5'- CAG ААТ АСС TGA TTG ATA GCA -3'Мутантная последовательность имеет вид: 5'- CAG AAT ACT GAT TGA TAG CA -3' Определите характер мутации: А) делеция Б) нонсенс В) сдвиг рамки считывания 2. Нормальная аллель гена содержит 2 сайта узнавания для рестриктазы R, расстояние между которыми составляет 4 кб. Мутантная аллель возникла в результате замены пары оснований, приведшей к появлению дополнительного сайта рестрикции. Определите генотип пациента по приведенному результату рестрикционного анализа: 4 кб 2.5кб 1.5кб А) нормальная гомозигота Б) мутантная гомозигота В) гетерозигота 3. Для работы ДНК-полимеразы необходимо наличие: A) однонитевой матричной ДНК Б) инициируещего кодона B) двунитевого участка на 3' конце молекулы Г) четырех типов дезокситрифосфатов Д) транспортных РНК 4. Идентификация в геномной ДНК участков, комплементарных ДНК-зонду, может осуществляться методом: A) Нозерн блот-гибридизации Б) Вестерн блот-гибридизации B) блот-гибридизации по Саузерну Г) гибридизации in situ на хромосомных препаратах Д) гибридизации in situ на гистологических препаратах 1.11 Примерный перечень вопросов к зачету (экзамену). Модуль «Биохимия» 1. Аминокислоты: строение молекул, химические свойства, изомерия, классификация. Заменимые и незаменимые аминокислоты 2. Белки: уровни организации белковой молекулы, классификация белков 3. Биологическая роль белков 4. Ферментативный катализ. Классификация ферментов. Структура ферментов. Факторы, влияющие на активность ферментов. Механизм действия ферментов 5. Углеводы: классификация углеводов, изомерия, физические и химические свойства моносахаридов 6. Полисахариды: строение молекул, физические и химические свойства важнейших полисахаридов (целлюлоза, крахмал, хитин и др.) 7. Олигосахариды: строение молекул, физические и химические свойства. 8 Биологическая функция углеводов 9. Липиды. Строение молекул, физические и химические свойства. Классификация липидов 10. Биологическая роль липидов 11. Метаболизм азота: синтез и распад аминокислот. Цикл мочевины. 12. Распад и синтез гема и азотистых оснований 13. Обмен углеводов: утилизация углеводов в энергетическом обмене. Гликолиз и цикл Кребса. 14. Синтез углеводов. Глюконеогенез. Нарушения обмена углеводов 15. Взаимодействие ферментных систем синтеза и распада углеводов. Локализация отдельных процессов в организме животных 16. Обмен липидов. β-окисление и синтез жирных кислот. Образование кетоновых тел и пути их обезвреживания. Перекисное окисление липидов 17. Витамины: водорастворимые витамины, их классификация, источники поступления в организм, суточная потребность и биологическая роль. 18. Жирорастворимые витамины: их классификация, источники поступления в организм, суточная потребность и биологическая роль. 20 Витаминоподобные вещества. Антивитамины. 21. Гормоны. Классификация гормонов, пути их синтеза, биологическая роль. Нарушения гормонального баланса 22. Нуклеиновые кислоты: строение, физические и химические свойства. Биосинтез нуклеиновых кислот Модуль «Молекулярная биология» 1. Предмет и задачи молекулярной биологии. Предпосылки ее возникновения, основные открытия. Перспективы развития молекулярной биологии. 2. Физические, биохимические и биологические методы исследования в молекулярной биологии. 3. Первичная структура ДНК. Межнуклеотидная связь. Нуклеазы рестрикции. Физическое картирование ДНК. Секвенирование ДНК. 4. Вторичная структура ДНК. Правила Э. Чаргаффа. Модель ДНК Дж. Уотсона и Ф. Крика. Полиморфизм двойной спирали ДНК. Сверхспирализация ДНК. 5. Третичная структура ДНК вирусов и бактерий. Уровни организации хроматина в эукариотических клетках. 6. Доказательства генетической роли ДНК. Полуконсервативный механизм репликации ДНК (работы М. Мезельсона и Сталя). 7. Репликация ДНК. Ферменты репликации. Точность синтеза ДНК и коррекция. Основные принципы репликации. 8. Особенности репликации у прокариот и эукариот. Топологические проблемы репликации. Регуляция репликации. 9. Репарация ДНК и ее виды: прямая реактивация, темновая репарация, эксцизионная репарация. SOS-репарация. Репарация неспаренных нуклеотидов. 10. Молекулярные механизмы гомологичной рекомбинации. Генная конверсия. Сайтспецифическая рекомбинация. 11. Транскрипция у прокариот. Структура РНК-полимеразы. Цикл транскрипции. Понятие об опероне. Регуляция транскрипции у прокариот. 12. Особенности транскрипции у эукариот. Факторы транскрипции. Энхансеры и сайленсеры. Механизмы активации белков-регуляторов транскрипции. Значение гормонов в регуляции транскрипции. 13. Подвижные генетические элементы прокариот и эукариот, механизмы их перемещения и роль в эволюции. 14. Денатурация и ренатурация ДНК. Метод реассоциации в изучении генома эукариот. Сателлитная ДНК. Умеренные повторы и уникальные последовательности генома. Мозаичность строения эукариотических генов. 15. Репликация и транскрипция вирусных геномов. 16. Процессинг первичных транскриптов у прокариот и эукариот. Регуляция экспрессии генов путем альтернативного сплайсинга. Транс-сплайсинг. 16. Процессинг иРНК у прокариот и эукариот. Механизм сплайсинга и его виды. Регуляция экспрессии генов путем альтернативного сплайсинга. Транс-сплайсинг. Редактирование РНК. 17. Процессинг рРНК и тРНК у прокариот и эукариот. Аутосплайсинг. Природные и синтетические рибозимы (нуклеозимы, минизимы) и перспективы их использования. 17. Обратная транскрипция. Роль обратной транскрипции в эволюции и изменчивости генома. Ретротранспозоны, их типы. Псевдогены. 18. Аминокислотный состав белков. Пептиды. Первичная структура белков. Структурные особенности пептидной связи. Методы определения первичной структуры белка. 19. Вторичная структура белков. α-Спираль, β-структура, β-изгиб. Оптические методы изучения вторичной структуры. Прионизация белков. 20. Третичная структура белков. Денатурация и ренатурация белка. Молекулярные шапероны. Методы изучения третичной структуры белков. 21. Четвертичная структура белка и ее функциональное значение. Методы исследования четвертичной структуры белков. 22. История открытия информационной РНК. Структура иРНК. Расшифровка генетического кода. Основные свойства генетического кода. 23. История открытия транспортных РНК. Структура тРНК. Аминоацил-тРНК-синтетазы. Аминоацилирование тРНК. 24. Рибосомы, их локализация в клетке. Рибосомные РНК и белки. Четвертичная структура рибосом. Структурные превращения рибосом. Прокариотический и эукариотический типы рибосом. Полирибосомы. Бесклеточные системы трансляции. 25. Инициация трансляции. Общие принципы, значение, основные этапы инициации. Инициация трансляции у прокариот и эукариот. Белковые факторы инициации. 26. Элонгация трансляции. Поступление аминоацил-тРНК в рибосому. Транспептидация. Транслокация. Факторы элонгации. 27. Терминация трансляции: терминирующие кодоны, белковые факторы терминации, гидролиз пептидил-тРНК. 28. Регуляция трансляции. Трансмембранный перенос белков. Котрансляционные и посттрансляционные модификации белков. 1.12 Комплект экзаменационных билетов (утвержденный зав. кафедрой до начала сессии). Хранится на кафедре естественных наук. 1.13 Примерная тематика рефератов. Модуль «Биохимия» Биологически активные амины Искусственный синтез гормонов Сахарный диабет: причины возникновения, способы лечения и профилактики Методы медицинского контроля обмена азота Хитин, его природные формы, производные, биологическая роль и пути использования человеком Водорастворимые формы жирорастворимых витаминов Взаимодействие витаминов с различными продуктами питания Всасывание жирорастворимых витаминов в кишечнике Биохимическая роль печени Биохимия мышечного сокращения Нейропептиды Модуль «Молекулярная биология» 1. ДНК ― материальный носитель наследственной инфор мации. 2. Биосинтез белка в клетке. 3. Транскрипция и трансляция. 4. Генетический код и его свойства. 5. Регуляция белкового синтеза. 6. Строение и функции гена. 7. Химический и ферментативный синтез генов. Выделение генов. 8. Современное представление о гене. 9. Генетическая инженерия. 1.14 Примерная тематика курсовых работ. Запасные углеводы луковичных культур Влияние фитогормонов на запасание углеводов в луковицах тюльпанов 1.15 Примерная тематика квалификационных (дипломных) работ. Нарушение обмена углеводов у жителей Крайнего Севера 1.16 Методика(и) исследования (если есть). 1.17 Бально-рейтинговая система, используемая преподавателем для оценивания знаний студентов по данной дисциплине. Бально-рейтинговая система при изучении биохимии не применяется РАЗДЕЛ 2. Методические указания по изучению дисциплины (или её разделов) и контрольные задания для студентов заочной формы обучения. Студенту-заочнику в контрольной работе следует в сжатой форме изложить основные положения темы, ответить на поставленные вопросы, решить задачи, сделать (при необходимости) схематические зарисовки с соответствующими пояснениями. Решение задач по молекулярной генетике предусматривает знание молекулярных основ наследственности: кодирование генетической информации, процессов репликации ДНК, прин ципов транскрипции и трансляции наследственной информации. Курс насыщен большим количеством специальных терминов. Для их усвоения необходимо выписать незнакомые термины и дать им объяснения. В рекомендуемых учебниках приводится краткий словарь терминов, можно пользоваться также биологическими энциклопедическими словарями. РАЗДЕЛ 3. Содержательный компонент теоретического материала. Теоретический (лекционный) материал предлагается представить схематично, в виде: наименование темы лекции; план лекции; основных понятий и положений; тезисов; схем; графиков; таблиц; набора компьютерных слайдов; электронных конспектов лекций (презентаций); проблемы для обсуждения и вопросы для самоконтроля; ссылки на литературные источники по теме, приведенные в рабочей программе курса. Модуль «Биохимия» Лекция 1. Аминокислоты План: 1. Общая формула аминокислот 2. Классификация аминокислот: - аминокислоты с гидрофобным радикалом - аминокислоты с полярным радикалом - аминокислоты с отрицательно заряженным радикалом - аминокислоты с положительно заряженным радикалом - аминокислоты с ароматическим радикалом 3. Химические свойства аминокислот: амфотерность, реакции по карбоксильной и аминогруппе. Взаимодействие аминокислот друг с другом 4. Биологическая роль аминокислот Лекция 2. Белки. Уровни организации белковой молекулы План: 1. Понятие о структурной организации белковой молекулы. Особенности первичной структуры белка: - генетическая детерминированность - стабильность - уникальность последовательности - первичная структура определяет более высокие уровни организации белковой молекулы 2. Первичная структура белка 3. Вторичная структура белка - ά- спираль, параметры спирали - β-конформация, параметры - водородные связи как фактор поддержания вторичной структуры 4. Третичная структура белка, факторы, обеспечивающие ее поддержание 5. Четвертичная структура белка Лекция 3. Классификация и биологическая роль белков План 1. Классификация по выполняемым функциям - каталитические белки - запасные белки - белки-ингибиторы ферментов - белки- регуляторы активности генов - защитные белки ( иммуноглобулины и белки свертывания крови) - транспортные белки - белки мембран - токсические белки (яды змей, паукообразных и других животных) - сократительные белки - рецепторы - гормоны белковой и пептидной природы - белки вирусных капсидов - белки клеточной стенки растений 2. Классификация по составу - простые белки - сложные белки (липопротеины, гликопротеины, нуклеопротеины, хромопротеины, металлопротеины) 3. Биологическая роль белков Лекция 4 Ферменты План 1. Особенности ферментативного катализ. 2. Физические и химические свойства ферментов 3. Структура молекулы ферментов - активный центр ферментов (связывающий и каталитический центры) - апофермент - коферменты и кофакторы - аллостерические центры 4. Механизм ферментативного катализа 5. Мультиферментные комплексы 6. Изозимы 7. Факторы, влияющие на активность ферментов: - кислотность среды - концентрация субстрата - температура - ионный баланс среды - наличие активаторов и ингибиторов 8. Классификация и номенклатура ферментов - оксидоредуктазы - трансферазы - гидролазы - лиазы - изомеразы - лигазы Лекция 5 Углеводы. Моносахариды План 1. Углеводы как класс органических соединений 2. Моносахариды 3. Изомерия моносахаридов 4. Физические свойства моносахаридов 5. Химические свойства моносахаридов - обусловленные наличием карбонильной группы - обусловленные наличием гидроксильных групп - обусловленные наличием полуацетального гидроксила Лекция 6 Олигосахариды и полисахариды План 1. Глюкозидная связь 2. Важнейшие олигосахариды - лактоза - сахароза - мальтоза - раффиноза 3. Физические и химические свойства олигосахаридов 4. Биологическая роль олигосахаридов 5. Полисахариды - гомо- и гетерополисахариды - линейные и разветвленные молекулы полисахаридов 6. Важнейшие полисахариды - крахмал - пектины - гемицеллюлозы - целлюлоза - хитин - муреин Лекция 7. Липиды План 1. Понятия «липиды» и «липидоподобные вещества» 2. Жирные кислоты: - строение молекулы жирных кислот - насыщенные и ненасыщенные жирные кислоты - содержание различных жирных кислот в организмах разных систематических групп - важнейшие жирные кислоты ( капроновая, каприловая, каприновая, лауриновая, миристиновая, пальмитиновая, стеариновая, арахиновая, бегеновая, олеиновая, линолевая, линоленовая, арахидоновая, эруковая) - физические свойства жирных кислот - химические свойства жиных кислот 3. Классификация липидов - глицериды и воска - фосфолипиды - стероиды - гликолипиды 4. Биологическая роль липидов Лекция 8. Обмен азота План. Метаболизм аминокислот - декарбоксилирование - дезаминирование - переаминирование - прямое аминирование - синтез и распад аминокислот 2. Цикл мочевины 3. Синтез и распад гема 4. Синтез и распад азотистых оснований 5. Нарушения азотного обмена Лекция 9. Обмен углеводов План. 1. Переваривание и всасывание углеводов Гликолиз и гликогенолиз Брожение Цикл Кребса Пентозофосфатный путь Взаимосвязь различных путей утилизации углеводов Синтез углеводов Глюконеогенез Роль печени, мышц, кишечника и других органов в обмене углеводов Нарушения обмена углеводов Лекция 10. Обмен липидов План. 1. Переваривание и всасывание липидов. Желчные кислоты, их роль в переваривании жиров 2. Расщепление жирных кислот - β-окисление жирных кислот в митохондриях - образование и обезвреживание кетоновых тел - перекисное окисление липидов 3. Биосинтез жирных кислот - карбоксилирование ацетил-коэнзима А - перенос 2- и 3-х углеродных фрагментов на ацилпереносящий белок - образование ацето-ацетил ацилпереносящего белка - гидрирование кетогруппы с образованием альдегидной группы - дегидратация - гидрирование двойной связи 4. Биосинтез глицеридов и фосфолипидов 5. Особенности биосинтеза простагландинов и лейкотриенов Лекция 11. Водорастворимые витамины План 1. Понятия «витамины», «витаминоподобные вещества», «антивитамины» 2. Витамин В1, структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза 3. Витамин В2 – сложный комплекс веществ - рибофлавин - пантотеновая кислота - фолиевая кислота - никотиновая кислота и никотинамид структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза 4. Витамин В6 (пиридоксин) структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза 5. Витамин В 12 (цианкобаламин) структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза 6. Витамин С , структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза 7. Витамин Н (биотин) Лекция 12 Жирорастворимые витамины План 1. Витамин А (ретинол), структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза. β-каротин- провитамин А 2. Витамин Д (кальциферол) – комплекс веществ, структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза 3. Витамин Е (токоферол) – важнейший жирорастворимый антиоксидант, структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза 4. Витамин К, структура молекулы, источники поступления, суточная потребность, симптомы авитаминоза Лекция 13. Витаминоподобные вещества и антивитамины План 1. Понятие «витаминоподобные вещества» 2. Витамин Р – сложный комплекс веществ со сходными функциями : катехины, халконы, флавины, флавононы, изофлавоны, флавонолы). Источники, потребность, биологическая роль 3. Убихинон. Биологическая роль, пути синтеза в организме человека, симптомы недостатка 4. Коэнзим Q, его биологическая роль, потребности организма, источники. Аналоги парааминобензойной кислоты – сульфаниламиды. 5. Пангамовая кислота (витамин В15). Предполагаемая роль в организме человека. Источники. 6. Инозит, его роль в поддержании фукционирования печени. источники инозитола. Роль инозитола в метаболизме растений 7. Пирролохинолинохинон, предполагаемая биологическая роль. 8. Витамин U. 9. Липоевая кислота, ее роль в энергетическом обмене Лекция 14. Гормоны. План. 1. Биологическая роль гормонов 2. Химическая природа гормонов - гормоны белковой и пептидной природы - производные аминокислот - стероидные гормоны 3. Механизм взаимодействия гормона с рецептором 4. Гормоны гипоталамуса, строение молекул, биологическая роль, пути синтеза: - кортикотропин - лютропин - фоллитропин - тиреотропин - пролактины - липотропины 5. Гормоны гипоталамуса, строение молекул, биологическая роль, пути синтеза: - вазопрессин - окситоцин - рилизинг-гормоны Лекция 15 Гормоны других желез внутренней секреции План 1. Гормоны щитовидной железы 2. Гормоны вилочковой железы 3. Гормоны надпочечников (мозгового и коркового вещества) 4. Гормоны поджелудочной железы 5. Гормоны гонад 6. Нарушения гормонального обмена, причины и методы лечения Модуль «Молекулярная биология» Лекция № 1. История возникновения и развития молекулярной биологии. Молекулярная биология – наука о механизмах хранения, воспроизведения, передачи и реализации генетической информации, о структуре и функции нуклеиновых кислот и белков. Роль биохимии, цитологии и генетики в становлении молекулярной биологии. Качественный скачок в развитии молекулярной биологии, связанный с раскрытием основных путей хранения, передачи и реализации генетической информации в 50―70-х годах XX века. Расцвет молекулярной биологии в 80-е годы XX века в связи с разработкой генноинженерных методов. Современные теоретические и практические задачи, перспективы развития молекулярной биологии. Вопросы для самопроверки: 1. Что изучает молекулярная биология? 2. назовите основные моменты в истории развития молекулярной биологии. 3. Каков вклад российских ученых в развитие молекулярной биологии? Литература: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 2. Проблемы и перспективы молекулярной генетики. Том 1 / Отв. ред. Е.Д. Свердлов – М.: Наука, 2003. 3. Ратнер В.А. Хроника великого открытия: идеи и лица // Природа. 1998. № 4. С. Лекция № 2. Методы молекулярной биологии. 1. Физические методы изучения структуры и свойств нуклеиновых кислот и белков: рентгеноструктурный анализ, электронная микроскопия, метод радиоактивных изотопов, седиментационный анализ и др. 2. Биохимические методы: хроматография, электрофорез, изоэлектрофокусирование и другие методы фракционирования биополимеров. 3. Биологические: культуры клеток, гибридные клетки, бесклеточные системы, клеточные линии гибридов, получение моноклональных антител. Вопросы для самопроверки: 1. Опишите принципы основных методов молекулярной биологии. Литература: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 2. Методы анализа белков и нуклеиновых кислот в тканях и органах насекомых: Методические разработки / Под ред. Ю.Б.Филипповича, Г.А. Севастьяновой. - Ч. 1. - М.: МГПИ им. В.И. Ленина, 1980. 3. Практикум по биохимии / Под ред. С.Е.Северина, Г.А.Соловьевой. ― М.: Изд-во МГУ, 1989. 4. Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. ― М.: Просвещение, 1982. Лекция № 3. Основы генетической инженерии. 1. Понятие о рекомбинантных ДНК. 2. Рестрикция ДНК. Рестриктазы и их виды, свойства и особенности воздействия на ДНК. 3. Клонирование ДНК. Плазмиды, их свойства и функции. Векторы молекулярного клонирования. 4. Гибридизация нуклеиновых кислот, ДНК-зонды. Блоттинг, его виды. 5. Определение нуклеотидных последовательностей ДНК (секвенирование): метод Максама―Гилберта, метод Сангера-Коульсона и их модификации. 6. Способы получения генов. Химико-ферментативный синтез генов. Получение генов с использованием обратной транскриптазы. 7. Полимеразная цепная реакция и другие методы амплификации нуклеиновых кислот. 8. Создание искусственных генетических систем. Вопросы для самопроверки: 1. Что такое рекомбинантная ДНК, как ее создают и для чего применяют? 2. Какие векторы используются для молекулярного клонирования? 3. Опишите основные виды рестриктаз, их свойства и особенности воздействия на ДНК. 4. Какие разновидности блоттинга вы знаете? В каких случаях их применяют? 5. Опишите разные способы получения генов. 6. Что такое библиотека генов и какие виды библиотек бывают? Литература: Биотехнология / Отв. ред. А.А.Баев. ― М.: Наука, 1984. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. Уотсон Дж., Туз Дж., Курц Д. Рекомбинантые ДНК. ― М.: Мир, 1986. Лекция № 4. Нуклеиновые кислоты. 1. Доказательства генетической роли нуклеиновых кислот. 2. Первичная структура нуклеиновых кислот. 3. Макромолекулярная структура нуклеиновых кислот. 4. Неканонические формы ДНК. Вопросы для самопроверки: 1. Какие эксперименты послужили доказательством генетической роли нуклеиновых кислот? 2. Что такое нерегулярные биополимеры? 3. Опишите разницу между понятиями нуклеотид, нуклеозид и азотистое основание. 4. Чем отличается строение ДНК и РНК? 5. Какие формы ДНК вы знаете? Литература: Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. Льюин Б. Гены. – М.: «Мир», 1987. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. ― М.: Высшая школа, 1990. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. Лекция № 5. Нуклеиновые кислоты. 1. Сверхспирализация ДНК. Конформационные переходы в сверхспирализованной молекуле. Топоизомеразы и топоизомеры ДНК. 2. Разновидности и функции РНК. 3. Строение иРНК, тРНК, рРНК. 4. Концепция «Мир РНК». Вопросы для самопроверки: 1. Какие разновидности топоизомераз встречаются в клетках прокариот и эукариот? 2. Какие процессы в клетке происходят при участии топоизомераз? 3. Каков механизм действия топоизомераз? 4. Перечислите все виды РНК, встречающиеся в клетках живых организмов. Какие функции они выполняют? 5. Почему считается, что РНК являются эволюционно наиболее древними молекулами? Литература: Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. ― М.: Высшая школа, 1990. Спирин А.С. Рибонуклеиновые кислоты как центральное звено живой материи //Вестник Российской академии наук. 2003. Т. 73. № 2. С. 117-127. Лекция № 6. Репликация ДНК. Основные принципы репликации. Доказательство полуконсервативного механизма репликации. Ферменты репликации. Репликативная вилка, ее организация и функционирование. Особенности репликации у прокариот. Репликация кольцевых и линейных ДНК прокариот. Особенности репликации у эукариот. Теломерные последовательности ДНК. Структура и функции теломеразы человека. Теория старения в связи с динамикой структуры теломеры. Вопросы для самопроверки: Особенности ферментативного аппарата репликации ДНК у прокариот и эукариот. Что такое репликон, унирепликонный и мультирепликонный механизмы репликации? Как решается проблема репликации кольцевых молекул ДНК? Как решается проблема репликации теломерных участков линейных молекул ДНК? Литература: Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. Льюин Б. Гены. – М.: «Мир», 1987. Молекулярная биология клетки / Б.Альбертс и др. ― М.: Мир, 1994. ― Т. 1-3. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. ― М.: Высшая школа, 1990. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. 1. 2. 3. 4. Лекция № 7. Регуляция репликации ДНК. Регуляция репликации у прокариот. Регуляция репликации у эукариот. Роль метилирования в регуляции репликации. Импринтинг и его биологические последствия. Метилирование ДНК в онтогенезе и эволюции организмов. Вопросы для самопроверки: 1. Как осуществялется регуляция репликации у прокариот и эукариот? 2. Что такое метилирование ДНК, когда оно осуществляется, какие ферменты в этом участвуют? 3. Какова роль метилирования ДНК в процессах жизнедеятельности клетки, в онтогенезе и эволюции организмов? Литература: 1. Ванюшин Б.Ф. Материализация эпигенетики, или Небольшие изменения с большими последствиями // Химия и жизнь. 2004. № 2. С. 32-37. 2. Гвоздев В.А. Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК // Соросовский образовательный журнал. 1999. № 10. С. 11-17. 3. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 4. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. ― М.: Высшая школа, 1990. Лекция № 8. Репарация ДНК. 1. Прямая репарация 2. Эксцизионная репарация. 3. SOS-репарация. 4. Ферменты репарации. 5. Репарация и метилирование ДНК. 6. Молекулярные основы канцерогенеза. Онкогены. Вопросы для самопроверки: 1. Какие виды повреждения ДНК бывают и каковы их причины? 2. Какие механизмы репарации ДНК вам известны? В каких случаях они используются клеткой? 3. Как взаимосвязаны процессы репарации и метилирования ДНК? 4. Что такое онкогены и какую роль в процессах канцерогенеза они играют? Литература: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 2. Ланцов В.А. Репарация ДНК и канцерогенез: универсальные механизмы 3. 4. 5. 6. репарации у про- и эукариот и последствия их повреждения у человека // Молекулярная биология. М. 1998. Т. 32. Вып. 5. С. 757-772. Программируемая клеточная гибель / Под ред. В.С.Новикова. ― СПб.: Наука, 1996. Самуилов В.Д., Олескин А.В., Лагунова Е.М. Программируемая клеточная смерть // Биохимия. М. 2000. Т. 65. Вып. 8. С. 1029-1046. Сойфер В.Н. Репарация генетических повреждений // Соросовский образовательный журнал. М. 1997. Вып. 8. С. 4-13. Телитненко М.М., Остроумов С.А. Введение в проблемы биохимической экологии. ― М.: Наука, 1990. Лекция № 9. Рекомбинация. 1. Общая рекомбинация. 2. Сайтспецифическая рекомбинация. 3. Роль рекомбинации в пострепликативной репарации, в возникновении хромосомных перестроек. 4. Генная конверсия. Вопросы для самопроверки: Опишите механизмы общей рекомбинации и сайтспецифической рекомбинации. Приведите примеры биологических явлений, основой которых является гомологичная рекомбинация. Что такое генная конверсия? Как она возникает? Литература: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 2. Льюин Б. Гены. – М.: «Мир», 1987. 3. Молекулярная биология клетки / Б.Альбертс и др. ― М.: Мир, 1994. ― Т. 1-3. 4. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. Лекция № 10. Структура геномов. Геномика – наука о геномах. Структура геномов вирусов и фагов. Биосинтез вирусных нуклеиновых кислот. Геном прокариот. Рестрикция и модификация ДНК. Плазмиды и мобильные генетические элементы бактерий. Геном эукариот. Уникальные и повторяющиеся последовательности ДНК. Сателлитная ДНК. Мозаичность генов эукариот. Подвижные элементы генома эукариот. Геномы митохондрий и хлоропластов. Банки нуклеотидных последовательностей, программа “Геном человека”. Геномная дактилоскопия. Вопросы для самопроверки: 1. Особенности структуры генов прокариот и эукариот. 2. Особенности расположения генов в геномах прокариот, эукариот и вирусов. 3. Мобильные генетические элементы прокариот и эукариот и механизмы их перемещения по геному. 4. Структура геномов митохондрий и пластид. Литература: 1. Жимулев И.Ф. Современные представления о структуре гена у эукариот // Соросовский образовательный журнал. 2000. Т. 6. № 7. С. 17-24. 2. Киселев Л.Л. Геном человека и биология XXI века // Вестник РАН. 2000. Т. 70. Вып. 5. С. 412-424. 3. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 4. Свердлов Е.Д. Микрокосм генома // Молекулярная биология. М. 1999. Т. 33. Вып. 6. С. 917-940. 5. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. Лекция № 11. Транскрипция. 1. Принципы транскрипции. 2. Структура РНК-полимеразы. 3. Этапы транскрипции (инициация, элонгация, терминация). 4. Строение мРНК. Транскриптон. 5. Особенности транскрипции у прокариот. 6. Особенности транскрипции у эукариот. Факторы транскрипции. 7. Обратная транскрипция. Роль обратной транскрипции в эволюции и изменчивости генома. Ретротранспозоны, их типы. Вопросы для самопроверки: 1. РНК-полимеразы прокариот и эукариот: строение, функции. 2. Строение промотора у прокариот и эукариот. 3. Инициация транскрипции у прокариот и эукариот. 4. Терминация транскрипции у прокариот и эукариот. 5. Особенности транскрипции у эукариот. 6. Понятия оперон, транскриптон. Литература: Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. ― М.: Высшая школа, 1990. Патрушев Л.И. Экспрессия генов. – М.: Наука, 2000. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. Лекция № 12. Регуляция транскрипции. 1. Позитивная и негативная регуляция транскрипции. 2. Регуляция транскрипции на этапе инициации, элонгации и терминации транскрипции. 3. Регуляция транскрипции у прокариот. Понятие об опероне. Роль аттенюаторов и рибосом в регуляции транскрипции. 4. Регуляция транскрипции у эукариот. Энхансеры и сайленсеры. Механизмы активации белков-регуляторов транскрипции. Значение гормонов в регуляции транскрипции. Вопросы для самопроверки: 1. Примеры позитивной и негативной регуляции транскрипции у прокариот. 2. Аттенюация. 3. Основные механизмы регуляции транскрипции у эукариот. Литература: 1. Гвоздев В.А. Механизмы регуляции активности генов в процессе транскрипции // Соросовский образовательный журнал. 1996. № 1. С. 23-31. 2. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 3. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. ― М.: Высшая школа, 1990. 4. Патрушев Л.И. Экспрессия генов. – М.: Наука, 2000. 5. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. Лекция № 13. Процессинг РНК. 1. Особенности процессинга тРНК и рРНК у бактерий. 2. Процессинг про-мРНК и созревание мРНК у эукариот (кэпирование, сплайсинг, полиаденилирование). 3. Роль малых ядерных РНК и белковых факторов. Сплайсосома. 4. Особенности процессинга рРНК в ядрышке. 5. Аутосплайсинг. Природные и синтетические рибозимы и перспективы их использования. 6. Альтернативный сплайсинг, его биологические последствия. 7. Транс-сплайсинг. Вопросы для самопроверки: 1. Особенности созревания РНК у прокариот. 2. Процессы, приводящие к созреванию рРНК и тРНК у эукариот. 3. Этапы созревания иРНК эукариот. 4. Понятия сплайсинг, аутосплайсинг, альтернативный сплайсинг, транс-сплайсинг. Значение этих процессов. Литература: Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. ― М.: Высшая школа, 1990. Патрушев Л.И. Экспрессия генов. – М.: Наука, 2000. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. Лекция № 14. Разнообразие структур и функций белков. Аминокислотный состав белков. Пептиды. Первичная структура белков. Структурные особенности пептидной связи. Роль водородных связей в формировании вторичной структуры белков. α-Спираль, β-структура, β-изгиб. Прионизация белков и патологические последствия этого явления. Вопросы для самопроверки: 1. Аминокислоты, пептиды. Пептидная связь. 2. Вторичная структура белка. Сверхвторичные структуры. Домены. 3. Прионизация белков и патологические последствия этого явления. Литература: 1. Зенгбуш П. Молекулярная и клеточная биология. ― М.: Мир, 1982. ― Т. 1-3. 2. Молекулярная биология клетки / Б.Альбертс и др. ― М.: Мир, 1994. ― Т. 1-3. 3. Степанов В.М. Молекулярная биология. Структура и функции белков. ― М.: Высшая школа, 1996. Лекция № 15. Разнообразие структур и функций белков. 1. Сверхвторичные структуры белков; учение о белковых доменах. 2. Третичная структура белков. Денатурация и ренатурация белка. 3. Формирование пространственной структуры белка в живой клетке. 4. Конструирование каталитически активных антител ― абзимов и перспективы их применения. 5. Молекулярные шапероны и их роль в фолдинге полипептидных цепей. 6. Четвертичная структура белка и ее функциональное значение. Вопросы для самопроверки: 1. Примеры связи структуры и функций белков у ферментов, иммуноглобулинов, белков, обеспечивающих двигательную функцию, белков-рецепторов гормонов и др. 2. Роль различных групп белков (изоферментов, иммуноглобулинов, фосфо- и гликопротеинов, металлотионеинов, белков теплового шока и др.) в развитии резистентности и адаптации к веществам, загрязняющим экосистемы. 3. Роль каталитически активных белков в детоксикации ксенобиотиков. 4. Конструирование каталитически активных антител ― абзимов и перспективы их применения. Литература: 1. Зенгбуш П. Молекулярная и клеточная биология. ― М.: Мир, 1982. ― Т. 1-3. 2. Молекулярная биология клетки / Б.Альбертс и др. ― М.: Мир, 1994. ― Т. 1-3. 3. Степанов В.М. Молекулярная биология. Структура и функции белков. ― М.: Высшая школа, 1996. Лекция № 16. Генетический код. 1. Расшифровка генетического кода. 2. Основные свойства генетического кода. 3. Таблица генетического кода. Вопросы для самопроверки: История открытия генетического кода. Свойства генетического кода. Особенности кодового словаря. Литература: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 2. Льюин Б. Гены. – М.: «Мир», 1987. 3. Молекулярная биология клетки / Б.Альбертс и др. ― М.: Мир, 1994. ― Т. 1-3. 4. Роллер Э. Открытие основных законов жизни. ― М., 1978. 5. Сингер М., Берг П. Гены и геномы. В 2-х томах – М.: «Мир», 1998. Лекция № 17. Рибосомы и их роль в биосинтезе белка. Локализация рибосом в клетке. Рибосомные РНК и рибосомные белки. Четвертичная структура рибосом. Структурные превращения рибосом. Прокариотический и эукариотический типы рибосом. Полирибосомы. Вопросы для самопроверки: 1. Современные представления о структуре рибосом. 2. Особенности структуры рибосом у эукариот и прокариот. Рибосомы митохондрий и пластид. 3. Функциональные центры рибосом. Литература: Зенгбуш П. Молекулярная и клеточная биология. ― М.: Мир, 1982. ― Т. 1-3. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. Молекулярная биология: Структура рибосом и биосинтез белка / Под ред. А.С.Спирина. ― М.: Высшая школа, 1986. Лекция № 18. Биосинтез белка. 1. Первичная, вторичная и третичная структура транспортной РНК. Аминоацилирование тРНК. 2. Этапы синтеза белка на рибосомах (инициация, элонгация, терминация). 3. Инициация трансляции. Общие принципы, значение, основные этапы инициации. Инициация трансляции у прокариот и эукариот. Белковые факторы инициации. 4. Элонгация трансляции. Поступление аминоацил-тРНК в рибосому. Транспептидация. Транслокация. Факторы элонгации. 5. Терминация трансляции: терминирующие кодоны, белковые факторы терминации, гидролиз пептидил-тРНК. Вопросы для самопроверки: Этапы биосинтеза белка. Этапы инициации трансляции, ее особенности у прокариот и эукариот. Этапы элонгации трансляции. Особенности терминации трансляции. Литература: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 2. Молекулярная биология клетки / Б. Альбертс и др. ― М.: Мир, 1994. ― Т. 1-3. 3. Молекулярная биология: Структура рибосом и биосинтез белка / Под ред. А.С.Спирина. ― М.: Высшая школа, 1986. Лекция № 19. Биосинтез белка. 6. Регуляция трансляции. 7. Трансмембранный перенос белков. 8. Котрансляционные и посттрансляционные модификации белков. 9. Бесклеточные системы трансляции. Понятие о белковой и ферментной инженерии. Вопросы для самопроверки: 1. Позитивная и негативная регуляция трансляции. 2. Регуляция трансляции у бактериофагов. 3. Регуляция трансляции рибосомных белков. 4. Структура и механизм воздействия бактериальных токсинов на биосинтез белка. 5. Бесклеточные системы трансляции и перспективы их использования для внеклеточного синтеза белков. Литература: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 2. Молекулярная биология клетки / Б. Альбертс и др. ― М.: Мир, 1994. ― Т. 1-3. 3. Молекулярная биология: Структура рибосом и биосинтез белка / Под ред. А.С.Спирина. ― М.: Высшая школа, 1986. Лекция № 20. Межмолекулярные взаимодействия. 1. Белок-белковые взаимодействия и их значение для самосборки белковмультимеров и надмолекулярных белковых структур. 2. Белково-нуклеиновые взаимодействия в процессе регуляции активности генома, при самосборке субклеточных структур, вирусов и фагов. 3. Белково-липидные взаимодействия и формирование биологических мембран. Липопротеины, их классификация и функции. 4. Межклеточная химическая сигнализация и ее типы. Рецепторы пептидных гормонов и нейротрансмиттеров. 5. Молекулярные аспекты взаимодействия различных видов животных, растений и микроорганизмов в экосистемах. 6. Молекулярная биология развития. Вопросы для самопроверки: 1. Понятие о ключевых регуляторных белках у животных и человека (белки теплового шока и пр.). 2. Белковые факторы транскрипции эукариот: особенности их структуры и взаимодействия с ДНК. 3. Рецепторы гормонов, их типы и особенности узнавания ДНК. Литература: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: ACADEMA, 2003. 2. Корочкин Л.И. Как гены контролируют развитие клеток // Соросовский образовательный журнал. 1996. № 1. С. 17-22. 3. Кувичкин В.В. ДНК-липидные взаимодействия in vitro и in vivo // Успехи современной биологии. М. 2000. Т. 120. Вып. 5. С. 466-476. 4. Спирин А.С. Регуляция трансляции мРНК связывающими факторами у высших эукариот // Успехи биологической химии. М. 1996. Т. 36. С. 3-48. РАЗДЕЛ 4. Словарь терминов (глоссарий). Модуль «Биохимия» Аденин – нуклеотид, состоящий из остатка азотистого основания – аденозина, рибозы и трех остатков фосфорной кислоты Адреналин – гормон, медиатор нервной системы из группы катехоламинов Активаторы ферментов – высоко- или низкомолекулярные вещества, повышающие активность ферментов, но при этом не входящие в состав фермента Алкогольдегидрогеназа – фермент, окисляющий спирт с образованием альдегида Аллостерический фактор – высоко- или низкомолекулярные вещества, присоединяющиеся к аллостерическому центру ферментов, влияющие на их активность Альдозы- моносахариды, имеющие карбонильную группу ά-амилаза – фермент, гидролизующий крахмал с образованием декстринов Амилоза – линейный полисахарид, состоящий из остатков глюкозы Амилопектин – разветвленный полисахарид, состоящий из остатков глюкозы Апофермент – белковая часть фермента Арахидоновая кислота – ненасыщенная жирная кислота Аскорбиновая кислота – витамин С, водорастворимый антиоксидант, участвует в синтезе коллагена и других метаболических процессах Ацетил –коэнзим А – SH- фермент, участвующий во многих метаболических процессах Ацетилхолин – нейромедиатор парасимпатической нервной системы Биотин – витамин Н, противодерматитный водорастворимый витамин Брожение – анаэробное окисление дыхательных субстратов, в результате которого образуются органические кислоты или спирты. Витамины – биологически активные вещества, не синтезирующиеся в организме большинства животных, но необходимые для обмена веществ, являющиеся кофакторами или активаторами ферментов, донорами функциональных групп и т.д. Воска – сложные эфиры высших жирных кислот и высших одно- и двухатомных спиртов с числом углеродых атомов 16 Галактоза – гексоза, входит в состав лактозы Гексакиназа –фермент, фосфорилирующий глюкозу к реакциях гликолиза Гем – железосодержащий тетрапорфирин, простетическая часть гемоглобина Гемоглобин – хромопротеин, включает в себя 2 ά-цепи и 2 β-цепи, а также гемм Денатурация белка – утрата пространственной структуры белковой молекулы в результате действия высоких температур, солей тяжелых металлов, ионизирующего излучения. ДНК-лигаза – фермент, осуществляющий сшивание фрагментов ДНК после репликации Желчные кислоты – компоненты желчи, обеспечивающие эмульгирование жиров, поступающих в кишечник Инозит- шестиатомный спирт Карнитин – фактор, обеспечивающий поступление жирных кислот в митохондрии Липаза – фермент, катализирующий гидролиз эфирной связи в молекуле глицеридов Метаболизм- то же, что и обмен веществ, включает в себя два процесса : катаболизм (расшепление веществ) и анаболиз (синтез) Моносахариды – углеводы, содержащие от 3 до 7 атомов углерода, могут существовать в линейной, пиранозной или в фуранозной форме Мутазы – ферменты, катализирующие перенос остатка фосфорной кислоты в пределах одной молекулы Нингидрин – реактив, используемый для обнаружения белков Обратная транскриптаза – фермент, катализирующий обратную транскрипцию – синтез ДНК на матрице РНК Оксидо-редуктазы –ферменты, катализирующие окислительно-восстановительные реакции Орнитин – небелковая аминокислота, важный компонент обмена азота Пентозы – моносахариды, содержащие пять атомов углерода Пировиноградная кислота – ά-кето-кислота, продукт окисления глюкозы в гликолизе Прогестерон – гормон половых желез Ретинол- то же, что и витамин А Сахароза – дисахарид, состоящий из остатка глюкозы и фруктозы Стеариновая кислота – предельная жирная кислота Стероиды – липидоподобные вещества, обладающие гормональной активностью Ферменты- белки, обладающие каталитической активностью Целлюлоза – линейный, нерастворимый в воде полисахарид, состоящий из остатков глюкозы Цикл Кальвина – метаболический процесс, протекающий у растений и некоторых прокариот, в ходе которого происходит ассимиляция углекислого газа рибулозодифосфатом Цитохромы – оксидоредуктазы, содержащие гем, участвуют в процессе клеточного дыхания и фотосинтеза Эритропоэз – процесс образования эритроцитов Модуль «Молекулярная биология» Лекция № 1. История возникновения и развития молекулярной биологии. Бактериофаги – вирусы бактерий. Биоинформатика ― наука, использующая средства информатики для решения различных биологических задач (статистический анализ нуклеотидных последовательностей ДНК, моделирование свёртывания белка, анализ его аминокислотной последовательности; предсказание функций по первичной структуре биополимеров; моделирование пространственной структуры биополимеров). Геномика – наука, изучающая структуру геномов живых организмов. Протеомика – наука, исследующая полные наборы белков, функционирующих на разных этапах развития организма. Рентгеноструктурный анализ – анализ трехмерного расположения атомов в молекулах, основанный на дифракции рентгеновских лучей. Лекция № 2. Методы молекулярной биологии. Бесклеточные системы - многокомпонентные системы in vitro, используемые в биохимии для воспроизведения в пробирке всех этапов синтеза биополимеров. Метод радиоавтографии - метод регистрации веществ, меченых изотопами. Изоэлектрофокусирование – метод разделения белков в зависимости от их заряда в градиенте рН, создаваемом с помощью специальных реагентов (амфолинов). Клеточная линия - культура однородных клеток, происходящих чаще всего от одной родительской пары клеток, и обладающих определенными и относительно постоянными свойствами и характеристиками. Культура ткани, культура клеток - метод, позволяющий сохранять жизнеспособность клетки и выращивать клетки, ткани, небольшие органы (или их части) животного, включая человека, или растения вне организма на/в питательной среде. Моноклональные антитела ― антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, то есть произошедшими из одной плазматической клетки-предшественницы. Ультрацентрифугирование - метод разделения и исследования высокомолекулярных соединений, вирусов и субклеточных частиц под действием центробежных сил. Хроматография - физико-химический метод разделения и анализа смесей, основанный на распределении их компонентов между двумя фазами - неподвижной и подвижной (элюент), протекающей через неподвижную. Электрофорез ― разделение электрически заряженных полимеров в электрическом поле. Обычно ведется в гелях (гель-электрофорез), чтобы зоны разделяемых молекул не размывались тепловым движением. Лекция № 3. Основы генетической инженерии. Амплификация ― искусственный специфический синтез большого числа копий небольшого фрагмента ДНК на базе ПЦР. Библиотека генов ― набор клонированных фрагментов ДНК, полностью перекрывающих исходную молекулу ДНК, выделенную из какого-либо специфического источника. Блот-гибридизация по Саузерну ― метод идентификации участков ДНК, содержащих комплементарные ДНК-зонду последовательности, среди электрофоретически разделенных фрагментов ДНК, фиксированных на твердом матриксе (нитроцеллюлозных или нейлоновых фильтрах). Вектор (ДНК) ― модифицированные плазмидные, фаговые, вирусные, дрожжевые или бактериальные ДНК, обеспечивающие проникновение экзогенной ДНК в клетки хозяина. Вестерн-блот гибридизация (иммуноблот) ― метод идентификации с помощью меченых антител электрофоретически разделенных антигенов, фиксированных на твердом матриксе (нитроцеллюлоз-ных или нейлоновых фильтрах). Геномная ДНК ― тотальная ДНК, выделенная из любого биологического источника. ДНК-зонд ―любая однонитевая ДНК ограниченного размера, используемая для поиска комплементарных последовательностей в молекуле большего размера или среди пула разнообразных молекул ДНК. ДНК-экспрессионные системы ― клеточные культуры (бактериальные, дрожжевые или эукариотические), синтезирующие чужеродные белки. Клонирование ― встраивание чужеродной ДНК в векторную молекулу ДНК или РНК и введение этой конструкции в фаговые, бактериальные или эукариотические клетки хозяина. Комплементарная ДНК (кДНК) ― однонитевая ДНК, образующаяся при обратной транскрипции мРНК. Липкие концы ― комплементарные однонитевые участки ДНК, расположенные на концах молекул ДНК. Нозерн-блот гибридизация ― метод идентификации молекул РНК, содержащих комплементарные ДНК-зонду последовательности, среди электрофоретически разделенных РНК, фиксированных на твердом матриксе (нитроцеллюлозных или нейлоновых фильтрах). Нуклеазы ― общее название ферментов, расщепляющих молекулы нуклеиновых кислот. Плазмиды ― небольшие кольцевые двухцепочечные молекулы ДНК, способные к автономной репликации, которые могут присутствовать в различном числе копий в бактериальных клетках; часто используются в качестве векторных молекул. Полимеразная цепная реакция (ПЦР), или специфическая амплификация ДНК ― избирательный синтез in vitro большого числа копий (порядка миллиона) небольшого фрагмента ДНК размером обычно от 50 до нескольких тысяч нуклеотидов по матричной молекуле ДНК. Рекомбинантная ДНК - химерные молекулы ДНК, составленные из фрагментов разного происхождения. Рестриктаза (эндонуклеаза) ― фермент бактериального происхождения, разрезающий на фрагменты двунитевую молекулу ДНК в местах, соответствующих специфической последовательности из 4-12 нуклеотидов. Рестрикты ― фрагменты ДНК, образовавшиеся после её гидролиза рестриктазой. Рестрикционная карта ― схема молекулы ДНК, на которой указаны места разрезания её различными рестриктазами. Рестрикционный анализ ― метод молекулярной диагностики мутаций, случайным образом затрагивающих сайты рестрикции. Сайт ― определенное место в молекуле ДНК. Сайт рестрикции ― специфическая последовательность из 4-12 нуклеотидов, узнаваемая эндонуклеазой; место взаимодействия рестриктазы с ДНК. Секвенирование ― определение нуклеотидной последовательности молекулы ДНК. Лекция № 4, 5. Нуклеиновые кислоты. Азотистое основание – гетероциклическая азотсодержащая молекула, входящая в состав ДНК и РНК. Наибольшее распространение имеют 5 оснований: пуриновые - аденин (A), гуанин (G) и пиримидиновые – цитозин (C), тимин (T) и урацил (U). Тимин специфичен для ДНК, а урацил – для РНК. Гибридизация ― отжиг денатурированных нуклеиновых кислот различного происхождения с образованием ДНК/РНК- или ДНК/ДНК-гибридов. Дезоксирибонукпеиновая кислота (ДНК) ― вещество наследственности; единственный тип молекул, способных к самовоспроизводству и кодированию генетической информации; нитевидная молекула, в которой остов из чередующихся остатков дезоксирибозы и фосфорной кислоты ковалентно соединен с 4 азотистыми основаниями, расположенными в варьирующем порядке: аденином, тимином, гуанином и цитозином; может существовать как в однонитевой, так и в двунитевой форме за счет образования водородных связей между комплементарными парами оснований по правилу А-Т, Г-Ц. Денатурация ДНК (плавление ДНК) – переход ДНК из двухнитевой формы в однонитевую при разрыве водородных связей между комплементарными парами оснований под воздействием высоких температур. Килобаза (кб) ― единица измерения длины молекулы ДНК, равная тысяче пар оснований. Комплементарность оснований – свойство оснований специфически спариваться друг с другом: гуанин с цитозином и аденин с тимином (в РНК или гибридных ДНК/РНКдуплексах – аденин с урацилом). Нуклеозиды - гликозиды, в состав которых входят пуриновое или пиримидиновое основание и углевод рибоза или дезоксирибоза. Нуклеотиды - фосфорные эфиры нуклеозидов. Нуклеотиды состоят из азотистого основания (пуринового или пиримидинового), углевода (рибозы или дезоксирибозы) и одного или нескольких остатков фосфорной кислоты. Нуклеотиды входят составной частью в нуклеиновые кислоты, коферменты и др. Отжиг – процесс восстановления (ренатурация) двухцепочечной молекулы ДНК из одиночных полинуклеотидных цепей одного происхождения путем постепенного охлаждения. Палиндром - последовательности в двунитчатой ДНК, в которой одинаковые основания расположены в противоположных направлениях. Ренатурация – восстановление (после денатурации) нативной (биологически активной) пространственной структуры биополимера (белка или нуклеиновой кислоты). В частности, ренатурация ДНК (после денатурации нагреванием) может происходить при медленном охлаждении, что используется для получения гибридных гетеродуплексов. Рибонуклеиновая кислота (РНК) ― нитевидная молекула, в которой остов из чередующихся остатков рибозы и фосфорной кислоты ковалентно соединен с 4 азотистыми основаниями, расположенными в варьирующем порядке: аденином, урацилом, гуанином и цитозином. Шпилька - двухцепочечный участок одноцепочечной молекулы ДНК или РНК, образованный в результате комплементарных взаимодействий между соседними инвертированными последовательностями нуклеотидов. Лекция № 6, 7. Репликация ДНК. ДНК-геликаза; белок, раскручивающий двойную спираль – фермент, катализирующий локальное раскручивание двойной спирали ДНК вверх и/или вниз от места ее связывания с молекулой ДНК за счет двух молекул АТФ на каждую пару нуклеотидов. ДНК-геликаза участвует в разделении нитей в репликационной вилке в процессе репликации ДНК. ДНК-лигаза - фермент, катализирующий образование фосфодиэфирных связей между соседними нуклеотидами в молекуле ДНК. ДНК-полимераза―фермент комплементарного синтеза ДНК. ДНК-праймаза - фермент, осуществляющий синтез РНК-праймера во время репликации ДНК. У E. coli ДНК-праймаза является отдельным ферментом и кодируется геном dna C. У эукариот ДНК-праймаза - это субъединица αДНК-полимеразы. ДНК-праймаза отличается от обычных РНК-полимераз тем, что способна использовать в качестве субстрата как рибо-, так и дезоксирибонуклеотиды. ДНК-топоизомераза I - фермент, который катализирует раскручивание негативно (но не позитивно) суперспирализованной ДНК в кольцевую, ковалентно замкнутую двунитчатую ДНК, за счет временной насечки (разрыва) одной нити ДНК. ДНК-топоизомераза II - фермент, образующий временные двунитчатые разрывы в релаксированной или суперскрученной кольцевой ДНК. Затравка, праймер - короткий олигонуклеотид ДНК или РНК, комплементарный участку более длинной молекулы ДНК или РНК. К его 3’-OH-концу ДНК-полимераза может добавлять нуклеотиды в растущую цепь ДНК в 5’→3’-направлении. Отстающая цепь, запаздывающая цепь - цепь дочерней ДНК, на которой синтез комплементарной цепи во время репликации осуществляется посредством соединения фрагментов Оказаки. Праймосома - комплекс белков (ферментов), требующийся для инициации синтеза запаздывающей цепи в репликативной вилке посредством образования фрагментов Оказаки. Редупликация ДНК – самоудвоение молекулы ДНК. Репликатор ― участок ДНК, ответственный за инициацию репликации. Репликон ― молекула ДНК или её участок, репликация которого протекает под контролем одного репликатора. Теломер - концевой участок хромосомы, иногда богатый гетерохроматином, играющим роль в сохранении целостности хромосомы за счет предотвращения слипания теломеров. Теломераза - фермент группы трансфераз, контролирующий размер, количество и нуклеотидный состав теломеров хромосом. Теломераза представляет собой сложный рибонуклеопротеиновый комплекс (РНК, содержащая 159 нуклеотидов, является матрицей для синтеза мотива TTGGG, до 100 повторов которого содержится в каждом теломере) с молекулярной массой около 500 кД. Точка начала репликации, ориджин репликации – нуклеотидная последовательность (ori-сайт), с которой начинается синтез ДНК. Кольцевые бактериальные хромосомы содержат 1 ori-сайт, тогда как в каждой эукариотической хромосоме их много. Фрагменты Оказаки - фрагменты ДНК размером в несколько тысяч (бактерии) или несколько сотен (эукариоты) нуклеотидов, вновь синтезирующиеся в период ДНКрепликации с запаздывающей нити. Экзонуклеаза ― фермент, гидролизующий фосфодиэфирные связи с концов ДНК. Эндонуклеаза ― фермент, гидролизующий фосфодиэфирные связи внутри нити ДНК. Лекция № 8. Репарация ДНК. Ник ― однонитевой разрыв в дуплексе ДНК с образованием З‘ОН- и 5‘Р-концов; ликвидируется ДНК-лигазой. Пострепликативная репарация, рекомбинационная репарация - обнаружение и замена неправильно спарившихся оснований во вновь синтезированной ДНК. В основе лежит механизм гомологичной рекомбинации. Например, у E. coli система репарации ошибок спаривания оснований выявляет ошибочные спаривания во вновь синтезированной нити ДНК, в результате происходит вырезание этих оснований и коротких расположенных рядом последовательностей и восстановление их ДНК-полимеразой. Пострепликативная репарация имеет место в тех случаях, когда для полного исправления повреждения недостаточно процесса эксцизионной репарации. Репарация - ферментативная коррекция ошибок в нуклеотидной последовательности молекулы ДНК (т.е. исправление повреждений, спонтанно возникающих в процессе репликации и рекомбинации или вызванных действием внешних факторов). Различают фотореактивацию, эксцизионную и пострепликативную репарацию. Репарацию осуществляют специфические репаративные ферменты. Фотореактивация, световая репарация - явление восстановления молекул ДНК, поврежденных УФ излучением, в результате последующего воздействия видимого света. Этот процесс катализируется ДНК-фотолиазой, которая связывается с пиримидиновыми димерами в темноте, но использует световую энергию (365-405, 435-445 нм) для разрыва связей, образовавшихся между соседними тимидинами в результате воздействия УФ излучения. Эксцизионная репарация – явление восстановления молекул ДНК, основанном на удалении поврежденного участка и последующем его восстановлении ДНК-полимеразой, использующей в качестве матрицы комплементарную цепь. SOS-репарация; репарация, склонная к ошибкам - репарация поврежденной ДНК у E. coli, катализируемая ферментами, которые индуцируются сложным, но скоординированным механизмом. SOS-репарация - это клеточная реакция на сильные повреждения ДНК (напр., радиацией) и мутации нуклеотидов, которые ингибируют репликацию. Поскольку повреждения часто полностью разрушают матрицу, то SOSрепарация может приводить к мутациям. Лекция № 9. Рекомбинация. Гомологичная рекомбинация, общая рекомбинация – обмен последовательностями между гомологичными молекулами ДНК. Интеграза ― фермент, осуществляющий внедрение какого-либо генетического элемента в геном через специфический сайт. Кроссинговер - взаимный обмен генетическим материалом между гомологичными хромосомами, приводящий к новой комбинации аллелей. Незаконная рекомбинация – сборная группа процессов, где рекомбинация происходит без гомологии между молекулами ДНК, и при этом без участия механизмов сайтспецифической рекомбинации или транспозиций. В качестве примеров можно привести захват ретровирусом некоторых клеточных генов при его эксцизии из хромосомы хозяйской клетки, а также интеграцию фрагментов ДНК, вводимых в клетки позвоночных с помощью микроинъекций. Механизмы незаконной рекомбинации малоизучены. Общим для них является соединение концов негомологичных молекул ДНК. Рекомбинация - перераспределение генетического материала родителей, приводящее к наследственной комбинативной изменчивости. В общем смысле под рекомбинацией понимают создание новой комбинации генов при соединении гамет родителей, более узко рекомбинация – обмен участками хроматид и хромосом в процессе клеточного деления. У прокариот рекомбинация осуществляется в процессе конъюгации, трансформации либо трансдукции, у вирусов – при смешанной инфекции. У эукариот, как правило, рекомбинация характерна для мейоза (мейотическая рекомбинация), но иногда имеет место и в митозе (соматическая рекомбинация). Сайт-специфическая рекомбинация – рекомбинация, происходящая между специфическими последовательностями ДНК в пределах очень коротких участков гомологии, обычно 15-30 п.н. Широко распространена у прокариот и низших эукариот. Характерным примером такой рекомбинации служит встраивание кольцевой ДНК фага λ в хромосому Е. coli и ее обратное выщепление. Транспозиция – процесс перемещения небольшой последовательности нуклеотидов в новый генетический локус. Лекция № 10. Структура геномов. Ген ― основная физическая и функциональная единица наследственности, несущая информацию от одного поколения к другому. Ген представляет собой специфическую последовательность нуклеотидов в ДНК, а у некоторых вирусов - в РНК, детерминирующих или нуклеотидную последовательность транспортных РНК (тДНК), или рибосомных РНК (рДНК), или последовательность аминокислот в белках (структурные гены). Геном ― полная генетическая система клетки, определяющая характер онтогенетического развития организма и наследственную передачу в ряду поколений всех структурных и функциональных признаков. Интрон ― не кодирующая область гена, вырезаемая в процессе сплайсинга при образовании мРНК из первичного РНК-транскрипта. Кластер генов - 1. Группа генов, входящих в семью мультигенов. 2. Повторы одного и того же или родственных генов, расположенных на хромосоме рядом. Лидерная последовательность, лидер - транскрибируемая часть эукариотического гена, следующая за кэп-сайтом и предшествующая стартовому кодону. Мобильные элементы генома - последовательности ДНК, способные перемещаться внутри генома живых организмов. Мультигенное семейство, семейство генов – набор структурно и функционально тесно взаимосвязанных генов, происходящих от одного предкового гена путем дупликаций или мутационного процесса. Могут быть кластеризованы на одной и той же хромосоме (например, гены, кодирующие рибосомную РНК) или разбросаны по всему геному (гены белков теплового шока). Оперон ― у прокариот совокупность совместно транскрибируемых генов, обычно контролирующих родственные биохимические функции, экспрессия которых находится под контролем общего регуляторного элемента. Плазмиды ― небольшие кольцевые двухцепочечные молекулы ДНК, способные к автономной репликации, которые могут присутствовать в различном числе копий в бактериальных клетках; часто используются в качестве векторных молекул. Перекрывающиеся гены - гены с перекрывающимися последовательностями нуклеотидов (напр., у фага fХ174 ген Е перекрывается с геном D). Перекрывающиеся гены продуцируют два различных полипептида, потому что соответствующие иРНК транслируются в двух различных рамках считывания. Псевдоген ― мутационно измененная последовательность ДНК, имеющая высокую степень гомологии с функциональным геном, но не способная транскрибироваться или продуцирующая неактивный генный продукт. Сателлитные повторы ― короткие, не превышающие 200 пар оснований высокоповторяющиеся последовательности ДНК, расположенные тандемными блоками и занимающие около 10% генома. —микро ― сателлитные ДНК с длиной повторяющегося элемента в диапазоне от 1 до 4 нуклеотидов. —мини ― сателлитные ДНК с длиной повторяющегося элемента в диапазоне от 5 до 100 нуклеотидов. Трейлер, трейлерная последовательность – 3’-некодирующая область гена, т. е. последовательности на 3’-конце эукариотических генов, которые не кодируют белок, но также транскрибируются. Экзон ― кодирующий участок гена. Лекция № 11, 12. Транскрипция. Активатор - молекула белка или РНК, которая активирует ген после связывания с регуляторными последовательностями, расположенными вверх от точки начала транскрипции. Апорепрессор - белок, регулирующий действие белка-репрессора. Аттенюатор - у бактерий последовательность нуклеотидов, расположенная перед опероном и регулирующая его экспрессию. Геномный импринтинг ― различное фенотипическое проявление мутации в зависимости от ее прохождения через отцовский или материнский гаметогенез. Избыточная ДНК - ДНК, не несущая кодирующих функций. Индуктор, эвокатор - низкомолекулярное вещество, которое связывается с репрессором и переводит его в негативную форму, не способную связываться с оператором , в результате чего происходит дерепрессия генов. Кодирующая нить, смысловая нить – нить двухцепочечной молекулы ДНК, нуклеотидная последовательность которой идентична РНК, транскрибированной с соответствующей антисмысловой нити, за исключением того, что она содержит тимин (Т) вместо урацила (U). Иногда обе нити могут транскрибироваться, но в противоположных направлениях. Корепрессор – в репрессирующей генетической системе эффекторная молекула (обычно конечный продукт в метаболических путях), которая при связывании с регуляторным белком апорепрессором ингибирует транскрипцию генов в оперонах. Моноцистронная иРНК - иРНК, кодирующая только одну полипептидную цепь. Негативный генетический контроль, негативная регуляция - прекращение экспрессии гена путем связывания специфического репрессорного белка с оператором, расположенным вверх от кодирующей области у многих генов, что одновременно предотвращает связывание РНК-полимеразы. Обратная транскриптаза ― фермент, катализирующий реакцию синтеза ДНК на матрице РНК. Оператор ― регуляторный участок гена (оперона), с которым специфически связывается репрессор, предотвращая тем самым начало транскрипции. Полицистронная иРНК – гигантская молекула информационной РНК, определяющая последовательность аминокислот двух или более белков, образуемых соседними цистронами одного и того же оперона . Промотор ― основной регулятор работы гена; расположен в 5'-нетранслируемой области; место взаимодействия ДНК с РНК-полимеразой. Регулон ― система генов, разбросанных по всему геному, но подчиняющихся общему регуляторному белку. Репрессор – белок, кодируемый регуляторным геном, который связывается с высокой точностью с соответствующим оператором. Связанный репрессор блокирует движение РНК-полимеразного комплекса вдоль промотора и предотвращает инициацию синтеза РНК. РНК-полимераза ― фермент, осуществляющий транскрипцию ДНК. Сайленсер, глушитель транскрипции - последовательность ДНК в промоторах эукариотических генов размером 20–200 п. о., снижающая или отменяющая (заглушающая) экспрессию генов. Действует только в цис-положении. Спейсер – нетранскрибируемая последовательность ДНК, отделяющая тандемно расположенные копии экспрессирующегося гена. Терминатор транскрипции – последовательность нуклеотидов в молекуле ДНК, вызывающая прекращение транскрипции РНК-полимеразой синтеза иРНК у конца оперона или отдельного гена. Транскриптон, единица транскрипции - последовательность ДНК от места инициации транскрипции (кэп-сайт) до сайта ее терминации, узнаваемая ДНК-зависимой РНК- полимеразой , которая может включать один ген и более. Транскрипция ― синтез молекул первичного РНК-транскрипта, комплементарных определенным участкам молекулы ДНК (генам). Транскрипционный фактор ― фермент активации и/или репрессии генной активности, способный взаимодействовать с молекулами ДНК. Цистрон - любая последовательность ДНК, которая детерминирует нуклеотидную последовательность зрелой тРНК, иРНК или рРНК. Цистрон включает лидерную, трейлерную и интронную последовательности. Термин введен С. Бензером в 1957 г. Экспрессия гена ― процесс реализации информации, закодированной в гене. Состоит из двух основных стадий ― транскрипции и трансляции. Энхансер ― регуляторный участок ДНК, усиливающий транскрипцию с ближайшего к нему промотора. Энхансер, усилитель транскрипции специфическая цис-действующая последовательность нуклеотидов, многократно усиливающая транскрипцию генов РНКполимеразой II. Например, энхансер вируса SV40 (размер – 72 пары нуклеотидов) может усиливать транскрипцию бета-глобинового гена в 200 раз, даже находясь на значительном удалении от него и в любой ориентации по отношению к промотору. Способность ряда энхансеров взаимодействовать со специфическими белками в дифференцированных клетках обеспечивает тканеспецифичный характер экспрессии соответствующих генов. Считается, что энхансер является одной из форм мобильных генетических элементов. Цис-положение - означает "на этой стороне". В молекулярной биологии используется для обозначения последовательности ДНК (гена), локализованной на той же самой хромосоме, что и рассматриваемая (обсуждаемая) последовательность (напр., энхансерная последовательность), находящаяся вверх от точки инициации гена, позитивно влияющая на его экспрессию и являющаяся цис-действующей последовательностью. То же самое для белков: напр., цис-активирующий фактор, цис-активирующий белок или дезактивирующий фактор, белок. Инсулятор – цис-регуляторный элемент, который блокирует взаимодействие между энхансером и промотором, если расположен между ними. Лекция № 13. Процессинг РНК. Альтернативный сплайсинг - форма сплайсинга, обеспечивающая кодирование одним геном структурно и обычно функционально различающихся полипептидов. Альтернативный сплайсинг сопровождается соединением экзонов гена в разных комбинациях с образованием различных зрелых молекул мРНК. Альтернативный сплайсинг характерен, в частности, для генов кальцитонина и соматостатина. Аутосплайсинг - сплайсинг предшественников мРНК, происходящий без участия какихлибо др. макромолекул (ферментов), т.е. мРНК сама является катализатором этого процесса (рибозимом). Явление аутосплайсинга открыто Т.Цехом с соавт. в 1981 при анализе процессинга рибосомной 26S-рРНК у инфузории Tetrahymena thermophila. Кэпирование – присоединение к 5’-концу большинства молекул иРНК эукариот 7-метилгуанозинового остатка. Кэп присоединяется к иРНК сразу после транскрипции с помощью гуанилил трансферазы. Кэп выполняет несколько функций: а) способствует правильному сплайсингу первичного транскрипта; б) защищает иРНК от разрушения экзонуклеазами ; в) 7-метил-гуанозин является ключевым сигналом для инициации трансляции иРНК. Матричные РНК (мРНК) ― молекулы РНК, состоящие из последовательностей, комплементарных экзонам генов; образуются в результате сплайсинга и концевых модификаций из молекул первичного РНК-транскрипта. Полиаденилирование – ферментативное посттранскрипционное добавление поли(А)хвостов размером в 200 адениновых остатков к 3’-концу гетерогенной ядерной РНК и матричной (информационной) РНК у эукариот во время ее процессинга перед выходом в цитоплазму. иРНК гистонов не претерпевают полиаденилирования. Процессинг - комплекс процессов образования зрелых молекул РНК и белков в клетке; включает ряд последовательных расщеплений молекулы-предшественника эндонуклеазой или протеазами с образованием конечных, функционально активных продуктов и деградации «избыточных» участков. У эукариот процессинг мРНК включает этап вырезания интронов и образования зрелой молекулы в результате сплайсинга. Также к системе процессинга относят различные модификации – например, метилирование отдельных оснований и др. Редактирование РНК – посттранскрипционная модификация первичной структуры РНК. Включает модификацию азотистых оснований в молекуле РНК (дезаминирование, метилирование, восстановление и др.), а также вставку нуклеотидов внутрь транскрибированных цепей РНК. Рибозимы - молекулы РНК, обладающие ферментативной активностью (как правило, свойством автокатализа). Впервые рибозимы были охарактеризованы при исследовании процессов аутосплайсинга предшественника 26S-рРНК у инфузории Tetrahymena thermophila. РНКтранскрипт (первичный) ― молекулы РНК, образующиеся в процессе транскрипции. Сплайсинг―процесс вырезания последовательностей, комплементарных интронам, из молекулы первичного РНК-транскрипта. Сплайсосома, сплайсеосома, сплайсинговый комплекс - многокомпонентный комплекс факторов сплайсинга (SF) и малых ядерных РНК (мяРНК), катализирующих сплайсинг ядерных предшественников РНК (про-РНК), в результате чего образуется зрелая иРНК у эукариот. Транс-сплайсинг – явление, при котором происходит образование ковалентных связей между фрагментами РНК, синтезированными на разных генах. Лекция № 14, 15. Разнообразие структур и функций белков. Абзимы - моноклональные антитела, обладающие каталитической активностью. Абзимы связываются и стабилизируют молекулы промежуточных реакций в процессе образования конечного продукта. Аминокислоты - органические кислоты, содержащие одну или несколько аминогрупп. Белки – природные полипептиды с молекулярной массой более 6 кДа. Белки теплового шока - специфические белки, известные у большинства организмов, вырабатываются в ответ на тепловой шок, когда биосинтез многих других белков подавлен. Индукция синтеза белков теплового шока может происходить и под действием некоторых химических агентов (этиловый спирт, экдистерон, хлорид кадмия и др.), в связи с чем их иногда называют стрессовыми белками. Они высоконсервативны у различных организмов – наиболее распространены белки теплового шока размером около 70 кД (семейство hsp-70). Вторичная структура белка - укладка полипептидной цепи в альфа-спиральные участки и бета-структурные образования (слои); в образовании вторичной структуры белка участвуют водородные связи. Домен - участок полипептидной цепи белка, выполняющий какую-либо его функцию (например, цитоплазматический домен, трансмембранный домен и т.п.). По мнению некоторых генетиков, каждый домен кодируется участком гена, расположенным между соседними интронами (т.е. одним экзоном), что обусловливает эволюционный консерватизм положения интронов (например, в генах альфа- и бета-гемоглобина млекопитающих). Пептиды - природные или синтетические соединения, молекулы которыхрых построены из остатков α-аминокислот, соединенных между собой пептидными (амидными) связями C(O)NH. По числу аминокислотных остатков, входящих в молекулы пептидов, различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называются олигопептидами, содержащие более 10 аминокислотных остатков – полипептидами. Первичная структура белка – порядок чередования аминокислотных остатков в полипептидной цепи белка. Прио́ны ― особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда высших животных (т. н. «медленные инфекции»). Прионизация – процесс превращения нормального клеточного белка в прионный, сопровождаемый многократным увеличением доли β-структур. Третичная структура белка - высшая пространственная структура, образующаяся в результате фолдинга отдельной полипептидной цепи. Радикалы – боковые цепи аминокислот, не участвующие в образовании пептидных связей. Фолдинг - процесс сворачивания полипептидной цепи в правильную пространственную структуру. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами. Четвертичная структура белка - свойственная только полимерным белкам форма пространственной организации, обусловленная различными вариантами взаиморасположения и взаимодействия отдельных полипептидных цепей. Шапероны – специфические белки, обеспечивающие формирование третичной структуры полипептидных цепей других белков. Лекция № 16. Генетический код. Антикодон - группа из трех оснований, занимающая фиксированное положение в транспортной РНК, которая комплементарна кодону в информационной (матричной) РНК. Генетический код - система записи наследственной информации в молекулах нуклеиновых кислот , основанная на определении чередований последовательностей нуклеотидов в ДНК или РНК, образующих кодоны соответствующих аминокислот белков. Каждый кодон кодирует одну молекулу аминокислоты. Кодон ― последовательность из трех нуклеотидов в молекуле мРНК, соответствующая аминокислоте или сигналу терминации трансляции. Стартовый кодон, сайт инициации трансляции - тринуклеотид (у прокариот - AUG, GUG; у эукариот - AUG) в информационной РНК, инициирующий синтез полипептидов. Стартовый кодон кодирует N-формилметионин у бактерий и метионин у эукариот. Стоп-кодон, нонсенс-кодон, терминатор - тринуклеотид в информационной РНК, сигнализирующий об окончании синтеза полипептида и освобождении полной полипептидной цепи от рибосомы. Существует три различных типа стоп-кодонов: UAG (амбер), UGA (опал) и UAA (охра). Ни один из них не соответствует антикодону тРНК. Лекция № 17. Рибосомы и их роль в биосинтезе белка. Аминоацильный центр рибосомы – участок 50S субчастицы рибосомы, к которому присоединяется несущая аминокислоту (аминоацил-тРНК) тРНК, если антикодон этой тРНК соответствует кодону иРНК, находящемуся в данный момент в аминоацильном центре. Пептидильный центр рибосомы – участок рибосомы, к которому присоединяется пептидил-тРНК в процессе транялсции. Пептидилтрансферазный центр рибосомы – участок 50S субчастицы рибосомы, в котором идет синтез пептидной связи. Полирибосома, полисома - молекула РНК с несколькими расположенными на ней активными рибосомами, на каждой из которых синтезируется молекула белка. Рибосома - органелла клетки, рибонуклеопротеидная частица, с участием которой осуществляется биосинтез белка (трансляция). Рибосома состоит из двух (большой и малой) субчастиц, для взаимодействия которых необходимы ионы магния. Лекция № 18, 19. Биосинтез белка. Аминоацилирование тРНК – присоединение аминокислоты к 3’-концу тРНК, катализируемое АРСазой. Происходит за счет энергии АТФ. Аминоацил-тРНК-синтетазы, АРСазы - специфические ферменты, катализирующие активирование аминокислот и связывание последних с определенными тРНК. Изоакцепторные тРНК - различные виды тРНК, специфичные к одной и той же аминокислоте, которые в ряде случаев узнают различные кодоны. Рамка считывания ― нуклеотидная последовательность, выраженная в кодирующих триплетах, начинающаяся со стартового кодона и заканчивающаяся нонсенс-кодоном. Реакция транспептидирования – синтез пептидной связи с участием аминоацил-тРНК. Трансляция ― синтез полипептидной цепи по молекуле мРНК. Шайн-Далгарно последовательность ― участок прокариотической мРНК, необходимый для посадки на неё рибосом и её правильной трансляции. Содержит последовательность нуклеотидов, комплементарную 3’-концу 16S рибосомной РНК. Лекция № 20. Межмолекулярные взаимодействия. Онкогены ― гены, чьи продукты обладают способностью трансформировать эукариотические клетки так, что они приобретают свойства опухолевых клеток. Протоонкогены ― нормальные хромосомные гены, мутации которых могут привести к злокачественному перерождению клетки. РАЗДЕЛ 5. Практикум по решению задач (практических ситуаций) по темам лекций (одна из составляющих частей итоговой государственной аттестации). Данный раздел должен включать в себя: примеры решения задач (практических ситуаций) по темам, на которые предложены аналогичные задания в экзаменационных (зачетных) билетах. тексты задач (практических ситуаций) для самостоятельного решения при подготовке к итоговой аттестации (не более 2-х). Примеры решения задач по биохимии Определите активность фермента, катализирующего гидрирование единственной двойной связи в молекуле жирной кислоты, если за 30 секунд присоединилось 22.4 л водорода Решение: Каталитическая активность определяется в каталах, 1катал – каталитическая активность, способность осуществлять химическую реакцию со скоростью 1 моль/с. Определяем, сколько моль водорода израсходовано за 30 секунд. Число моль водорода равно числу моль прореагировавшей кислоты, так как кислота содержит только одну двойную связь. V H2/ Vm=22,4/22,4= 1 моль Определим, сколько моль кислоты прореагирует за 1 секунду: 22,4/30=0,75 Активность фермента равна 0,75 кат Тексты задач (практических ситуаций) для самостоятельного решения при подготовке к итоговой аттестации (не более 2-х). Дайте название по международной номенклатуре ферменту, катализирующему фосфорилирование фруктозо-6-фосфата в реакциях гликолиза Какое количество аминокислотных остатков содержится в полипептиде длиной 450 нм? Примеры решения задач по молекулярной биологии Характер решения задач по молекулярной генетике можно рассмотреть на следующем примере. Задача 1. Приведите графическую модель гена, если белковая молекула имеет следующий состав и последовательность аминокислот: глицин-лизин-пролин-серин. Запишем возможную последовательность нуклеотидов соответствующего участка и-РНК в соответствии с генетическим кодом, приведенным в таблице 1. Белок: глицин―лизин―пролин―серин (для серина использовали только 4 триплета) и-РНК ГГУ ААА ЦЦУ УЦУ ГГЦ ААГ ЦЦЦ УЦЦ ГГА ЦЦА УЦА ГГГ ЦЦГ УЦГ 4 × 2 × 4 × =128 4 Как видно, участок белка с этой последовательностью аминокислот мог образоваться в процессе трансляции у 128 вариантов и-РНК. И-РНК переписывает информацию о структуре белка в процессе транскрипции с гена. Определенное разнообразие возможных и-РНК (128) могло образоваться на основе такого же разнообразия генов. Следовательно, графически можно изобразить 128 вариантов гена, содержащих информацию о данной молекуле белка. Один из вариантов следующий (по первой строке триплетов): ___________________________ Ген ДНК ЦЦА ТТТ ГТА АГА и-РНК ГГУ ААА ЦЦУ УЦУ Таблица 1 Последовательность нуклеотидов в кодонах и-РНК для разных аминокислот Кодоны Аминокислоты 3 4 5 6 УУГ ЦУУ ЦУЦ ЦУА ЦУГ АУЦ АУА 1 2 Фенилаланин (фен) УУУ УУЦ Лейцин (лей) УУА АУУ Изолейцин (илей) Метионин (мет) старт АУГ Валин (вал) ГУУ ГУЦ ГУА ГУГ УЦУ УЦЦ УЦА УЦГ ЦЦУ ЦЦЦ ЦЦА ЦЦГ АЦУ АЦЦ АЦА АЦГ ГЦУ ГЦЦ ГЦА ГЦГ УАУ УАЦ Гистидин (гис) ЦАУ ЦАЦ Глутамин (глн) ЦАА ЦАГ Аспарагин (асн) ААУ ААЦ Аспарагиновая кислота (асп) ГАУ ГАЦ ААА ААГ ГАА ГАГ УГУ УГЦ Серин (сер) Пролин (про) Треонин (тре) Алании (ала) Тирозин (тир) Лизин (лиз) Глутаминовая кислота (глу) Цистеин (цис) Триптофан (трип) УГГ Аргинин (арг) ЦГУ ЦГЦ ЦГА ЦГГ Глицин (гли) ГГУ ГГЦ ГГА ГГГ «Охра» (терм) УАА «Амбер» (терм) «Опал» (терм) АГУ АГЦ АГА АГГ УАГ УГА Тексты задач (практических ситуаций) для самостоятельного решения при подготовке к итоговой аттестации (не более 2-х). 1. Напишите последовательность расположения аминокислот на одном из участков молекулы белка, если известно, что он кодируется такой последовательностью нуклеотидов ДНК: … АТГ ТЦГ ЦГТ ААА ЦАТ … Как изменится ответ, если химическим путем из молекулы ДНК будет удален десятый нуклеотид? 2. Определите количество аминокислот в белковой молекуле при условии, что молекулярный вес гена, контролирующего образование данного белка, равен 214 200 дальтон, а средний молекулярный вес одного нуклеотида составляет 340 дальтон. РАЗДЕЛ 6. Изменения в рабочей программе, которые произошли после утверждения программы. Характер изменений в программе Номер и дата протокола заседания кафедры, на котором было принято данное решение Подпись заведующего кафедрой, утверждающего внесенное изменение Подпись декана факультета (проректора по учебной работе), утверждающего данное изменение РАЗДЕЛ 7. Учебные занятия по дисциплине ведут: Ф.И.О., ученое звание и степень преподавателя Меньшакова М.Ю., к.б.н. Прохорова С.А., к.б.н., доцент Икко Н.В., к.б.н. Учебный год 2011/2012 Факультет ЕФКиБЖД 020201 Биология 2012/2013 ЕФКиБЖД 020201 Биология Специальность