ПОЛУЧЕНИЕ КЛЕТОЧНЫХ ФОРМ АНТИБИОТИКОВ АМИНОГЛИКОЗИДОВ ... ФТОРХИНОЛОНОВ ДЛЯ ИХ НАПРАВЛЕННОГО ТРАНСПОРТА В ОРГАНИЗМ
реклама

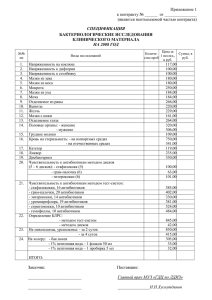
ПОЛУЧЕНИЕ КЛЕТОЧНЫХ ФОРМ АНТИБИОТИКОВ АМИНОГЛИКОЗИДОВ И ФТОРХИНОЛОНОВ ДЛЯ ИХ НАПРАВЛЕННОГО ТРАНСПОРТА В ОРГАНИЗМ Л.Е. Сипливая, А.В. Кукурека, Г.В. Сипливый, В.Я. Яцюк Курский государственный медицинский университет, г. Курск В литературе имеются данные о возможности использования стромы эритроцитов для направленного транспорта антибиотиков. Одним из доступных для практики методов включения антибиотиков в строму эритроцитов является гипоосмотический гемолиз. Эритроцитарные носители (ЭН) с включенными антибиотиками отличаются достаточно высокой устойчивостью и могут применяться для направленного транспорта в организм и, в частности, в печень, селезенку, почки. Так ряд авторов сообщают, что при введении гентамицина, включенного в эритроцитарный контейнер, существенно изменяется распределение препарата по органам и тканям: накопление в печени, селезенке, почках увеличивается в 1,7- 3; 1,9-2,7; 1,5 раза, кроме того, увеличивается период полувыведения и среднего времени удержания [1]. При направленном транспорте лекарственных средств в организм обсуждаются возможности использования различных векторов, одними из которых является применение лейкоцитов [2]. На основании изложенного перспективным является изучение возможности использования эритроцитарных и лейкоцитарных носителей как векторов для направленного транспорта антибиотиков или фторхинолонов с целью повышения их фармакологической эффективности при необструктивном пиелонефрите. Цель: отработка лабораторной технологии получения эритроцитарных и лейкоцитарных форм антибактериальных препаратов и изучение особенностей включения гентамицина, амикацина, ципрофлоксацина и офлоксацина в ЭН и лейкоцитарные носители (ЛН) здоровых животных и животных с пиелонефритом. Материалы и методы: Для получения эритроцитарных форм антибиотиков аминогликозидов и фторхинолонов использовали методику [3]. Эритроциты здоровых крыс и крыс с пиелонефритом инкубировали с растворами препаратов в концентрации: гентамицина 2 и 4 мг/мл (0,2%; 0,4%) и амикацина 12 и 24 мг/мл (1,2%; 2,4%), а фторхинолонов 3 и 6 мг/мл (0,3%; 0,6%) в течение 10, 30, и 60 минут при 4 0С. Выделенные из крови лейкоциты инкубировали с такими же концентрациями препаратов и временными интервалами, но при комнатной температуре (200С). Вначале инкубацию проводили с меньшей концентрацией, а затем концентрацию препаратов в инкубационной жидкости увеличивали в два раза. Устойчивость ЭН и ЛН на десорбцию и выделение препаратов из ЭН и ЛН определяли путем двукратного предварительного отмывания и инкубации их в аутологичной плазме при 370С в течение 30 минут. Концентрацию антибиотиков аминогликозидов или фторхинолонов в гемолизате ЭН, ЛН, инкубационной жидкости, в надосадочной жидкости после отмывания клеток, а также плазме крови после инкубации в ней ЭН, ЛН определяли спектрофотометрическими методиками [4,5]. Результаты и их обсуждение. Было установлено, что в ЭН здоровых доноров включается гентамицина 22,4% и 20,2% амикацина, а в ЭН крыс с пиелонефритом 20,1% и 18,2%, соответственно, для гентамицина и амикацина. Определено, что в ЭН здоровых крыс включается 17,9% ципрофлоксацина и 16,4% офлоксацина, а в ЭН животных с пиелонефритом, соответственно, 14,5% и 12,3%. Доказано, что антибиотики аминогликозиды и фторхинолоны в большей степени включаются в ЭН здоровых доноров. Полученные результаты свидетельствовали о более высоком включении антибиотиков аминогликозидов в ЭН животных с пиелонефритом в сравнении с фторхинолонами. Мы не обнаружили зависимости степени включения антибиотиков и фторхинолонов в ЭН от длительности инкубации. Разница в количественном содержании антибиотиков или фторхинолонов при инкубации 30 или 60 минут колебалась в пределах 1,5- 1,9%. Повышение концентрации препаратов в инкубационной жидкости в два раза привело к увеличению их содержания в ЭН как здоровых животных, так и животных с пиелонефритом в пределах 1,3 -1,5 раза. Изучение устойчивости ЭН к возможной десорбции и выделению антибиотиков или фторхинолонов в плазму крови показало достаточную их устойчивость, что позволяет использовать ЭН для включения и направленного транспорта антибиотиков аминогликозидов и фторхинолонов в органы и, в частности, почки. Отмечено более высокое включение препаратов в ЛН здоровых животных. Установлено, что введение АТФ в инкубационную среду повышает включение антибиотиков аминогликозидов и фторхинолонов в ЛН здоровых крыс. Показано, что в присутствии АТФ препараты практически в одинаковом процентном соотношении включаются в ЛН как здоровых животных, так и животных с пиелонефритом. Полученные данные представляют большой практический интерес, так как предполагают возможность использования собственных клеток в качестве векторов адресной доставки лекарственных средств, исключая услуги доноров. Мы установили, что при 20 минутах инкубации в присутствии АТФ количественное содержание препаратов в ЛН здоровых крыс и крыс с пиелонефритом было максимально. Удлинение времени экспозиции до 60 минут не приводило к существенному увеличению количественного содержания аминогликозидов и фторхинолонов в ЛН. Увеличение концентрации препаратов привело к повышению их содержания в ЛН, как здоровых животных, так и животных с пиелонефритом в 2,2 – 2,8 раза. Изучение процессов десорбции аминогликозидов и фторхинолонов из ЛН в плазму крови показало их достаточную устойчивость и тем самым подтвердило возможность использования лейкоцитов как контейнеров для направленного транспорта антибактериальных препаратов. Выводы: предложена лабораторная технология получения клеточных (эритроцитарных и лейкоцитарных) форм антибиотиков аминогликозидов и фторхинолонов, включающая выделение ЭН и ЛН, получение стандартизованных по количеству действующего вещества клеточных форм антибактериальных препаратов, установление стабильности, условий и сроков их хранения. Список литературы. 1. Генинг, Т.П. Фармакокинетика антибиотика, вводимого в организм в клеточных носителях / Т.П. Генинг, К.К. Мануйлов // Антибиотики и химиотерапия. - 1991.- №9. – С. 19-20. 2. Лохвицкий, С.В. Направленный транспорт антибиотиков при лечении больных диабетической гнойной остеоартропатией / С.В. Лохвицкий // Сахарный диабет. - 1999. - №3 (4). - С. 1-5. 3. Генинг, Т.П. Использование форменных элементов крови для направленной доставки химиотерапевтических и диагностических препаратов в очаг поражения / Т.П. Генинг, И.И. Колкер, Ж.Ш. Жумадилов // Антибиотики и химиотерапия. - 1988. - Т.33, №11 - С. 867-870. 4. Кукурека, А.В. Спектрофотометрическое определение лекарственных средств из группы аминогликозидных антибиотиков: автореф. дис… канд. фарм. наук / А.В. Кукурека; КГМУ. - Курск, 2000, - 18с. 5. Карлов, П.М. Исследование соединений групп фторхинолонов, иммобилизированных на различных носителях: автореф. дис… канд. фарм. наук / П.М. Карлов; КГМУ. – Курск, 2009. - 23с.