Модульный урок по теме "
реклама
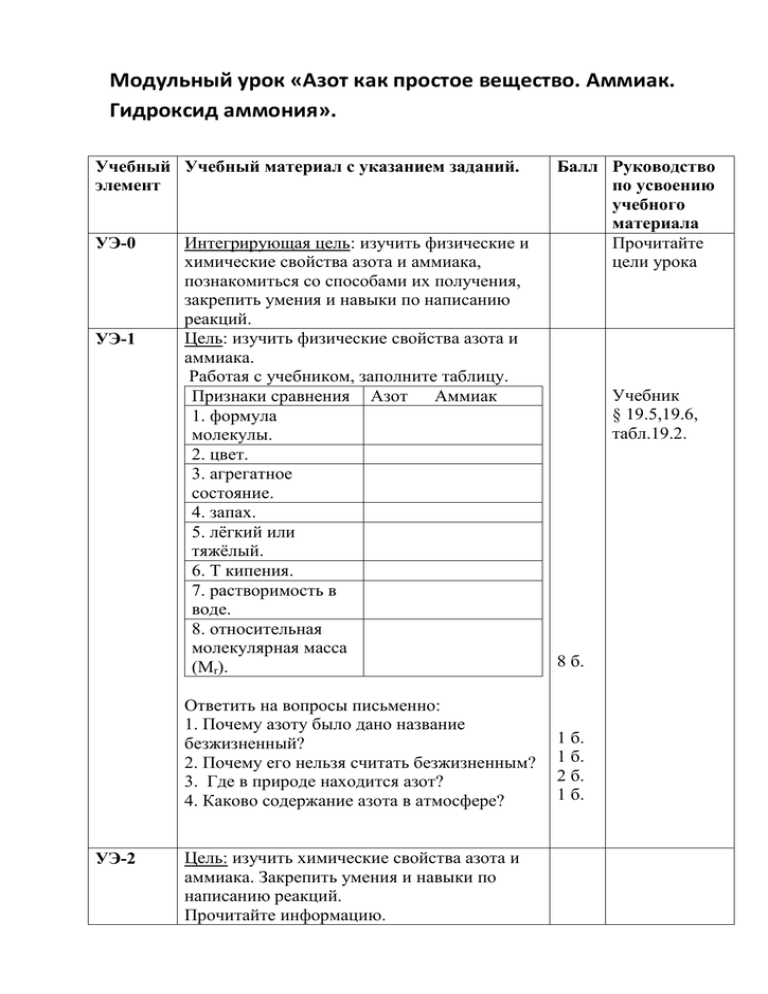
Модульный урок «Азот как простое вещество. Аммиак. Гидроксид аммония». Учебный Учебный материал с указанием заданий. элемент УЭ-0 УЭ-1 Интегрирующая цель: изучить физические и химические свойства азота и аммиака, познакомиться со способами их получения, закрепить умения и навыки по написанию реакций. Цель: изучить физические свойства азота и аммиака. Работая с учебником, заполните таблицу. Признаки сравнения Азот Аммиак 1. формула молекулы. 2. цвет. 3. агрегатное состояние. 4. запах. 5. лёгкий или тяжёлый. 6. Т кипения. 7. растворимость в воде. 8. относительная молекулярная масса (Мr). Ответить на вопросы письменно: 1. Почему азоту было дано название безжизненный? 2. Почему его нельзя считать безжизненным? 3. Где в природе находится азот? 4. Каково содержание азота в атмосфере? УЭ-2 Цель: изучить химические свойства азота и аммиака. Закрепить умения и навыки по написанию реакций. Прочитайте информацию. Балл Руководство по усвоению учебного материала Прочитайте цели урока Учебник § 19.5,19.6, табл.19.2. 8 б. 1 б. 1 б. 2 б. 1 б. Молекулы азота довольно прочны. Для того, чтобы азот вступил в реакцию нужно молекулу разрушить, а для этого необходимо затратить большую энергию Закончите реакции, пользуясь учебником. 1.а) NH3+H2O= б) Al+N2 = в) NH3 + H2SO4 = г) FeCl3+NH4OH= Выполните задание самостоятельно. 2. Закончите реакции, составьте формулы по валентности, расставьте коэффициенты: а) CuSO4+NH4OH → б) NH3 + HNO3 → в) Ca + N2 → 3. Что такое «нашатырный спирт»? 4. Что такое аммиачная вода? Как ее используют? 5. Какую среду имеет водный раствор аммиака? УЭ-3 УЭ-4 Цель: познакомиться с лабораторными и промышленными способами получения азота и аммиака. 1. Из чего получают азот в промышленности? 2. Запишите уравнение реакции, отражающей лабораторный способ получения азота. 3. Запишите уравнение реакции, отражающей лабораторный способ получения аммиака. 4. Запишите уравнение реакции синтеза аммиака. Укажите условия его осуществления (t, p, катализатор). 5. Какой процесс называется циркуляционным? Цель: закрепить знания об азоте и аммиаке, их свойствах. Проверьте усвоение знаний. Ответьте на вопросы устно: 1. Какое место занимает азот по распространённости в атмосфере? 2. Какое агрегатное состояние имеют азот и аммиак? 4 б. Учебник § 19.6 и табл. 19.2. 9 б. 1 б. 1 б. 1 б. 1 б. 1 б. 1 б. 4 б. 2 б. 1 б. 1 б. Табл. 19.2, учебник § 19.6 3. Как нужно держать сосуд при заполнении его азотом или аммиаком (вверх дном или вниз дном)? 4. Какую формулу имеет ион аммония? Усложнённое задание. 1. Закончите реакции. Какой коэффициент должен быть перед формулой аммиака. NН3+ CuO → Cu+N2 + ? а) 4; б) 3; в) 2; г) 1. 2. В уравнении реакции горения аммиака NH3+O2=N2+H2O сумма всех коэффициентов равна: а) 4; б) 8; в) 15; г) 10. Подведение итогов. Рефлексия Прочитайте цели урока. Достигли ли вы цели? В какой степени? Оцените свою работу. 40-47 баллов – оценка «5», 33-40 баллов – оценка «4», 23-32 - оценка «3», менее 23 баллов – «2». 1 б. 1 б. 3 б. 3 б. Д/З § 19.5, 19.6 1 ур. ?9 2 ур. ?12 (писм.) П.З. №3