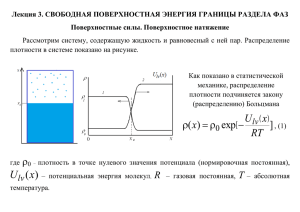
2. Адсорбция на границе жидкость-газ. Понятие о ПАВ. Уравнение Гиббса-Шишковского.
реклама

З А Н Я Т И Е N 15 ТЕМА: Поверхностные явления и адсорбция. Хроматография ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ: 1. Понятие о поверхностной энергии и поверхностном натяжении. 2. Адсорбция на границе жидкость-газ. Понятие о ПАВ. Уравнение Гиббса-Шишковского. Правило Дюкло-Траубе. 3. Адсорбция на твердых адсорбентах. Влияние температуры на смещение адсорбционного равновесия. Уравнение Ленгмюра. Теории молекулярной адсорбции. Уравнение Фрейндлиха. 4. Адсорбция электролитов на твердых адсорбентах: избирательная и ионообменная адсорбция. Правило Панета-Фаянса. 5. Применение адсорбентов в медицине. Энтеросорбенты. Гемо-, плазмо- и лимфосорбция. 6. Хроматография. Роль хроматографии в медико-биологических исследованиях. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ Молекулы жидкости, находящиеся в поверхностном слое на границе жидкость–газ, испытывают со стороны молекул газа значительно меньшее притяжение, чем со стороны молекул жидкости. В результате возникает сила, направленная внутрь жидкости. Свободная поверхность жидкости находится в состоянии натяжения и представляет собой как бы натянутую пленку, стремящуюся к сокращению, толщина которой равна радиусу сферы молекулярного действия. Поверхностное натяжение – это сила, отнесенная к единице длины линии, ограничивающей поверхность жидкости, и действующая в сторону уменьшения этой поверхности; обозначается σ (сигма). Поверхностное натяжение численно равно свободной энергии единицы площади поверхности и выражается в Джоулях на квадратный метр (Дж/м2 или Н/М). Поверхностная энергия системы Gs= σS, (где σ - поверхностное натяжение; S – площадь поверхности). Согласно второму закону термодинамики, система стремится уменьшать свободную энергию поверхности. В чистых жидкостях это осуществляется за счет сокращения площади поверхности (жидкость, на которую не действуют посторонние силы, всегда стремится принять форму шара, происходит соединение мелких капель в одну большую). В растворах уменьшение свободной энергии поверхности осуществляется за счет перехода в поверхностный слой молекул вещества, имеющего поверхностное натяжение, меньшее поверхностного натяжения растворителя. Увеличение концентрации вещества в поверхностном слое по сравнению с концентрацией его внутри раствора называется адсорбцией. Вещества, понижающие поверхностное натяжение, накапливаются в поверхностном слое. Это поверхностно-активные вещества. К ним относятся органические соединения, в состав молекул которых одновременно входит полярная группа ( – ОН, –СООН, –NН2) и неполярная углеводородная цепь, т.е. дифильные молекулы. Поверхностный избыток Г (моль/см2 или кмоль/м2) есть избыток растворенного вещества содержащегося в 1 см2 или 1 м2 поверхностного слоя по сравнению с количеством вещества в слое такой же площади внутри объема. Зависимость между Г, и концентрацией раствора C была установлена Гиббсом: С Г RT C где R – газовая постоянная; 1 Т – абсолютная температура; – бесконечно малое изменение σ с бесконечно малым изменением С). C По предложению П.А. Ребиндера, величина была названа поверхностной активностью, так как она характеризует способность вещества понижать поверхностное натяжение. Траубе установил, что в любом гомологическом ряду удлинение углеродной цепи гомолога на группу -СН2 – увеличивает его поверхностную активность в 3-3,5 раза. Это значит, что способность вещества понижать поверхностное натяжение увеличивается. При истечении жидкости из капилляра сила поверхностного натяжения заставляет жидкость собираться у края отверстия в каплю, которая отрывается в тот момент, когда масса капли ничтожно превышает поверхностное натяжение. Чем больше поверхностное натяжение, тем тяжелее и соответственно крупнее будет капля. Таким образом, поверхностное натяжение пропорционально плотности и обратно пропорционально количеству капель, вытекающих из одного и того же объема. Поверхностное натяжение определяется по формуле: ( Н 2 О) dn( H 2 O) d ( H 2 O) n ( H 2 O) dn( H 2 O) d ( H 2 O) n (1) где σ – поверхностное натяжение исследуемой жидкости; σ (H2O) – поверхностное натяжение воды; d и d (H2O) – плотности исследуемой жидкости и воды; n и n (H2O) – число капель исследуемой жидкости и воды. Для разбавленных водных растворов, плотность которых мало отличается от единицы, формулу можно упростить: n( H 2 O) (2) n σ (H2O) = 72,75 мН/м (72,75.10ˉ3 Н/м или 72,75.10ˉ3 Дж/м2) при температуре 20oС, поэтому для определения поверхностного натяжения достаточно подсчитать количество капель исследуемой жидкости и воды, вытекающей из одного и того же объема. Для определения поверхностного натяжения пользуются сталагмометром Траубе. Жидкость засасывают немного выше верхней кольцевой метки, затем дают ей свободно вытекать, подсчитывая количество капель, образующихся при вытекании отмеченного на сталагмометре объема (от верхней метки до нижней) и по формуле (2) определяют поверхностное натяжение. ( H 2 O) УЧЕБНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА N 15 ЛАБОРАТОРНАЯ РАБОТА N 1 Определение зависимости поверхностного натяжения растворов от длины углеводородной цепи поверхностно-активного вещества Для этого определить σ 0,1 М водных растворов следующих спиртов: C2H5ОН, С3Н7ОН, С4H9ОН, С5Н11ОН. Начертить кривую зависимости от числа углеродных атомов в молекулах спиртов (nC). 2 ЛАБОРАТОРНАЯ РАБОТА N 2 Определение зависимости σ раствора от концентрации поверхностно-активных веществ Для этого определить σ водных растворов амилового спирта следующих концентраций: 0,01, 0,025, 0,05, 0,1, 0,2 М. Начертить кривую зависимости σ от концентрации раствора. ПРИМЕЧАНИЕ: Предварительно промыть сталагмометр несколько раз водой и определить количество капель воды. Определение растворов проводить в указанном выше порядке. При переходе к лабораторной работе 2, сталагмометр и стаканчик несколько раз промыть водой. В выводе проанализировать зависимость поверхностного натяжения водных растворов спиртов от длины углеводородной цепи молекул спирта и от концентрации спирта (рис.1, рис.2). σ 0 σ 1 2 3 4 5 n(С) Рис. 1 Зависимость поверхностного натяжения (σ) от длины углеродной цепи (амил.сп.) См. Рис. 2 Зависимость поверхностного натяжения (σ) от концентрации амилового спирта Вспомогательные материалы: (оснащение занятия) а) сталогмометры для определения поверхностного сталогмометрическим методом; б) химические стаканы; в) растворы различных спиртов с заданными концентрациями; г) таблицы 1-3. натяжения жидкостей Материалы для контроля усвоения темы: – программированные контрольные работы по теме "Поверхностные явления. Адсорбция". МАТЕРИАЛЫ ДЛЯ САМОПОДГОТОВКИ СТУДЕНТОВ: 1. Что называют внутренним давлением жидкости? Каков механизм возникновения поверхностного натяжения? В каких единицах выражают σ? 2. Что такое адсорбция? Какие процессы вызывают это явление? Каков характер этого процесса – протекает ли он самопроизвольно? 3. Каковы знаки ΔG, ΔS и ΔН для адсорбции газа на кристалле? 4. Напишите уравнение изотермы адсорбции Гиббса, проанализируйте входящие в него величины. 5. Как формулируют правило Дюкло-Траубе? Приведите эмпирическое уравнение Шишковского. 6. Напишите уравнение Фрейндлиха, описывающее адсорбцию газов и жидкостей на твердых поверхностях. Как определяют его константы? 3 7. Напишите уравнение изотермы адсорбции Ленгмюра, проанализируйте его. 8. Избирательная адсорбция ионов. Правило Пескова-Фаянса. Лиотропные ряды. Расчетные задачи: 1. Активная площадь поверхности активированного древесного угля достигает 1000 м2 на 1 г угля. Рассчитайте массу фосгена, которая должна поглотится 0,10 м2 площади поверхности угля, если 1 г угля адсорбирует 0,440 л фосгена. ОТВЕТ: 0,19.10 г 2. Теплота адсорбции аммиака на мелко раздробленной меди равна 29,3 кДж/моль. Какой объем аммиака поглотится медью, если при этом выделилось 158,6 кДж теплоты? 3. Поверхностное натяжение σ водного раствора масляной кислоты при t = 20 оС подчиняется эмпирическому уравнению Шишковского: σ = σ o – 29,8·10ˉ3 ln (1 + 19,64.С), где σ o – поверхностное натяжение чистой воды, равное 72,75·10ˉ3 н/м. При С = 0,01 М рассчитать σ раствора. Вычислить адсорбцию. МАТЕРИАЛЫ УИРС: Строение клеточных мембран. ЛИТЕРАТУРА ОСНОВНАЯ: 1. Конспект лекций. 2. Ю.А. Ершов и др. "Общая химия", М., "Высшая школа", 1993, с. 423-450; 3. Захарченко В.Н. "Коллоидная химия", М., "Высшая школа", 1989 г., с. 28-80; ДОПОЛНИТЕЛЬНАЯ: 1. К.Н. Зеленин "Химия", Санкт-Петербург, спец. литература, с. 235-264; 2. Равич-Щербо М.И., Новиков В.В. "Физическая и коллоидная химия" М., "Высшая школа", 1975, с. 153-175; 3. Глинка Н.Л. "Общая химия", Л., "Химия", 1988, с. 309-318. 4