Лекция 01 - Введение. Поверхностные явления
реклама

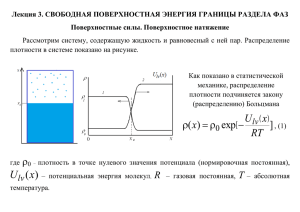
КОЛЛОИДНАЯ ХИМИЯ З начение ко лло идно й химии Коллоидная химия –– это раздел физической химии, изучающий поверхностные явления и дисперсные системы. Своеобразие свойств дисперсных коллоидных систем обусловлено влиянием поверхности, размер которой в этих системах настолько большой, что значительная доля всех структурных элементов вещества (молекул, атомов или ионов) оказывается на границе раздела фаз. Наиболее ярко влияние поверхности на свойства проявляется в наносистемах, объектах современных нанотехнологий, в которых доля вещества, находящегося в поверхностных слоях, исключительно велика и поэтому именно поверхностные явления становятся доминирующими и определяют характерные свойства этих систем. Особое значение коллоидная химия имеет в развитии фармации. Во-первых, практически бóльшая часть лекарственных форм: таблетки, гранулы, порошки, пасты, мази, суспензии, эмульсии, аэрозоли являются объектами изучения коллоидной химии. Во-вторых, способы получения, очистки и стабилизации лекарственных препаратов — это получение, очистка и стабилизация дисперсных коллоидных систем. В-третьих: изучение свойств лекарственных препаратов, контроль их производства, выбор метода оценки стабильности, идентификация, определение чистоты лекарственных препаратов в современной фармации имеют коллоидно-химическую основу. Вопросы рациональной повышения эффективности технологии, хранения, терапевтического действия лекарств также связаны с уровнем и достижениями физической химии поверхностных явлений и дисперсных систем. 1 ЛЕКЦИЯ № 1 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ 1.1. Те рм оди нами ка пове рх ност ных явле ний Поверхностные явления протекают на границах раздела фаз и обусловлены особыми свойствами поверхностных слоев. Состояние молекул или атомов, находящихся в поверхностном слое, иное, чем у молекул или атомов, находящихся в объеме фазы. Из-за нескомпенсированности сил межмолекулярного взаимодействия со стороны воздуха энергия у молекул поверхностного слоя выше, чем у молекул в объеме фазы. Фаза I - водяной пар в воздухе Граница раздела фаз F=0 Фаза II - вода F≠0 Суммарный избыток энергии молекул поверхности —свободная поверхностная энергия Гиббса Gs. Общая энергия системы G — сумма поверхностной энергии Гиббса Gs и энергии Гиббса объемной фазы Gv: G = Gs + Gv Пусть имеется гомогенная фаза с площадью поверхности А, тогда: Gs = A hσ – TAsσ, где hσ и sσ — энтальпия и энтропия единицы поверхности, а Ahσ и Asσ — энтальпия (Hs) и энтропия (Ss) поверхности. 2 Общая энергия Гиббса системы: G = Hv – TSv + Hs – TSs, где Hs и Ss — избыточные значения термодинамических величин, обусловленные наличием поверхностных слоев. Поверхностная энтальпия Hs = Gs + TSs. фактор незначителен, то Hs = Gs. Если энтропийный 1.2. Пове рх ност ное натяже ние Поверхностное натяжение (σ) — это работа, которую требуется затратить для образования единицы поверхности (размерность Дж/м2 ). Поверхностное натяжение (σ) — это сила, действующая тангенциально (по касательной) к поверхности, отнесенная к единице длины контура, ограничивающего поверхность раздела фаз, и препятствующая ее самопроизвольному увеличению (размерность Н/м). Поверхностное натяжение (σ) — это мера избытка энергии поверхностной энергии, приходящегося на единицу площади поверхности, который возникает за счет нескомпенсированности сил межмолекулярных взаимодействий у молекул поверхностного слоя. Зависимость поверхностного натяжения от различных факторов От природы жидкости От температуры При повышении температуры силы межмолекулярных взаимодействий ослабевают и поверхностное натяжение уменьшается. σ = σ0 – α(T–T0 ) При критической температуре исчезает поверхность раздела фаз жидкость—пар, поверхностное натяжение становится равным 0. 3 От давления При повышении давления увеличивается взаимодействие поверхностных слоев жидкостей с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности (сила F становится меньше) –– поверхностное натяжение уменьшается. Зависимость поверхностного натяжения водных растворов различных веществ от их природы и концентрации ПАВ (поверхностно-активные вещества) — вещества, понижающие поверхностное натяжение водных растворов. σПАВ ൏ σН2О Неионогенные ПАВ — спирты, альдегиды, кетоны, сложные эфиры. Ионогенные ПАВ — органические кислоты, амины и их соли. СН 3 СОО СН3 NH3 + ПИВ (поверхностно-инактивные вещества) — вещества, повышающие поверхностное натяжение водных растворов. Сильные неорганические электролиты — соли, кислоты, щелочи. σПИВ σН2О ПНВ (поверхностно-неактивные вещества) — вещества, не изменяющие поверхностное натяжение водных растворов. Многоатомные спирты, углеводы. σПИВ ൎ σН2О 4