IgG-антитела к антигенам базальной мембраны клубочков почек
реклама

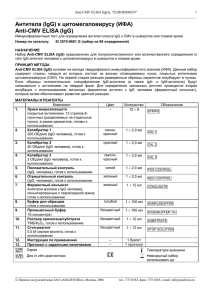
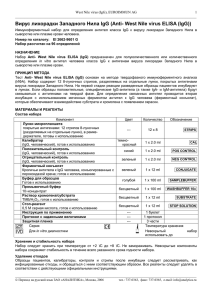
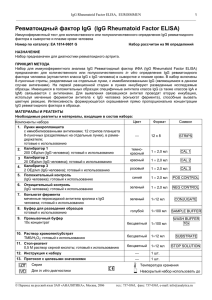
Anti-GBM_ELISA (IgG), EUROIMMUN AG 1 _____________________________________________________________________________________________________ Регистрационное удостоверение ФС №2005/1125 от 18.08.2005 г. IgG-антитела к антигенам базальной мембраны клубочков почек (Anti-GBM ELISA (IgG)) Иммуноферментный тест для определения аутоантител класса IgG к антигенам базальной клубочков почек (GBM) в сыворотке или плазме крови человека Номер по каталогу: ЕА 1251-9601 G мембраны Набор рассчитан на 96 определений НАЗНАЧЕНИЕ Набор Anti-GBM ELISA (IgG) предназначен для полуколичественного или количественного определения in vitro IgG-антител человека к базальной мембране клубочков почек (GBM-антигены) в сыворотке и плазме крови. ПОКАЗАНИЯ К ПРИМЕНЕНИЮ: Синдром Гудпасчера (Goodpasture’s syndrome). ПРИНЦИП МЕТОДА Тест Anti-GBM ELISA (IgG) основан на методе твердофазного иммуноферментного анализа (ELISA). Данный набор содержит стрипы, каждый из которых состоит из восьми отламываемых лунок, покрытых антигенами GBM. На первой стадии реакции разведенные образцы пациентов инкубируют в лунках. Если образцы положительные, специфические IgG-антитела (а также IgA- и IgM-антитела) будут связываться с антигенами на твердой фазе. Для определения связанных антител проводится вторая инкубация с использованием меченных ферментом антител к IgG человека (ферментный конъюгат), которые затем обеспечивают развитие цветной реакции. МАТЕРИАЛЫ И РЕАГЕНТЫ Компонент 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. Лунки микропланшета покрытые антигенами: 12 стрипов 8-луночных (разделяемых на отдельные лунки), в рамке-держателе, готовы к использованию Калибратор 1 200 ОЕд/мл (IgG, человеческий), готов к использованию Калибратор 2 20 ОЕд/мл (IgG, человеческий), готов к использованию Калибратор 3 2 ОЕд/мл (IgG, человеческий), готов к использованию Положительный контроль (IgG, человеческий), готов к использованию Отрицательный контроль (IgG, человеческий), готов к использованию Ферментный конъюгат Кроличьи антитела к IgG человека, конъюгированные с пероксидазой хрена; готов к использованию Буфер для образцов Готов к использованию Промывочный буфер 10×концентрат Раствор хромогена/субстрата Хромоген – тетраметилбензидин, субстрат – перекись водорода, готов к использованию Стоп-реагент 0,5 М серная кислота, готов к использованию Инструкция по применению Протокол с заданными величинами Цвет Количеств о 12 × 8 STRIPS темнокрасный красный 1 × 2,0 мл CAL 1 1 × 2,0 мл CAL 2 светлокрасный синий 1 × 2,0 мл CAL 3 1 × 2,0 мл POS CONTROL зеленый 1 × 2,0 мл NEG CONTROL зеленый 1 × 12 мл CONJUGATE голубой 1 × 100 мл SAMPLEBUFFER бесцветный 1 × 100 мл WASHBUFFER 10× бесцветный 1 × 12 мл SUBSTRATE бесцветный 1 × 12 мл STOP SOLUTION – – 1 буклет 1 протокол – Обозначение Хранение и стабильность набора: Набор следует хранить при температуре от +2 °С до +8 °С. Не замораживать. Невскрытые компоненты набора сохраняют стабильность в течение всего указанного срока годности набора. _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2007, тел.: 737-0363, факс: 737-0365, e-mail: [email protected] Anti-GBM_ELISA (IgG), EUROIMMUN AG 2 _____________________________________________________________________________________________________ Утилизация отходов: Образцы пациентов, калибраторы, контроли и стрипы после инкубации следует рассматривать как инфицированные отходы и обращаться с ними соответствующим образом. Все реагенты следует утилизировать в соответствии с действующими официальными инструкциями. ПОДГОТОВКА И СТАБИЛЬНОСТЬ РЕАГЕНТОВ Примечание: Перед использованием все реагенты необходимо прогреть до комнатной температуры (от +18 °С до +25 °С) в течение 30 минут. После первого использования реагенты сохраняют стабильность в течение указанного срока годности, если они хранятся при температуре от +2 °С до +8 °С и защищены от микробной контаминации. Прочие сведения о стабильности отдельных реагентов указаны ниже. Лунки, покрытые антигенами: Готовы к использованию. Вскройте защитную упаковку планшета, расстегнув имеющуюся на пакете самоуплотняющуюся застежку. Во избежание конденсации влаги внутри лунок, не вскрывайте пакет до тех пор, пока он не нагреется до комнатной температуры. Отломив необходимое количество лунок, остальные неиспользованные лунки немедленно вложите вновь в ту же защитную упаковку и плотно закройте ее на застежку (не вынимайте из упаковки пакетик с влагопоглотителем). После первого вскрытия упаковки плотно упакованные вновь лунки с антигенами можно хранить минимум 4 месяца в сухом месте при температуре от +2 °С до +8 °С. Калибраторы и контроли: Готовы к использованию. Необходимо тщательно перемешать перед использованием. Ферментный конъюгат: использованием. Готов к использованию. Необходимо тщательно перемешать перед Буфер для образцов: Готов к использованию. Промывочный буфер: Поставляется в виде 10-кратного концентрата. Если образовались кристаллы, их можно растворить перед разведением буфера, нагревая концентрат до 37°С и интенсивно взбалтывая. Необходимое количество концентрата следует отобрать из бутыли чистой пипеткой и растворить деионизированной или дистиллированной водой (1 часть концентрированного реагента плюс 9 частей воды). Например, для проведения анализа на 1 стрипе: к 5 мл концентрата следует добавить 45 мл воды. Готовый разведенный промывочный буфер стабилен до 1 месяца, если его хранят при температуре от +2 о С до +8 оС и правильно используют. Раствор хромогена/субстрата: Готов к использованию. После отбора необходимого количества реагента из флакона немедленно вновь закройте его, так как раствор чувствителен к свету. Во время использования раствор хромогена/субстрата должен быть бесцветным. Не используйте раствор, если он приобрел голубую окраску. Стоп-реагент: Готов к использованию. Предостережение: Использованные контрольные сыворотки и калибраторы были проверены на антитела к ВИЧ-1 и ВИЧ-2 и вирусу гепатита С, а также на наличие HBsAg, методами иммуноферментного анализа и иммунофлуоресценции и при этом показали отрицательные результаты. Тем не менее, все используемые материалы следует считать потенциально опасными и обращаться с ними, соблюдая необходимые меры предосторожности. Некоторые реагенты содержат токсический агент азид натрия. Избегайте его попадания на кожу. ПОДГОТОВКА И СТАБИЛЬНОСТЬ ОБРАЗЦОВ ПАЦИЕНТОВ Материал образцов: Сыворотка или плазма (ЭДТА, гепарин или цитрат) крови человека. Стабильность: Образцы пациентов, предназначенные для исследования этим методом, можно хранить до 14 дней при температуре от +2 оС до +8 оС. Разведенные образцы необходимо использовать в течение одного рабочего дня. Разведение образцов: Образцы пациентов разводят 1:101 буфером для образцов. Например: разведите 10 мкл сыворотки в 1,0 мл буфера для образца и тщательно перемешайте на вортексе (пипетки для этого не подходят). ПРИМЕЧАНИЕ: Калибраторы и контроли готовы к использованию, их разводить не надо. _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2007, тел.: 737-0363, факс: 737-0365, e-mail: [email protected] Anti-GBM_ELISA (IgG), EUROIMMUN AG 3 _____________________________________________________________________________________________________ ПРОЦЕДУРА ИССЛЕДОВАНИЯ Для полуколичественного анализа проводите одновременно с инкубацией положительного и отрицательного контролей и образцов пациентов инкубацию калибратора 2. Для количественного анализа проводите одновременно с инкубацией положительного и отрицательного контролей и образцов пациентов инкубацию калибраторов 1, 2 и 3. Инкубация образцов (1-я стадия) Промывка Инкубация конъюгата (2-я стадия) Промывка Инкубация субстрата (3-я стадия) Остановка реакции Измерение Внесите в отдельные лунки планшета в соответствии со схемой внесения реагентов по 100 мкл калибраторов, положительного и отрицательного контролей или разведенных образцов сыворотки или плазмы крови. Инкубируйте при комнатной температуре (18-25 °С) в течение 30 минут. Вручную. Удалите содержимое лунок, затем последовательно промойте все лунки 3 раза, каждый раз внося по 300 мкл приготовленного промывочного буфера в каждую лунку. Автоматическая. Промойте лунки 3 раза, внося по 400 мкл приготовленного промывочного буфера в каждую лунку (программирование устройства для промывания планшетов в режиме переполнения: “Overflow Modus”). Оставляйте промывочный буфер в каждой лунке в течение 30 – 60 секунд во время каждого цикла промывки, затем удаляйте содержимое лунок. После промывки (вручную или автоматической) тщательно удаляйте остатки промывочного буфера из лунок, постукивая перевернутым планшетом о фильтровальную бумагу. Примечание. Остатки жидкости (>10 мкл), скапливающейся в лунках после промывки, могут повлиять на субстратную реакцию и привести к получению ложно заниженных значений оптической плотности. Неправильная промывка (например, менее 3 промывочных циклов, слишком маленькие объемы промывочного буфера или слишком короткое время реакции) может привести к ложно завышенным значениям оптической плотности. Внесите в лунки планшета по 100 мкл конъюгата фермента (меченных пероксидазой антител к IgG человека). Инкубируйте при комнатной температуре (18-25 °С) в течение 30 минут. Удалите содержимое лунок. Промойте, как описано выше. Внесите в лунки планшета по 100 мкл раствора хромоген/субстрат. Инкубируйте при комнатной температуре (18-25 °С) в течение 15 минут (предохраняйте от воздействия прямых солнечных лучей). Внесите в лунки планшета по 100 мкл стоп-реагента в той же последовательности и с той же скоростью, как и раствор хромоген/субстрат. С помощью планшетного спектрофотометра измерьте интенсивность окрашивания в лунках при длине волны 450 нм (значение референтной длины волны между 620 нм и 650 нм) в течение 30 минут после добавления стопреагента. Перед измерением осторожно покачайте микропланшет для обеспечения равномерного распределения раствора. СХЕМА РАЗМЕЩЕНИЯ НА ПЛАНШЕТЕ ОБРАЗЦОВ И КОНТРОЛЕЙ A B C D E F G H 1 C2 Pos Neg P1 P2 P3 P4 P5 2 P6 P7 P8 P9 P 10 P 11 P 12 P 13 3 P 14 P 15 P 16 P 17 P 18 P 19 P 20 P 21 4 P 22 P 23 P 24 5 6 7 C1 C2 C3 pos neg P1 P2 P3 8 P4 P5 P6 P7 P8 P9 P 10 P 11 9 P 12 P 13 P 14 P 15 P 16 P 17 P 18 P 19 10 P 20 P 21 P 22 P 23 P 24 11 12 Представленная выше схема представляет собой пример размещения проб на планшете: - на стрипах 1-4 - для полуколичественного определения IgG-антител в 24 образцах пациентов (от Р 1 до Р 24); - на стрипах 7-10 - для количественного определения IgG-антител в 24 образцах пациентов (от Р 1 до Р 24). В соответствующие лунки вносят и инкубируют калибраторы (от С1 до С3), положительный контроль (pos.), отрицательный контроль (neg.), а также образцы пациентов (Р 1 – Р 24). Достоверность анализа можно увеличить, размещая и измеряя каждую анализируемую пробу в двух параллельных лунках (дубликатах). _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2007, тел.: 737-0363, факс: 737-0365, e-mail: [email protected] Anti-GBM_ELISA (IgG), EUROIMMUN AG 4 _____________________________________________________________________________________________________ Лунки можно отламывать от стрипов по одной. Это позволяет привести в соответствие используемое количество лунок и количество исследуемых образцов и, таким образом, минимизировать расход реагентов. Положительный и отрицательный контроли выполняют роли внутренних контролей для проверки правильности процедуры тестирования. Их следует использовать при каждой постановке анализа. РАСЧЕТ РЕЗУЛЬТАТОВ Полуколичественный анализ Результаты можно оценить полуколичественно, рассчитывая отношение ОП в лунке с контрольным образцом или в лунке с образцом пациента относительно ОП в лунке с калибратором 2. Для расчета этого отношения используйте следующую формулу: Отношение (RATIO) = ОП контрольного образца или образца пациента ОП калибратора 2 Фирма EUROIMMUN рекомендует следующую интерпретацию результатов: Отношение (RATIO) < 1,0: Отношение (RATIO) ≥ 1,0: Отрицательный результат Положительный результат Количественный анализ На графике линейной зависимости откладывают величины ОП, измеренные для 3 калибровочных сывороток (ось Y) против концентрации антител в этих сыворотках, выраженной в относительных единицах ОЕд/мл (ось X). По полученным точкам проводят стандартную кривую для определения концентрации антител в образцах пациентов. Для расчета кривой с помощью компьютера используйте способ построения по точкам (“point-to-point”). Ниже приведен пример типичной калибровочной кривой. Не используйте ее, пожалуйста, для определения концентрации антител в образцах пациентов. 2.0 Оптическая плотность 1.8 1.6 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 0 20 40 60 80 100 120 140 160 180 200 ОЕд/мл Если ОП образца пациента лежит выше величины ОП для калибратора 1 (с концентрацией 200 ОЕд/мл), результат следует выражать как “>200 ОЕд/мл”. Такой образец рекомендуется развести 1:400 и протестировать повторно, а результат, полученный по калибровочной кривой (в ОЕд/мл), умножить на коэффициент разведения 4. Верхняя граница интервала нормальных значений неинфицированных людей (уровень отсечения, cutoff), рекомендованная фирмой EUROIMMUN, составляет 20 относительных единиц (ОЕд)/мл. EUROIMMUN рекомендует следующую интерпретацию результатов: < 20 ОЕд/мл: ≥ 20 ОЕд/мл: Отрицательный результат Положительный результат Для определений, проводящихся в дубликатах, следует использовать в расчетах среднее значение двух величин. Если эти две величины существенно расходятся между собой, анализ образца следует повторить. Для установления диагноза всегда, кроме результатов серологических исследований, необходимо учитывать клинические симптомы пациента. ХАРАКТЕРИСТИКИ ТЕСТА Калибровка: Так как в настоящее время не существует Международного стандарта (референтной сыворотки с антителами к GBM-антигенам), калибровка выполняется в относительных единицах (ОЕд). Для каждой группы тестов, выполненных на наборах определенной серии, величины ОП калибратора и относительные единицы и/или отношения (RATIO), определенные для положительного и отрицательного контролей, должны лежать в границах, установленных для наборов этой серии. Протокол с установленными значениями включается в поставку набора. Обнаружение отклонения контрольных _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2007, тел.: 737-0363, факс: 737-0365, e-mail: [email protected] Anti-GBM_ELISA (IgG), EUROIMMUN AG 5 _____________________________________________________________________________________________________ значений от указанных в спецификации будет свидетельствовать о неправильной постановке анализа; в этом случае тест следует повторить. Активность фермента, используемого в составе набора, зависит от температуры, поэтому величины ОП могут варьироваться, если не используется термостат. Чем выше температура воздуха в помещении во время инкубации с субстратом, тем выше величины ОП. Сходные изменения происходят и с временем инкубации. Однако, таким же воздействиям подвергается и сыворотка калибратора, поэтому при расчете результатов возможные колебания в основном компенсируются. Антиген: Используемые в наборе лунки покрыты высокоочищенными ∝-3-цепями коллагена IV типа, содержащими эпитопы требуемых антигенов GBM. Главными компонентами базальной мембраны почечных клубочков (GBM) являются белки внеклеточного матрикса коллагенового типа IV, ламинин, фибронектин и протеогликаны. Аутоантитела к GBM нацелены на эпитопы коллагена IV типа. Молекула коллагена IV типа состоит из 3 альфа-цепей, каждая имеет молекулярную массу 170 кДа. Альфа-цепи образуют спиральную третичную структуру из нескольких доменов, отделенных друг от друга последовательностями, несущественными для формирования доменов. Компактная спиральная зона (домен 7S) расположена с N-конца, а глобулярная структура NC1 – с С-конца цепи. Главным антигеном для антител к GBM является домен NC1 цепи альфа-3(IV). Линейность: Линейность теста исследовали, используя серию разведений сыворотки пациента с высокой концентрацией антител. Тест Anti-GBM ELISA (IgG) линеен в пределах интервала измерения 2 – 200 ОЕд/мл. Аналитическая чувствительность: Аналитическая чувствительность – это величина, равная 3SD образца, не содержащего аналита, и представляет собой наименьший определяемый титр антител. Аналитическая чувствительность теста Anti-GBM ELISA (IgG) составляет приблизительно 1 ОЕд/мл. Перекрестная реактивность: Данный ELISA-тест не показал наличия перекрестной реактивности. Вещества, мешающие определению: Проведению анализа не мешали образцы с признаками гемолиза, липемические и иктерические образцы с концентрациями гемоглобина вплоть до 10 мг/мл, триглицеридов – до 20 мг/мл и билирубина – до 0,4 мг/мл. Воспроизводимость: Воспроизводимость теста исследовали, определяя коэффициент вариации (CV) результатов анализа трех сывороток с концентрациями антител, попадающими на разные участки калибровочной кривой. Величины CV внутри одного опыта определяли из 20 параллельных измерений каждой сыворотки. Величины CV в разных опытах получали, проводя по 4 параллельных измерения каждой сыворотки в течение 6 различных дней. Вариабельность внутри одного опыта, n = 20 Сыворотка Среднее CV (ОЕд/мл) (%) 1 58 3,3 2 60 4,9 3 83 3,4 Вариабельность в разных опытах, n = 4 × 6 Сыворотка Среднее CV (ОЕд/мл) (%) 1 60 5,1 2 65 6,6 3 85 5,0 Референтный интервал: Уровни анти-GBM аутоантител (IgG) анализировали, используя набор EUROIMMUN ELISA на панели 300 здоровых доноров крови. При уровне отсечения (cut-off), равном 20 ОЕд/мл, все доноры крови оказались отрицательными по анти-GBM. Специфичность и чувствительность 14 образцов сывороток пациентов с синдромом Гудпасчера и 180 образцов пациентов с другими заболеваниями исследовали, используя набор Anti-GBM ELISA (IgG). Специфичность и чувствительность составили 100 %. Группы пациентов (общее число 194) Синдром Гудпасчера СКВ Гранулематоз Вегенера Ангиопатия (Microscopic polyangitis) Синдром Черга-Штрауса n 14 10 0 50 20 10 Количество позитивных по анти-GBM аутоантителам 14 (100 %) 0 0 0 0 Корреляция ИФА с тестом, использующим метод непрямой иммунофлуоресценции (IIFT): 14 образцов сывороток пациентов с синдромом Гудпасчера и 420 образцов не охарактеризованных сывороток исследовали, используя набор EUROIMMUN Anti-GBM ELISA (IgG) и набор EUROIMMUN IIFT (IgG) в качестве референтного метода. Специфичность ИФА относительно метода непрямой иммунофлуоресценции составила 99 %, а чувствительность – 100 %. _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2007, тел.: 737-0363, факс: 737-0365, e-mail: [email protected] Anti-GBM_ELISA (IgG), EUROIMMUN AG 6 _____________________________________________________________________________________________________ n=434 ИФА IIFT положительный отрицательный положительный 47 0 отрицательный 5 382 КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ Антитела к антигену GBM являются маркером всех типов аутоиммунного гломерулонефрита, включая синдром Гудпасчера. В тех случаях, когда в аутоиммунный процесс не вовлечены легкие, анти-GBM аутоантитела обнаруживаются в 60 % сывороток пациентов; при дополнительном вкладе анти-GBM аутоантител легочной ткани, доля обнаружения возрастает до 80 – 90 %. СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ Список литературы приведен в оригинале инструкции на английском языке. Внимание! Перевод сделан с английского оригинала инструкции. Перед постановкой исследования сверьте номер и дату издания вложенного в набор оригинала с указанными в настоящем переводе (см. внизу справа). При несовпадении номеров или дат обратитесь в «Аналитику» за новым переводом, либо руководствуйтесь оригиналом инструкции. Anti-GBM ELISA_EA_1251-9601G_rus.doc 30.05.2007 9:48 Оригинал E1 2081G_A_UK_C02.doc – 01.12.05 _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2007, тел.: 737-0363, факс: 737-0365, e-mail: [email protected]