критический стеноз артерии единственной функционирующей
реклама

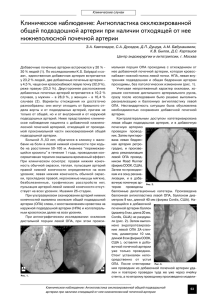
КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ РЕГИОНАРНОГО КРОВООБРАЩЕНИЯ 65 КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ РЕГИОНАРНОГО КРОВООБРАЩЕНИЯ © Коллектив авторов, 2013 УДК 616.61-007:616.136.7-007.271-089 КРИТИЧЕСКИЙ СТЕНОЗ АРТЕРИИ ЕДИНСТВЕННОЙ ФУНКЦИОНИРУЮЩЕЙ ПОЧКИ: ОТКРЫТАЯ ХИРУРГИЯ ИЛИ СТЕНТИРОВАНИЕ – КАКОВА РАЗНИЦА? В.С. Аракелян, Н.А. Гидаспов, Я.Г. Колесников, Н.Р. Гамзаев, М.В. Шумилина, Н.В. Бортникова, Р.Г. Букацелло, Е.В. Головинова ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева» (директор – академик РАН и РАМН Л.А. Бокерия) РАМН, Рублевское шоссе, 135, Москва, 121552, Российская Федерация Аракелян Валерий Сергеевич, доктор мед. наук, профессор, руководитель отделения хирургии артериальной патологии; e-mail: [email protected]; Гидаспов Никита Андреевич, кандидат мед. наук, науч. сотр.; Колесников Ян Геннадьевич, клинический ординатор; Гамзаев Назим Рагимович, кандидат мед. наук, заместитель руководителя по лечебной работе; Шумилина Маргарита Владимировна, доктор мед. наук, руководитель группы ультразвуковых исследований сердечно-сосудистой и органной патологии; Бортникова Наталья Владимировна, науч. сотр.; Букацелло Роман Геннадьевич, кандидат мед. наук, науч. сотр.; Головинова Евгения Викторовна, клинический ординатор В статье представлен опыт успешной хирургической реваскуляризации почечной артерии при атеросклеротическом поражении у пациента с единственной функционирующей почкой. Рассматриваются современные тактические подходы к диагностике и терапии атеросклеротического стеноза почечных артерий, показания к реваскуляризации почечной артерии, а также алгоритм выбора метода реваскуляризации. Ключевые слова: стеноз почечной артерии; единственная почка; хирургическая реваскуляризация. V.S. Arakelyan, N.A. Gidaspov, Ya.G. Kolesnikov, N.R. Gamzaev, M.V. Shumilina, N.V. Bortnikova, R.G. Bukatsello, E.V. Golovinova A.N. Bakoulev Scientific Center for Cardiovascular Surgery of Russian Academy of Medical Sciences, Rublevskoe shosse, 135, Moscow, 121552, Russian Federation Arakelyan Valeriy Sergeevich, MD, Professor, Head of Department of Surgery Arterial Pathology; Gidaspov Nikita Andreevich, Cand. Med. Sci., Researcher; Kolesnikov Yan Gennad'evich, Clinical Intern; Gamzaev Nazim Ragimovich, Cand. Med. Sci., Deputy Head of Medical Work; Shumilina Margarita Vladimirovna, MD, Head of the Group of Ultrasonic Research Cardiovascular and Organ Pathology; Bortnikova Natal’ya Vladimirovna, Researcher; Bukatsello Roman Gennad’evich, Cand. Med. Sci., Researcher; Golovinova Evgeniya Viktorovna, Clinical Intern A case of successful surgical RA revascularization in a patient presenting with renal artery stenosis secondary to atherosclerosis and a single functioning kidney is reported. Current strategies in the diagnosis and treatment of atherosclerotic renal artery stenosis, indications for renal artery revascularization and a choice algorithm for revascularization techniques are identified. Key words: renal artery stenosis; single kidney; surgical revascularization. Введение Стеноз почечной артерии – распространенное и грозное проявление атеросклеротического процесса. Согласно популяционным эпидемиологическим исследованиям, около 6,8% населения старше 65 лет страдают дан- ным заболеванием [1]. Его частота значительно повышается среди людей с клинически явным атеросклеротическим поражением любого другого бассейна. Свыше 50% пациентов с окклюзирующим поражением артерий нижних конечностей и аорты, а также лиц с анев- КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ КРОВООБРАЩЕНИЯ, № 3, 2013 CRITICAL ARTERY STENOSIS OF A SINGLE FUNCTIONING KIDNEY: OPEN SURGERY OR STENTING – WHAT IS THE DIFFERENCE? 66 КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ РЕГИОНАРНОГО КРОВООБРАЩЕНИЯ ризмой брюшной аорты имеют гемодинамически значимый стеноз почечной артерии [2]. Он является независимым предиктором смерти: при естественном течении 73% пациентов погибают в течение 7 лет [3]. Функция почки в течение 2 лет сохраняется у 97% пациентов с двумя почками и односторонним поражением, снижается до 82% – у пациентов с двусторонним поражением и драматически падает до 45% – у пациентов с единственной почкой [4]. В мировой литературе встречаются единичные сообщения о хирургическом лечении атеросклеротического стеноза почечной артерии (АСПА) у пациентов с единственной почкой [5]. В последнее время эндоваскулярные процедуры практически вытеснили открытые оперативные вмешательства как метод реваскуляризации бассейна почечных артерий. Между тем нельзя не отметить тот факт, что как ангиография, так и имплантация стента в почечную артерию, даже при техническом успехе процедуры, в 15% случаев сопровождается ухудшением и без того нарушенной почечной функции [6]. Особое значение эти обстоятельства приобретают при наличии у пациента единственной почки. Мы решили представить следующий клинический случай как пример возможностей хирургического метода реваскуляризации почечной артерии. КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ КРОВООБРАЩЕНИЯ, № 3, 2013 Клинический случай П а ц и е н т П., 56 лет, поступил в клинику с жалобами на: повышение артериального давления, максимально до 270/120 мм рт. ст. (несмотря на прием трех гипотензивных препаратов в максимальной терапевтической концентрации), головокружение, головные боли, общую слабость. Анамнез: считает себя больным в течение последних 3 лет, когда впервые было зарегистрировано повышение цифр артериального давления. Наблюдался по месту жительства, последние 6 мес регулярно получал гипотензивную терапию, до этого – эпизодически. Ухудшение контроля артериальной гипертензии отмечает с мая 2012 г. (повышение АД до 270/120 мм рт. ст.). Пациент выкуривал по пачке сигарет в день на протяжении 36 лет, в течение последних 4 лет не курит. В 2009 г. пациент перенес холецистэктомию по поводу желчно-каменной болезни. Объективный статус: без особенностей. По данным лабораторно-инструментального обследования противопоказаний к операции не выявлено. При ведении пациента мы использовали «Руководство по описанию случаев реваскуляризации почечных артерий для клинических исследований» [7]. Согласно данному руководству, в качестве скринингового исследования для подтверждения стеноза мы использовали УЗИ почек и ультразвуковое дуплексное сканирование почечных артерий, протокол которого приводим ниже. Левая почка бобовидной формы. Подвижность 2 см. Контуры неровные. Размеры: длина – 78 мм, ширина – 36 мм, толщина паренхимы – 6 мм. Правая почка бобовидной формы. Подвижность 2,4 см. Контуры относительно неровные. Размеры: длина – 106 мм, ширина – 65 мм, толщина паренхимы – 12 мм. Чашечки – 9 мм. Конкременты: микролиты. Почечные артерии: диаметр внутреннего просвета правой почечной артерии 2,1 мм, диаметр дистальнее – 5 мм. Линейные скорости кровотока (ЛСК, систолическая/диастолическая/средняя) по проксимальному отделу правой почечной артерии – 157/43/73 см/с, РI = 1,6 (повышен), по сегментарной артерии – 46/10/24 см/с, RI = 1,6 (повышен); кровоток по проксимальному отделу левой почечной артерии не картируется, по сегментарной артерии – 60/13/38 см/с, RI = 0,53 (снижен). Заключение: эхопризнаки хронического пиелонефрита справа. Нефролитиаз. Левая почка значительно уменьшена в размерах. Стеноз правой почечной артерий 60–65%. В качестве уточняющего предоперационного исследования руководство [7] предписывает выполнение КТ- или МР-ангиографии. Пациент поступил с результатами КТ-ангиографического исследования, выполненного амбулаторно. Заключение: КТ-картина тромбоза левой почечной артерии, уменьшение левой почки в размерах. Изменения правой почечной артерии с локальным сужением ее просвета. Выраженный атеросклероз брюшного отдела аорты и обеих ОПА (рис. 1, 2). Для предоперационной оценки функции почек использовалась нефросцинтиграфия. Заключение: справа – умеренная степень нарушения преимущественно выделительной функции почки. Выведение радиофармацевтического препарата неравномерное, по типу дискинезии мочевых путей. Слева – нефункционирующая почка. сятому межреберью справа. После рассечения диафрагмы и ее медиальной ножки пересечен большой чревный нерв. Выделена брюшная аорта на уровне правой почечной артерии. Правая почечная артерия с систолическим дрожанием, пальпаторно в устье почечной артерии определяется атеросклеротическая бляшка. После введения гепарина аорта пристеночно отжата на уровне почечной артерии, пережата почечная артерия. Выполнена аортотомия по заднеправой стенке аорты на уровне почечной артерии. Проведена трансаортальная эндартерэктомия из почечной артерии. Атеросклеротическая бляшка полностью удалена. Аортотомическое отверстие ушито непрерывным обвивным швом полипропиленовой нитью 6/0–13 мм. Пущен кровоток. Визуально – пульсация правой почечной артерии отчетливая, пальпаторно – стенка артерии мягкая, пульсовые волны без систолического дрожания. Линия шва герметична. Диафрагма и рана ушиты послойно, наглухо, с оставлением активных дренажей в правой плевральной полости и забрюшинном пространстве. Наложена асептическая повязка. Послеоперационный период неосложненный, пациент выписан в удовлетворительном состоянии на 7-е сут. Гемодинамический успех оценивался в раннем послеоперационном периоде с помощью УЗИ почечных артерий (артерия полностью проходима, признаков стеноза не выявлено), клинический успех планируется оценить в динамике (табл. 1). Рис. 1. Мультиспиральная КТ-ангиограмма ветвей брюшной аорты, 3D-реконструкция. Визуализируется извитость и кальциноз инфраренального отдела брюшной аорты, гемодинамически незначимый устьевой стеноз верхней брыжеечной артерии. Левая почечная артерия не контрастируется, определяется локальный гемодинамически значимый устьевой стеноз правой почечной артерии. Обращает на себя внимание аваскулярная область в верхнем полюсе правой почки Диагноз клинический: мультифокальный атеросклероз. Окклюзия левой почечной артерии, нефункционирующая левая почка. Устьевой стеноз правой почечной артерии. Вазоренальная гипертензия, соответствующая артериальной гипертензии III ст., риск сердечно-сосудистых осложнений (ССО) очень высокий. Хроническая болезнь почек II–III ст. Операция 10 сентября 2012 г.: торакофренопараректальный забрюшинный доступ по де- Рис. 2. Компьютерные томограммы органов брюшной полости и малого таза с контрастированием: а а – 3D-реконструкция, определяется заполнение контрастом чашечно-лоханочной системы правой почки, правого мочеточника и мочевого пузыря, левая почка контраст не выделяет; б – фронтальный срез, очевидно уменьшение размеров левой почки, контрастирования ее чашечно-лоханочной системы не отмечено б Таблица 1 Динамика изменения скорости клубочковой фильтрации (СКФ) СКФ По Cockroft–Gault, мл/мин По MDRD Study Prediction Equation, мл/мин/1,73 м2 По CKD-EPI, мл/мин/1,73 м2 05.09.2012 10.09.2012 11.09.2012 14.09.2012 66 78 79 61 73 73 51 60 59 62 73 73 КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ КРОВООБРАЩЕНИЯ, № 3, 2013 67 КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ РЕГИОНАРНОГО КРОВООБРАЩЕНИЯ 68 КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ РЕГИОНАРНОГО КРОВООБРАЩЕНИЯ Рекомендации по выписке: немедикаментозная коррекция факторов риска ССО, средние терапевтические дозы статинов, ацетилсалициловой кислоты, блокаторов кальциевых каналов (БКК), β-адреноблокаторов, антагонистов рецепторов ангиотензина-2 I типа (АРА), сцинтиграфия и УЗИ почек, а также суточное мониторирование артериального давления в динамике через 2 мес. КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ КРОВООБРАЩЕНИЯ, № 3, 2013 Обсуждение По анатомическому варианту поражения АСПА может быть устьевым (не более 5 мм от устья почечной артерии по данным ангиографического исследования), неустьевым, диффузным или же представленным стенозом лишь ветви почечной артерии. Примерно в 90% случаев АСПА локализуется в устье и проксимальной трети сосуда, очень часто бляшка захватывает периренальную аорту [8]. Гемодинамическая значимость стеноза определяется на основании наличия клинических проявлений, сужения артерии по диаметру более 50%, пикового систолического градиента давления более 20 и среднего градиента – более 10 мм рт. ст. Существует классификация АСПА, предложенная Safian&Madder. Согласно данной классификации, различают АСПА с нормально функционирующей паренхимой или с нефропатией (типы 1 и 2 соответственно) и нормальной перфузией паренхимы или с ишемией (типы А и В соответственно) [9]. Эта классификация проста и удобна для выделения группы пациентов, которые получат максимальный эффект от реваскуляризации. Лучшими кандидатами являются пациенты без или с минимальными проявлениями нефропатии и с доказанной ишемией почечной паренхимы (тип 1В), как пациент из описанного выше клинического наблюдения. Основными целями, которые преследует лечащий врач, являются: сохранение функции паренхимы почки, нормализация АД и снижение риска ССО. На сегодняшний день в распоряжении клиницистов имеются два способа достижения поставленных целей: консервативная терапия и реваскуляризация. Консервативная терапия подразумевает немедикаментозное и наилучшее медикаментозное (НМЛ) лечение. Реваскуляризация, в свою очередь, подразделяется на эндоваскулярную и хирургическую. При принятии решения о инвазивной реваскуляризации необходимо учитывать физи- ологические особенности артериального кровоснабжения почки (кровоток значительно превышает метаболические потребности органа). Почка значительно менее чувствительна к ишемии, чем, например, мозг или сердечная мышца. Этот факт объясняет низкую распространенность вазоренальной гипертензии (ВРГ) среди пациентов с АСПА, а также редкость случаев купирования артериальной гипертензии после успешных реваскуляризирующих процедур. Исходя из вышеизложенного, все пациенты с АСПА должны получать НМЛ [10]. Известны зарубежные руководства [2, 11], которые стоит учитывать при разработке тактики ведения пациентов с АСПА ввиду отсутствия национальных рекомендаций по диагностике и лечению данной нозологии. Показания к реваскуляризирующей процедуре в этих документах определяются конкретной клинической картиной. В руководстве Американской коллегии кардиологов [2] алгоритм выбора тактики реваскуляризации почечных артерий изложен в виде лаконичной схемы (рис. 3), а в руководстве Европейского общества кардиологов [11] – в виде таблицы (табл. 2). Показаниями к хирургическому лечению АСПА являются: неудавшееся чрескожное вмешательство, сложная для чрескожного вмешательства анатомическая ситуация (множественные почечные артерии малого диаметра, окклюзия почечной артерии с сохраненной функцией паренхимы почки, раннее деление почечной артерии на ветви, Класс I/B) и сочетание АСПА с необходимостью параренальной аортальной реконструкции (Класс I/C) [2]. К прогностически неблагоприятным факторам относятся: преклонный возраст, значительная отягощенность сопутствующими заболеваниями (ОИМ, ХСН, диабет, ХОБЛ), атрофия почки, выраженное поражение паренхимы почки, протеинурия более 1 г/сут, редукция дистального русла. Вопрос о показаниях к реваскуляризации остается дискутабельным до сих пор, несмотря на наличие нескольких рандомизированных клинических исследований (РКИ): DRASTIC, NITER, RAVE, STAR, ASTRAL, CORAL. «Большие» исследования – STAR, ASTRAL и CORAL продемонстрировали отсутствие эффекта транслюминальной ангиопластики и стентирования по сравнению с НМЛ в отношении артериальной гипертензии, функции почек, частоты сердечно-сосудистых событий. Чрескожная транслюминальная ангиопластика (стентирование показано в исключительных случаях) (Класс I/B) Показано стентирование (Класс I/B) Хроническая почечная недостаточность в сочетании с односторонним стенозом (у пациента с двумя почками) (Класс IIb/C) Хирургическая коррекция Гемодинамически значимый стеноз почечной артерии в сочетании с возвратными симптомами, необъяснимой ХСН или внезапным, необъяснимым отеком легких (Класс I/B) Хроническая почечная недостаточность в сочетании с двусторонним стенозом почечных артерий или стенозом артерии единственной функционирующей почки (Класс IIa/B) КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ КРОВООБРАЩЕНИЯ, № 3, 2013 *Жизнеспособная почка – почка с размерами длинника более 7 см. Рис. 3. Показания к реваскуляризации (схема). Общепризнано, что хирургическое лечение доказало свою эффективность при стенозе почечной артерии как атеросклеротического генеза, так и при фибромускулярной дисплазии. На сегодняшний день хирургический метод рассматривается как основной при невозможности выполнения менее инвазивной процедуры – чрескожного вмешательства [2]. ХСН – хроническая сердечная недостаточность Фибромускулярная дисплазия почечной артерии со стенозом Баллонная ангиопластика почечной артерии/стентирование Стеноз почечной артерии и нестабильная стенокардия (Класс IIa/B) Атеросклеротический стеноз почечной артерии Асимптомный гемодинамически значимый односторонний стеноз артерии жизнеспособной* почки (Класс IIb/C) Асимптомный гемодинамически значимый двусторонний стеноз почечных артерий или стеноз артерии единственной жизнеспособной почки (Класс IIb/C) Стеноз почечной артерии при: – нарастающей, резистентной или злокачественной артериальной гипертензии; – артериальной гипертензии в сочетании с уменьшением размеров одной почки; – артериальной гипертензии при непереносимости медикаментозного лечения (Класс IIa/B) КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ РЕГИОНАРНОГО КРОВООБРАЩЕНИЯ 69 70 КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ РЕГИОНАРНОГО КРОВООБРАЩЕНИЯ Таблица 2 Рекомендации: стратегии лечения стеноза почечных артерий [11] Класс рекомендаций Уровень доказательности Ингибиторы ангиотензин-превращающего фермента (иАПФ), АРА и БКК являются эффективными средствами для лечения артериальной гипертензии при стенозе почечных артерий I B иАПФ и АРА противопоказаны при выраженном двустороннем стенозе почечных артерий и в случае стеноза артерии единственной функционирующей почки III B IIb A I B Эндоваскулярное лечение может рассматриваться как метод лечения стеноза почечных артерий при нарушении функции почек IIb B Баллонная ангиопластика стеноза почечных артерий может рассматриваться как метод лечения у пациентов с необъяснимой застойной сердечной недостаточностью или внезапным отеком легких при сохранной систолической функции левого желудочка IIb C IIb C Рекомендации Медикаментозная терапия Эндоваскулярное лечение Ангиопластика, предпочтительнее со стентированием, может рассматриваться как метод лечения при более чем 60% симптомном АСПА В случае выполнения ангиопластики устьевого АСПА рекомендовано дополнять процедуру стентированием Хирургическое лечение КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ КРОВООБРАЩЕНИЯ, № 3, 2013 Хирургическое лечение может рассматриваться как метод лечения стеноза почечных артерий у пациентов, которым планируется вмешательство на брюшной аорте, пациентов со сложной анатомией почечных артерий и после безуспешной попытки эндоваскулярного лечения На сегодняшний день имеется лишь одно РКИ (RAOOD), в котором «head-to-head» сравнивались эндоваскулярная и открытая методики реконструкции почечной артерии. В данном РКИ не было обнаружено разницы в исходах лечения, за исключением количества койко-дней, проведенных в стационаре (18 – при хирургии против 10 – при баллонной ангиопластике со стентированием) [12]. Также в обширном метаанализе было показано статистически значимое превосходство открытого вмешательства перед эндоваскулярным относительно контроля гипертензии (21%, 95% CI 9–33%, р = 0,001) и сохранения функции почки (34%, 95% CI 18–54%, р = 0,001) [13]. Также стоит принять во внимание высокую вероятность рестеноза в стенте у пациентов после стентирования артерии единственной функционирующей почки (87 ± 6%) в течение 5 лет [14]. Учитывая вышеизложенные факты, взвесив возможные риск и пользу от вмешательства, был сделан выбор в пользу хирургического лечения АСПА у данного конкретного пациента и получены отличные ближайшие результаты операции. Выводы 1. Лечение пациентов с АСПА должно быть комплексным и всегда включать НМЛ. 2. Кандидаты на реваскуляризацию почечной артерии должны тщательно отбираться. 3. Методом выбора для лечения АСПА является чрескожная транслюминальная ангиопластика со стентированием почечной артерии. 4. Хирургическая реваскуляризация может быть использована в сложных клинических ситуациях в центрах, имеющих большой соответствующий опыт, даже у пациентов с высоким риском. Литература/References 1. 2. 3. 4. 5. 6. 7. 8. Hansen K.J., Edwards M.S., Craven T.E. et al. Prevalence of renovascular disease in the elderly: a population-based study. J. Vasc. Surg. 2002; 36: 443–51. Hirsch A.T., Haskal Z.J., Hertzer N.R. et al. ACC/AHA 2005 guidelines for the management of patients with peripheral arterial disease. J. Am. Coll. Cardiol. 2006; 47: 1239–312. Zierler R.E., Bergelin R.O., Davidson R.C. et al. A prospective study of disease progression in patients with atherosclerotic renal artery stenosis. Am. J. Hypertens. 1996; 9: 1055–61. Connolly J.O., Higgins R.M., Walters H.L. et al. Presentation, clinical features and outcome in different patterns of atherosclerotic renovascular disease. Q. J. Med. 1994; 87: 413–21. Reilly J.M., Ruhin B.G., Thompson R.W. et al. Revascularization of the solitary kidney: A challenging problem in a high risk population. Surgery. 1996; 120 (4): 732–6; discussion 736–7. Sahin S., Cimşit C., Andaç N., Baltacioglu F., Tuglular S., Akoglu E. Renal artery stenting in solitary functioning kidneys: technical and clinical results. Eur. J. Radiol. 2006; 57 (1): 131–7. Rundback J.H., Sacks D., Kent K.C. et al. Guidelines for the reporting of renal artery revascularization in clinical trials. J. Vasc. Int. 2003; 14: 477–92. Mukherjee D. Renal artery stenosis: who to screen and how to treat? ACC Curr. J. Rev. 2003; 12: 70–5. КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ РЕГИОНАРНОГО КРОВООБРАЩЕНИЯ 9. 10. 11. Safian R.D., Madder R.D. Refining the approach to renal artery revascularization. J. Am. Coll. Cardiol. Intv. 2009; 2: 161–74. Textor S., Lerman L., McKusick M. The uncertain value of renal artery intervention: where are we now? J. Am. Coll. Cardiol. Intv. 2009; 2: 175–82. Tendera M., Aboyans V., Bartelink M.-L. et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases. Eur. Heart J. 2011; 32: 2851–906. 12. 13. 14. 71 Balzer K.M., Pfeiffer T., Rossbach S. et al. Prospective randomized trial of operative vs interventional treatment for renal artery ostial occlusive disease. J. Vasc. Surg. 2009; 49: 667–74. Abela R., Ivanova S., Lidder S. et al. An analysis comparing open surgical and endovascular treatment of atherosclerotic renal artery stenosis. Eur. J. Vasc. Surg. 2009; 38: 666–75. Davies M.G., Saad W.E., Bismuth J.X. et al. Endovascular revascularization of renal artery stenosis in the solitary functioning kidney. J. Vasc. Surg. 2009; 49: 953–60. Поступила 21.05.2013 © Коллектив авторов, 2013 УДК 616.132.5-073.75-036.8 СРАВНИТЕЛЬНАЯ ОЦЕНКА ДИАГНОСТИЧЕСКОЙ ЭФФЕКТИВНОСТИ РАЗЛИЧНЫХ ЛУЧЕВЫХ МЕТОДОВ ИССЛЕДОВАНИЯ БРАХИОЦЕФАЛЬНЫХ АРТЕРИЙ Л.А. Бокерия, И.П. Асланиди, В.Н. Макаренко, Г.Г. Гецадзе, Т.Н. Сергуладзе, E.Р. Двалишвили ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева» (директор – академик РАН и РАМН Л.А. Бокерия) РАМН, Рублевское шоссе, 135, Москва, 121552, Российская Федерация Цель исследования – сравнительная оценка диагностической эффективности различных лучевых методов обследования критических стенозов артерий каротидного и вертебробазилярного бассейнов: дигитальной субтракционной ангиографии (ДСА), компьютерной томографической ангиографии (КТА) и бесконтрастной магнитно-резонансной томографической ангиографии (МРА) при критических стенозах артерий каротидного и вертебробазилярного бассейнов. Материал и методы. Проведено 441 (100%) ангиографическое исследование, из них ДСА – 391 (88,7%), КТА и бесконтрастных МРА – 50 (11,3%) исследований. Диагностическая ценность дигитальной субтракционной ангиографии, КТА и бесконтрастной МРА сравнивалась методами, разработанными для испытания интерпретирующих медицинских установок, с помощью трехзначной схемы квалификаций, при определении степени критического стеноза 75–99% для внутренней сонной и позвоночной артерий. Результаты. Согласно обобщенным показателям диагностической эффективности всех используемых методов ангиографии, наблюдается снижение индекса чувствительности для вертебробазилярного бассейна относительно каротидного бассейна на 10,1%, индекса специфичности – на 6,1% и индекса позитивного высказывания – на 5,5%. При сравнении общих показателей диагностической ценности ДСА, КТА и бесконтрастной МРА установлено, что обобщенный индекс чувствительности, специфичности и позитивного высказывания составил 97,6, 93,7 и 84,7% соответственно. Заключение. Ультразвуковое дуплексное сканирование с ДСА – наиболее чувствительные и информативные методы визуализации стено-окклюзирующих поражений брахиоцефальной артерии (БЦА). КТА рекомендуется для исследования критических стенозов и окклюзий БЦА для уточнения локализации высоко расположенных атеросклеротических бляшек. Бесконтрастную МРА следует использовать при аллергии на контрастные препараты. Ключевые слова: компьютерная томография; бесконтрастная магнитно-резонансная томография головного мозга; дигитальная субтракционная ангиография брахиоцефальной артерии. КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ КРОВООБРАЩЕНИЯ, № 3, 2013 Бокерия Лео Антонович, доктор мед. наук, профессор, академик РАН и РАМН, директор; Асланиди Ираклий Павлович, доктор мед. наук, профессор, заведующий отделом ядерной диагностики; Макаренко Владимир Николаевич, доктор мед. наук, профессор, заведующий рентгенодиагностическим отделом; Гецадзе Гела Гурамович, врач-рентгенолог; Сергуладзе Тинатин Нодариевна, кандидат мед. наук, врач ультразвуковой диагностики; e-mail: [email protected]; Двалишвили Екатерина Рамазиевна, мл. науч. сотр.