ОКИСЛЕНИЕ КАРБИДА КРЕМНИЯ ОКСИДАМИ УГЛЕРОДА
реклама

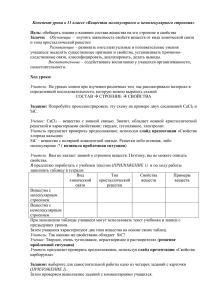
ОКИСЛЕНИЕ КАРБИДА КРЕМНИЯ ОКСИДАМИ УГЛЕРОДА Научный руководитель - А.С. Иванов А.С. Деянов, А.А. Русинкевич, В.А. Чурин, В.В. Власов В микротвэлах ВТГР с оксидным топливом вследствие деления урана или плутония появляется избыток кислорода. В результате, растет давление СО, которое может привести к разрушению покрытий, как по механизму сосуда давления, так и по механизмам коррозии SiC слоя. При высоких выгораниях необходимым элементом микротвэлов ВТГР с плутониевыми кернами является геттер кислорода, резко снижающий давление СО в процессе выгорания и обеспечивающий высокие значения эксплуатационной надежности МТ. Геттер может быть выполнен в виде тонкого слоя карбида кремния на керне, предварительно покрытом тонким слоем плотного пироуглерода. При этом подслой плотного пироуглерода должен играть роль барьера между оксидным керном и карбидом кремния. Проблема окисления карбида кремния актуальна, поскольку карбид кремния является одновременно геттером и силовым слоем и его окисление существенно влияет на работоспособность рассматриваемых элементов конструкции МТ. Кинетика разложения карбида кремния при окислении рассматривалась в ряде работ. Поскольку именно пленка двуокиси кремния обуславливает высокую устойчивость карбида кремния к окислению, весьма интересно провести исследование этой пленки, получить представление о ее происхождении, превращениях в ней различных фаз SiO2 и ее влиянии на процесс окисления. В ранних работах предполагалось, что пленка на поверхности окисленного SiC представляет собой аморфную двуокись кремния. Но позднее с помощью электронной дифракции были обнаружены крошечные кристаллики кристобалита В работах [1, 2] исследована кинетика окисления SiC при давлении кислорода от 10-2 до 0.5 мм.рт.ст. Были обнаружены два существенно различных процесса окисления – пассивное и активное. Пассивное окисление возникало при условии формирования на поверхности пленки из диоксида кремния. Активное окисление сопровождалось образованием летучего монооксида кремния. В работе [1] изучали условия перехода от одной стадии окисления к другой при изменении давления кислорода и температуры. При этом давления и температуры перехода от одной стадии к другой были соотнесены с термодинамическими условиями окисления системы SiC + C с образованием SiO и СО. В работе [3] авторы предположили, что при окислении карбидов образуются оксидные пленки, препятствующие протеканию реакции окисления. В рамках этой логики, если реакции протекают, то это свидетельствует о наличии разрывов в окисной пленке. Отметим, что растрескивание окисной пленки может возникать как в процессе ее роста, так и в следствие террмоциклирования. В [4] показано, что при низком давлении высокая скорость окисления может возникать при образовании SiO. Следуя работе [5] и по аналогии с рассмотренным там окислением кремния, мы будем называть этот процесс – быстрым, активным окислением. Процесс же сопровождающийся образованием оксида SiO2, будем называть пассивным окислением. Окисление SiC было особенно хорошо изучено при нормальном давлении, где образовывалась пленка кварца [4, 6-11]. В некоторых работах [6, 10, 11] показано, что аморфные пленки кварца образовывалась при окислении при температурах ниже 1300 °C , а кристобалит при температурах выше 1300 °C . В работе [12] предположено, что при окислении углерода образование защитной оксидной пленки предотвращает взаимодействие углерода с кислородом. Если взаимодействие происходит, возможно происходит и разрушение оксида. В таблице 1 показаны реакции, которые могут возникать в Si-C-O системе и ассоциированные реакции. Разрушение оксидной пленки может происходить, когда образовывается кварцевая пленка. Окисление также может происходить без образования оксидной пленки (реакции 2, 4). Реакция 5 показывает, что SiC диссоциирует при условиях вакуума, если пары кремния удалены. Реакции твердой фазы карбида кремния с кварцем (6, 7) могут происходить, если газообразные продукты реакции удалены. Реакции 6 и 7 можно сравнить с реакциями между кремнием и кварцем. Равновесное давление монооксида кремния (для реакций 6 и8) может быть рассчитано по данным таблицы 1. Если существует достаточно большое количество монооксида кремния в газовой фазе, реакции 6 и 8 могут быть изменены с образованием пленки кварца на кремнии. № 1 2 3 4 5 6 7 8 Таблица 1 Термохимический анализ системы Si-C-O Реакции Константы равновесия при температуре 13270С 26.26 SiC(s) + 3/2O2(g) ⇔ SiO2 (s) + CO(g) 13.51 SiC(s) + O2(g) ⇔ SiO (g) + CO(g) 30.96 SiC(s) + 2O2(g) ⇔ SiO2 (s) + CO2(g) 18.22 SiC(s) + 3/2O2(g) ⇔ SiO (g) + CO2(g) -2.428 SiC(s) ⇔ Si (s) + C(s) -11.98 SiC(s) + 2SiO2(s) ⇔ 3SiO (g) + CO(g) -20.02 SiC(s) + 3SiO2(s) ⇔ 4SiO (g) + CO2(g) -2.520 1/2Si(s) + 1/2SiO2(s) ⇔ SiO (g) Для наших задач необходимо установить температуру образования кристобалита. Для решения этого вопроса была рассмотрена фазовая диаграмма равновесия системы Si-O (Рис. 1). Рис. 1 – Фазовая диаграмма равновесия системы Si-O Единственная исчерпывающая диаграмма равновесия в литературе для конденсированной Si-O системы при давлении 0.1 МПа приведена в [13]. В этой диаграмме отсутствует нестабильная фаза SiO, показаны границы областей с двумя фазами, где различные полиморфы SiO2 существуют вместе с Si. Фазовая диаграмма Si-O приблизительно такая же как и в [13]. Тридимит S-VI включен, несмотря на некоторые признаки того, что это только метастабильное состояние в чисто бинарной системе. Общий термин “кварц” применяется к любой разновидности SiO2. Высокий кристобалит стабилен при температурах выше 1470°C и стабильно плавится при давлении 0.1 МПа. Утверждается, что высокий кристобалит устойчив до температуры 1050°C, но в настоящее время оценивается, что эта температура представляет лишь сосуществование метастабильного кристобалита и высокого кварца. По данной диаграмме температура образования кристобалита заметно выше (на 170°C), чем указанная в работах [6, 10, 11]. Возможно, данное расхождение вызвано отсутствием углерода в системе Si-O. Для проверки данного утверждения необходимо провести дополнительные экспериментальные исследования. Дополнительно к рассмотренной литературе и фазовой диаграмме равновесия системы Si-O были проведены расчеты системы Si-C-O по программе Ivtanthermo. Для этого рассмотрена система Si-C-O и система Si-O при давлении 1 атм. и 0,1 атм., в диапазоне температур от 700 до 1800 К. Количество кислорода в расчетах соответствовало количеству кислорода в газовой фазе под оболочкой микротвэла при соответствующих давлениях. В состоянии термодинамического равновесия весь свободный кислород взаимодействует с SiC, окисляя его до SiO2. Причем, кристобалит образуется при температуре 1070К, что не совпадает ни с одной из линий на фазовой диаграмме. Рис. 2 – Термодинамическая система Si-C-O, рассчитанная по программе Ivtanthermo. P= 1 атм. Сравнивая систему Si-C-O и Si-O по программе расчета термодинамического состояния Ivthantermo, мы не нашли существенных различий в содержании SiO2. По всей видимости, кислорода достаточно для полного окисления SiC, с образованием SiO2, CO и CO2. Отсутствие в расчетах в программе Ivtanthermo фазовых переходов при температуре 1400°С, скорее всего, свидетельствует об отсутствии необходимых данных в базе данных Ivtanthermo. Для уточнения расхождений в литературе, на фазовых диаграммах и в расчетных кодах необходимо проведение экспериментальных исследований рассматриваемой системы. Список литературы 1. E.A. Gulbransen et al. “The Oxidation of Silicon Carbide at 1150 to 1400 0C and at 9.103 to 5.10-1 Torr Oxygen Pressure” ─ J. Electrochem. Soc., v. 113, 1966, p. 1311. 2. J.E. Antill, J.B. Warburton, “Active to Passive Transition in the Oxidation of SiC”, Corrosion Sci., v. 11, 1971, p. 337. 3. Webb, W.W., Norton, Y.T., Wagner, J. J. Electrochem. Soc., v. 103, 112 (1956) 4. J. Ervin, J. Am. Ceram. Soc., v. 41, 347 (1958) 5. C. Wagner, “Passivity During the Oxidation of Silicon at Elevated Temperatures”, ─ J. Appl. Phys., v. 29, 1958, p. 1295 6. P. J. Jorgensen, M. E. Wadsworth, and I. B. Cutler, ibid., 42, 613 (1959) 7. P. J. Jorgensen, M. E. Wadsworth, and I. B. Cutler, ibid., 43,209 (1960) 8. R.F. Adamsky, J. Phys. Chem., 63, 305 (1959) 9. K. Motzfeldt, Acta Chem. Scand., 18, 1596 (1964) 10. G. I. Finch and H. Wilman, Trans. Faraday Soc., 33, 337 (1937) 11. H. G. Heine and P. Scherer, Helv. Phys. Acta, 13,489 (1940) 12. W. W. Webb, J. T. Norton, and C. Wagner, This Journal, 103, 112 (1956) 13. R.E. Johnson and A. Muan, J. Am. Ceram. Soc., 51(8), 430-433 (1968).