Флуоресцентные белки: свойства и применение
реклама

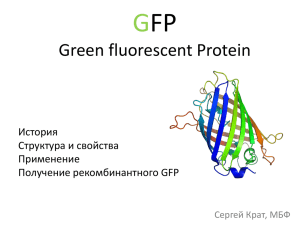
ФЛУОРЕСЦЕНТНЫЕ БЕЛКИ – ПРИРОДНОЕ РАЗНООБРАЗИЕ И ПРИМЕНЕНИЕ В ЭКСПЕРИМЕНТАЛЬНОЙ БИОЛОГИИ Лукьянов С.А. Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН Glowfish Реализация генетической информации Дифференциальная экспрессия генов Изучение экспрессии генов Изучение экспрессии генов Пробы для детекции мРНК in situ Пробы для детекции белка in situ ‘Репортерные гены’ In vivo Большинство методов может быть использовано для срезов и для whole mount гибридизации Гидромедуза Aequorea victoria Биолюминесценция стимул Фотопротеин Фотопротеин Изменение конформации белка Окисленный люциферин свет Гидромедуза Aequorea victoria Осаму Шимомура и коллеги (1974 г) Aequorea victoria GFP – вторичный эмиттер в биолюминесцентной системе медузы Открытие: Клонирование: Первое использование: Нобелевская премия: Shimomura et al. (1962) Prasher et al. (1992) Chalfie et al. (1994) and Inouye &Tsuji (1994) 2008 год 4-5 нм Структура GFP 11 -слоев образуют бочонок с -спиралью в середине (238 ак). Хромофор образуется внутри глобулы путем автокаталитической циклизации остова трех аминокислот (Ser65-Tyr66-Gly67) Автокаталитическая циклизация хромофора Хромофор образуется внутри глобулы путем автокаталитической циклизации остова трех аминокислот (Ser65-Tyr66-Gly67) OH Tyr 66 OH OH OH H N O O NH O Gly67 O H N OH N H Ser 65 O N O2 , –H2O2 N –H2O O N Зеленый флуоресцентный белок, GFP • Генетически кодируется • Сам образует хромофор • Не нуждается в низкомолекулярных кофакторах и субстратах Использование GFP Анализ экспрессии генов Прижизненное мечение организмов, тканей, клеток, клеточных структур и белков Области применения GFP Видно, где и когда включается промотор; можно метить организмы или группы клеток Области применения GFP Можно следить за локализацией белков в живых клетках Области применения GFP сигнал внутриклеточной локализации Можно метить клеточные структуры Эндоплазматический ретикулум Комплекс Гольджи Мутанты GFP Yellow (EYFP, Venus, …) em 528 nm Green (EGFP, Emerald, …) em 508 nm Cyan (ECFP, Cerulean, …) em 475 nm Blue (EBFP) em 448 nm Wavelength, nm Использование GFP и его мутантов Анализ белок-белковых взаимодействий с помощью резонансного переноса энергии Фостера (Foster Resonance Energy Transfer, FRET). Передача энергии от молекулы донора к молекуле акцептора происходит посредством диполь–дипольного взаимодействия. Флуоресценция в дальнекрасной области спектра предпочтительнее для визуализации целых организмов (whole body imaging) Клонирование генов GFP-подобных белков из коралловых полипов (1999) Юлий Лабас 1933-2008 Matz et al., Nat Biotechnol. 1999 Окраска кораллов Нефлуоресцентная окраска кораллов также обусловлена GFPподобными белками Как возникает окраска Вещество эффективно поглощает среднюю часть спектра видимого света. Комбинация оставшегося синего и красного света дает характерную малиновую окраску. Разноцветные, окрашенные и бесцветные GFP-подобные белки из медуз Aequorea coerulescens (безцветный белок) Phyalidium sp. (желтый белок) Antomedusae (хромобелок) Зеленые флуоресцентные белки копепод (2004) Mantis shrimp C. H. Mazel et al., Science, 2004 Зеленый флуоресцентный белок ланцетника (2007) Эволюция GFP-подобных белков Annelida Nematoda Crustacea Mollusca Arthropoda Branchiostoma Chordata Echinodermata Hydrozoa Anthozoa Cnidaria Typhlocoela Ctenophora Porifera 1.0 0 400 450 mTFP1 TagCFP, Cerulean Azurite, EBFP2 TagBFP 2.0 500 550 mOrange 600 mPlum TagRFP, TagRFP-T mStrawberry mRuby mCherry mRaspberry mKate2 mKO Venus, TagYFP, Citrine, Topaz, SYFP2, etc. EGFP, EmGFP, AcGFP1, Wasabi, TagGFP2, etc. Sirius Fluorecence, a.u. Флуоресцентные белки: цветовое разнообразие 650 700 Wavelength, nm Структура хромофоров природных флуоресцентных белков Расширение возможностей: использование GFPподобных белков для многоцветного мечения внутриклеточных структур HeLa HeLa HeLa Окрашивание частей клетки с помощью разноцветных флуоресцентных белков Фиолетовый митохондрии Синий цитоскелет Зеленый микротрубочки Желтый – аппарат Гольджи Красный - ядро Whole body imaging Сравнение в эмбрионах Xenopus laevis. Трансгенные эмбрионы Xenopus laevis экспрессирующие Катюшу и DsRed-Express под контролем кардио-актинового промотера. (a,с) Катюша, стадия эмбриона 33 (b,d) Головная часть, на срезе (e-h) DsRed-Express, аналогичные фото. Сердце визуализуется только на срезе (i) 2.5 месячные лягушки. Трансгенная мышь, экспрессирующая дальне-красный флуоресцентный белок Katushka в поджелудочной железе (островки Лангенгарса) Diéguez-Hurtado et al., 2010 Использование флуоресцентных белков для скрининга лекарственных препаратов Получение флуоресцентных стабильных клеточных линий Прививание опухолей Стабильно-трансфецированные опухолевые клетки Отбор и проверка прототипов лекарственных препартов Визуализация опухолей Терапия контроль Контроль Препарат 1 Препарат 2 опыт Мечение опухолевых клеток в мыши Рак простаты PC-3-RFP Глиома U87-RFP Глиома U87-RFP and GFP Рак груди MDA-MB-435-GFP Рак поджелудочной железы MIA-PaCa-2-RFP Рак кишечника HCT-116-RFP Дальнекрасный белок mKate mKate: Excitation max - 588 nm Emission max- 635 nm Quantum yield - 0.36 Extinction coefficient 45,000 M-1cm-1 Connexin 43 Alpha-tubulin Alpha-actinin Vinculin EB3 protein Images were kindly provided by Michael W. Davidson (Florida State University) mKate2-EB3 fusion (microtubule end-binding protein) By Michael W. Davidson (Florida State University) mKate2.7- alpha actinin Развитие Drosophila Steltzer lab, Nat. Meth. 2007 Развитие рыбки Danio rario Ras-GFP мембрана Гистон H2B-RFP наложение Steltzer lab, Nat. Meth. 2007 Технология ―Brainbow‖ Livet et al. Nature 2007 ~100 colors! ‗‗Fucci‘‘- индикатор клеточого цикла Miyawaki lab, Cell 2008 Часы клеточного цикла в голове эмбриона мыши GFP — Cdt1, G1 фаза RFP — Geminin, S/G2/M фазы Miyawaki A. Cell, 2008 Флуоресцентный таймер DIC FITC rhodamine overlay 5 Mid-age organelles 2h 4 Old organelles Young organelles 5h 3 Early expression 2 10h 1 50h 500 600 Wavelength, nm Late expression 700 Terkikh et al., 2000; Verkhusha et al., 2004 Фотоактивируемые флуоресцентные белки (2002) «Фотоактивация» флуоресценции asulCP asulCP – природный «разгорающийся» флуоресцентный белок определяющий пурпурную окраску щупалец морского анемона Anemonia sulcata. asulCP становиться ярко флуоресцентным под действием зеленого света и гаснет под действием синего. Anemonia sulcata Lukyanov et al., JBC 2000 Разжигание и гашение флуоресценции asulCP Палитра фотоактивируемых флуоресцентных белков PS-CFP2 Chudakov et al., Nat. Biotechnology, 2004 Перемещение белков Скорость и направление движения Коэффициент диффузии Выявление мобильных и стабильных фракций Обмен между компартментами Скорость обращения Перемещение органелл Скорость и направление движения Скорость обмена содержимого Деление и слияние Перемещение клеток Скорость и направление движения Локализация Частота делений Форма и объем Время Перемещение химерного белка PSCFP-hDAT внутри филоподий HEK293 клеток (в течение 15 мин) Мониторинг фибрилларина с помощью Dendra (точечная активация 488 нм лазером) Дифракционный барьер PALM/STORM и тд. 200 нм 10 нм Аппрокимация: функция рассеяния точки (PSF) Сверхразрешающая микроскопия: photoactivation localization microscopy, PALM Новая микроскопия позволяет преодолеть дифракционный барьер. Метод основан на повторяющихся циклах фотоактивации, детекции и гашения флуоресценции Разрешение более чем 20 нм! Betzig E, et al., Science 2006 Двухцветная PALM PALM с использованием TagRFP Большинство флуоресцентных белков время TagRFP время Быстрое обесцвечивание - выход на “плато” фотоактивации TagRFP-zyxin, живые клетки HeLa, активация одним лазером Фрагмент 80x80 пикселей Реконструкция TagRFP-zyxin, живые клетки TagRFP-zyxin TagRFP-тубулин, фиксированные клетки Зеленые флуоресцентные белки – светоиндуцируемые доноры электронов Oxygen-independent green-to-red EGFP photoconversion in presence of electron acceptors ―oxidative redding‖ Fluorescence, % Oxidative redding 100 0 Compound E´0, V n K3[Fe(CN)6] Benzoquinone Cytochrome c MTT Glucose oxidase (FAD) FMN NAD+ 0.42 0.29 0.22 -0.11 -0.22 -0.22 -0.32 1 2 1 2 2 2 2 EC50 for green fluorescence decrease, M 60 70 400 1200 10 100 n.d. Excitation/ Emission 575 nm 607 nm Wavelength EC50 for red fluorescence increase, M 500 2000 >1500 4000 15 150 n.d. Relative redding efficiency 100 80 5 80 4 15 0.5 Bogdanov et al., Nature Chem.Biol. 2009 Oxidative ―reddening‖ of EGFP Bogdanov et al, Nat. Chem. Biol. 2009 Cytochrome c reduction by EGFP 0.7 Absorbance 0.6 0.5 0.4 CytC (+3) 0.3 CytC (+2) 0.2 EGFP 0.1 0 350 400 450 500 550 600 Wavelength, nm Yield of reduced cyt c ~ 1,7! EGFP reddening in mammalian cells Redding of an endogenous green fluorescent protein in vivo Button polyp Zoanthus Confocal optical section through tentacle Zooxantella 50 m 488 Биологическая роль GFPподобных белков Annelida Nematoda Crustacea Mollusca Arthropoda Branchiostoma Chordata Echinodermata Hydrozoa Anthozoa Cnidaria Typhlocoela Ctenophora Porifera 1. 2. 3. Вторичный эмиттер в биолюминесцентных системах Защита от солнца для симбиотических водорослей кораллов Окраска 4. Трансфер электронов Основные области применения флуоресцентных белков Glowfish и другие… Z. Gong et al., BBRC 2003; S. Ding et al., Cell, 2005 X.Y.Yin et al., Biol. Rep., 2007 Институт биоорганической химии им. академиков М.М.Шемякина и Ю.А.Овчинникова Лаборатория Молекулярных технологий Лаборатория Биофотоники Группа Флуоресцентных инструментов Лаборатория Молекулярных основ эмбриогенеза Лаборатория Ренгеноструктурного анализа Группа Химии хромопротеинов Институт Биохимии им. А.Н.Баха РАН Нижегородская государственная медицинская академия