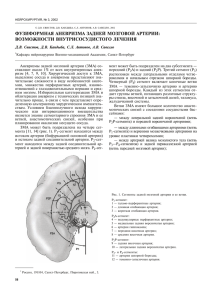
Диссертация Люньковой РН__
реклама

ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИКО-СТОМАТОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ А.И. ЕВДОКИМОВА» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ На правах рукописи Люнькова Регина Николаевна РАСШИРЕННЫЕ БАЗАЛЬНЫЕ ДОСТУПЫ В ХИРУРГИИ АРТЕРИАЛЬНЫХ АНЕВРИЗМ ГОЛОВНОГО МОЗГА ДИССЕРТАЦИЯ на соискание ученой степени кандидата медицинских наук Специальность 14.01.18. – Нейрохирургия Научный руководитель: Академик РАН, доктор медицинских наук, профессор Владимир Викторович Крылов Москва – 2015 2 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ……………………………………………………………………………………………5 ГЛАВА 1 ОСОБЕННОСТИ ПРИМЕНЕНИЯ РАСШИРЕННЫХ БАЗАЛЬНЫХ ДОСТУПОВ В ХИРУРГИИ АРТЕРИАЛЬНЫХ АНЕВРИЗМ ГОЛОВНОГО МОЗГА (ОБЗОР ЛИТЕРАТУРЫ) …………………………………………………………………………11 1.1 Артериальные аневризмы головного мозга, для лечения которых необходимо применение базальных доступов…………………………………………………………………………………..12 1.2 Эффективность эндоваскулярного и микрохирургического лечения артериальных аневризм головного мозга………..……………………………………………………………………….……..17 1.3 Современная стратегия в лечении сложных артериальных аневризм …………………….31 1.4 Расширенные базальные доступы в хирургии артериальных аневризм головного мозга….36 1.5 Индивидуальная анатомическая изменчивость задних отделов артериального круга большого мозга применительно к выбору хирургического доступа …………………………… 49 1.6 Заключение к главе 1…………………………………………………………………………… 51 ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ……………………………… 53 2.1 Материалы и методы топографо-анатомических исследований ……………………………. 53 2.1.1 Общая характеристика анатомического материала………………………………………… 53 2.1.2 Методика приготовления анатомических препаратов ...……………………………………53 2.1.3 Методики топографо-анатомических исследований…………………………………….… 55 2.1.3.1 Методика исполнения заднего петрозального доступа ………………………………… 57 2.1.4 Обеспечение анатомических исследований ………………………………………………..62 2.2 Материалы и методы клинического исследования……………………….. ……………….…62 2.2.1 Методики проведения расширенных базальных доступов в хирургии артериальных аневризм головного мозга…………………………………………………………………………. 63 ГЛАВА 3 ХИРУРГИЧЕСКАЯ АНАТОМИЯ ЗАДНИХ ОТДЕЛОВ АРТЕРИАЛЬНОГО КРУГА БОЛЬШОГО МОЗГА …………………………….…………………………………… 66 3.1 Общая характеристика анатомического материала………………………………………….. 66 3.2 Хирургическая анатомия задних отделов артериального круга большого мозга, базилярной и задней мозговой артерий ..…………………………………….…………………..66 3.2.1 Тип строения задних отделов артериального круга большого мозга………………………66 3.2.2 Изменчивость базилярной артерии…………………………………………………………..67 3.2.3 Изменчивость Р1-сегмента задней мозговой артерии………………………………………68 3 3.2.4 Изменчивость Р2- и Р3-сегментов задней мозговой артерии и формирование проксимальной бифуркации Р2-сегментом задней мозговой артерии……………………………70 3.2.5 Изменчивость перфорирующих ветвей задней мозговой артерии ……………………… 72 3.2.6 Задние медиальные ворсинчатые артерии…………………………………………………. 74 3.2.7 Задние латеральные ворсинчатые артерии………………………………………………… 75 3.2.8 Корковые ветви задней мозговой артерии ………………………………………………… 77 3.3 Хирургическая анатомия верхней мозжечковой артерии……………………………….. 80 3.3.1 Топография устья верхней мозжечковой артерии…………………………………………..80 3.3.2 Бифуркация верхней мозжечковой артерии и модели кровоснабжения ………………… 81 3.3.3 Топография верхней мозжечковой артерии относительно черепных нервов и намёта мозжечка………………………………………………………………………………………………84 3.4 Заключение к главе 3 ……………………………………………………………………………87 ГЛАВА 4 РАСШИРЕННЫЕ БАЗАЛЬНЫЕ ДОСТУПЫ В ХИРУРГИИ СЛОЖНЫХ ТРУДНОДОСТУПНЫХ АРТЕРИАЛЬНЫХ АНЕВРИЗМ ГОЛОВНОГО МОЗГА……… 89 4.1 Инфратемпоральный орбитозигоматический доступ (анатомическое обоснование)…………………………………………………………………… 89 4.1.1 Общая характеристика анатомического материала………………………………………… 89 4.1.2 Оценка параметров операционной раны…………………………………………………….. 89 4.1.3 Общая характеристика орбитозигоматического доступа……………………………………91 4.1.4 Анатомическое обоснование применения орбитозигоматического доступа в хирургии труднодоступных церебральных артериальных аневризм…………………………………………92 4.2 Передний петрозальный доступ (анатомическое обоснование) ………………………. 99 4.2.1 Общая характеристика анатомического материала……………………………………… 99 4.2.2 Оценка параметров операционной раны…………………………………………………… 99 4.2.3 Общая характеристика переднего петрозального доступа ………………………………. 100 4.2.4 Анатомическое обоснование применения переднего петрозального доступа в хирургии труднодоступных церебральных артериальных аневризм ……………………………..……… 102 4.2.5 Топография нейроваскулярных структур из переднего петрозального доступа…………105 4.3 Задний петрозальный доступ (анатомическое обоснование) …………………………..110 4.3.1 Общая характеристика анатомического материала……………………………………… 110 4.3.2 Оценка параметров операционной раны…………………………………………………….110 4.3.3 Общая характеристика задних петрозальных доступов……………………………………111 4.3.4. Анатомические аспекты заднего петрозального доступа (модификация) ………………112 4.3.5 Анатомическое обоснование применения заднего петрозального доступа в хирургии труднодоступных церебральных артериальных аневризм………………………………………..113 4 4.3.5.1 Исследование параметров операционной раны заднего петрозального доступа на экстрадуральном этапе операции…………………………………………………………………. 114 4.3.5.2 Исследование параметров операционной раны заднего петрозального доступа на интрадуральном этапе операции………………………………………………………………….. 115 4.4 Заключение к главе 4………………………………………………………………………… 117 ГЛАВА 5 РАСШИРЕННЫЕ БАЗАЛЬНЫЕ ДОСТУПЫ В ЛЕЧЕНИИ СЛОЖНЫХ АРТЕРИАЛЬНЫХ АНЕВРИЗМ ГОЛОВНОГО МОЗГА…………………………………….119 5.1 Характеристика больных со сложными артериальными аневризмами головного мозга, для лечения которых использовали расширенные базальные доступы……………………………..119 5.2 Особенности клинико-неврологического и инструментального обследования больных со сложными артериальными аневризмами головного мозга……………………………………….121 5.3 Характеристика расширенных базальных доступов, проведенных для лечения сложных артериальных аневризм головного мозга………………………………………………………….122 5.4 Применение расширенных базальных доступов у больных со сложными артериальными аневризмами головного мозга………………………………………………………………………123 5.5 Результаты применения расширенных базальных доступов у больных со сложными артериальными аневризмами головного мозга……………………………………………………136 5.6 Заключение к главе 5.. ……………………………………………………………………… 137 ЗАКЛЮЧЕНИЕ………………………………………………………………………………… 139 ВЫВОДЫ………………………………………………………………………………………… 148 РЕКОМЕНДАЦИИ В ПРАКТИКУ…………………………………………………………… 150 СПИСОК СОКРАЩЕНИЙ ………………….………………………………………………… 152 СПИСОК ЛИТЕРАТУРЫ………………………………………………………………………. 153 ПРИЛОЖЕНИЯ…………………………………………………………………………………... 173 5 ВВЕДЕНИЕ АКТУАЛЬНОСТЬ ТЕМЫ Артериальные аневризмы (АА) головного мозга являются наиболее частой причиной нетравматических субарахноидальных кровоизлияний (САК) и диагностируются более чем в 50% наблюдений, составляя 13-14 пациентов на 100000 населения в год [64]. Необходимость раннего выключения разорвавшейся АА из кровотока обусловлена высокой степенью летальности от повторного кровоизлияния из артериальной аневризмы, достигающей 70% [30, 39, 61, 64, 98, 106, 196]. Одной из проблем является снижение тракционных повреждений головного мозга в ходе хирургического лечения АА головного мозга [114, 159, 224, 227, 253]. Применение базальных доступов обеспечивает визуализацию труднодоступного сегмента артериального круга большого мозга (АКБМ), несущего АА [64, 77, 96, 121, 127, 130, 144, 152, 160]. Категории сложных артериальных аневризм, которые требуют для лечения применения базальных доступов, составляют 5-14,4% от всех АА головного мозга [70, 77, 92, 135, 169, 200, 224]. По данным N. Andaluz и соавт. (2011) из числа всех пациентов со сложными артериальными аневризмами - 2\3 больных имеют в анамнезе САК [77]. На долю АА вертебробазилярного бассейна (ВББ) из всех сложных АА с разрывом приходится 43%, где 19% составляют аневризмы верхушки базилярной артерии (БА). Пациенты со сложными артериальными аневризмами труднодоступной локализации без разрыва составляют 19,6% (преимущественно это аневризмы офтальмического и клиноидного сегментов внутренней сонной артерии - ВСА) от всех больных с артериальными аневризмами без разрыва. Больные со сложными разорвавшимися аневризмами составляют 12,7% от всех пациентов с артериальными аневризмами головного мозга, имеющими в анамнезе САК [77, 99, 182, 218]. Микрохирургическое лечение больных с труднодоступными артериальными аневризмами требует при подходе к эфферентному артериальному сегменту (каменистый, кавернозный и клиноидный сегменты ВСА, бифуркация и ствол БА, устье передней нижней мозжечковой артерии - ПНМА) дополнительной резекции костей медиальных и латеральных отделов основания черепа (крыша и латеральный край орбиты, зрительная распорка, передние и задние наклоненные отростки, спинка турецкого седла, верхушка пирамидки височной кости, сосцевидная, барабанная и каменистая часть височной кости, зоны ската, крыша внутреннего слухового прохода, мыщелковая часть затылочной кости, яремный бугорок и др.) для создания условий визуализации, диссекции, клипирования артериальной аневризмы или проведения операции реваскуляризации с реконструкцией кровотока [64, 80, 81, 101, 177, 191, 224, 253]. 6 Применение расширенных базальных доступов улучшает показатели хирургического лечения больных с труднодоступными артериальными аневризмами [77, 79, 218, 224]. Доступ с резекцией медиальных отделов костей основания черепа по сравнению с обычной краниотомией, способствует лучшей визуализации пришеечной части артериальной аневризмы головного мозга, дистального и проксимального сегмента артерии, несущей артериальную аневризму [5, 30, 47, 108, 125, 137, 239]. Применение расширенного базального доступа позволяет открывать одновременно несколько смежных анатомических областей, что увеличивает диапазон оперативного действия, уменьшает тракцию головного мозга и глубину операционной раны [48, 54, 64, 65, 68, 74, 79, 97, 101, 130, 158, 189, 199, 210, 224]. Расширенные базальные доступы показаны для лечения аневризм офтальмического сегмента ВСА с низким расположением шейки АА, аневризм каротидной полости, аневризм А1-сегмента передней мозговой артерии (ПМА) и передней соединительной артерии (ПСА) с высоким расположением купола АА и наличием базального САК, гигантских аневризм средней мозговой артерии (СМА) и артериальных аневризм ВББ [64, 70, 127, 137, 218, 224]. Лечение труднодоступных АА головного мозга является наиболее сложным разделом сосудистой нейрохирургии, требующим знаний и навыков базальной хирургии [77, 100, 130, 200, 224, 253]. Работы, посвященные анализу топографо-анатомических и клинических параллелей при выполнении оперативных доступов к артериальным сегментам АКБМ через основание черепа немногочисленны, а приведенные в них данные часто противоречивы [79, 96, 97, 102, 121, 141, 142, 172, 193, 194, 195,231, 255]. Исходя из вышеизложенного, существует необходимость анатомического обоснования применения расширенных базальных доступов для лечения труднодоступных артериальных аневризм головного мозга. ЦЕЛЬ РАБОТЫ Разработать расширенные базальные доступы к труднодоступным сегментам АКБМ в хирургии артериальных аневризм головного мозга. ЗАДАЧИ ИССЛЕДОВАНИЯ 1. Разработать методику получения блок-препаратов головного мозга в твердой мозговой оболочке на основании черепа для изучения микрохирургической анатомии артерий ВББ и моделирования базальных доступов. 7 2. Выявить особенности микрохирургической анатомии базилярной артерии (БА), задней мозговой артерии (ЗМА) и верхней мозжечковой артерии (ВМА). 3. Определить параметры операционной раны при расширенных базальных доступах к труднодоступным сегментам АКБМ (хирургические углы операционной раны, глубина операционной раны, хирургические промежутки). 4. Разработать модификации доступов с оптимальными параметрами операционной раны при лечении АА с учётом краниометрических характеристик. НАУЧНАЯ НОВИЗНА 1. Определена частота встречаемости фетального типа строения задних отделов АКБМ, требующая в большинстве случаев применения базального доступа при подходе к АА верхушки базилярной артерии. 2. Установлена корреляция между толщиной Р1-сегмента ЗМА и типом строения задних отделов АКБМ - чем толще ЗСА (фетальный тип строения задних отделов АКБМ), тем уже диаметр Р1-сегмента ЗМА и труднее подход к верхушке БА при использовании стандартного птерионального доступа. 3. Дано детальное описание хирургической анатомии проксимальной бифуркации ЗМА и вариантов отхождения корковых и перфорирующих ветвей ЗМА. Выделение типов проксимальной би-(три)фуркации Р2Р-сегмнта ЗМА основано на топографии бифуркации относительно отделов обводной цистерны и крючка гиппокампа. 4. Установлены типы ветвления ВМА и особенности отхождения перфорирующих ветвей, которые необходимо учитывать при подходах и клипировании АА верхушки БА. 5. Установлена корреляция между топографией верхушки БА по отношению к спинке турецкого седла, угловыми параметрами основания черепа и черепными индексами, влияющими на выбор и направление базального доступа. Низкое залегание верхушки БА является показанием для применения базальных доступов (орбитозигоматического транскавернозного или переднего петрозального доступа - доступа Kawasе) с целью обеспечения адекватной визуализации, диссекции и клипирования АА верхушки БА. 6. Определены средние показатели вертикальных и горизонтальных операционных углов орбитозигоматического доступа, переднего и заднего петрозальных доступов, разработаны показания к применению расширенных базальных доступов в зависимости от анатомического варианта труднодоступной АА (параклиноидный регион, отделы БА и ЗМА, устья ВМА и ПНМА). 8 ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ 1. Предложена методика получения блок-препаратов ГМ на основании черепа в ТМО для изучения топографо-анатомических взаимоотношений нейроваскулярных структур ГМ и моделирования вариантов базальных доступов. 2. Выявленные анатомо-топографические особенности строения задних отделов АКБМ, дистальных отделов БА и ЗМА позволяют определить выбор и направление базального доступа к труднодоступным АА головного мозга. 3. Определены показания к применению базальных доступов в зависимости от топографии АА по отношению к костным структурам (спинка турецкого седла, наклоненные отростки, верхушка пирамидки височной кости), типа строения задних отделов АКБМ и угловых параметров основания черепа. 4. Выявлены особенности выполнения транскавернозных и транспетрозальных микрохирургических подходов по параметрам операционной раны при орбитозигоматических и комбинированных петрозальных доступах к клиноидному сегменту ВСА, верхушке БА, Р1- и Р2-сегментам ЗМА, устьям ВМА и ПНМА. ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ 1. При выборе доступа к АА труднодоступной локализации необходимо учитывать особенности строения сегментов АКБМ и рельефа основания черепа. 2. Наличие у больного труднодоступной АА ВББ в сочетании с фетальным типом строения задних отделов АКБМ, низким расположением верхушки БА по отношению к спинке турецкого седла, а также наличием коротких размеров супраклиноидного отдела ВСА требует применения базальных доступов с резекцией костей основания черепа - наклоненных отростков и спинки турецкого седла (орбиозигоматический транскавернозный доступ) или верхушки пирамидки височной кости (доступ Kawasе) для создания оптимальных условий при подходе, выделении и клипировании АА БА. 2. Артериальные аневризмы офтальмического сегмента ВСА с низким расположением шейки аневризмы под передним наклоненным отростком и дистальным кольцом требуют применения передних транскавернозных доступов. Выполнение низкой трепанации с резекцией верхней и латеральной стенки орбиты при ОЗД создает оптимальные условия для резекции переднего наклоненного отростка, зрительной распорки, диссекции 9 каротидных колец для базального осмотра пришеечной части параклиноидной АА и её клипирования. 3. Орбитозигоматический доступ является универсальным для выполнения передней и задней клиноидэтомии, передней петрозэктомии, при выполнении комбинированных петрозальных доступов. Обзор сегментов АКБМ из создаваемых хирургических промежутков (резекция костей в треугольниках Dolenc, Hakuba, Glasscock, Kawasе, Day-Fukushima, Mullan, Lateral Loop) различается по параметрам операционной раны относительно АА конкретной локализации. АППРОБАЦИЯ РАБОТЫ Основные положения и материалы диссертации были доложены: - на XI региональной конференции прикладной анатомии и хирургии СНО и молодых ученых медицинских ВУЗов и лабораторий НИИ, Россия, г. Санкт-Петербург, 2003 г. - на всероссийских научно-практических конференциях «Поленовские чтения», Россия, г. Санкт-Петербург 2003, 2012, 2013 гг. - на Мастер-классах «Хирургия церебральных аневризм» отделения неотложной нейрохирургии НИИ СП им. Н.В. Склифосовского и Aesculap Academia, Россия, г. Москва, 2012, 2013, 2014 гг. - на совместных заседаниях проблемно-плановой комиссии №5 «Хирургические заболевания и повреждения нервной системы» НИИ СП им.Н.В. Склифосовского и кафедры нейрохирургии и нейрореанимации Московского государственного медико-стоматологического университета имени А.И. Евдокимова, Россия, г. Москва, 2012, 2014 гг. - на конференции «Современные методы лечения больных с артериальными аневризмами и артериовенозными мальформациями», Россия, г. Москва, 2014 г. ПУБЛИКАЦИИ ПО ТЕМЕ ДИССЕРТАЦИИ По теме диссертации опубликовано 11 печатных работ в виде статей и тезисов в журналах, сборниках трудов и материалов съездов и конференций, в том числе 3 статьи в журналах «Нейрохирургия», входящих в перечень ВАКа Минобрнауки Российской Федерации. 10 ВНЕДРЕНИЕ РАБОТЫ Расширенные базальные доступы для лечения больных с труднодоступными артериальными аневризмами головного мозга внедрены в работу отделения неотложной нейрохирургии НИИ скорой помощи им. Н.В. Склифосовского, Россия, г. Москва. СТРУКТУРА И ОБЪЕМ ДИССЕРТАЦИИ Диссертация представлена виде рукописи, имеющей титульный лист, оглавление, текст диссертации, включающий введение, 5 глав, заключение, выводы, рекомендации в практику, список сокращений, список литературы, включающий 68 отечественных и 190 зарубежных источников, 5 приложений. Диссертация изложена на 177 страницах, включает 27 таблиц и 72 рисунка. 11 ГЛАВА 1 ОСОБЕННОСТИ ПРИМЕНЕНИЯ РАСШИРЕННЫХ БАЗАЛЬНЫХ ДОСТУПОВ В ХИРУРГИИ АРТЕРИАЛЬНЫХ АНЕВРИЗМ ГОЛОВНОГО МОЗГА (ОБЗОР ЛИТЕРАТУРЫ) Артериальные аневризмы (АА) головного мозга (ГМ) являются наиболее частой причиной нетравматических субарахноидальных кровоизлияний (САК) и диагностируются от 50-80% наблюдений, составляя 13-14 пациентов на 100 000 населения в год [26, 64, 89, 100]. Средний возраст пациентов, у которых происходит субарахноидальное кровоизлияние, колеблется от 35 до 65 лет [56, 64, 89, 98]. Летальность при разрывах аневризм ГМ составляет от 32 до 67% [6, 30, 219]. Риск разрыва связан с размерами, формой и локализацией АА [64]. Прогресс в науке и технике за последнее десятилетие значительно модернизировал нейрохирургические методы лечения и диагностики церебральных аневризм [14, 23, 27, 49, 64, 84]. Микрохирургическое клипирование и эндоваскулярное лечение - две основные нейрохирургические стратегии в лечении разорвавшихся и неразорвавшихся артериальных аневризм головного мозга [64, 100, 191, 200, 215, 257]. Лечение церебральной АА началось с перевязки несущей её артерии, известное как лигирование Гюнтера («Hunterian ligation») [100]. Первым такую технику лечения гигантской АА внутренней сонной артерии (ВСА) применил в 1885 году V. Horsely (1857-1916) [238]. N. Dott (1897-1973) и H. Cushing (1869-1939) впоследствии применили окутывание стенки АА мышцей. Следующим этапом в становлении хирургии аневризм ГМ стала разработка H. Cushing и W. Dandy (1886-1946) клипса, который позволял полностью выключать АА из кровотока. В 1937 году W. Dandy первым клипировал шейку АА ВСА серебряным V-образным клипсом [64]. С тех пор хирургия АА прошла длинный путь, предложены различные типы клипс, модели нейрохирургических микроскопов, инструментов и методов нейровизуализации. Значительно продвинулось понимание патогенеза АА, ангиоспазма, разработана тактика лечения аневризм и последствий её разрыва [21-40, 50, 55, 64, 67, 70, 77, 200]. Основной методикой лечения АА является клипирование шейки аневризмы. Для этой цели используют клипсы и стандартный нейрохирургический доступ (чаще птериональный) [64, 252]. Эффективность метода составляет 92-96% при лечении артериальных аневризм типичной локализации [47, 87]. Параллельно техническому развитию методов традиционного клипирования аневризм формировалась эндоваскулярная хирургия [64]. Первая платиновая микроспираль была разработана и апробирована в 1991 году итальянским нейрохирургом G. 12 Guglielmi [100]. После одобрения в 1995 FDA методики эндоваскулярного лечения с помощью микроспирали начали развиваться и другие внутриартериальные технологии по выключению АА из кровотока: баллон-ассистированное и стент-ассистированное эндоваскулярное лечение микроспиралями, установка потоковых стентов, ремоделирующих гемодинамику в аневризме [64, 92, 94, 105, 198, 200, 220, 229, 238]. Современные новые методики улучшения изображения, разработка новых катетеров, микрокатетеров, видов микроспиралей, баллонов, потоковых стентов позволило в 77-80% полностью выключать АА из кровотока и 20-23% выключать АА частично [64, 87, 107, 138, 154, 182, 190, 196]. Оба подхода в лечении АА – микрохирургическое клипирование и эндоваскулярное выключение аневризмы из кровотока – высокоэффективны при правильном их выборе. В настоящее время критериями выбора методов лечения аневризм являются локализации, размер и форма АА, характер кровоизлияния, тяжесть состояния и возраст пациента [64, 200, 218]. А В С D Рисунок 1 Пример лечения сложной артериальной аневризмы базилярной артерии Больной 52-х лет с АА ствола базилярной артерии. Для лечения применен интра-интракраниальный анастомоз и дистальная окклюзия несущей АА артерии из орбитозигоматического базального доступа, А – КТ-снимок частично тромбированной АА, вдающейся в мост ГМ и образующей с вентральной частью моста единый конгломерат (стрелка), В - D – Интраоперационные фотографии, В – Широкопросветный анастомоз из радиальной артерии вшит в Р2А-сегмент ЗМА (стрелка), С – Ростральный конец анастомоза вшит в М2-сегмент СМА (стрелка), D – Клипирование ствола БА выше АА (стрелка). Послеоперационный тромбоз АА распространился на перфорирующие артерий БА, в результате чего наступила смерть – ШИГ-5 (из статьи M.E. Sughrue и соавт., 2011 [238]). Однако выбор методов лечения больших и гигантских АА, аневризм с широкой шейкой, аневризм с атеросклеротическими изменениями в области шейки АА и эфферентной артерии, наличием афферентных артерий в области тела и купола АА представляет большие трудности и часто требует комбинированного лечения (рис. 1) [87, 88, 92, 100, 238]. 1.1 Артериальные аневризмы головного мозга, для лечения которых необходимо применение базальных доступов Аневризмы считаются сложными, если имеют широкую шейку, большие размеры, атеросклеротически измененные и фузиформные стенки, отхождения ветвей из тела аневризмы, 13 то есть такие характеристики аневризмы, которые не позволяют провести обычное клипирование шейки [64, 77, 187, 200]. Сложная аневризма часто не может быть достигнута из обычного хирургического доступа, из-за её труднодоступности, и не может быть вылечена с помощью эндоваскулярного метода из-за широкой шейки или других гемодинамических характеристик [64, 88. 93, 100, 132, 257]. На современном этапе нейрохирургии лечение такой патологии требует комбинации различных методов лечения - применение базальных доступов, этапное ремоделирование широкой шейки АА, клипирование и эндоваскулярное лечение в условиях гибридной рентген-операционной [70, 111, 169, 171, 187, 188, 200, 245]. Комбинированный подход к лечению сложных АА берет начало с публикаций B.L. Hoh и соавт. (2001) о лечении фузиформных АА, псевдоаневризм и АА с широкой шейкой [139]. Авторы комбинировали микрохирургическую и эндоваскулярную методики, первоначально изменяя потоки в АА, а затем выключали ее из кровотока. Цель первичного вмешательства (частичного клипирования или введение в полость АА микроспирали) состояла в измении потока в полости аневризмы. Понимание гемодинамики функционирующей ремоделированной АА давало возможность правильно выбрать путь дальнейшего лечения – клипирование, эндоваскулярное лечение, окклюзия несущей АА артерии, реваскуляризирующая операция [27]. Инвалидизация после комбинированной методики лечения составляет 6,3% и летальность 10,4% [100]. M.T. Lawton и соавт. (2003) продемонстрировали опыт мультимодального подхода в лечении сложных АА, используя комбинацию методик: клипирование после частичного эндоваскуляроного выключения аневризмы микроспиралями, частичное клипирование и эндоваскулярное лечение, селективная реваскуляризация и микрохирургическая окклюзия АА, окклюзия несущего АА сосуда и реваскуляризация [169]. В 95% авторам удалось полностью выключить АА из кровотока, в 86% достигнут отличный результат лечения по ШИГ=1. Процент осложнений после эндоваскулярного лечения микроспиралями сложных АА (интраоперационный разрыв, миграция и протрузия микроспиралей) составляет от 47-60% [87, 182, 190]. Y. Lim и соавт. (2008) сообщили о комбинированном лечении АА ГМ, применив эндоваскулярное лечение и клипирование АА. У 9 из 19 больных были осложнения после эндоваскулярного лечения, которые были устранены микрохирургическим клипированием [171]. Однако микрохирургическое клипирование в данной ситуации не конкурирует, а дополняет лечение этой сложной церебральной аневризматической патологии. Одно из первых определений «сложной аневризмы» («Complex Intracranial Aneurysms») принадлежит L. Hacein-Bey и соавт. (1998), применившим его для обозначения артериальных аневризм головного мозга, прежде всего по анатомическим, но также и по клиническим характеристикам [132] (табл. 1). 14 Таблица 1 Характеристики сложной АА, введенные L. Hacein-Bey (1998) и дополненные O. Choudhri (2013) Анатомические характеристики сложных АА Размер: большой, гигантский, недостаточный для клипирования и введения микроспирали Форма: фузиформная, серпантинная, псевдоаневризма, рвущаяся стенка аневризмы Содержимое: тромбы, кальциноз стенок, дисплазированные сосуды стенки аневризмы Шейка: необходимо выполнение сложного нейрохирургического доступа, широкая шейка, кальцинированная шейка, вовлечение перфорирующих артерий Перианевризматическое окружение – аневризма плотно окружена тканью мозга, костью или спайками от предыдущего лечения Клинические характеристики, повышающие риск плохого исхода лечения Hunt&Hess > 3 Наличие ангиоспазма на момент лечения Сопутствующие заболевания – кардиоваскулярная, легочная, почечная или эндокринная патология Возраст больного Группа сложных АА, в исследовании L. Hacein-Bey и соавт., включала каротидноофтальмические АА, гигантские АА СМА и АА ВББ [132]. В лечении таких АА авторы применили комбинированный метод лечения - клипирование и эндоваскулярное лечение (с разной последовательностью), достигнув в 92% окклюзию аневризмы с исходом по ШИГ=1. Многие авторы термин «сложная аневризма» употребляют при трудностях в лечении этой патологии, большом проценте плохих результатов и летальности после лечения, а также необходимостью подходить к таким АА с высокой степенью технической нейрохирургической подготовки (микрохирургические навыки диссекции и клипирования АА при сложной форме и широкой шейке, умение выполнять базальные доступы, реваскуляризирующие операции, ремоделирование аневризмы, введение в полость АА микроспиралей, стентирование стенозированной несущей артериальную аневризму артерии и т.д.), а также возможности высокотехнологичного нейроанестезиологического обеспечения (остановка сердца в момент клипирования АА, реанимационные мероприятия после длительного охлаждения больного при реваскуляризирующих операциях, профилактика и лечение ангиоспазма) [64, 74, 77, 156, 224]. Ранее термин «сложная для лечения аневризма» употребляли для клинических характеристик (хирургического лечения и его исходов) гигантских АА. Однако после публикации R. Henel и соавт. (2008) и по настоящее время в понятие «сложные аневризмы» включают не только гигантские АА, но и АА меньших размеров, однако находящиеся в труднодоступных для хирургического лечения местах головного мозга или основания черепа, 15 сопровождающиеся высокой летальностью после самого хирургического подхода. R. Hanel и R. Spetzler ввели 6 ключевых нейрохирургических характеристик, по которым аневризму следует считать «сложной» [135]. N. Andaluz и соавт. (2011) пополнили этот перечень [77]. В настоящее время существует 12 атрибутов сложной АА (рис. 2). Рисунок 2 Интраоперационные и ангиографические снимки, характеризующие сложные артериальные аневризмы головного мозга А – Диаметр АА больше 25 мм («гигантские АА»), В – Тромбированная АА, С – Аневризма со сложной формой, D – Труднодоступная локализация аневризмы с большой летальностью и ивалидностью после проведения нейрохирургического доступа («труднодоступные АА»), E – АА с неудачно проведенным лечением, F – Аневризма с кальцинированными стенками, G – Образование конгломерата «АА-головной мозг», H – Мозолеобразные «blister-like» АА с быстро рвущейся стенкой, I – Несущая артерия является частью АА, J – Наличие афферентных ветвей, исходящих из тела и купола АА, К – АА с широкой шейкой, L – фузиформные АА (из статьи N. Andaluz и соавт., 2011) [77]). Категории сложных аневризм, требующих для лечения применения базальных доступов, составляют 5 - 14,4% от всех АА головного мозга [70, 77, 135, 224]. Пациенты со сложными артериальными аневризмами труднодоступной локализации без разрыва составляют 19,6% (в основном это параклиноидная локализация: офтальмический и клиноидный сегменты ВСА) и с наличием в анамнезе САК - 12,7% от всех АА головного мозга [77, 156, 224] (рис. 3). 16 – А В 87,3% 80,4% 12,7% 19,6% Рисунок 3 Эпидемиология сложных АА головного мозга А – Доля сложных АА с САК (12,7%) в общем проценте церебральных АА с разрывом (87,3%), В – Доля сложных АА без разрыва (19,6%) в общем проценте церебральных АА без разрыва (80,4%) [70, 77, 156, 182, 224]. По данным N. Andaluz и соавт. (2011) из числа всех сложных артериальных аневризм 2\3 больных составляют пациенты, имеющие в анамнезе САК, оставшаяся треть представлена пациентами с аневризмами труднодоступной локализации без разрыва АА [77] (рис. 4). А 14,4% В 85,6% 29% 38% 9% 24% Рисунок 4 Эпидемиология сложных АА головного мозга А – Доля сложных АА (14,4%) в общем проценте церебральных АА (85,6%), В – Процент локализаций в структуре сложных АА: 38% - АА передних отделов АКБМ с разрывом, 29% – АА ВББ с разрывом, 24% – АА передних отделов АКБМ без разрыва, 9% – АА ВББ без разрыва [77, 156, 182]. Из числа сложных АА с САК самая многочисленная группа представлена аневризмами передних отделов АКБМ. На долю АА ВББ в этой группе приходится 43%, где 19% составляют аневризмы верхушки БА от всех сложных АА, имеющих в анамнезе САК (рис. 5). А В 19% 24% 73% 57% 27% Рисунок 5 Локализация сложных АА головного мозга А – Сложные АА с разрывом. Доля АА ВББ занимает 43% (первое место – АА верхушки базилярной артерии - 19%) от всех АА с разрывом. Аневризмы передних отделов АКБМ составляют 57% (первое место – 13% АА СМА), В – Сложные АА без разрыва. Доля АА передних отделов занимает 73% (первое место АА офтальмического сегмента ВСА), остальные 27% - АА ВББ [70, 77, 154, 182]. 17 Сложные АА ассоциированы с тяжелой инвалидизацией и летальностью после лечения [70, 135, 156, 200, 218]. Нюансы строения аневризмы (величина, форма шейки, направление купола, кальциноз или истончение стенок АА, топография к эфферентному сосуду и ветвям) и анатомо-топографические аспекты локализации АА к костям центральных отделов основания черепа (параклиноидная и параселлярная области, верхушка пирамиды височной кости, зоны ската) определяют наиболее технически сложную для нейрохирургии нозологическую группу АА ГМ – сложные артериальные аневризмы головного мозга [64, 92, 100, 127, 130, 224]. 1.2 Эффективность эндоваскулярного и микрохирургического лечения артериальных аневризм головного мозга Эндоваскулярное лечение АА Основный фактор, ограничивающий возможности применения эндоваскулярной хирургии в лечении сложных АА - это широкая шейка аневризмы (≥4 мм, отношение высоты АА к её шейке <1,5-2) поскольку возникает риск экстракции микроспирали в несущую аневризму артерию, а также возрастает частота неполной окклюзии АА с наличием резидуальной шейки (Raymond II) или резидуальной АА (Raymond III) [64, 150, 183, 207, 245]. Возникающие в связи с протрузией микроспирали тромбоэмболические и ишемические осложнения, разрыв АА в момент проведения эндоваскулярного вмешательства, а связанные с частичной окклюзией АА - геморрагические осложнения в раннем и реканализация аневризмы в более позднем послеоперационном периоде – являются основными причинами неудовлетворительных результатов эндоваскулярного лечения сложных АА [100, 184, 196, 200]. Ремоделирование васкулярной анатомии с целью управления потоками в теле АА и её пришеечной части являются условиями тромбирования АА и выключения аневризмы из кровообращения [27, 200]. Первые работы в этом направлении сделаны J. Moret (1997), который использовал эндоваскулярное ремоделирование шейки АА несъемным баллоном, раздувая его перед шейкой в момент размещения микроспирали, тем самым повышая плотность упаковки микроспирали и препятствуя её выпадению [186]. Использование «техники ремоделирования» позволило достигнуть J. Moret полной окклюзии АА (Raymond I) в 77% случаев при лечении труднодоступных АА с широкой шейкой. В арсенале современных эндоваскулярных нейрохирургов имеются баллоны, отличающиеся разной проходимостью и способностью изменять форму. Продолговатые (Hyper Glide™,0.010″) и круглые (N°1Balt Extrusion®, Ultra Flow®) баллоны применяют для окклюзии аневризм Т-образных бифуркаций, в частности АА верхушки БА с широкой шейкой, осуществляя протекцию как Р1-сегментов ЗМА и устьев ВМА, так и ремоделирование широкой шейки АА [235]. Баллоны Transform™ (C и SC,014″), Septer™ (C и SC,014″) и HyperForm™ (0″) способны изменять форму, тем самым одновременно 18 осуществлять протекцию шейки АА и афферентных ветвей, исходящих из самой АА в момент размещения микроспирали [183]. Такие баллоны используют для окклюзии АА сложной формы с широкой шейкой, в частности аневризм СМА [219, 238]. Для осуществления техники ремоделирования шейки баллоном используют различные варианты окклюзии АА: ретроградную окклюзию, двойную технику ремоделирования, сброс одновременно несколько микроспиралей за единицу инфляционного времени для повышения их адгезии к стенке сосуда и друг к другу и т.д. [94, 175, 196, 200, 220, 235]. Позднее для АА бифуркаций и сложных АА с широкой шейкой было разработано стент-ассистированная методика ремоделирования гемодинамики в аневризме, позволяющая увеличивать плотность упаковки микроспирали и уменьшать процент реканализаций. Все известные типы стентов - Neuroform™ (NF, NF2Treo, NF3), LVIS™, Leo™, Enterprise™, Solitare (SOLO first version) по структуре делятся на две основные группы – открыто- и закрытоячеистые, каждая из которых имеет свои преимущества и недостатки [182, 229]. Техника стентирования также различна («jailed-catheter technique» и «trans-cell technique» для реконструкции стенки артерии, «Y-stent&waffle-cone technique» и «Xstent technique» для стентирования АА бифуркаций) [138, 190, 201, 229, 257]. Использование техники внутрисосудистого ремоделирования шейки баллоном или стентом при лечении сложных АА увеличивает процент полной окклюзии АА и уменьшает количество реканализаций аневризмы после эндоваскулярной операции, по сравнению с простым введением микроспиралей [197, 201, 228, 229]. Ремоделирование широкой шейки баллоном Анализ больших проспективных исследований – CLARITY (АА с разрывом) (2011) [196] и ATENA (АА без разрыва) (2009) [197] по применению баллонного ремоделирования показали различие показателей процента полной окклюзии у больных с аневризмами с наличием в анамнезе САК. У больных с разрывом АА высок показатель осложнений (тромбэмболия и повторный разрыв АА) и летальности, достигающий 20,7% по сравнению с больными АА без разрыва - равный 15,4% [196] (табл. 2 и 3). Процент полной окклюзии аневризмы с использованием баллона менее эффективен у больных без разрыва и составляет 59,8%, что значительно меньше, чем у больных АА с разрывом, составляющим 94,9% [197] (табл. 3 и рис. 6, А). Наиболее частые осложнения эндоваскулярной окклюзии – тромбоэмболические и геморрагические (табл. 4). Риск этих осложнений при использовании баллона возрастает в 4,5-5 раз по сравнению со стандартной группой, пролеченной только микроспиралями (M. Sluzewski, 2006) [200]. Наиболее часты тромбогенные осложнения, составляющие 2,4-45,5% в группе ремоделирования [183, 220, 228]. K.F. Layton и соавт. (2007) [цит. по 200] показали увеличение случаев тромбоэмболии в группе ремоделирования по сравнению с обычным введением микроспиралей, составившими 14% и 9%, соответственно. Частота тромбоза несущей АА артерии зависела от ширины шейки и 19 составила 16% при шейке АА больше 4 мм с развитием ишемического инфаркта в 10% случаев по сравнению с процентом тромбоза при узкой шейке (6%) с последующей ишемией в 3%. По данным A.M. Spiotta и соавт. (2011) ишемическая картина на МРТ при эндоваскулярном лечении имеется у 24,7% и с одинаковой частотой для групп, пролеченных с использованием баллона и без [236]. По данным N. Chalouhi и соавт. (2013) процент тромбоэмболии составил 6,6% при использовании баллона и был основным из осложнений [94]. В группе АА с разрывом показатели тромбоэмболии одинаковы для больных пролеченных ремоделированием и с использованием просто микроспиралей (8,0% и 8,1%), однако летальность, связанная с тромбозом меньше в группе ремоделирования аневризм с САК в 3 раза по сравнению с группой, где использовались только микроспирали (0,4% и 1,2%) [228]. Таблица 2 Результаты лечения сложных АА и АА с широкой шейкой с использованием метода баллонного ремоделированиям Исследование (Автор), год, количество наблюдений Chalouhi N., 2013, N=76 [94] Santillan A., 2013, N = 491[220] Modi J., 2011, N=11[183] Lubicz B., 2008, N=92[175] CLARITY*, 2011, N = 768 ATENA*, 2009, N = 572 [197] АА с разрывом (R) /АА без разрыва (UR) R=40 UR=36 R=274 UR= 217 R=6 UR=5 R+ UR R=160 UR=222 Интраоперационные осложнения, % 6,6: тромбоэмболия, включая разрыв - 1,3 9,6: тромбоэмболия -2,4; разрыв-3,9; технические проблемы - 3,3 45,5 Качество Летальокклюзии, % ность и инвалидность, Полная Неполная % 5,2 59,2 - Реканализация и реоперация, % 35,6 34,3 - - Raymond II – 27,3 10 - 2,6 0 72,7 - 2,3 90 16,9: тромбоэмболия и разрыв АА 11,7: тромбоэмболия -5,4; разрыв - 3,2; технические проблемы - 3,2 3,8 94,9 5 - 3,7 59,8 Raymond II -22,5 Raymond III – 14,6 - 13 *Список наиболее известных международных исследований по качеству лечения АА CLARITY study (Clinical and Anatomic Results in the Treatment of Ruptured Intracranial Aneurysms) [196] ATENA study (Analysis of Treatment by Endovascular Approach of Nonruptured Aneurysms) [197] CARAT study (Cerebral Aneurysm Rerupture After Treatment) [150] ISAT study (International Subarachnoid Aneurysm Trial) [184] ISAT (Risk of recurrent subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the ISAT: long-term follow-up) [185] BRAT (Barrow Ruptured Aneurysm Trial) [181] BRAT- 3 (Barrow Ruptured Aneurysm Trial: 3-year results) [234] 20 Таблица 3 Сравнения показателей инвалидности и летальности в группах пролеченных только микроспиралями и баллонным ремоделированием при лечении сложных АА Исследование (Автор), год CLARITY (АА с разрывом), 2011[196] ATENA (АА без разрыва), 2009 [197] Shapiro М., 2009 (АА с разрывом) [228] Shapiro М., 2009 (АА без разрыва) [228] Инвалидность и летальность, Полная окклюзия, % % Стандартная Группа Стандартная Группа группа ремоделирования группа ремоделирования 3,8 88,7 5,1 94,9 3,1 3,7 59,8 59,8 2,7 1,7 49 73 0,6 0,9 - - M. Shapiro и соавт. (2009) показали уменьшение показателей интраоперационного разрыва АА в 2 раза в группе баллонного ремоделирования АА с САК, составившим 1,7% по сравнению с группой стандартного лечения с использованием только микроспиралей, составившим 3,4% [228] (табл. 4). В группе АА без разрыва этот показатель составил 1,8% и 1,4%, соответственно. В исследовании ATENA (АА без разрыва) (2009) также отмечено, что интраоперационный разрыв аневризм характерен для групп с ремоделированием [197]. Риск разрыва увеличивается в этой группе в 1,45 раза по сравнению с контрольной. В исследовании CLARITY (АА с CАК) риски геморрагических осложнений одинаковы для обеих групп [196]. Таблица 4 Частота интраоперационных осложнений при использовании техники баллонного ремоделирования и введения микроспиралей при лечении АА с широкой шейкой Исследование (Автор), год, количество наблюдений Santillan A., 2013, N = 491 [220] ATENA (АА без разрыва), 2009, N: c баллоном = 222; без баллона = 325 [197] Shapiro M., 2009, (АА с разрывом) [228] Sluzewski M., 2006 [200] Chalouhi N., 2013, N = 76 [94] Вид интраоперационных осложнений Разрыв АА, % Тромбогенные Техногенные осложнения, % осложнения, % Без Без Без С С С баллоном баллона баллоном баллона баллоном баллона >3,9 3,9 2,4 3,3 3,2 2,2 5,4 6,2 3,2 2,5 1,7 3,4 8,0 8,1 - - 4,0 - 0,8 - 9,8 6,6 2,2 - - - 21 Анатомические результаты окклюзии сложной аневризмы с широкой шейкой с САК при ремоделировании и введении микроспиралей по данным M. Shapiro и соавт. (2009) составляют: Raymond I – 73% при ремоделировании против 49% при введении только микроспиралей, Raymond II – 22% и 39%, Raymond III – 5% и 13%, соответственно [228] (рис. 6, В). То есть, частота полного выключения сложной аневризмы при использовании ремоделирования шейки увеличивается в 1,5 раза, частота неполной окклюзии (Raymond II-III), ведущей к реканализации и дальнейшим осложнениям – разрыву аневризмы, выпадению и миграции микроспирали - уменьшаются в 2,4 раза. Эти показатели иллюстрируют эффективность использования техники ремоделирования для лечения сложных аневризм с широкой шейкой (особенно с наличием разрыва АА) (рис.6, А). По данным J.S. Waldron и соавт. (2009) основной причиной выпадения микроспирали является неполное выключение АА [245]. Полная экстракция микроспирали и её миграция при Raymond II-III достигает 60%. По данным N. Chalouhi и соавт. (2013) частота реканализации и повторного разрыва в группе баллонного ремоделирования сложных АА с плотностью упаковки микроспирали более 28,3% заметно снижены и составляют 4,3% и 1,3%, соответственно [94]. A. Delgado и соавт. (2014) лечили 54 АА экстрапластичным баллоном Sceptre XC со средней упаковочной плотностью микроспирали 39,4% (12-72,2). В 64% случаев достигнута полная окклюзия, в 13% - окклюзия с резидуальной шейкой и в 23% - с резидуальным мешком АА [105]. Авторами сделан вывод, что при снижении плотности упаковки микроспирали возрастает процент реканализаций и возвращения больных для дальнейшего лечения [87, 105, 182]. А 5,1% 40,2% 94,9% 59,8% ATENA (АА без САК) CLARITY (АА с САК) В 22% 5% 13% 38% 73% 49% Полная оккл. Субтотал. оккл Ремоделирование шейки Неполная оккл 5% Без ремоделирование шейки Рисунок 6 Показатели эндоваскулярного лечения АА А – Сравнение процентов полной и частичной окклюзии АА (94,9% и 59,8%) к неудачной окклюзии (5,1% и 40,2%) в группах АА с САК и без разрыва [196, 197], В – Сравнение показателей окклюзии в группах с ремоделированием шейки баллоном и без применения техники ремоделирования [228]. 22 Ремоделирование широкой шейки стентом Стент-ассистированное ремоделирование сложных артериальных аневризм с широкой шейкой увеличивает процент полной окклюзии АА микроспиралью по сравнению с баллоном в 1,5 раза, однако во столько же раз увеличивается и процент осложнений [190, 200, 229]. Основная причина летальности и инвалидности при использовании стента – тромбоэмболия, стент-стеноз и стент-ишемия [168, 182, 190, 201, 229]. В проанализированной нами за 2010-2014 годы литературе по использованию стентассистированного ремоделирования сложных АА с широкой шейкой показатель осложнений колеблется от 0 до 28% с летальностью от 0 до 19% (табл. 5). Таблица 5 Результаты лечения сложных АА и АА с широкой шейкой с применением стент-ассистенции Качество окклюзии, % Исследование Реканализа(Автор), год, Осложнения, % Летальция и Полная количество А. Интраоперационные ность, реоперация, Raymond Неполная наблюдений В. Постоперационные % % I Zhao K.J., А. тромбоэмболия - 9,1 Raymond II – (2012), 0 54,5 36,4 и Raymond 18,2 N=11 [257] III – 9,1 Shapiro M., А. 19: техногенные 14 (из (2012), осложнения-9, включая группы N= 1517 разрыв АА-2,2; 2,1 45 55 Raymond I) [229] тромбоз артерий -10 23 (из В. 7,1: стент-стеноз-3,5; неполной стент-окклюзия – 0,6; окклюзии) инсульт-3 13 реоперция Piotin М., А. 7,4 (2010), 4,6 52,7 14,9 N=216 [201] Nishido H., А. 9,4: ишемия-7; (2014), геморрагия -2,3 2,7 64,1 15,5 N=323 [190] Hetts S.W., А. 6,6 3,8 (2014) В. 8,8 (ишемия) Нет данных Нет данных Нет данных N=361 [138] Bodily K.D., А. 15: разрыв АА-2; Raymond II-19 (2011), внутричерепная гематома 19 38,3 Raymond III-13 Нет данных N = 339 [88] -8; тромбоэмболия -5 Mc Laughlin N., (2013), N=702 [182] А. 0-19,2 (в среднем 4,3) В. 0-8,8 (в среднем 4,0) и Нет отсроченный стент-стеноз данных 0-20,6 (в среднем 5,3) 19,3-98,1 (в среднем 46,3) 0-28,8 (в среднем 13,2) На первом месте по численности стоят тромбоэмболические и ишемические осложнения. М. Shapiro и соавт. (2012) провели анализ лечения 1517 АА с использованием 23 стента [229]. Процент всех осложнений составил 26,1%, с интраоперационной летальностью 2,1%. Тромбоэмболия имела место в 10%, являющейся причиной летальности в 0,6%. Геморрагические осложнения имели место в 2,2% с летальностью 0,9%. X. Gao и соавт. (2012) провели анализ результатов лечения сложных АА с техникой ремоделирования шейки стентом Wingspan. Интраоперационная летальность, связанная с тромбоэмболией, составила 5,7%, в дальнейшем в течение месяца после лечения развились ишемические и геморрагические осложнения с общим процентом инвалидности и летальности 11,4% [122]. В этой серии наблюдений частота полной окклюзии АА составила 71,4%, резидуальную шейку наблюдали в 20% случаев, частичную окклюзию в 8,6%. Процент реканализации составил - 6,4%. Н. Nishido и соавт. (2014) в серии 1815 больных со сложными АА показали, что количество ишемических осложнений (7%), ведущих к смерти в группе со стентом в 2 раза больше, чем без стента (3,5%). Сравнивая показатели осложнений в группе стент-ассистированного ремоделирования, оказалось, что процент ишемических осложнений наблюдался в 3 раза чаще (7%), чем геморрагических осложнений (2,3%) [190]. Общий процент инвалидности и летальности в группе больных, которым проводилось ремоделирование АА стентом, составил 9,4% против 5,6% в группе стандартного эндоваскулярного лечения с применением только микроспирали без применения техники ремоделирования (табл. 6). Таблица 6 Частота интраоперационных осложнений и летальности при использовании техники ремоделирования шейки стентом и при лечении только микроспиралями сложных АА и АА с широкой шейкой Осложнения, Исследование % (Автор), год, количество Без Стент наблюдений стента Piotin M., 2010, N=1325, N (СГ) = 1109, N (ГР) 3,8 7,4 = 216 [201] Nishido H., 5,6: 9,4: 2014, N=1815 ишемия ишемия N (СГ) = 1492 -3,5 -7, N (ГР) = 323 гемор[190] рагия-2,3 Летальность, % Без стента «Удачная » Реканализация окклюзия АА и реоперация, микроспиралью, % %* Без Без Стент Стент Стент стента стента 1,2 4,6 69,8** 52,7** 33,5 14,9 1,1 2,7 70,3** 64,1** 35,5 15,5 СГ – стандартная группа, ГР – группа ремоделирования, * - показатель количества больных, которым «удалось» разместить в полости аневризмы микроспираль от общего количества больных, которым проводилось эндоваскулярное лечение; ** в статьях не указана градация окклюзии. 24 S. Geyik и соавт. (2013) лечили 500 АА с широкой шейкой, используя в 68% случаев стент Enterprise, в 19,6% стент Solitaire, в оставшихся случаях – стент Wingspan, LEO и Neuroform [123]. Авторы добились полной окклюзии АА только в 42,2% с осложнениями в 6,4% и реканализацией АА в 8%. Доля тромбэмболий была в 7раз больше, чем геморрагических осложнений и была причиной интраоперационной летальности в 0,8%. Для стент-ассистенции характерно развитие отсроченного стент-стеноза [95, 191, 201, 229]. Процент этого осложнения колеблется, составляя 0-20,6% [182]. N. Chalouhi и R. Drueding (2013) провели анализ лечения 435 больных со сложными АА с использованием стентов Neuroform и Enterprise, пытаясь определить предикторы стент-стеноза [95]. Авторами показано, что у 5% больных развивается сужение артерии. Увеличение процента стеноза не зависело от типа стента. Главные условия формирования стенозирования несущей АА артерии – молодой возраст больного, АА офтальмического сегмента ВСА и извитость стентированной артерии [95, 182, 229]. По данным K.D. Bodily и соавт. (2011) для сложных АА с разрывом использование стентов увеличивает риск геморрагических осложнений в 2 раза по сравнению с количеством тромбоэмболий, летальностью 19% и инвалидностью 14% [88]. В проанализированной ими серии наблюдений сложных АА с разрывом процент «успешно» пролеченных больных со стент-ассистенцией с разной степенью окклюзии составил 61% (206 из 339 больных). Полная окклюзия АА достигнута в 63% (у 130 из 206), что к общему числу больных составило 38,3% (130 из 339). Неполная окклюзия АА (Raymond II и III), составила 19% и 13%, соответственно (от числа окклюзированных аневризм). Высокие показатели интраоперационного разрыва АА связаны с необходимостью проводить двойную противосвертывающую терапию (клопидогрел +аспирин) за несколько дней до операции и гепарин во время стентирования. В серии из 36 больных с АА с широкой шейкой и наличием САК К. Golshani и соавт. (2012) показали значительное число осложнений (17%), из которых 8,3% составила острая ишемия в результате окклюзии несущей артерии (ВСА, Р1-сегмент ЗМА) с большим процентом плохих исходов (19%) и небольшим показателем полной окклюзии (30%) [124]. Показатели эндоваскулярного лечения в этой серии были хуже, чем при клипировании АА. В этой же группе процент реканализации (Raymond III) с наблюдением от 2 до 9 месяцев составил 33%, процент наличия АА с резидуальной шейкой (Raymond II) составил 19%. Данные результаты потребовали дальнейшего эндоваскулярного лечения аневризм или их клипирования. Многочисленные статьи, посвященные стент-вспомогательной окклюзии АА, сообщают о большом разбросе процента полной окклюзии АА, варьирующего от 13,2% до 94,4% с разным процентом реканализации от 8,1 до 60% [87, 88, 89, 182, 200, 229, 245]. M.F. Lawson и соавт. (2011), исследовали отдаленные результаты стентирования АА с широкой шейкой (в среднем через 15,4 месяца). Авторы показали, что в группе стент-вспомогательного ремоделирования 25 имеется уменьшение частоты реканализации в 4,6 раза (8%) ранее окклюзированных аневризм, по сравнению с частотой реканализации (37,5%), которая наблюдалась в группе больных, пролеченных только микроспиралями без техники ремоделирования [168]. Частота полной окклюзии при ремоделировании шейки стентом также была в 2,2 раза больше (89%), чем при введении только микроспиралей (40%). По данным M.G. Piotin и соавт. (2014) отсроченная окклюзия АА возрастает после ремоделирования на 73,4% по сравнению со стандартным эндоваскулярным лечением [201]. Предикторами реканализации АА, разрыва АА и возвращения больных для повторного лечения являются размер АА, ширина шейки и плотность упаковки микроспиралей, которая зависит от типа (баллон, стент) и техники ремоделирования. Чем больше шейка, тем выше процент экстракции микроспирали и реканализации [197]. Можно предсказать выпадения микроспирали, если показатель отношения ширины к высоте упакованной микроспирали больше 2,5, а угол клина больше 90 [245]. Влияние типа стента и техники ремоделирования на процент реканализации показано в работе N. Chalouhi и Р. Jabbour (2013), лечивших 552 сложных АА без разрыва и с САК с использованием стентов Neuroform и Enterprise. Частота окклюзии аневризм с Raymond I-II составила 87,5% [93]. Процент осложнений во время процедуры составил 6,2% (4,6% тромбоз, 1,2% разрыв АА) с летальностью 0,4%. Стент-стеноз имел место у 2,5%, ишемические инфаркты, развившиеся в течение 11 месяцев, составили 0,6%. Процент осложнений, летальности и инвалидности был различен в группах АА без САК и АА с САК. В группе без разрыва АА процент осложнений составил 4,7% с летальностью и инвалидностью - 1,9%. В группе АА с САК – 25% и 12,7%, соответственно. N. Chalouhi и Р. Jabbour (2013) показали, что предикторами выпадения микроспирали и реканализации АА, требующей повторного лечения являются «неполная» окклюзия АА, использование открытоячеечных стентов, разорвавшаяся аневризма и ее локализация (параклиноидные и АА ВББ). При исследовании типов стентов и методик стентирования показано, что наибольший процент реканализации и реопераций дает стент Neuroform (открытоячеечный стент) - 14% и 8,8%, чем стент Enterprise - 9,1% и 5,4%, соответственно [93, 229]. D. Ding и D.Raper (2014) представили результаты лечения 57 АА верхушки базилярной артерии с САК. Осложнения развились в 23% (18% тромбоз и 5% кровоизлияния) [107]. Отмечено увеличение осложнений в 4 раза (28%) при использовании одного микрокатетера для введения микроспиралей, чем при использовании двойного микрокатетера (7%) [107]. R. Chitale и соавт. (2013) лечили 84 больных со сложными АА и АА с широкой шейкой, использовав ремоделирование стентом (44 больных) и баллоном (40 больных) [99]. Количество геморрагических, тромбоэмболических и процент всех осложнений, связанных с процедурой были представлены в 6,8%, 11,4% и 18,2% в группе, где использовался стент, и 2,5%, 7,5% и 10% в группе, где использовался баллон, 26 соответственно. Благоприятные результаты (шкала Rankin 0-2) были у 61% в группе, где использовался стент и 77% в группе, где использовался баллон. Такие же данные приводят N. Chalouhi и R.M. Starke (2013) [92] (табл. 7). Таблица 7 Результаты лечения сложных АА и АА с широкой шейкой при ремоделировании шейки баллоном и стентом Ремоделирование Сложной АА с широкой шейкой, N = 101 Баллоном, N=32 Стентом, N=69 Осложнения, % 6 Окклюзия АА (Raymond I) % 50 9 75,4 Микрохирургическое клипирование Отсроченная окклюзия через 7 месяцев, % сложных Реканализация и реоперации, % 42,8 15,6 76,6 4,3 АА Показатели и проценты эффективности открытого хирургического лечения, летальность и инвалидность после клипирования АА зависят от хирургического опыта лечения сложных аневризм конкретной локализации. Частота инвалидности и летальности после клипирования варьирует от 4,6–14%. Процент полной окклюзии АА остается на высоких цифрах 95-98,1%. Количество хороших исходов варьирует от 66 до 98,9% [64, 70, 77, 87, 215]. Эта цифра зависит от локализации АА и наличия разрыва аневризмы. Среди не разорвавшихся сложных аневризм - 73% занимают АА передних отделов АКБМ, чаще в области офтальмического сегмента ВСА. Клиники, где широко применяют для лечения орбитозигоматический доступ и клиноидэктомию имеют лучшие результаты лечения по сравнению с клиниками, не практикующими базальные доступы. Например, у N. Andaluz и соавт. (2011) после клипирования сложных АА без разрыва хорошие результаты составляют 89% - Rankin (0-2) (рис.7, В). Среди всех сложных АА доля разорвавшихся АА составляет 67%. Аневризмы ВББ представлены в 43% от всех сложных АА с разрывом. Показатели лечения сложных АА с САК по данным N. Andaluz (2011) следующие: хорошие результаты по шкале Rankin (0-2) - 42,2%, удовлетворительные результаты Rankin (34) – 29,7% и неудовлетворительные - Rankin (5-6) - 28,1% (рис. 7, А) [77]. А В Rankin (0-2) Rankin (3-4) Rankin (5-6) Рисунок 7 Сравнения исходов лечения сложных аневризм с разрывом и без разрыва А – Сложные АА с разрывом, В – Сложные АА без разрыва [77]. 27 А. Rodriquez-Hernandez и соавт. (2013) лечили 631 АА (с разрывом и без разрыва). Полная облитерация АА составила 98,3%, летальность - 5,3% [215]. Хорошие результаты были 92,0% в группе не разорвавшихся АА и 70,2% в группе разорвавшихся. Неудовлетворительные результаты лечения связаны с наличием САК, размерами АА, состоянием больного [25, 218]. Хирургическое лечение аневризм ВББ наиболее сложное [17, 25, 64]. Преимущественно все аневризмы ВББ имеют разрыв и все считаются труднодоступными как для эндоваскулярного лечения (аневризмы бифуркаций с широкой шейкой), так и для клипирования (необходимость применения базального доступа). Наиболее часто встречаются АА верхушки БА, составляющие 19% от всех сложных АА с разрывом и 12,5% от всех сложных АА [77]. N. Sanai и Р. Tarapore (2008) лечили 228 АА ВББ, использовав в 75% прямое клипирование АА [218]. Аневризмы в 81% были с разрывом, большинство АА имели небольшие размеры (10 mm, 67%), в 22% были большими (>10 мм) и 11% были гигантскими (>25мм). Средний диаметр АА составил 8,97 мм. Из них АА верхушки БА составили 46,5%, АА ЗМА-11,8%, ВМА-10% и устья ПНМА-3,5%. Для микрохирургического лечения во всех случаях проведены базальные доступы (рис. 8). Орбитозигоматический доступ использовали в 66,4% для лечения аневризм верхней трети БА, транскондилярный крайне латеральный доступ был выбран в 21,7% для АА нижней трети БА и расширенный ретросигмовидный для АА устья ПНМА. Летальность составила 7,4% и инвалидность 7,8%. Полная окклюзия АА достигнута в 98,1%. Исход по ШИГ(1-2) был у 66%. У 85% больных наблюдали улучшение в клинической картине после лечения по сравнению с исходным статусом [218]. А В Рисунок 8 Клипирование аневризм ВББ из базального орбитозигоматического доступа А – Клипирование аневризмы устья ВМА (стрелки), В – Клипирование аневризмы верхушки БА (стрелки) (из статьи N. Sanai и соавт., 2008 [218]). По данным N. Sanai и соавт.(2008) микрохирургическое клипирование аневризм ВББ по надежности и исходам лечения лучше, чем эндоваскулярное лечение [218]. 28 O.M. Diaz и L. Rangel-Castilla (2012) сопоставили результаты лечения 90 АА СМА, использовав эндоваскулярное и микрохирургическое лечение [106]. Лучший результат лечения наблюдался после микрохирургической окклюзии АА. В исследовании авторов аневризм с разрывом было 20% у пациентов, которым выполняли эндоваскулярное лечение и 26% у больных, которым проводили клипирование. Осложнения, связанные с процедурой были в 16% при использовании микроспирали против 0% при использовании клипса. Полная и почти полная (Raymond I-II) окклюзия в группе больных, которым проводили эндоваскулярное лечение, составила 86% против 95% полной окклюзии (Raymond I) в группе больных, которым проводили клипирование АА. Исход по шкале Rankin 3-6 через 6 месяцев был 10% в группе больных, которым проводили эндоваскулярное лечение против 5,6% в группе больных, которым проводили клипирование АА. После 9 месяцев реоперации по поводу реканализаци АА в группе с эндоваскулярным лечением составила 14% и 0% у больных с микрохирургической окклюзией АА [106]. Мультицентровое рандомизированное исследование исходов лечения 2143 больных с разорвавшимися АА (ISAT, 2002) показало, что плохой исход лечения среди группы больных после эндоваскулярного лечения (шкала Rankine 3-6) составил 23,7% (летальность 11%), после кипирования - 31% (летальность 14%) [184]. Однако риск повторного кровоизлияния в 3,3 раза был выше в группе после эндоваскулярного лечения, чем после клипирования. Исследование исходов в течение года после лечения разорвавшихся АА проведено BRAT (2012) показало, что после эндоваскулярного лечения 233 АА плохие исходы (шкала Rankine > 2) составили 23,2%, а после клипирования 238 АА – 33,7% [181]. Однако через три года по данным BRAT-3 (2014) плохие исходы после эндоваскулярного лечения (170 АА) составили уже 30%, а после клипированния (179 АА) - 35,8%. После эндоваскулярного лечения за 3 года наблюдения у 64 пациентов (38%) произведено клипирование аневризм в связи с реканализацией, и только у 4 больных (2%) после клипирования аневризм проведены повторные операции [234]. Анализируя результаты исследований BRAT (2012) и BRAT-3 (2014) можно сделать вывод, что результаты эндоваскулярного лечения разорвавшихся АА в течение первого года после операции лучше, однако спустя 3 года – хуже [181, 234]. H. Li и соавт. (2014) проанализировали результаты 4 рандомизированных и 23 серийных исследований по лечению АА. Общее число больных составило 11568, из которых микрохирургическое клипирование выполнено 7230 больным и эндоваскулярное лечение выполнено 4338 больным [170]. Авторы показали, что на 1 году исходы лечения были лучше после эндоваскулярного лечения. Летальность была одинакова в обеих группах, ангиоспазм чаще развивался после клипирования. Радикальность окклюзии АА была характерна для микрохирургического лечения. Риски повторных разрывов и реваскуляризации АА были выше 29 после эндоваскулярного лечения [170]. J.S. Hwang и M.K. Hyun (2012) сравнили результаты лечения после клипирования и эндоваскулярного лечения 31865 АА без разрыва в серии 4160 исследований [146]. Выявлено, что процент инвалидности и неврологического дефицита после клипирования выше по ШИГ и по шкале Rankin в первые 6 месяцев, чем после эндоваскулярного лечения. Однако в период более 6 месяцев этой разницы не обнаружено[146]. S.L. Blackburn и соавт. (2014) проанализировали результаты лечения АА СМА без разрыва у 1891 больных, включая сложные АА [87]. Клипированы 1052 АА и 839 АА лечили эндоваскулярным методом. Инвалидность и летальность после клипирования составила 5,1% и 16,5% после эндоваскулярного лечения. Интраоперационный тромбоз после клипирования возник в 1,8% и 10,7% после эндоваскулярного лечения. Полная окклюзия полости АА через 69 месяцев составила 95,5% после клипирования и в 67,8% после эндоваскулярного лечения. Наличие резидуальной шейки и резидуального мешка составило – 1,7% и 2,8% после клипирования АА и 20,3% и 11,9% после эндоваскулярного лечения, соответственно (таб. 8). Таблица 8 Радикальность выключения артериальных аневризм из кровотока Радикальность выключения АА Полная окклюзия (Raymond I) Клипирование, % 95,5 Эндоваскулярное лечение,% 67,8 Неполная окклюзия АА, наличие резидуальной шейки (Raymond II) 1,7 20,3 Неполная окклюзия АА, заполнение всей аневризмы (Raymond III) 2,8 11,9 По данным CARAT (2008) [150] риск повторного разрыва при радикальности выключения Raymond II составляет – 5,9%, при наличии резедуального мешка - 17,9% (табл. 10). Даже при полной окклюзии АА риск разрыва после клипирования составляет 1,3% и 3,4% после эндоваскулярного лечения. По данным A. Molyneux и соавт. (2009, ISAT) риск повторного разрыва АА после эндоваскулярного лечения в 3,5 раза выше, чем после клипирования [185]. Это демонстрирует кривая Kaplan–Meier (рис.9). Таблица 10 Вероятность повторного разрыва АА в зависимости от степени ее окклюзии Окклюзия АА, % 100 91-99 70-90 Риск повторного разрыва Аневризмы, % 1,1 2,9 5,9 <70 17,9 Степень окклюзии АА по шкале Raymond Полное выключение (Raymond I) Неполное выключение с наличием Резидуальной шейки аневризмы (Raymond II) Неполное выключение с наличием Резидуального мешка аневризмы (Raymond III) 30 Рисунок 9 Кривая Kaplan–Meier График демонстрирует риск повторного разрыва аневризмы, коррелирующий с частотой неполной окклюзии АА (данные ISAT, 2009) [185]. В работах пятилетней давности при описании качеств лечения полная окклюзия и резидуальная шейка объединялись и авторами трактовались как «хороший» результат лечения. Однако даже при «полной» окклюзии АА (Raymond I) реканализация отмечена в 14% случаев при эндоваскулярном лечении [229]. Поэтому в настоящее время для прогнозирования рисков повторного разрыва и реканализации аневризм следует количество и вид «неполной» окклюзии АА обязательно отмечать, так как позже именно он будет причиной проведения повторного лечения. S.L. Blackburn и соавт. (2014), сопоставляя данные по исходам лечения 1891 больных с АА СМА, показали разницу в результатах после клипирования и эндоваскулярного лечения [87]. Случаев реканализации после клипирования не обнаружено, тогда как после эндоваскулярного лечения реканализация составила 14,3% и была причиной реопераций в 5,3%. В работе демонстрируется наглядная разница в видах лечения (табл. 11 и рис. 10). Таблица 11 Результаты лечения АА при микрохирургическом клипировании и эндоваскулярном лечении микроспиралями Характеристики лечения Клипирование, % Эндоваскулярное лечение, % Количество больных, пролеченных без осложнений Интраоперационный разрыв Летальность 95,5 59,8 Разница (отношение большего показателя к меньшему) Меньше в 1,6 раза 1,2 0,7 4,1 1,5 Больше в 3,4 раза Больше в 2,1 раза Инвалидность 5,5 22 Больше в 4 раза Тромбоэмболия Окклюзия несущей артерии Реканализация 1,8 0,3 0 18 0,7 10,4 Больше в 10 раз Больше в 2,3 раза Больше в 10,4 раза Реоперация 0,14 3,3 Больше в 23,6 раза 31 А В Кол-во больных, пролеченных без осложнений Интраоперационный разрыв Летальность Инвалидность Тромбоэмболия Реканализация Реоперация Рисунок 10 Результаты лечения АА после микрохирургического клипирования и эндоваскулярного лечения А – Группа больных после микрохирургического клипирования, В – Группа больных после эндоваскулярного лечения. Диаграмма наглядно показывает разницу в количестве осложнений, реканализаций и реопераций в группах (анализ данных статьи S.L. Blackburn и соавт. (2014) [87]). 1.3 Современная стратегия в лечении сложных артериальных аневризм Для полного выключения сложных АА в настоящее время используют комбинацию эндоваскулярного и микрохирургического методов лечения, которые дополняют друг друга. С растущим объемом эндоваскулярных операций неизбежен риск неполного выключения АА, ее реканализации, развития интраоперационных осложнений, требующих микрохирургического вмешательства для их устранений. Клинический опыт лечения сложных АА показывает эффективность сочетания эндоваскулярной и микрохирургической стратегии, направленной, прежде всего на ремоделирование васкулярной анатомии как начального этапа лечения с целью обеспечения наилучших условий для дальнейшей (эндоваскулярной или микрохирургической) окклюзии артериальной аневризмы [100, 132, 169, 171, 188, 190, 200]. Аневризмы со сложными анатомическими характеристиками из-за технических сложностей клипирования (труднодоступность, широкая шейка аневризмы) и проведения эндоваскулярных операций (широкая шейка, ведущая к экстракции микроспирали; извитость артерии, ограничивающая маневренностью катетера) остаются серьезной проблемой для выбора вида лечения [218, 257]. Широкая шейка является препятствием для осуществления обоих видов лечения, поэтому ремоделирование шейки (баллон, стент, клипс) обеспечивает дальнейшее успешное лечение сложных АА [100, 200]. Понимание необходимости сочетания 32 несколько видов лечения для выключения сложной АА формировалось под влиянием неудач эндоваскулярных вмешательств даже при использовании техники ремоделирования шейки аневризмы. Только одно эндоваскулярное ремоделирование не решает проблему лечения сложных АА, а наличие большого процента осложнений, летальности и реканализаций (до 35,7% без моделирования шейки по данным Н. Nishido и соавт., 2014 [190]) ставит под сомнение эффективность только эндоваскулярного лечения этой патологии. Большой процент реканализаций после неполной и полной окклюзии с риском повторного разрыва аневризмы диктует необходимость повторного лечения [87, 100,171, 200, 245]. По данным М. Nakamura и соавт. (2013) из числа реопераций после эндоваскулярного лечения больных выпадение микроспирали в просвет несущего сосуда и его миграция занимала 60%. В 33,3% отмечено уплотнение койла с формированием резидуальной шейки [188]. В 87% отмечено прогрессивное увеличение аневризмы с ее заполнением. Авторы провели успешное клипирование всех аневризм с реканализацией с надежной окклюзией АА и заключили, что аневризмы с неполной окклюзией, наличием резидуальной шейки нужно продолжать лечить микрохирургическим клипированием и можно добиться хороших результатов. Y.C. Lim и соавт. (2008) показали эффективность такой хирургической стратегии [171]. В их работе у 68% больных первым этапом лечения АА проведена эндоваскулярная окклюзия АА, затем клипирование оставшейся части АА. В 69% поводом для микрохирургических вмешательств были интраоперационные осложнения при эндоваскулярном лечении (разрыв АА, выпадение и миграция микроспирали). В 32% не подлежащим первичному эндоваскулярному лечению аневризмам в силу своих анатомических характеристик сначала ремоделировали шейку клипсом, а затем ее успешно окклюзировали микроспиралью. Промежуток времени между двумя вмешательствами составил в среднем 6 мес. При анализе статей (13-14 год) эти два этапа комбинированного лечения сложных АА сейчас не столь растянуты во времени. Если раньше подключение второго вида лечения имело место при наличии реканализации аневризмы и производилось спустя несколько месяцев как необходимость, то современная хирургия сложных АА осуществляется в единой гибридной операционной, позволяющей осуществлять надежное выключение сложной аневризмы, используя преимущества обоих методов лечения [100, 111, 187, 200]. Y.J. Murayama и соавт. (2013) заключают, что комбинация эндоваскулярного и микрохирургического методов лечения этой сложной патологии является новой хирургической стратегией [187]. BM. Kim и соавт. (2010) сообщили об эффективном эндоваскулярном лечении 24 больных с АА при наличии остаточной шейки после клипирования [155]. Интервал между клипированием и эндоваскулярном лечением составил от 8 дней до 31 мес. Полная эмболизация микроспиралью 33 при комбинированном методе лечения достигнута в 79%, резидуальная шейка наблюдалась после лечения в 21%, процент инвалидности составил 4,2%. В современной нейрохирургической литературе проанализирован опыт лечения сложных аневризм. O. Choudhri и соавт. (2013) продемонстрировали успех лечения 67 больных со сложными АА применив комбинированный микрохирургический и эндоваскулярный подход [100]. Микрохирургическое клипирование чаще использовали как начальный этап лечения. O. Choudhri и соавт. реконструировали шейку АА клипсом, делая ее максимально узкой для обеспечения впоследствии более удачного размещения в нутрии АА микроспирали (рис.11). А В С D Рисунок 11 Комбинированное лечение сложной артериальной аневризмы офтальмического сегмента ВСА без разрыва А и В – 3D-КТ снимки, стрелкой указана гигантская АА офтальмического сегмента ВСА. Базальная поверхность пришеечной части закрыта передним наклоненным отростком, С – Первый этап лечения сложной параклиноидной аневризмы с применением микрохирургического метода. Выполнен орбитозигоматический доступ, передняя клиноидэктомия и ремоделирование шейки клипированием (стрелка). Клипс не полностью перекрывает просвет пришеечной части АА, D – Окончательный этап лечения – эндоваскулярное выключение АА из кровотока микроспиралями. Конгломерат микроспиралей внутри АА (стрелка), треугольником указан клипс (из статьи O. Choudhri и соавт. (2013) [100]). O. Choudhri и соавт. применяли также окклюзию несущей АА артерии, сочетая её с вариантами реваскуляризирующих операций. В других случаях после начального размещения микроспирали в теле аневризмы, пришеечную часть выключали клипированием (рис. 12). 34 А В С D Е F Рисунок 12 Комбинированное лечение сложной разорвавшейся артериальной аневризмы коммуникантного сегмента правой ВСА А и В – Ангиограммы до лечения АА сложной формы (стрелка) с наличием локального вазоспазма, Hunt & Hess 3, С – Ангиограмма заполнения пришеечной части (Raymond II) после первого этапа лечения – эндоваскулярной окклюзии большей части АА, D – Интраоперационные фотографии аневризмы коммуникантного сегмента внутренней сонной артерии из орбитозигоматического доступа. Купол и часть тела АА с микроспиралью (стрелка) расположены под связочным аппаратом и свободным краем намёта мозжечка, Е - Выполнен второй этап лечения - микрохирургическое выключение резидуальной части АА из базального доступа клипсом (стрелка), F – Ангиограмма после комплексного лечения сложной АА – аневризма не заполняется (Raymond I) (из статьи O. Choudhri и соавт. (2013) [100]). Авторы акцентировали внимание на одной из ключевых характеристик сложных АА – её «труднодоступности» из обычного доступа, подчеркивая необходимость выполнения расширенных базальных доступов в лечении таких аневризм. R.A. Hanel (2008), N. Andaluz (2011), O. Choudhri (2013) и др. во всех представленных сериях пролеченных больных со сложными АА с применением открытого хирургического или комбинированного лечения использовали только базальные доступы [ 100, 127, 132, 135, 156,160, 168, 169, 171, 218, 224]. Наиболее часто используемые базальные доступы в хирургии сложных АА – орбитозигоматические, орбитозигоматические транскавернозные, доступы Kawase и задние петрозальные доступы [70, 77 ,100, 127, 158, 177, 224]. Использование базальных доступов в микрохирургическом лечении сложной АА решает две проблемы. Первая проблема: базальный сегмент АКБМ закрыт костями основания черепа. Доступ с резекцией костей основания обеспечивает подход к труднодоступному сегменту АКБМ несущему АА с возможностью полного клипирования. Вторая проблема: в половине случаев сложные АА имеют трудно клипируюмую пришеечную часть. Укладка клипса затруднена из-за ширины шейки, кальциноза 35 и тромбоза АА, включением в АА эфферентных и афферентных артерий. Базальный доступ меняет операционный угол клипирования АА, обеспечивая низкий подход к шейке с возможностью её полной окклюзии. Если не удается сразу полностью окклюзировать аневризму клипсом, то выполняют реконструктивное микрохирургическое клипирование уменьшающее ширину шейки для дальнейшего размещения в теле АА микроспирали. Частичное перекрытие шейки меняет гемодинамику в аневризме и провоцирует ее разрыв. Поэтому после ремоделирования АА укутывают АА мышцей или хирургической марлей, а последующий этап лечения в идеале проводят в этот же день. При проведении операции реваскуляризации расширенный базальный доступ обеспечивает условия для наложения анастомоза (большой операционный угол, небольшая глубина раны, обнажение смежной анатомической области, например для формирования анастомоза с ветвями наружной сонной артерии) при небольшой тракции головного мозга. Мультимодальный подход в лечении сложных АА (сочетание микрохирургии, базальной нейрохирургии, эндоваскулярной хирургии) необходим в случаях широкой шейки АА, локализации АА на извитом участке сосуда (петли ВСА) или бифуркации (БА), наличии артерий выходящих из тела АА, ригидности или истончении стенок АА. При выборе микрохирургического или комбинированного лечения используют только базальные доступы, обеспечивающие обнажение труднодоступного сегмента с возможностью клипировать или ремоделировать шейку сложной АА. В последнем случае аневризму подготавливают к дальнейшим этапам лечения – эндоваскулярному лечению или реваскуляризации кровотока (рис. 13). А В 3,1% 65,6% 3,1% 46,9% 9,4% 3,1% 28,1% 29,7% Рисунок 13 Современные виды лечения сложных АА головного мозга А – Лечение сложных АА с разрывом: 65,6% – клипирование АА с использованием базальных доступов; 28,1% – комбинированное микрохирургическое и эндоваскулярное лечение с использованием техники начального ремоделирования шейки (клипс, стент или баллон), 3,1% – окклюзия несущей артерии и реваскуляризация кровотока из расширенных базальных доступов; 3,1% – наблюдение, В – Лечение сложных АА без разрыва: 46,9% – клипирование с использованием базальных доступов; 29,7% – эндоваскулярное лечение с использованием техники ремоделирования шейки баллоном или стентом; 9,4% – реваскуляризирующие операции из базальных доступов; 3,1% – наблюдение (анализ данных лечения сложных АА из статьи N. Andaluz и соавт., 2011 [77]). 36 1.4 Расширенные базальные доступы в хирургии артериальных аневризм головного мозга Базальные доступы улучшают показатели хирургического лечения больных с АА головного мозга [64, 127, 224]. Доступ с резекцией основания черепа, по сравнению с обычной краниотомией, обеспечивает визуализацию труднодоступного сегмента АКБМ, несущего АА способствует лучшей визуализации шейки АА, уменьшает глубину операционной раны и облегчает тракцию ГМ [37, 39, 64, 102, 114, 1284]. Базальные доступы применяют для лечения AA со сложными анатомическими характеристиками [64, 77, 100, 135, 156, 253]. Базальные инфратемпоральные доступы, доступы применяемые в сосудистой (орбитозигоматические нейрохирургии доступы, включают орбитозигоматические транскавернозные доступы, преаурикулярные субтемпоральные инфратемпоральные доступы, передние, средние и задние инфратемпоральные доступы), доступы через дно средней черепной ямки (доступы Kawase), транспирамидные и комбинированные транспетрозальные доступы (транскохлеарные, ретролабиринтные, транслабиринтные варианты) и крайне латеральные транскондилярные доступы [64, 77, 130, 135, 159, 210, 224] (рис.14). Рисунок 14 Виды расширенных базальных доступов для микрохирургического клипирования сложных аневризм головного мозга (из статьи R.A. Hanel и соавт., 2008 [135]). Базальные доступы показаны для лечения труднодоступных АА передних отделов АКБМ (АА клиноидного сегмента и АА офтальмического сегмента ВСА, АА каротидной полости, аневризм А1-сегмента передней мозговой (ПМА) и передней соединительной артерий (ПСА) с высоким расположением купола аневризмы, гигантских аневризм СМА и АА ВББ с низким расположением верхушки базилярной артерии (БА), аневризм устья и сегментов (Р1-Р2) задней мозговой артерии (ЗМА), устьев верхней мозжечковой артерии (ВМА) и передней нижней мозжечковой артерии (ПНМА) [64, 77, 81, 100, 144, 218, 224, 227, 238]. 37 Орбтозигоматический доступ Резекция латеральной стенки орбиты увеличивает хирургическую доступность передних отделов АКБМ от 50% (A. Banerjee и соавт., 2011) [82] до 75% (M. Alaywan и соавт., 1990) [72] по сравнению с классическим птериональным доступом, где адекватному осмотру мешает сфеноорбитальная часть переднелатеральных отделов основания черепа [64, 74, 76, 102]. Для подхода к параклиноидным артериальным аневризмам орбитоптериональные и орбитозигоматические доступы обеспечивают оптимальные условия для клиноидэктомии, резекции крыши зрительного канала, зрительной распорки, рассечения каротидных колец с транскавернозным подходом к клиноидному сегменту внутренней сонной артерии и каротидной полости [64, 77 , 85, 108, 113, 144, 128, 135, 224]. Экстрадуральная техника передней клиноидэктомии как часть транскавернозного доступа была предложена в 1983 V.V. Dolenc [108, 224]. «Dolenc approach» с резекцией переднего наклоненного отростка и зрительной распорки является важным элементом базального доступа при подходе к клиноидному сегменту ВСА, каротидной полости, устью глазной артерии, расположенному ниже уровня дистального кольца и является важной составляющей транскавернозных доступов при подходе к АА верхушки БА [30, 96, 157, 159, 224, 227, 253]. Интрадуральную резекцию переднего наклоненного отростка проводят при выраженной его длине, наличии среднего наклоненного отростка и каротико-клиноидного отверстия, при лечении гигантских параклиноидных АА [149, 155, 224]. При подходе к шейке низких каротидно-офтальмических АА или аневризм каротидной полости необходима не только передняя клиноидэктомия, но и мобилизация устьев глазной или гипофизарной артерий [108, 145, 149]. Орбитозигоматический доступ (ОЗД) позволяет провести аккуратную диссекцию мембран в области клиноидного (Dolenc) и каротидного (Umansky) треугольников передних отделов крыши кавернозного синуса, серповидной связки, дистального и проксимального каротидных колец, каротидного чехла и каротидно-офтальмической мембраны с сохранением целостности медиального, передненижнего кавернозных венозных пространств и венозного клиноидного сплетения [26, 37, 64, 210, 253]. A.L. D`Ambrosio и соавт. (2008) описали увеличение углов осмотра из ОЗД комплекса ПСА-А1-сегмента ПМА, переднего наклоненного отростка и верхушки БА по сравнению с птериональным доступом на 41%, 43% и 62% соответственно [102]. При увеличении тракции на 1 см хирургическая доступность этих мишеней увеличивается на 31±18%. D.D. Cavalcanti и соавт. (2010) отметили увеличение вертикальных углов обзора ПСА, задней соединительной артерии (ЗСА), бифуркаций ВСА и СМА из трансцилиарного трансорбитального доступа по сравнению с супраорбитальным в 2,4-2,9 раза [91]. Вертикальные углы обзора ПСА, бифуркации ВСА и СМА при супраорбитальном доступе составили 8,4°, 9,3° и 16,2°, при дополнительной резекции орбиты (трансорбитальный доступ) угловые показатели доступности 38 этих мишеней возросли, составив 23,6° для ПСА, 27,3° для ВСА и для бифуркации СМА-39,3° [91]. Преимущества трансцилиарного орбитозигоматического доступа отмечены W.L.Warren и соавт. (2010), которые применили его в хирургии каротидно-офтальмических АА, аневризм ПСА и СМА [248]. Переднелатеральные базальные доступы позволяют открывать оптикокаротидный и ретрокаротидный промежутки снизу, спереди и сбоку, меняя углы обзора. Из-за отсутствующей стенки орбиты возможен более низкий базальный осмотр пришеечной части АА, а при гигантских или фузиформных АА базальная резекция обеспечивает моделирование мешка аневризмы для клипирования с надежной идентификацией афферентных артерий или проведение реваскуляризирующих операций [64, 127, 224]. Резекция латерального края и крыши орбиты как составная часть базального доступа описана ещё в 1889 R.U. Kronlein [178]. В дальнейшем предложенный F. Kraus (1908) супраорбитальный доступ был превращен L.L. Mc Arthur (1912) [74] и C.H. Frazier (1913) [91] в трансорбитальный с блок-резекцией латерального края и крыши орбиты и адаптирован к хирургии селлярного региона [76, 224]. Основываясь на работах J.A. Jane (1982) и O. Al-Mefty (1987) [256], P. Pellerin (1984) [74] и A. Hakuba (1986) [134] добавили к орбитоптериональному доступу резекцию скуловой дуги и применили орбитозигоматический инфратемпоральный доступ в хирургии передней и средней черепных ямок (ПЧЯ и СЧЯ), верхних отделов ската [224]. Наряду с ранними работами по использованию ОЗД (M. Alaywan и соавт. (1990) [72], M.W. McDermott и соавт. (1990), J.B. Delashow и соавт. (1992) [223]) чаще цитируемой в литературе является работа J.M. Zabramski и соавт. (1998) [108, 224, 256]. Увеличение углов операционного действия популяризировала ОЗД как вариант расширенного птерионального доступа к оптикокаротидному и каротидно-окуломоторному треугольникам [224, 253]. Первый морфометрический анализ параметров ОЗД принадлежит J.M. Schwartz и соавт. (1999) [223]. Идею применить конус с многоугольником в основании J.M. Schwartz и соавт. позаимствовали у E. Emery и соавт. (1994), применивших «cone`d approach» для морфометрии хирургических доступов. В дальнейшем в литературе возникают понятие «window of access» S. Honeybul (1996), «аngle of attack» и «working area» L.F. Gonzalez (2002), «projection angle» N. Andaluz (2003) и «surgical freedom» E.G. Figueiredo (2006) [74, 108, 114, 128] (рис. 15). J.M. Schwartz и соавт.(1999), показали, что резекция крыши орбиты увеличивает зону осмотра заднего наклоненного отростка, задней петроклиноидной связки и верхушки БА на 26%, 39% и 28%, соответственно [223]. N. Andaluz и соавт. (2003) продемонстрировали значительное увеличение углов осмотра комплекса А1-ПМА и ПСА из ОЗД по сравнению с птериональным доступом (ПТД), составившим 46% в аксиальной плоскости (ОЗД, 72.92±6.57°, ПТД 49.75±2.27°) [74]. E.G. Figueiredo и соавт. (2005) также показали значительное увеличение 39 вертикального операционного угла с центрированием на комплексе А1-ПСА из орбитоптерионального доступа, составившим в среднем 25° по сравнению с 11° при ПТД [115]. L.F. Gonzalez и соавт. (2002, 2005) показали, что орбитальная резекция увеличивала вертикальный угол атаки в среднем на 10,2±0.7° по сравнению с ПТД [127, 128]. А В D C E F Рисунок 15 Примеры расчёта операционных параметров при краниобазальных доступах А – Расчёт «хирургической свободы» (A.L. D`Ambrosio и соавт., 2008) [108], В – Расчёт вертикального и горизонтальных углов (E.G. Figueiredo и соавт., 2005) [115], С – Расчёт операционной площади (A.S. Little и соавт., 2008) [172], D – Расчёт проекционного угла и угла атаки (А. Chanda и соавт., 2002) [96], E – Расчёт хирургической свободы и углов, применяя принцип конуса и многоугольника в основании (J.M. Schwartz и соавт., 1999) [223], F – Расчёт «хирургической свободы» и операционной площади (S.W. Chang и соавт., 2009) [97]. A. Banerjee и соавт. (2011) выбрали несколько целей для измерения зон доступности обнажаемых анатомических объектов из орбитоптерионального, ОЗД и ПТД. Обзор и «углы атаки» комплекса А1-ПСА, хиазмы, бифуркации ВСА и зрительного канала увеличивались в расширенных базальных вариантах соответственно на 50%, 29%, 9% и 15% [82] (рис. 16). А В С Рисунок 16 Анатомический смысл увеличения «угла атаки» при краниобазальных доступах А – Птериональный доступ, В – Орбитоптериональный доступ. Резекция крыши и латеральной стенки орбиты уменьшает проекционный угол, что приводит к увеличению «угла атаки» параклиноидной области (штрих), С – «Угол атаки» при орбито-птериональном доступе, измеряемый угломером (из статьи A.Banerjee и соавт., (2011) [82]) 40 Аналогичные результаты получены и другими авторами [172, 224, 243, 250]. F. Beretta и соавт. (2010) показали, что переднелатеральные базальные доступы увеличивают каудальный угол обзора хиазмальной цистерны и субкаллезного поля, что позволяет хорошо визуализировать А1- и А2-сегменты ПМА, ПСА и шейку АА без резекции прямой извилины [85]. Это важно при резко ограниченном осмотре на фоне базального САК, гематомы субкаллезной области, отёке ГМ или при высоком залегании комплекса А1-ПСА. При увеличении вертикального угла атаки хорошо визуализируется шейка АА, А1- и А2-сегменты ипси- и контрлатеральной стороны ПМА, обеспечивая лучшие условия для диссекции и проксимальный контроль с возможностью временного клипирования [55, 56, 64, 67, 74, 224]. Анатомическое обоснование применения инфратемпорального орбитозигоматического доступа для транскавернозного подхода к верхушке БА сделано рядом исследователей. В работах описаны различные методики исполнения транскавернозных трансклиноидных доступов при подходе к верхушке БА, отличающихся последовательностью резекции наклоненных отростков, спинки турецкого седла областью входа в кавернозный синус, мобилизацией сегментов ВСА, рассечением каротидных колец и каротидно-офтальмической мембраны, связочного аппарата намета мозжечка [64, 108, 114, 127, 144, 160, 227, 253, 255]. Орбитозигоматический доступ – это один из вариантов инфратемпоральных доступов [210, 224]. В преаурикулярном субтемпоральном варианте с резекцией дна СЧЯ в области латеральной петли, треугольниках Kawase и Glasscock, резекцией височно-нижнечелюстного сустава доступ позволяет подойти к отделам каменистого и рваного сегментов ВСА, задней и латеральной петлям ВСА. Мобилизация из каротидного канала и отведение ВСА кпереди позволяет широко открыть медиальные отделы ската, ствол БА, канал Dorello и устье ПНМА [210]. Такой доступ необходим при подходе к гигантским аневризмам БА [6, 37, 64, 110, 177]. Орбитозигоматический доступ считается одним из представителей «half-and-half approach» - темпорополярных доступов смешанного направления - птерионального и подвисочного [83,224]. Темпорополярные доступы, введенные K. Sano (1980) и R.C. Heros (1993), основаны на подвисочных доступах C.G. Drake (1961), птериональных транссильвиевых доступах M.G. Yasargil (1976) [48, 65, 211, 252, 255]. Темпорополярные доступы обеспечивают переднебоковой осмотр параселлярного региона и межножковой цистерны [210, 246, 247]. J. Dzierzanowski и соавт. (2008) показали значительное улучшение осмотра верхушки БА из орбитозигоматического доступа в среднем на 40%, увеличение угла атаки на 10-11° с уменьшением глубины раны на 19% по сравнению с птериональным доступом [109]. Орбитозигоматический доступ увеличит обзор центральных отделов черепа спереди на 26-39% за счет резекции орбиты и на 13-22% сбоку за счет резекции скуловой дуги [102, 202, 223, 255]. Однако для претемпоральной тракции требуется сечение дренажных вен передних 41 отделов височной доли и существенное смещение супраклиноидного отдела ВСА, А1-сегмента ПМА и М1-сегмента СМА для обеспечения возможности доступа к верхушке БА через каротидные промежутки [203]. Для обеспечения оптимальных размеров оптико-каротидного и каротидно-окуломоторного промежутков ОЗД применяется с транскавернозными доступами [127, 158, 227]. A.S. Youssef и соавт. (2004) показали увеличение каротидно-окуломоторного промежутка на 48% (антрально) и 22% (каудально) при применении орбитозигоматического транскавернозного доступа [255]. Дополнение доступа задней клиноидэктомией увеличивает объем обнажения базилярной артерии на 69% с абсолютной длиной БА варьирующей от 7 до 24 мм (в среднем 15) [96, 113, 114, 225]. Ряд исследователей использовали ОЗД при трансхороидальных и трансункальных доступах к верхушке БА, к латеральным отделом межножковой и ножковой цистернам, Р1- и Р2-сегментам ЗМА, указывая на преимущества низкого базального осмотра, обеспечиваемого орбитозигоматической резекцией [148, 203, 250]. Доступы к обводной цистерне, проксимальной и дистальной бифуркациям ЗМА технически сложны и требуют четкого представления топографии искомой хирургической цели по отношению к содержимому среднего и заднего инцизуральных пространств [199, 214, 222]. Микрохирургическая анатомия цистерн вырезки намета мозжечка и хирургические доступы к сегментам ЗМА представлена в работах A.J. Ulm и соавт. (2004) [242], J.C. Fernandez-Miranda и соавт. (2010) [112], A. Wu и соавт. (2010) [250]. Орбитозигоматический доступ используют при подходе к кавернозному и каменистому сегментам ВСА, создавая условия для оптимальной диссекции крыши и латеральных отделов кавернозного синуса (область глазодвигательного треугольника, треугольники Dolenc, Hakuba, Fukushima, Umansky, Mullan, Parkinson, Day, Day-Fukushima, Lateral Loop [64, 108, 121, 210], Glasscock-Paullus [194], Kawase-Kanzaki (Siobara) [151, 224]), паракливальных треугольников [108, 195, 210] с надежной визуализацией сегментов ВСА и осуществлением диссекции, клипирования артериальных аневризмы, реваскуляризации или проксимального контроля с обнажением передней, медиальной, латеральной и задней петель ВСА [79, 108, 224, 253]. Базальные доступы востребованы для патологических процессов латеральной щели и медиобазальных отделов височной доли [222, 239, 241, 250]. A. Cunha и соавт. (2010) показали, что ОЗД улучшает условия подхода, моделирования шейки и клипирования гигантских аневризм СМА [101]. Гигантские аневризмы СМА представлены в 33,7% от всех гигантских аневризм ГМ [64]. Они часто разрываются или быстро увеличиваются с наличием ишемии в дистальных артериальных сегментах СМА. Эндоваскулярные вмешательства не всегда эффективны [87, 219, 224, 225]. Рационально микрохирургическое выключение аневризмы из кровотока [87]. Выбор ОЗД является наиболее оптимальным. Если не удается выключить АА, то проводят операцию обходного артериального шунтирования [191, 225]. В данном случае 42 резекция в области латеральной петли являются этапом для подхода к крыловидно-нёбному сегменту верхнечелюстной артерии и местом для укладки широкопросветного анастомоза от общей (или наружной) сонной артерии. Орбитозигоматический доступ с резекцией дна СЧЯ облегчает условия подхода к Р2-сегменту ЗМА, накладывание интра-интракраниального анастомоза с сегментами СМА при лечении гигантских аневризм СМА [191, 224, 225, 250]. Петрозальные доступы от пре- и постаурикулярных инфратемпоральных доступов до расширенных цервикальных трансюгулярных доступов, сочетающиеся с транспозицией ВСА,VII нерва или позвоночной артерии, позволяют осмотреть скат сверху (спереди и сзади) из подвисочных доступов; снизу и сбоку со стороны подвисочной и крыловидно-нёбной ямок; сзади и снизу со стороны задней черепной ямки (ЗЧЯ) и шеи [48, 64, 65, 79, 80, 210, 224]. Латеральные и заднелатеральные базальные доступы обеспечивают подход к субтенториальным цистернам, кливальной и петрокливальной областям, дают хороший осмотр латерального отдела межножковой цистерны, верхушки БА, устья и Р1-сегмента ЗМА, таламоперфорирующих артерий, ножковой и обходной цистерн, содержимого латеральных отделов квадригеминальной цистерны, устья, переднего и латерального понтомезенцефалического сегментов ВМА, Р2А- и Р2Р-сегментов ЗМА, проксимальной и дистальной бифуркации ЗМА [65, 79, 97, 130, 141, 152, 224, 226, 231]. Преимущественно все АА ВББ оперируются с использованием базальных доступов [77, 108, 144, 218, 237]. По данным В.В. Крылова и соавт. (2012) АА БА составляют 55,6%, АА ВМА - 8,1% от всех аневризм ВББ [64]. В 62% купол мешка АА БА занимает задненижнее положение в проекции межножковой ямки [252]. Диссекцию аневризмы затрудняют таламоперфорирующие артерии, III нерв, мезенцефалические отделы дна III желудочка. Применение базального доступа обеспечивает условия для адекватного клипированиия АА этой локализации. Применяют орбитозигоматические транскавернозные доступы, транспирамидные доступы с различным объёмом резекции частей височной кости (каменистой, сосцевидной, тимпанической), заднелатеральные доступы с резекцией мыщелка и яремного бугорка затылочной кости, а также различные модификации расширенных транспетрозальных инфратемпоральных подвисочных доступов со стороны средней черепной, подвисочной и крыловидно-нёбной ямок, отличающиеся последовательностью обнажения анатомических областей, особенностями работы с ветвями тройничного нерва, каменистой частью ВСА и лицевого нерва с резекцией (или без) височно-нижнечелюстного сустава [64, 110, 114, 210, 224]. Петрозальные доступы максимально приближают глаз хирурга к операционному полю и создают выгодные условия осмотра зон ската, стволов базилярной и мозжечковых артерий, межножковой, препонтинной, церебелломедулярной и премедулярной цистерн [127, 130, 151]. Петрозальные доступы изначально разрабатывались для удаления шваном, менингиом и 43 хордом основания черепа, с обязательным обнажением зон ската и петрокливальной щели [65]. Передний петрозальный доступ (ППД) относятся к расширенным вариантам доступов со стороны средней черепной ямки и в сосудистой нейрохирургии он известен под названием «Kawase approach», обеспечивающим выход к верхушке БА и верхним отделам ската (рис. 17). А В С Рисунок 17 Передний петрозальный доступ (ППД) А – Схема резекции верхушки пирамиды височной кости в треугольнике Kawase (К.М. Aziz и и соавт. 2000) [79], В – Рисунок обзора препонтинной цистерны, устья ПНМА и нижнего каменистого синуса из ППД (H.J. Steiger и соавт., 2006) [237], С – Маркировка основания черепа с границами обнажения зон ската из вариантов петрозальных резекций (стрелки) (MA. Horgan и соавт., 2000) [141]. Первыми петрозэктомию выполнили Z. Bochenek и A. Kukwa в 1975 [130]. T. Kawase и соавт. (1985) показали её ценность для доступа к верхушке БА [151]. Дальнейшая эволюция модификаций петрозальных доступов адаптировалась сосудистыми хирургами в силу определенных специфик цереброваскулярных заболеваний (наличие в анамнезе САК, являющегося причиной отёка мозга в острый период, затрудняющим тракцию мозга; трудной диссекцией цистерн основания в более поздний период САК; наличие труднодоступных АА, требующих дополнительной резекции костей основания черепа и гигантских аневризм, требующих многопланового осмотра для адекватного клипирования или реконструкции кровотока и т.д.) [64, 130, 224]. Аневризмы ВББ остаются наиболее сложными для лечения [17, 26, 37, 158]. Аневризмы верхушки БА труднодоступны при птериональном доступе [40, 64, 130]. Ситуация осложняется вариативным положением верхушки БА относительно спинки турецкого седла, различными размерами наклоненных отростков, закрывающих операционное поле [114, 224]. Применение переднего петрозального доступа показано при низком залегании АА БА с направлением купола АА к межножковой ямке, при коротком супраклиноидном отделе ВСА или при фетальном типе строения задних отделов АКБМ [64, 113, 114, 127]. Передний петрозальный доступ открывает межножковую и препонтинную цистерны сбоку, даёт возможность обойти перфорирующие артерии, утолщенную ЗСА и оптимально обнажить пришеечную часть АА в зоне квадрифуркации БА [210, 224]. 44 Резекция верхушки пирамидки височной кости показана также при АА ствола БА и устья ПНМА [125, 224]. Исторически развитием передних транспетрозальных доступов к скату послужила разработка методики транскохлеарного доступа с выделением и перемещением лицевого нерва из его канала, описанной в работах W.F. House и W.E. Hitselberger в 1976 году [48, 65, 130, 224]. После этого передней границей резекции пирамидки височной кости являлся каменистый сегмент ВСА. Передняя петрозэктомия представляет по сути вариант указанного выше доступа. Резекция верхушки пирамидки височной кости через дно СЧЯ обнажает скат, межножковую ямку и БА, под максимально низким углом осмотра [79, 97, 210] (рис. 18). А В С D Рисунок 18 Топография нейроваскулярных структур из переднего петрозального доступа (ППД) – доступ Kawase А – Обзор артерий вертебробазилярного бассейна, верхнего ската и петрокливальной щели из ППД (A.L.Jr. Rhoton и соавт., 2006) [210], В – Схема базальных доступов, используемых для лечения аневризм устья ПНМА. Доступ Kawase обозначен треугольником (L.F. Gonzalez и соавт., 2004) [125], С – Классификация доступов, которые используют для лечения аневризм, В.В. Крылов и соавт. (2012) [64] доступ Kawase относят к латеральным доступам. По классификации L.F. Gonzalez и соавт. (2005) [127], L.Sekhar и соавт. (2006) [224], J.D. Day и соавт. (2012) [103] доступ Kawase относят к расширенным доступам через дно средней черепной ямки, D – Градация базальных доступов через дно средней черепной ямки (СЧЯ): а – доступы через дно СЧЯ, в – передняя петрозэктомия (доступ Kawase), с – темпорозигоматические доступы (из атласа L. Sekhar и соавт. (2006) [224]). В дальнейшем было дано анатомическое обоснование передней петрозэктомии и продемонстрирован опыт применения транспетрозальных доступов для лечения сосудистых и опухолевых поражений петрокливальной области [48, 73, 103, 177, 224]. Несмотря на хорошо отработанную технику резекции верхушки пирамиды височной кости, некоторые хирурги предпочитают резецировать верхушку интрадурально [130, 237]. Во всех вариантах передний петрозальный доступ позволяет в отличие от задних петрозальных доступов обнажать твердую мозговую оболочку верхнего ската без разрушения улитки и лабиринта, и имеет преимущества перед другими подвисочными доступами в виде увеличения угла операционного действия, 45 меньшей тракции височной доли, экстрадуральным подходом, что особенно важно при операции на стороне доминантного полушария с целью сохранения нижней анастомотической вены Labbe [48, 65, 130, 140, 210, 224, 239, 246]. Дополнительным преимуществом передней петрозэктомии является возможность визуализировать среднюю линию ската, что важно для адекватного клипирования АА устьев ЗМА, ВМА, ПНМА [79, 130, 141, 166, 224]. При сравнении описанных в литературе доступов к основанию черепа наиболее широкими, позволяющими экзокраниальные структуры одновременно основания открывать черепа как являются эндокраниальные, расширенные так и подвисочные преаурикулярные и постаурикулярные инфратемпоральные доступы [210, 224]. С их помощью, как указывают авторы L. Sekhar и соавт. (2006) [224], M.H. Bilsky и соавт. (2005) [86], M.D. Vilela и соавт. (2004) [244], M. Wanibuchi и соавт. (2009) [246], S.J. Hentschel и соавт. (2010) [137], T. Fukushima и соавт. (2012) [121] возможно удаление обширных новообразований, занимающих нескольких анатомических областей основания черепа и распространяющихся в околоносовые синусы и подвисочную ямку. В сосудистой нейрохирургии такие доступы востребованы для обеспечения более широкого обнажения зон ската и БА, создания анастомозов между наружной и внутренней сонными артериями, при клипировании гигантских и труднодоступных АА, особенно ВББ, где предельная тракция ГМ при обычном доступе недостаточна, а зона доступности ограничена небольшим операционным углом, что препятствует адекватной диссекции аневризмы и её клипированию [110, 130, 224] (рис. 19). А В С Рисунок 19 Расширенный субтемпоральный преаурикулярный инфратемпоральный доступ с резекцией дна СЧЯ в треугольниках Day-Fukushima, Glasscock, Kawase и височнонижнечелюстного сустава с транспозицией задней петли каменистого отдела ВСА А – Общий вид доступа, В – Обнажен каменстый сегмент ВСА (стрелка), С – Топография нейроваскулярных структур со стороны подвисочной и крыловидно-нёбной ямок после отведения ВСА. Стрелка на БА с устьем ПНМА (из атласа A.L.Jr. Rhoton и соавт. (2006) [210]). . Классификации базальных доступов представлены во многих работах [48, 65, 68, 73, 79, 121, 131, 134, 141, 166, 178, 210-212, 221, 226, 244, 246]. Классификации базальных доступов к аневризмам головного мозга представлены в нескольких работах В.В.Крылова и соавт. (2012) 46 [64], L.F. Gonzalez и соавт. (2005) [127], H.J. Steiger и соавт. (2006) [237], B.A.L. Sekhar и соавт. (2006) [224], R.A Hanel и соавт. (2008) [135], В.А. Gross и соавт. (2012) [130]. Классификации инфратемпоральных доступов и их модификации представлены в 11 главе атласа M. Wanibuchi и соавт. (2009) [246], где модификации преаурикулярных трансзигоматических передних инфратемпоральных доступов обозначены как «Pericavernous Lateral Loop approach» - перикавернозные доступы с хирургической зоной работы в области латеральной петли (треугольник дна средней черепной ямки) для экстрадуральных подходов к Меккелевой полости, латеральным отделам кавернозного синуса и для выполнения экстраинтра-краниальных анастомозов с сегментами верхнечелюстной артерии [121, 224, 247]. Эти доступы начали использовать с 1998 года, сначала для лечения неврином V нерва. В настоящее время – это ключевые доступы для реваскуляризирующих операций [121]. Ранее в литературе они встречались под названием «epidural temporopolar approach» [247]. По методике K. Yoshida и T. Kawase (1999) они сопровождаются петрозальной резекцией из вариантов зигоматических, орбитозигомитических и петрозальных доступов [247, 258]. Модификации темпорополярных экстрадуральных доступов предложены J.D. Day и T. Fukushima (1994), а также S.L. Nutik и соавт. (1998) для лечения аневризм БА и АА кавернозного отдела ВСА [255, 247]. Эволюция базальных доступов в сосудистой нейрохирургии параклиноидного, параселлярного и петрокливального регионов представлена в работах E. Seoane и соавт. [227], A. Yasuda и соавт. [253], V. Dolenc и соавт.[108], L. Sekhar и соавт. [224]. Ретросигмовидный доступ при доступах к аневризмам ствола базилярной артерии имеет узкий и глубокий хирургический «коридор», требующий предельной тракции петрозальной поверхности мозжечка и моста ГМ [80, 97]. Это способствовало развитию задних петрозальных пресигмовидных доступов к АА БА [130, 131, 224]. Современные задние петрозальные доступы основаны на комбинации супра- и инфратранстенториальном подходе [210, 224] (рис.20). А В С Рисунок 20 Задний петрозальный доступ (ЗПД) А – Схема резекции сосцевидной части височной кости в треугольнике Trautman (из статьи К.М. Aziz и соавт., 2000) [79], В – Схема интрадурального этапа ЗПД – рассечение пресигмовидной ТМО, верхнего каменистого синуса, намета c обнажением церебеллопонтинного угла и прекливальных цистерн (из атласа L. Sekhar и соавт., 2006) [224], С – Анатомический препарат ЗПД. Обнажены артерии ВББ [224]. 47 Основная концепция задних петрозальных доступов - височно-затылочная трепанация с обнажением сигмовидного синуса, синодурального угла и задних отделов верхнего каменистого синуса в треугольнике Trautman [80, 130, 210]. Рассекая пресигмовидную твердую мозговую оболочку, верхний каменистый синус, намет и осуществляя тракцию задних отделов височной доли, задний петрозальный доступ позволяет обнажить все зоны ската и ствол БА [210, 224]. Важно, что задний петрозальный доступ является пресигмовидным доступом и позволяет осмотреть медиальные отделы ската с хорошей боковой визуализацией коротких перфорирующих сосудов БА и истоков мозжечковых артерий, дистанция осмотра также укорочена [80, 81, 210, 224, 231]. Этот доступ для лечения цереброваскулярных заболеваний популяризирован R.F. Spetzler и соавт. в 1992 [130]. Преимущество заднего петрозального доступа, отмеченное ещё A. Hakuba, это хороший хирургический угол при клипировании АА ВББ [130, 224]. Задний петрозальный доступ в отличие от переднелатеральных базальных доступов и расширенных доступов со стороны средней черепной ямки позволяет обнажать БА на всю длину, устья ЗМА и мозжечковых артерий от верхнего до нижнего нейроваскулярных комплексов, обеспечивая боковой осмотр БА и ската [73, 81, 110, 177, 210] (рис.21). А В С D Рисунок 21 Задний петрозальный доступ (ЗПД) А – Общий вид доступа, В – Топография нейроваскулярных структур из ЗПД. Стрелки на ЗМА и ВМА, С – Пресигмовидный осмотр ствола БА - стрелка (хирургический промежуток между V и VII+VIII), D – Пресигмовидный осмотр ствола устья ПНМА - стрелка (хирургический промежуток между VII+VIII и каудальной группой черепных нервов) (из атласа A.L.Jr. Rhoton и соавт. (2006) [210]). Чаще всего задний петрозальный доступ комбинируют с вариантами заднебоковых доступов (ретросигмовидным доступом с резекцией яремного бугорка, транскондилярным крайне латеральным доступом, трансцервикальным трансюгулярным доступом, расширенными вариантами преаурикулярных орбитозигоматических субтемпоральных инфратемпоральных и постаурикулярных транстемпоральных доступов [216, 224, 226, 250]. В последнем варианте задний петрозальный доступ становится частью комбинированных петрозальных доступов от 48 расширенных трансмастоидных инфратемпоральных доступов (например, «ITFA-рosterior» – постаурикулярный трансюгулярный задний инфратемпоральный доступ) [121, 246 в главе 16 «Posterior Transmastoid Posterior Infratemporal Fossa Transjugular Approach», С.-311-343], транслабиринтных транскохлеарных вариантов c резекцией верхушки пирамидки височной кости и транспозицией ВСА до постаурикулярных трансцервикальных транстемпоральных доступов, обеспечивающих широкий подход к сегментам ВСА и зонам ската, яремному отверстию, петрокливальному и параселлярному регионам, кавернозному синусу и орбите [177, 194, 210, 224, 244, 246 в главе 15 «Combined Petrosal Approach», С. 291-310]. Несмотря на то, что анатомические исследования и теоретические предпосылки к резекциям костей основания черепа относятся к началу прошлого века, только с развитием современных средств нейровизуализации, новейших схем анестезиологического обеспечения, использованием пластических технологий и микрохирургической техники, позволяют в настоящее время проводить сложнейшие нейрохирургические доступы с резекцией костей основания черепа с максимальным обнажением интересующей зоны [26, 49, 64, 65, 164, 224]. Применяемые в сосудистой нейрохирургии переднелатеральные и латеральные доступы не дают грубых косметических дефектов и обеспечивают возможность реконструировать основания черепа местными тканями (жир, мышцы, фасции, апоневроз) или использовать титановые микроконструкции (сетки, пластины) [48, 164, 192, 224]. M. Kusumi и соавт. (2012) использовали абдоминальную фасцию и жир, фиксируя их ко дну СЧЯ микрошурупами на тонкой титановой перфорированной микропластине, закрывая пресигмовидный дефект после комбинированного петрозального доступа [163]. S.M. Raza и соавт. (2008) использовали титановые сетки для закрытия дефекта дна СЧЯ после орбитозигоматического доступа [208]. По данным литературы проценты летальности и инвалидизации, связанные с применением базальных доступов колеблется от 0 до 8% и от 18 до 63%, соответственно [77, 137, 162, 163, 177, 218, 224]. По данным Т.С. Origitano и соавт. (2006) частота осложнений при применении переднелатеральных базальных доступов составляет 17% [192]. Наиболее часты инфекционные осложнения (бактериальный менингоэнцефалит) – 25% и некроз костного лоскута – 30%, в 10% случаев имела место напряженная пневмоцефалия, в 10% - тракционные повреждения и венозный инфаркт [6, 64, 65, 137, 173, 192, 224]. На долю случаев развившегося постоперационного вазоспазма, компрессии базальных отделов ГМ избыточно уложенным жировым фрагментом после пластики основания черепа, ликвореи, тромбоза синусов и интракраниальной гипотензии приходится 15% осложнений [58, 170, 192]. При использовании инфратемпоральных доступов к основанию черепа частота осложнений связанных с проведением доступа по данным S.J. Hentschel и соавт. (2010) составила 31% случаев [137]. Из них самые частые осложнения были повреждения краниальных нервов (25% случаев), некроз 49 лоскута, инфеционные осложнения и инсульты (31% случаев). L.N. Sekhar и соавт. (2006) в 14 главе «Cranial base approaches to aneurysms» (страницы 193-211) описывает конкретные осложнения, которые связанные с определенным видом базального доступа [224]. Например, при выполнении ОЗД часто вскрывают фронтальный синус, следовательно, повышается риск инфекционных осложнений и возникновения напряженной пневмоцефалии, а при обширной резекции крыши и латеральной стенки орбиты (более чем необходимо), часто возникает энофтальм. При использовании же петрозальных доступов наиболее часты посттракционные венозные инфаркты, повреждение вены Лаббе, ВСА,VII,VIII черепных нервов, ликворея [224]. В хирургии основания черепа необходимы знания вариантов топографии ключевых анатомических структур [65, 121, 210, 224]. S. Osawa и соавт. (2009,2010) изучали топографию каменистого отдела ВСА, анатомические варианты которой учитываются при проведении латеральных базальных доступов к скату [65, 193, 194]. В хирургии петрокливальной области важно положение канала Dorello и связки Gruber, протяженности зон ската, его глубина и величина петрокливального угла. Хорошие работы в этой области принадлежат M.A. Horgan и соавт. (2000) [141, 142], K.M. Aziz и соавт. (2000) [79], M.F. Ozveren и соавт. (2002) [195], A.L.Jr. Rhoton и соавт. (2006) [210], R. Siwanuwatn и соавт. (2006) [231], A.S. Little и соавт. (2008) [172], A.S. Youssef и соавт. (2008) [255], S.W. Chang и соавт. (2009) [97]. 1.5 Индивидуальная анатомическая изменчивость задних отделов артериального круга большого мозга применительно к выбору хирургического доступа Особенности индивидуальной анатомической изменчивости задних отделов АКБМ необходимо учитывать при выборе доступа в хирургии аневризм ВББ [26, 47, 64, 130, 158, 210]. По данным J.C. Fernandez-Miranda и соавт. (2010) фетальный тип строения задних отделов АКБМ встречается в 22% случаев [112]. В литературе эта цифра варьирует от 15 до 40% [210]. По данным A.L.Jr. Rhoton и соавт. (2006) гипопластический тип строения задних отделов АКБМ встречается в 26% случаев, билатерально гипопластический тип обнаружен в 6% [210]. В 8% случаев обнаружено наличие на одной стороне гипоплазированного типа строения, а на другой фетального типа [210]. Знания топографии сегментов и бифуркаций стволов ЗМА важны для предотвращения субтракционных повреждений отделов височной доли при подвисочных, транспетрозальных и комбинированных супра-инфратранстенториальных доступах [112, 137, 222, 242]. В хирургии аневризм вертебробазилярного бассейна особое внимание следует обратить на индивидуальное строение Р1- и Р2-сегментов ЗМА, в случаях их гипоплазии или фенестрации. Частота встречаемости гипоплазии Р1-сегмента (фетальный тип строения задних отделов АКБМ) 50 составляет унилатерально 20% и билатерально – 2% [210]. Фенестрированный тип строения Р2 ЗМА встречается от 0,3-1% случаев [148]. Частота фенестрации базилярной артерии составляет от 0,3-5,3% (W.P. Sanders и соавт. (1993), T. Iwashita и соавт. (2002)) и позвоночной артерии 0,3-2% (A.Maillo и соавт. (1991), P.V. Teodosopoulos и соавт. (2000)) [148]. Фенестрированный тип строения сегментов АКБМ часто ассоциирован с наличием артериальных аневризм ГМ. Топографические особенности индивидуального строения ВМА и её топографию относительно ствола ГМ, черепных нервов, намёта мозжечка, задних мозговых и перфорирующих артерий важно учитывать при выборе доступа к верхушке БА, инцизуральным пространствам вырезки намета мозжечка, петрокливальной щели, церебеллопонтинному углу, при осуществлении расширенных базальных доступов [64, 224]. По данным D.G. Hardy и соавт. (1980) верхняя мозжечковая артерия считается самой постоянной из субтенториальных артерий, однако указываются случаи её полного отсутствия [210]. Т. Matsushima и соавт. (1982) ввел понятие нейроваскулярные комплексы и отнес ВМА, IV и V нервы к верхнему нейроваскулярному комплексу [210]. Дупликатура ВМА встречается в 14-21% [64, 210]. По данным A.L.Jr. Rhoton и соавт. (2006) билатерально дупликатура ВМА встречается в 2%, в 4% ВМА исходит из ЗМА и проходит над III нервом [210]. Определение диаметров БА, устьев и сегментов ЗМА и ВМА важно для реваскуляризирующей нейрохирургии [110, 177, 224, 225]. 51 1.6 Заключение к главе 1 1 Часть АА (до 19,6%) относится к «сложным аневризмам» из-за ключевых показателей, таких как анатомия АА и тяжесть состояния больного. Сложная АА не может быть вылечена одним, каким либо методом, например, с применением только стандартных нейрохирургических доступов при клипировании АА или с использованием только эндоваскулярного лечения. Лечение сложных АА требует применения мультимодальной нейрохирургической стратегии. 2 В лечении сложных АА применение только эндоваскулярного метода дает большой процент неполной окклюзии (25-62%), реканализации (8-60%), повторного разрыва и возврата больного (5-38%) в нейрохирургическое учреждение для повторной операции. Тромбоэмболические и геморрагические осложнения (до 21,5%) встречаются в несколько раз больше у больных после эндоваскулярного лечения, чем у больных после клипирования. Большим количеством не долеченных больных (Raymond II-III) объясняется наличие «хороших результатов» по шкале Rankin и ШИГ в проспективных исследованиях в группах больных после эндоваскулярного лечения. Процент «полной окклюзии» АА в группе больных после эндоваскулярного лечения (30-60%) недостаточно высок, спустя некоторое время к наличию реканализаций при «неполной окклюзии» присоединяется ещё и процент (до 14%) из числа «полной окклюзии». Выключение сложных АА с широкой шейкой микроспиралью по надежности уступает микрохирургическому клипированию (J.S Waldron и соавт. (2009), S.L. Blackburn и соавт. (2014), BRAT (2012), BRAT-3 (2014), H. Li и соавт (2013) и др.) 3 Использование стентов и баллонов в техники ремоделирования шейки сложной АА имеет разные результаты лечения, как в самих группах, так и между когортой разрывных и неразрывных аневризм (данные ATENA (2009), CLARITY (2011), Н. Nishido и соавт. (2014), М. Shapiro и соавт. (2009,2012)). По результатам лечения АА с разрывом CLARITY (2011) и K.D. Bodily и соавт. (2011) лучше использовать баллонное ремоделирование. Однако в группе разрывных бифуркационных аневризм ВББ такое лечение спорно. N. Sanai и соавт. (2008) предпочитают микрохирургическую окклюзию АА ВББ, используя базальные доступы. 4 Использование стандартного хирургического доступа в хирургии сложных АА неприемлемо, в силу высокой инвалидизации и летальности. В лечении сложных АА необходимо выполнять базальные доступы, обеспечивающие визуализацию шейки аневризмы и её клипирование. 5 Наряду с применением базальных доступов в хирургии сложных АА одной из современных стратегий лечения сложных АА является комбинированное лечение – сочетание эндоваскулярной и микрохирургической окклюзии АА. Наиболее распространенные варианты когерентного лечения сложной АА, встретившиеся нам в литературе: 1. ремоделирование 52 шейки АА клипсом (по аналогии с техникой ремоделирования баллоном или стентом), а затем эндоваскулярное лечение, 2. частичное окклюзия АА микроспиралью, а затем проведение клипирование оставшейся резидуальной части (шейка, часть тела). При проведении микрохирургического выключения сложной АА (клипирование, ремоделирование, реконструкция кровотока) выполняются только базальные доступы. 6 Для лечения сложных АА применяются орбитозигоматические доступы, доступы Kawase, задние петрозальные доступы, расширенные варианты переднелатеральных доступов с резекцией дна СЧЯ и транспозицией ВСА и VII нерва, заднелатеральные базальные доступы. 7 Аневризмы ВББ включены в категорию труднодоступных сложных АА. В когорте разрывных сложных АА они занимают 43%, из которых 19% составляют АА верхушки БА. В группе сложных АА без разрыва они занимают 27%. Для адекватного выбора направления базального доступа необходимо знать, с каким вариантом строения задних отделов АКБМ мы имеем дело (нормальный, фетальный или гипопластический типы) и как верхушка базилярной артерии залегает по отношению к спинке турецкого седла. Диаметрально противоположные направления доступов – птериональное, петрозальное, заднее или смешанное дают различную топографию нейроваскулярных структур в заданной области хирургического поля. Поэтому знания топографии и вариантов индивидуального строения задних отделов АКБМ является ключевым при выборе направления базального доступа. Резюмируя вышесказанное, в наше диссертационное исследование включены два направления: А Оценка ключевых топографо-анатомических характеристик сегментов задних отделов АКБМ, влияющих на выбор базального доступа, с акцентированием внимания на частоте встречаемости фетального типа строения и низко расположенной к спинке турецкого седла верхушки базилярной артерии В Оценка хирургических параметров операционной раны наиболее популярных в сосудистой нейрохирургии базальных доступов – орбитозигоматического, переднего петрозального (доступа Каваза) и заднего петрозального доступов. 53 ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 2.1 Материалы и методы топографо-анатомических исследований 2.1.1 Общая характеристика анатомического материала Исследование хирургической анатомии базилярной артерии (БА), задней соединительной артерии (ЗСА) и задней мозговой артерии (ЗМА) проводили на 50 фиксированных блок-препаратах «головной мозг в твердой мозговой оболочке (ТМО) на вырубленном основании черепа», изъятых у трупов людей, умерших от соматической патологии без патологии центральной нервной системы. Артериальное русло каждого из блокпрепаратов наполняли окрашенной латексной композицией. Сравнительная морфометрия моделируемых расширенных базальных доступов (орбитозигоматического доступа, переднего и заднего транспетрозальных доступов) выполнена в секционном зале на 50 головах трупов людей, умерших в первые 24 часа с момента проведения патологоанатомического эксперимента и на 10 фиксированных головах трупов. 2.1.2 Методика приготовления анатомических препаратов Извлечение препаратов для исследования хирургической анатомии БА, ЗСА, ЗМА, ВМА осуществляли по следующей методике. В первые часы после смерти выполняли максимально базальный распил костей свода черепа через лобную и теменные кости. Свод черепа удаляли таким образом, чтобы не повредить твердую мозговую оболочку. После этого экстрадурально выделяли кости основания черепа до максимального предела видимости. Для извлечения головного мозга вместе с фрагментом основания черепа выполняли круговую деструкцию костей основания черепа стамеской и молотком. Линия деструкции проходила через площадку клиновидной кости, далее через малые и большие крылья клиновидных костей, крышу барабанной полости с переходом на затылочную кость кпереди от яремного бугорка до края большого затылочного отверстия с захватом мыщелков. Частично мобилизованный фрагмент костей основания черепа приподнимали в передней его части кверху одновременно пересекая глоточные мышцы и связки в направлении "спереди - назад". По мере извлечения мобилизованного фрагмента костей основания черепа обнажался краниовертебральный 54 переход, медуллоспинальное соединение. Выполняли экзартикуляцию атлантозатылочных суставов, пересечение спинного мозга, позвоночных артерий и оставшихся мышц и связок шеи. Полученный блок препарат представлял собой головной мозг с полностью сохраненной твердой мозговой оболочкой и фрагментом основания черепа (рис. 22). А В Рисунок 22 Макропрепарат головного мозга в ТМО на вырубленном основании черепа А – Вид спереди, В – Вид снизу. Извлеченный блок препарат готовили к анатомическому исследованию: перед фиксацией артериальную систему всех препаратов промывали физиологическим раствором, после чего выполняли наливку окрашенным латексом. Все препараты фиксировали в 10%-м р-ре формальдегида в течение 14 суток и более, после начинали диссекцию артерий (рис. 23). А В Рисунок 23 Макропрепарат основания черепа с инъецированными артериями и синусами А – Вид сбоку и слева. Препарат готов для проведения морфометрических и топографо-анатомических исследований артерий задних отделов АКБМ, В – Тот же препарат. Увеличенный вид, Х8. 55 В секционном зале на головах трупов моделировали расширенные базальные доступы. Использовали операционный микроскоп, высокоскоростной нейрохирургический костный бор и стандартный нейрохирургический набор инструментов. 2.1.3 Методики топографо-анатомических исследований Использовали следующие методики анатомического исследования: Метод поэтапной микропрепаровки артерий задних отделов АКБМ, БА, ЗМА и ВМА. Диссекцию артериального русла проводили под операционным микроскопом S100/OPMI Carl Zeiss, используя 3-12 кратное увеличение. Микрофотографирование выполняли цифровой фотокамерой Sony HDR-CX560 Е (рис. 24). А В Рисунок 24 Макропрепараты головного мозга с инъецированными латексом сосудами А – Диссекция проксимальной бифуркации Р2Р-сегмента ЗМА (стрелка), В – Диссекция межножковой цистерны, выделены таламоперфорирующие артерии (стрелка). Метод моделирования экстрадурального микрохирургического доступа (резекция скулоорбитального комплекса и латеральных отделов дна средней черепной ямки (СЧЯ), верхушки пирамиды височной кости, сосцевидной и тимпанической частей височной кости). Проводили сравнительную морфометрию расширенных базальных доступов (орбитозигоматического доступа - ОЗД, переднего петрозального доступа - ППД и заднего петрозального доступа - ЗПД) (рис. 25). Оценивали нейроваскулярные взаимоотношения в подвисочной ямке, рельеф и глубину СЧЯ и ПЧЯ, конфигурацию глазницы. Определяли размеры наружной и внутренней апертур хирургической раны. В исследовании ставилась задача оценки базального осмотра сегментов АКБМ, треугольников основания черепа, сегментов ВСА, ската и петрокливальной области, верхушки и ствола БА с устьями ЗМА и мозжечковых артерий из моделируемых расширенных базальных доступов. 56 Оценка угловых параметров базального доступа складывалась из измерения операционных углов (проекционный, вертикальный и горизонтальный угол). Оценка глубины раны проводилась путем измерений расстояния от самой удаленной точки, центрированной на интересующем участке АКБМ до границ базальной резекции костей основания черепа. А В C D E F Рисунок 25 Анатомические препараты - моделирование расширенных базальных доступов А – Орбитозигоматический доступ (ОЗД). Вскрыта периорбита (стрелка), B – Измерение уголовых параметров операционной раны из орбитозигоматического переднего транспетрозального доступа, C – Моделирование ОЗД на фиксированной голове трупа, выпелен орбитозигоматический комплекс (стрелка), D – Измерение глубины раны после расширенного инфратемпорального орбитозигоматического доступа с резекцией костей основания черепа в треугольниках Glasscock, Kawasе, Day-Fukushima с транспозицией ВСА (стрелка на задней петле ВСА), E – Измерение зон доступности ската из расширенного переднего петрозального доступа (стрелка), F – Измерение параметров резекции в треугольнике Kawasе (стрелка). После проведения доступов измеряли угловые размеры основания черепа (рис. 26). А В Рисунок 26 Анатомический препарат основание черепа (вид сбоку) и схема А – Измерение базилярного угла (стрелка), В – Измерение угла схождения пирамид (стрелка). 57 Микрохирургическую анатомию моделируемых доступов изучали с использованием операционного микроскопа МБС-10 и цифровой видеокамеры «Sony» HDR-CX560 Е. Фотографии этапов моделируемых доступов делали с 2-8 кратным увеличением. Использовали метод моделирования интрадурального этапа базального доступа (резекция наклоненных отростков, зрительной распорки, спинки турецкого седла, верхушки и мастоидной части височной кости) при транскавернозных и транспетрозальных микрохирургических подходах к сегментам ВСА, АКБМ и верхушке БА с последующей морфометрией, поэтапной диссекцией и поэтапным микрофотографированием. Параметры и возможности транскавернозного доступа оценивались измерением хирургических углов и глубины раны (параклиноидный отдел ВСА, межножковая цистерна и верхушкой БА). Исследовали объём и ракурс (снизу, спереди, сзади, сбоку, сверху) обнажения интересующего сегмента АКБМ и цистерн основания черепа в создаваемом хирургическом пространстве. Проводили сравнительную морфометрию микрохирургических подходов путем изучения количественных угловых параметров операционной раны в обзоре хирургических мишеней из моделированных базальных доступов разного направления. 2.1.3.1 Методика исполнения заднего петрозального доступа В проведенном исследовании модифицирована техника выполнения заднего петрозального доступа (ЗПД) с целью уменьшения тракционных повреждений задних медиобазальных отделов височной доли и петрозальной поверхности мозжечка. Анатомическое исследование проводили на 25 нефиксированных головах умерших от соматической патологии людей без патологии центральной нервной системы Предлагаемый трансмастоидный ретролабиринтный пресигмовидный доступ в отличие от стандартных пресигмовидных доступов, направлен сверху и медиально через сосцевидную и тимпаническую части височной кости со стороны СЧЯ, кпереди от сигмовидного синуса и синодурального угла. Этапы операции. Делают подковообразный постаурикулярный разрез кожи, начиная с заднелатеральных отделов височно-теменно-затылочной области продолжая до латеральной области субокципитального треугольника шеи книзу на 2 см от верхушки сосцевидного отростка. Далее отводят кожно-апоневротический лоскут, отсепаровывают мышечные группы от латеральной и заднелатеральной поверхности черепа, скелетируя ключевые точки – asterion, ось Henle, верхушку сосцевидного отростка. Проводят костно-пластическую трепанацию в теменно-височно-затылочной области и резекционную трепанацию в латеральной субокципитальной области. После этого приступают к экстрадуральному этапу проведения заднего транспетрозального доступа. Отсепаровывают ТМО задних отделов височной доли, 58 прилегающей к СЧЯ до обнажения синодурального угла, расщелины верхнего каменистого синуса и дугообразного возвышения. Высокоскоростным бором с насадкой 3-5 мм на 45-60 оборотах проводят деструкцию костей заднелатеральных отделов основания черепа в анатомически дозволенной зоне - треугольнике Trautman, начиная со стороны задних отделов СЧЯ. Резецируют тимпаническую и сосцевидную часть височной кости. Антеромедиальный край мастоидэктомии ограничен задним полукружным каналом, обращенным в просвет ЗЧЯ, параллельно верхнему каменистому синусу позади заднего края внутреннего слухового прохода (рис. 27). А В С D 4 Рисунок 27 Анатомические препараты и схема экстрадурального этапа заднего пертозального доступа (ЗПД) А – Комбинированная трепанация черепа в теменно-височно-затылочной и субокципитальной областях с обнажением поперечного и верхнего каменистого синусов, синодурального угла, В – Резекция высокоскоростным бором сосцевидной и тимпанической частей височной кости, С – Обнажена пресигмовидная ТМО в треугольнике Trautman, D – Схема. На схеме показаны границы резекции левой височной кости при ЗПД. 1 - зона костной резекции в треугольнике Trautman, 2 - пресигмовидная ТМО ЗЧЯ, обращенная в мосто-мозжечковый угол, 3 - верхний каменистый синус, 4 - задние отделы дна СЧЯ и eminenctia arcuata (пунктир), 5 - наружный слуховой проход; 6 - синодуральный угол. Антеролатеральный верхний край резекции ограничен верхним полукружным каналом, самая латеральная часть которого является местом перехода лабиринтного сегмента лицевого нерва в тимпанический сегмент. Антеролатеральный нижний край резекции ограничен латеральным полукружным каналом, самая латеральная часть которого является местом перехода тимпанического сегмента VII нерва в сосцевидный. Направление резекции косое до уровня ярёмной луковицы. Линия резекции проходит по задней кривизне всех полукружных каналов, не вскрывая канала лицевого нерва и наружного отверстия водопровода преддверия, которые остаются кпереди от резекции. Форма обнаженной ТМО задней черепной ямы треугольная, с вершиной направленной книзу. После проведения экстрадуральной костной части доступа, твердую мозговую оболочку ЗЧЯ рассекали вдоль сигмовидного синуса в направлении яремной луковицы. Вскрывали ТМО в теменно-височной области, рассекали верхний каменистый синус, края которого лигировали. Накладывали мозговой шпатель на задние отделы височной доли и рассекали намет мозжечка кпереди от верхнего каменистого синуса до свободного края намета позади V и местом входа IV нерва в заднелатеральные 59 отделы кавернозного синуса. Далее накладывали второй мозговой шпатель сверху на мозжечок и осуществляли тракцию его петрозальной поверхности. Пресигмовидно обнажали структуры церебеллопонтинного угла и петрокливальный регион сбоку и сзади. Структуры верхнего и среднего ската обнажали сверху субтемпорально транстенториально. Мобильность задним отделам височной доли придавал рассеченный верхний каменистый синус и отсутствующие мастоидная и тимпаническая части височной кости (рис. 28). А В С D V III IV IV V 2 1 3 Рисунок 28 Анатомические препараты интрадурального этапа ЗПД А – Рассечение теменно-височной ТМО, В – Рассечение ТМО петрозальной поверхности мозжечка, намёта и пересечение верхнего каменистого синуса. Вена Лаббе впадает в синодуральный угол (стрелка), С – Намёт мозжечка рассечен и отведен, тракция левой височной доли. Обнажены боковая поверхность моста, V и IV нервы, обходная, ножковая и церебеллопонтинная цистерны; D – Дополнительная тракция петрозальной поверхности мозжечка, отведение сигмовидного синуса и изменения наклона операционной оси открывает препонтинную цистерну и верхние отделы ската со стволом БА (1) и устьями ЗМА (2), ВМА (3) и ПНМА (стрелка). При этом синодуральный угол и вена Лаббе оставались сзади, что позволяло смещать сигмовидный синус кзади, увеличивая операционный угол осмотра кливальной области без увеличения тракции височной доли и мозжечка. В направлении сзади и сверху операционная ось проходит по отсутствующим частям височной кости, через рассеченный намет и верхний каменистый синус до передних отделов нижнего каменистого синуса и канала Dorello с входящим в него VI нервом. Обзор устья, сегментов и петель ПНМА, канала Дорелло возможен из трех основных хирургических промежутков – пресигмовидно между V и VII+VIII; пресигмовидно транстенториально между V и IV нервами (треугольник Fukushima); ретросигмовидно субтенториально между IX и V, и V и VII+VIII. Если требуется осмотреть нижний скат и структуры церебеллопонтинного угла снизу, сзади и латерально проводят ретросигмовидную тракцию. Таким образом, доступ превращается в комбинированный ретропресигмовидный подвисочный транстенториальный (рис. 29). Транслабиринтные и транскохлеарные петрозальные доступы, комбинированные орбитозигоматические пресигмовидные петрозальные доступы сопровождаются разрушением сенсорных структур внутреннего уха и дисфункцией или параличом лицевого нерва. В предложенном варианте модификации ЗПД резекции подвергается только мастоидная и тимпаническая часть височной кости со стороны задних отделов СЧЯ, в пределах треугольника 60 Trautman. Доступ можно комбинировать с трансзигоматическими подвисочными доступами, орбитозигоматическими инфратемпоральными доступами, обеспечивающими увеличения обзора прекливальных цистерн и ствола БА сверху, снизу, сбоку и спереди; комбинация ЗПД с крайне латеральными транскондилярными доступами обеспечивает более широкое обнажение ската со стороны задней черепной ямки и шеи. В А VI III VI V VII+VIII VII+VIII V IV VI D С VII+VIII VI 1 IV V V IV E F III V III VII+VIII VII+VIII XI+ X+ IX IX Рисунок 29 Анатомические препараты моделирования заднего петрозального доступа А – Общий вид пресигмовидного транстенториального осмотра препонтинной цистерны, В – Основание черепа со стволом головного мозга, срезанным на уровне среднего мозга. Топография черепных нервов к краям резекции мастоидной части височной кости, С – Дополнительная тракция петрозальной поверхности мозжечка с отведенным сигмовидным синусом открывает препонтинную цистерну со стволом БА (1) и устьем ПНМА сверху и сбоку. Обзор отводящего нерва - между V и VII+VIII (желтая стрелка), D - Виден канал Дорелло (стрелка). Обзор устья, сегментов и петель ПНМА, канала Дорелло осуществляется пресигмовидно транстенториально между V и IV нервами (треугольник Fukushima) (зеленая стрелка); Е – Расширенный путем мобилизации сигмовидного синуса ретросигмовидный субтенториальный обзор латеральных отделов ската между IX и VII+VIII, V и VII+VIII, V и III нервами (синие стрелки), F – Ретросигмовидный обзор нижнего нейроваскулярного комплекса. После выполнения доступа осуществляли вскрытие черепной коробки и измеряли дистанции между задней стенкой внутреннего слухового прохода, сигмовидным синусом, яремным отверстием, яремной луковицей, наружным отверстием водопровода преддверия, поддуговой ямкой и границами костной резекции. Исследовали возможности объема резекции сосцевидной части височной кости у черепов с разными краниометрическими 61 характеристиками, измеряли высоту сосцевидного отростка, линейные размеры основания черепа (угол схождения пирамид и базилярный угол) и широтно-продольный показатель исследуемого черепа (рис. 30). А В С 1 2 Рисунок 30 Анатомические препараты основания черепа после ЗПД и схема А – Направления осмотра из ЗПД. Канал Дорелло (стрелка) лежит на границе I и II зоне ската. Направления осмотра канала Дорелло: 1 - пресигмовидное супра-транстенториальное направление осмотра, 2 - ретросигмовидное субтенториальное направление осмотра, В – морфометрия границ резекции височной кости, С – схема левой височной кости с границами костной резекции. Предложенный вариант доступа можно использовать для подхода к стволу БА, устью ПНМА и клипирования АА БА, а также для реконструктивных операций кровотока с наложением широкопросветных интра-интракраниальных анастомозов (М2-Р2) или интраэкстракраниальных анастомозов (рис. 31). А В С D Рисунок 31 Лечение артериальной аневризмы базилярной артерии и схемы реконструкции кровотока с использованием заднего петрозального доступа А – Аневризма средней трети БА, стрелками указаны возможные направления подхода к АА, В – Транслабиринтный вариант заднего транспетрозального доступа с транспозицией лицевого нерва, С – Реконструкция кровотока бедренной веной. Анастомоз вшит в среднюю треть БА на уровне устья ПНМА и экстракраниально в наружную сонную артерию, D – Общий вид анастомоза (из статьи J. Evans и соавт., 2004 [110]). 62 2.1.4 Обеспечение анатомических исследований Для фиксации анатомического материала использовали стандартный эксикатор, заполненный 10%-м раствором формальдегида. Для проведения краниометрических исследований использовали штангенциркуль, линейку, угломеры, циркуль, транспортиры, миллиметровая бумага. Для получения фиксированных блок-препаратов «головной мозг в ТМО на вырубленном основании черепа» с налитым окрашенной латексной композицией артериальным руслом использовали патологоанатомические инструменты: пила, набор ножей разной длины, стамеска, молоток, ножницы, шприцы для промывания артериального русла, окрашенный латекс и лигатуры для перевязки ВСА и позвоночных артерий, 10% р-р формалина. Для диссекции артериального русла использовали нейрохирургические микроинструменты пинцеты, ножницы, зажимы. Для морфометрии использовали линейки, транспортиры. Для моделирования нейрохирургический набор, нейрохирургический доступов использовали микроинструменты, шпатели, операционный стандартный микроскоп, высокоскоростной нейрохирургический костный бор с насадками разного диаметра и формы. Для проведения морфометрических исследований хирургических промежутков использовали полоски миллиметровой бумаги, угломеры, циркуль. Для диссекции артериального русла использовали операционный микроскопом S100/OPMI Carl Zeiss. Расширенные базальные доступы проводились с использованием операционного микроскопа МБС-10. Для фотосъемки использовалась цифровая видеокамеры «Sony» HDR - CX560Е и фотокамера Nikon - 6200 с матрицей 14.0 мегапикселей, линзой с 10-кратным оптическим увеличением и режимами макро-(расстояние 7 см до объекта). 2.2 Материалы и методы клинического исследования Проведено хирургическое лечение 8 больным со сложными артериальными аневризмами головного мозга. Все больные прооперированны в НИИ СП им. Н.В. Склифосовского в период с апреля 2013 года по февраль 2014 года. Прооперированные пациенты представляли категорию больных со сложными артериальными аневризмами, включающие артериальные аневризмы труднодоступной локализации и гигантские АА (АА параклиноидной локализации и АА ВББ). Ко всем пациентам применены методы открытого хирургического лечения. Для клипирования аневризм труднодоступной локализации всем пациентам проведены базальные доступы с резекцией костей медиальных и латеральных отделов основания черепа. 63 2.2.1 Методики проведения расширенных базальных доступов в хирургии артериальных аневризм головного мозга Целью базального доступа является обнажение сегмента АКБМ, который имеет сложную топографию по отношению к костям основания черепа, подход к которому резко затруднен или не возможен при использовании стандартного доступа. Базальные доступы при клипировании труднодоступных АА применяют с целью визуализировать сегмент АКБМ, который закрыт костными структурами основания черепа (например, клиноидный сегмент ВСА закрыт передним наклоненным отростком и зрительной распоркой), а также с целью минимизировать тракционные повреждений на стороне доминантного полушария или в зоне жизненноважных отделов ствола ГМ (например, клипирование АА ВББ) [64, 224]. Для подхода к труднодоступным аневризмам параклиноидной локализации использовали двухлоскутный орбитозигоматический инфратемпоральный доступ [64, 224, 256]. После вскрытия ТМО по крылу основной кости осуществляли подход к ипсилатеральному зрительному нерву и ВСА, выполняя арахноидальную диссекцию со вскрытием каротидной и хиазмальной цистерн. Затем препарировали оптикокаротидный и ретрокаротидный промежутки со вскрытием межножковой цистерны [37, 64]. В последующем разводили острой диссекцией проксимальные отделы латеральной щели для визуализации терминального отдела ВСА, начальных отделов ПМА, СМА и отходящих от них ветвей. Следующим этапом являлось рассечение цистерны конечной пластинки. Дальнейшие этапы арахноидальной диссекции осуществлялись в зависимости от локализации и направления купола аневризмы [64, 210, 224]. В случаях артериальных аневризм офтальмического сегмента ВСА с нижнемедиальным направлением купола и расположением шейки ниже переднего наклоненного отростка и дистального каротидного кольца рассекали серповидную связку и зрительный чехол, осуществляли декомпрессию зрительного канала и резекцию переднего наклоненного отростка. После вскрытия клиноидного пространства в треугольнике Dolenc осуществляли рассечение дистального кольца и передних отделов интерклиноидной связки в каротидном треугольнике Umansky. Идентифицировали исток глазной артерии, шейку аневризмы и клипировали аневризму. В случаях аневризм офтальмического сегмента ВСА с переднелатеральным направлением купола, осуществляли рассечение твердой мозговой оболочки, покрывающей передний наклоненный отросток от его верхушки до верхней глазничной щели вдоль передних отделов передней петроклиноидной связки. Затем проводили резекцию переднего наклоненного отростка. Циркулярно рассекали дистальное каротидное кольцо в виде манжеты, идентифицировали устье глазной артерии и проводили клипирование аневризмы (рис. 32). 64 При клипировании параклиноидных артериальных аневризм использовали титановые клипсы фирмы «Aesculap» и «Codman». А В С D Рисунок 32 Схемы основных орбитозигоматических передних транскавернозных доступов при клипировании артериальных аневризм офтальмического сегмента ВСА с низким расположением пришеечной части аневризмы А – Варианты расположения шейки АА и направления купола АА: 1 - нижнемедиальное и 2 переднелатеральное, В – Схема рассечения ТМО переднего наклоненного отростка и границы его резекции (зеленое поле), С – клипирование АА с нижнемедиальным расположением купола, D – Клипирование АА с переднелатеральным направлением купола. Во всех проиллюстрированных случаях шейка АА находится ниже дистального кольца (зеленые стрелки) в проекции передних отделов крыши кавернозного синуса – в треугольниках Dolenc и Umansky. Купол АА в случае С вдается в переднемедиальные отделы кавернозного синуса, располагаясь между каротидным чехлом и каротидной бороздой клиновидной кости. В случае D аневризма часто находится под каротидно-окуломоторной мембраной, смещая III нерв, купол АА протрузирует под связочный аппарат намета (передняя петроклиноидная и менинго-периорбитальная связки) в переднелатеральных отделах кавернозного синуса (из атласа L. Sekhar и соавт., 2006 [224]). При наличии орбитозигоматический аневризм доступ в с области резекцией вертебробазилярного дна средней бассейна черепной выполняли ямки, низким ретрокаротидным подходом к межножковой цистерне и клипирование аневризмы (рис. 33). А В С Рисунок 33 Схемы направлений к верхушке БА и межножковой цистерне из орбитозигоматического доступа (ОЗД) А – ОЗД. Верхняя стрелка – птериональное направление, подход в ретрокаротидном промежутке, нижняя - смешанное (птериональное и подвисочное) направление доступа, В – ОЗД с резекцией дна СЧЯ и скелетированием V2 и V3 ветвей тройничного нерва, увеличивающее объем обзора из подвисочного направления, С – варианты транскавернозных базальных подходов к аневризме устья ВМА, занимающей межножковую и круральную цистерны (из атласа L. Sekhar и соавт., 2006 [224]). 65 При наличии комбинированный артериальной задний аневризмы петрозальный в области устья ПНМА пресигмовидный выполнили ретросигмовидный ретролабиринтный доступ, клипирование артериальной аневризмы. В случаях гигантских аневризм осуществляли расширенный орбитозигоматический доступ с резекцией дна средней черепной ямки в области латеральной петли костей основания черепа. При лечении гигантской параклиноидной АА произведена перевязка ВСА на шее, реконструкция кровотока лучевой артерией с наложением широкопросветного анастомоза от общей сонной артерии к М2-сегменту СМА (височная ветвь). Широкопросветный анастомоз размещен в зоне резекции дна средней черепной ямки в области V2-V3 (латеральная петля – базальный треугольник средней черепной ямки). Операции проводились с использованием микроскопа «OPMI Neuro NC4 фирмы "Carl Zeiss» под увеличением в 8-16 раз и микрохирургического инструментария. При клипировании аневризм вертебробазилярного бассейна использовали титановые клипсы фирм «Aesculap», «Codman» и «Sugita». 66 ГЛАВА 3 ХИРУРГИЧЕСКАЯ АНАТОМИЯ ЗАДНИХ ОТДЕЛОВ АРТЕРИАЛЬНОГО КРУГА БОЛЬШОГО МОЗГА 3.1 Общая характеристика анатомического материала Исследование хирургической анатомии базилярной артерии (БА), задней соединительной артерии (ЗСА), задней мозговой артерии (ЗМА) и верхней мозжечковой артерии (ВМА) проводили на 50 фиксированных блок-препаратах головной мозг в твердой мозговой оболочке на «вырубленном» основании черепа, изъятых у умерших от соматической патологии без патологии центральной нервной системы. Артериальное русло каждого из блокпрепаратов наполняли окрашенной латексной композицией. Морфометрические исследования проводили под операционным микроскопом S100/OPMI Carl Zeiss, используя 4-8 кратное увеличение. Микрофотографирование выполняли цифровой фотокамерой Sony HDR-CX 560 Е. Проведено исследование изменчивости строения задних отделов АКБМ, верхушки базилярной артерии, задней мозговой артерии, верхней мозжечковой артерии и перфорирующих артерий ствола головного мозга. 3.2 ХИРУРГИЧЕСКАЯ АНАТОМИЯ ЗАДНИХ ОТДЕЛОВ АРТЕРИАЛЬНОГО КРУГА БОЛЬШОГО МОЗГА, БАЗИЛЯРНОЙ АРТЕРИИ И ЗАДНЕЙ МОЗГОВОЙ АРТЕРИИ 3.2.1 Тип строения задних отделов артериального круга большого мозга В нашем исследовании выявлены три типа строения задних отделов АКБМ: нормальный, гипоплазированный и фетальный. Нормальный тип строения был выявлен при исследовании 24-х препаратов (48%). Гипоплазированный и фетальный типы строения были выявлены при исследовании 26-и препаратов (52%). При нормальном типе строения задних отделов АКБМ диаметр Р1-сегмента ЗМА превалирует над диаметром ЗСА, диаметр которой больше 1 мм. Гипоплазированный тип (диаметр ЗСА менее 1,0 мм) был выявлен при исследовании 10 препаратов (20%). Унилатеральный и билатеральный гипоплазированные типы выявили при исследовании 8 (16%) и 2 препаратов (4%) соответственно. 67 При фетальном типе строения задних отделов АКБМ диаметр одной или обеих ЗСА превалировал над диаметром Р1-сегмента ЗМА. Такое строение встретилось в 32%. Унилатеральный и билатеральный фетальные типы выявили в 20% и 12%, соответственно. 3.2.2 Изменчивость базилярной артерии В нашей серии наблюдений длина базилярной артерии (БА) составила 27-46 мм (в среднем – 34,5). Наибольший диаметр БА выявлен в области слияния позвоночных артерий и составил 3-8,2 мм (в среднем – 5,8). Наименьший диаметр отмечен в области дистальной трети и бифуркации БА: 3,8-6,9 мм (в среднем 4,7) (табл. 12). Таблица 12 Морфометрические характеристики базилярной артерии Авторы Yasargil M.G. [252] Lang J. [166] Длина БА, мм 15-40 (32) Диаметр БА, мм 4-4,5 Ход БА, % Прямой - 25 Крылов B.B. и соавт. [64] 22-36 (29,5) 4,8 Прямой - 54, с изгибом вправо - 30, с изгибом влево -10, S-6 Нет данных Наши данные N=50 27-46 (34,5) ВБС 3-8,2 (5,8) Верхушка БА 3,8-6,9 (4,7) Прямой в 90, с изгибом вправо – 10 32 4 Расположение бифуркации БА,% Нет данных Нет данных на уровне СТС - 44 выше СТС - 28 ниже СТС - 28 на уровне СТС - 36 выше СТС - 40 ниже СТС - 24 ВБС - вертебробазилярное сочленение, СТС - спинка турецкого седла. Ствол БА в 90% наблюдений располагался строго по средней линии, либо с незначительным отклонением от нее. В 10% наблюдений отмечено отклонение ствола БА латерально до нервов мосто-мозжечкового угла. Для выбора направления доступов к верхушке БА необходимы знания типа строения задних отделов АКБМ и положение БА относительно I зоны ската. В нашей серии наблюдений фетальный тип строения задних отделов АКБМ встретился в 32%, а в 24% верхушка БА находилась ниже уровня спинки турецкого седла (рис. 34). То есть в 1\3 исследуемого материала встретилось такое индивидуальное строение верхушки БА, которое является предикторами выбора расширенного базального доступа. В 10% наблюдений отмечено отклонение ствола БА латерально до нервов мосто-мозжечкового угла. Эти данные имеют значения для выбора вида, стороны доступа или его направления. 68 А 4% 16% В 40% 12% 36% 48% 20% 24% Рисунок 34 Иллюстрация индивидуальных топографо-анатомических особенностей строения задних отделов АКБМ, установленных в исследовании А – Тип строения задних отделов АКБМ: нормальный - 48%, гипоплазированный унилатеральный 16%, билатеральный - 4%, фетальный унилатеральный - 20%, билатеральный - 12%. Красным цветом отмечены типы строения задних отделов АКБМ значимые при выборе доступа, В – Положение верхушки БА по отношению к спинке турецкого седла (СТС). На уровне СТС - 36%, выше СТС - 40% и ниже 24%. Красным цветом показан процент топографии верхушки БА, значимый для выбора вида и направления базального доступа. 3.2.3 Изменчивость Р1-сегмента задней мозговой артерии Установлено, что диаметр Р1-сегмента ЗМА, а также количество перфорирующих сосудов, отходящих от него, различаются в зависимости от типа строения задних отделов АКБМ. Особенно наглядна разница диаметров Р1-сегмента ЗМА при унилатеральном гипопластическом и фетальном типах (табл. 13). Таблица 13 Морфометрические характеристики Р1-сегмента ЗМА Авторы Lang J. [166] Крылов В.В. и соавт. [40] Наши данные Диаметр Р1сегмента ЗМА, мм 2,3 2,4 УГТ- 2,2-4,3 (3,17) БГТ- 3,8-5,2 (4,1) УФТ- 0,8-2,2 (1,6) БФТ-1,2-2,0 (1,63) НТ- 2,0-3,6 (3,04) Длина Р1сегмента ЗМА, мм 3-14(7) 4-11(7,4) ГТ- 3- 11(10) ФТ-7,6-18,5(14) НТ-3,2-11 (5,8) Перфорирующие артерии Р1-сегмента ЗМА (локализация устьев) Задняя и верхняя стенки Р1-сегмента ЗМА Р1-сегмент ЗМА и бифуркации БА Прямые перфорирующие артерии отходят от задней стенки, огибающие ветви на всем протяжении Р1сегмента ЗМА УГТ - унилатеральный гипоплазированный тип строения задних отделов АКБМ; БГТ - билатеральный гипоплазированный тип строения задних отделов АКБМ; УФТ - унилатеральный фетальный тип строения задних отделов АКБМ; БФТ - билатеральный фетальный тип строения задних отделов АКБМ; НТ - нормальный тип строения задних отделов АКБМ. При гипоплазированном унилатеральном типе строения задних отделов АКБМ диаметр Р1-сегмента ЗМА на стороне гипоплазированной задней соединительной артерии был 2,2-4,3 мм (в среднем 3,17), а на противоположной гипоплазии стороне составил 1,9-4,0 мм (в среднем 69 2,8). То есть при гипоплазированном типе строения задних отделов АКБМ, где диаметр ЗСА меньше 1 мм, Р1-сегмент ЗМА на стороне гипоплазии был всегда толще (рис. 35). 1 Рисунок 35 Анатомический блок-препарат головного мозга на основании черепа с инъецированными латексом артериями и венами Вид спереди и сверху. Гипоплпзированная ЗСА (стрелка) и Р1-сегмент ЗМА (1). Диаметр гипоплазированной ЗСА варьировал от 0,5-0,9 мм, и был длиннее на 3-4 мм по сравнению с противоположной ЗСА, диаметр которой был нормальным и составил от 1,0-2,2 мм (в среднем 1,6). Р1-сегмент на стороне гипоплазии также был длиннее со средней длиной 10 мм (3-11). При билатеральной гипоплазии диаметр Р1 варьировал от 3,8-5,2 мм (в среднем 4,1). При унилатеральном фетальном типе строения задних отделов АКБМ диаметр Р1ЗМА на стороне фетального строения варьировал от 0,8 до 2,2 мм (в среднем 1,6). Диаметр ЗСА был 2,3-3,4 мм (рис. 36). При билатеральном типе диаметр Р1-сегмента ЗМА составил 1,2-2,0 мм (в среднем 1,63) с диаметром ЗСА 2,4-3,5 мм, при этом Р1ЗМА чаще правой стороны был толще. Длина Р1-сегмента ЗМА в фетальной группе составила от 7,6 до 18,5 мм (в среднем 14). А В Рисунок 36 Анатомические блок-препараты головного мозга на основании черепа с инъецированными латексом артериями и венами А – Вид сбоку и сверху. Фетальная ЗСА (стрелка), В – Вид спереди. Фетальная ЗСА и гипоплазированный Р1-сегмент ЗМА (стрелка). 70 При нормальном строении диаметр Р1ЗМА варьировал от 2,0 до 3,6 мм (в среднем 3,04) с длиной от 3,2 до 11мм (в среднем 5,8) с диаметром ЗСА от 1,1 до 1,9 мм (в среднем 1,36) и её длиной от 10 до 21 (в среднем 13,0). В исследовании нормального типа строения задних отделов АКБМ замечено, что III нерв чаще находится латерально Р1 ЗМА. Если же имеется фетальная конфигурация то III нерв лежит медиально, находясь либо ниже либо на уровне ЗСА и Р1-сегмента ЗМА. Это необходимо учитывать при выделении и клипировании аневризм бифуркации БА и устья верхней мозжечковой артерии (ВМА) из каротидно-офтальмического пространства. Аневризмы ВББ с фетальной конфигурацией ЗМА требуют применения доступов с резекцией костей основания черепа для обеспечения базального осмотра. 3.2.4 Изменчивость Р2- и Р3-сегментов задней мозговой артерии и формирование проксимальной бифуркации Р2-сегментом задней мозговой артерии При гипоплазированном и нормальном типах строения задних отделов АКБМ диаметр Р2-сегмента ЗМА составил 2,3-4,0 мм (в среднем 3,2). При фетальном типе строения задних отделов АКБМ диаметр Р2-сегмента ЗМА составила 2,1-3,1 мм (в среднем 2,7). Р2Р-сегмент ЗМА образует проксимальную би- или трифуркацию ЗМА. Область разветвления основного ствола ЗМА, как правило, располагается на границе cisterna cruralis и cisterna ambient, медиально от латерального коленчатого тела, находясь на расстоянии 3-10 мм (в среднем 6) от задневнутренней поверхности крючка гиппакампа. Разветвление ЗМА может быть либо на два либо на три основных крупных ствола. Один из стволов в 100% исследованных гемисфер являлся общей нижней височной артерией. В случае бифуркации ЗМА, второй ствол был общим для теменно-затылочной и шпорной артерий. В случае трифуркации второй ствол был теменно-затылочной, а третий - шпорной артерией. Образование би- или трифуркации основного ствола ЗМА в cisterna quadrigeminalis не обнаружено. Область разветвления ЗМА прочно фиксирована в обводной цистерне aa.thalamogeniculatae et pedunculoperforatae и “пучками” ЗЛВА, исходящими из основных её стволов. Выделены три формы ветвления ЗМА на первичные стволы: Первая форма Образование би- или трифуркации основного ствола ЗМА происходит в передних отделах обводной цистерны, находясь от крючка гиппокампа на расстоянии от 0 до 5 мм (в среднем 2,8). Основной ствол и его ветви делают крутой изгиб, внедряясь под парагиппокампальную извилину и находятся между задними отделами крючка гиппокампа и fimbria hippocampalis. Эта форма встречалась в 50%. Вторая форма Образование би- или трифуркации ЗМА происходит в средних отделах cisterna ambient, располагаясь между латеральным коленчатым телом и подушкой таламуса на 71 расстоянии от 6 до 9 мм (в среднем 7,5) от крючка гиппокампа. Один из главных стволов (общий ствол для теменно-затылочной и шпорной артерии) делает крутой изгиб и внедряется под крючок гиппокампа. Чаще от него отходят только задние латеральные ворсинчатые артерии (ЗЛВА). Эта форма встречалась в 10% наблюдений (рис. 37). А C В D E Рисунок 37 Блок-препараты головного мозга на основании черепа с инъецированными латексом сосудами Формы проксимальной би-трифуркации Р2Р-сегмента ЗМА. А – Первая форма (стрелка), B – Вторая форма (стрелка), C и D – Третья форма (стрелка), E – Топография проксимальной бифуркации левой ЗМА на границе ножковой и обводной цистерн (стрелка). Третья форма Образование би- или трифуркации основного ствола ЗМА происходит в задних отделах cisterna ambient на границе с cisterna quadrigeminalis. Разветвление располагается далеко от крючка гиппокампа на расстоянии от 11 до 17 мм (в среднем 14,5) между медиальным коленчатым телом и подушкой таламуса. Главный ствол (Р2Р-сегмент ЗМА) образует небольшой изгиб, незначительно проминирующий под крючок гиппокампа. Из 72 этого ствола отходили кортикальные ветви (гиппокампальные и передние височные артерии), ЗЛВА и длинные циркумферентные артерии. Эта форма встречалась в 39 %. Отсутствие бифуркации обнаружено в 1% случае. В исследовании всего материала встретился очень редкий тип кровоснабжения медиобазальной поверхности височной доли (препарат N17, правая гемисфера). Кровоснабжение зоны, которая обычно осуществляет ЗМА, происходило из гипертрофированной передней ворсинчатой артерии с диаметром 2,3 мм, которая разветвлялась подобно основному стволу нижней височной артерии. Её ветви входили в передние отделы хороидальной щели и питали сплетение бокового желудочка. Эта же артерия являлась источником для всех разновидностей перфорирующих сосудов ствола ГМ, а также для задней медиальной и латеральных ворсинчатых артерий. С этой же стороны имелся ствол ЗМА диаметром 2,0 мм, который не давал ветвей вокруг ствола, а разветвлялся только в области шпорной и теменно-височной борозды на одноименные артерии Топографию проксимальной би-(три)фуркации ЗМА нужно учесть при проведении вариантов подвисочных доступов, субтенториальных трансхороидальных, трансзигоматических инфратемпоральных доступов, комбинированных транстенториальных и транспетрозальных доступов (рис. 38). 50 40 30 50% 50% 20 10 39% 1% 10% 0 Рисунок 38 Иллюстрация частоты встречаемости вариантов индивидуального анатомического строения бифуркации Р2Р-сегмента ЗМА, установленных в исследовании По оси ординат – процент встречаемости. По оси абсцисс – количество типов: 50% - 1 тип, 10% - 2 тип, 39% - 3 тип, 1% - нет бифуркации. 3.2.5 Изменчивость перфорирующих ветвей задней мозговой артерии Все перфорирующие артерии ЗМА мы разделили на прямые и циркумферентные. Прямыми мы считали артерии, отходящие от основного ствола ЗМА под прямым углом и направляющиеся к стволу головного мозга. Эта группа сосудов включает в себя aa. thalamoperforatae posteriores, aa. thalamogeniculatae at aa. pedunculoperforatae. Циркумферентные перфорирующие артерии огибают ствол головного мозга прежде, чем войти в него. Среди сосудов этого типа выделяют длинные и короткие циркумферентные перфорирующие артерии. 73 Нами установлено, что прямые перфорирующие артерии, кровоснабжающие гипоталамус и область межножковой ямки, отходят от задней соединительной артерии, Р1сегмента ЗМА, задневерхней и латеральной поверхностей БА и проксимального отдела верхней мозжечковой артерий. Задняя соединительная артерия отдает на своем протяжении от 3 до 15 (в среднем 8) перфорирующих артерий, прободающих парамедианную и заднюю перфорирующие субстанции. Их диаметр составил 0,05-0,5 мм с экстрацеребральной длиной 5-19 мм. Наибольшее количество артерий отходит от средней трети ЗСА и Р1-сегмента ЗМА. В 21% наблюдений перфорирующие артерии этой группы ветвятся на более мелкие сосуды. В 79% ветвления не обнаружено. Задние таламоперфоррирующие артерии отходили от задневерхней стенок Р1-сегмента ЗМА, их диаметр составил 0,1-1,2 (в среднем 0,3) и длиной 4-12 мм. В 90% наблюдений эти артерии ветвились раньше вхождения в межножковую ямку. От задней и латеральной поверхностей дистальной трети БА отходит от 3 до 18 коротких огибающих перфорирующих артерий, диаметром 0,1-0,5 мм. Аa. thalamogeniculatae отходят в 15 % наблюдений от Р2А, в 80% - от Р2Р и в 5 % - от Р3 сегмента. Эти артерии перфорируют вещество головного мозга в области подушки таламуса, кровоснабжая заднюю часть латерального таламуса, заднюю ножку внутренней капсулы и зрительный тракт. Количество артерий этой группы - 3-8 (в среднем 5). В 50% наблюдений аa.thalamogeniculatae и задние латеральные ворсинчатые артерии отходят общим стволом от бифуркации ЗМА. Длинные и короткие огибающие артерии также могут быть источником aa. thalamogeniculatae. Топографию устьев таламоколенчатых артерий необходимо учитывать при выполнении вариантов подвисочных доступов, трансхороидальных доступов через височный рог бокового желудочка к обходной цистернам, Р2А и Р2Р-сегментам ЗМА (рис.39). 15% 5% 80% Рисунок 39 Иллюстрация локализации устьев аa. thalamogeniculatae 80% - устья артерий располагается на Р2Р-сегменте ЗМА и связаны с областью проксимальной бифуркации ЗМА, 5% - источник Р3-сегмент ЗМА и 15% - источник Р2А-сегмент ЗМА. В 90% наблюдений аa. pedunculoperforatae отходят в количестве 2-11 артерий (в среднем 6) от Р2А сегмента ЗМА, в 10% - от других сосудов. Эта группа артерий кровоснабжает кортикобульбарные и кортикоспинальные тракты, красное ядро, черную субстанцию. Огибающие ветви исходят из Р1- и Р2-сегментов ЗМА. Короткие огибающие артерии выявлены в 70% наблюдений. Артерии, начинавшиеся от Р1-сегмента ЗМА, перфорировали 74 мозговую ткань на латеральной поверхности ствола головного мозга в 80% наблюдений, в медиальном коленчатом теле - в 20%. Огибающие артерии, ответвлявшиеся от Р2-сегмента ЗМА кровоснабжали только покрышку среднего мозга и коленчатые тела. Короткие огибающие артерии в области устьев отдают ветви к межножковой ямке. Длинные огибающие артерии выявлены в 100% наблюдений. Все артерии этой группы перфорировали вещество головного мозга в области пластинки четверохолмия. Каждая из длинных огибающих артерий является источником 5 и более ветвей к латеральной поверхности ножки мозга и коленчатым телам. Артерии этой группы отходят от Р1-сегмента ЗМА дистальнее устьев коротких огибающих артерий в 75% наблюдений, в 25% - от Р2А сегмента. В области четверохолмия они ветвятся на множество мелких сосудов. Формирующаяся артериальная сеть анастомозирует с дистальными ветвями верхней мозжечковой артерии. Верхние холмики четверохолмной пластины кровоснабжаются перфорирующими артериями ЗМА, нижние - перфорирующими артериями, отходящими из верхней мозжечковой артерии. 3.2.6 Задние медиальные ворсинчатые артерии Задние медиальные ворсинчатые артерии (ЗМВА) выявлены в 100% наблюдений. Огибая ствол, в области четверохолмной цистерны они круто поворачивают вверх, проходя по бокам от шишковидной железы и кровоснабжая сосудистое сплетение III желудочка. Затем через отверстие Монро эти артерии входят в сплетение бокового желудочка. При удвоенной ЗМВА: первая ветвь отходила от Р2А, другая из крупного ствола нижней височной (Р2Р-сегмент ЗМА), шпорной или теменно-затылочной артерий (Р3 сегмент ЗМА). На всем протяжении ЗМВА отдают ветви к ножкам мозга, коленчатым телам, шишковидной железе и медиальным отделам таламуса. Диаметр ЗМВА был 0,2-1,4 мм (в среднем 1,1), в количестве одной или двух. Расположение устья ЗМВА зависело от типа строения задних отделов АКБМ. При нормальном типе ЗМВА в 43 % наблюдений отходили от Р2А, в 37,5% - от Р2Р, в 37,5% - от Р3 и в 7% - от Р1 сегмента ЗМА. Две ЗМВА были обнаружены в этом типе в 21,4%. Часто дупликатура ЗМВА сочеталась с двумя Р3 или двумя Р2Р-сегментами ЗМА. При гипоплазированном типе строения задних отделов АКБМ в 50% наблюдений ЗМВА отходили от Р2А, в 30% - от Р2Р, в 40% - от Р3 (чаще от шпорной артерий), в 10% - от Р1 сегмента ЗМА. Двойные ЗМВА обнаружены в этом типе в 30 % и отходили от Р3 или Р2Р ЗМА. 75 При фетальном типе строения задних отделов АКБМ в 56% наблюдений ЗМВА отходили от Р2А, в 6,5% - от Р2Р, в 19% - от Р3 и в 31% - от Р1 сегмента ЗМА. Двойные ЗМВА были обнаружены в этом типе в 12,5%. При этом типе имелся двойной сегмент Р3 (рис.40). А В С D Рисунок 40 Анатомические блок-препараты головного мозга на основании черепа с инъецированными латексом сосудами, иллюстрирующие топографию задних медиальных ворсинчатых артерий (ЗМВА) А – Ход ЗМВА в сосудистом сплетении боковых желудочков (стрелки), В – Вскрыты рога левого бокового желудочка, обнажен извилистый ход ЗМВА (стрелка), идущий из отверстия Монро (белая стрелка) в сосудистое сплетение бокового желудочка, С – Вскрыта сосудистая основа III желудочка, между внутренними венами располагаются петли ЗМВА, левая ЗМВА отходит от Р3-сегмента ЗМА (белая стрелка), D – Вход ЗМВА в отверстие Монро (стрелка). В 11% ЗМВА заходили в задние отделы хороидальной щели, отдавая здесь мелкие веточки, как это делают латеральные ворсинчатые артерии. 3.2.7 Задние латеральные ворсинчатые артерии Задние латеральные ворсинчатые артерии (ЗЛВА) попав в сосудистую щель, кровоснабжают сплетения боковых желудочков. Количество ЗЛВА 4-9 (в среднем 6) диаметром 76 0,1-0,4 мм. В 65% устья ЗЛВА располагались на основном стволе ЗМА: на Р2А сегменте в 20% наблюдений, на Р2Р – в 35%, на Р3 - в 10%. В остальных наблюдениях (35%) ЗЛВА отходили от парагиппокампальных артерий (11%), передних височных (2%), задних височных (5%), средних височных (1%), теменно-затылочных (5%), от ЗМВА (8%) и шпорных артерий (3%) (рис. 41). Задние латеральные ворсинчатые артерии кровоснабжают ножки мозга, заднюю комиссуру, латеральное коленчатое тело, дорсомедиальные таламические ядра, хвостатое ядро А В С D Рисунок 41 Анатомические препараты головного мозга, иллюстрирующие топографию задних латеральных ворсинчатых артерий (ЗЛВА) А – Анатомический блок-препарат головного мозга на основании черепа с инъецированными латексом сосудами. Вскрыт височный рог бокового желудочка, обнажено сосудистое сплетение. Крупный ствол ЗЛВА отходит от передней нижней височной артерии (стрелка). Передняя ворсинчатая артерии отдает несколько ункальных и гиппокампальных ветвей (зелёная стрелка), В – Тот же препарат. Увеличение Х12. Большая часть устьев ЗЛВА располагают на Р2Р-сегменте ЗМА в обводной цистерне (стрелки). Притоки вены Розенталя (педункулярный сегмент) концентрируются в ретроункальном пространстве (рядом с латеральным коленчатым телом на границе круральной и обводной цистерн), образуя важный в хирургии височной доли - нижний венозный угол (синяя стрелка), С – Анатомический препарат. Крючок гиппакампа и часть парагиппокампальной извилины удалены. Обнажено сплетение височного рога бокового желудочка. Обведена зона максимальной концентрации устьев и стволиков ЗЛВА (стрелка), D – Тот же препарат увеличенный вид. Увеличение Х8. Синяя стрелка на крупном стволе ЗЛВА, отходящем от гиппокампальной артерии (белая стрелка). 77 Часто общий ствол ЗЛВА, диаметром 0,5-0,7 мм формируется из 3-4 мелких артерий с диаметром 05 до 0,3 мм. Он образует петли в толще сплетения височного рога бокового желудочка. В этих случаях передняя ворсинчатая артерия тоньше, чем обычно. Задние латеральные ворсинчатые артерии, исходящие из Р2А (передних височных, ункальных и гиппокампальных ветвей) намного тоньше, чем ЗЛВА, исходящие от Р2Р и Р3-сегментов ЗМА. Это объясняется зоной перекрытия ЗЛВА с передними ункальными артериями, исходящими от передней ворсинчатой артерии, М1-сегмента СМА и хороидального сегмента ВСА. Однако при гипоплазии цистернального сегмента передней ворсинчатой артерии, который дает небольшое количество ветвей к гиппокампу и порогу островка (limen insulae), эту зону кровоснабжают передние и задние ункальные, парагиппокампальные артерии, исходящие от Р2А и Р2Р-сегментов ЗМА, от которых отходят ЗЛВА. Такую топографию следует учитывать при передних подвисочных доступах, орбитозигоматических транссильвиевых транслименальных трансхороидальных и трансункальных доступах к верхушке БА и Р1-Р2сегментам ЗМА, при резекции полюса височной доли. Например, при деструкции крючка гиппокампа при трансункальных доступах, пересечение ункальных и гиппокампальных артерий также повлечет за собой разрушение и крупных ветвей ЗЛВА с обеднением кровоснабжения сосудистого сплетения. 3.2.8 Корковые ветви задней мозговой артерии В эту группу включена группа нижних височных артерий, теменно-затылочные, шпорные и спленальные артерии. В группу нижних височных артерий включают гиппокампальные ветви, передние, средние и задние нижние височные артерии. Нижние височные артерии кровоснабжают нижнюю часть височной доли, перекрываясь с верхними височными артериями из СМА, питающие полюс височной доли. Гиппокампальная артерия обнаружена в 100% наблюдений, кровоснабжающая крючок и головку гиппокампа, гиппокампальную и зубчатую извилины. Эта артерия отходит от ствола ЗМА наиболее проксимально и является первой корковой ветвью ЗМА. В 90% наблюдений гиппокампальная артерия была представлена одним стволом, в 8% - двумя и в 2% - тремя. В 2 % наблюдений гиппокампальная артерия имела значительные размеры и распространялась на всю переднюю треть височной доли, включая его полюс. При этом доля кровоснабжения из каротидного бассейна была минимальной. Передняя нижняя височная артерия обычно являлась второй корковой ветвью ЗМА. Она обнаружена в 50% гемисфер, исходила от Р2А в 30% и 20% от общей нижней височной артерии. В 6% она снабжала полюс височной доли с диаметром от 1,2 до 1,7 мм. 78 Средняя нижняя височная артерия была обнаружена в 100% наблюдений и всегда отходила от общей нижней височной артерии. Ее диаметр составил 0,8-1,4 мм (в среднем 1,1). Задняя нижняя височная артерия была представлена в 100% гемисфер. Она исходила от Р2Р в 87% и от Р3 в 13%. Ее диаметр был от 0,7 до 2,4 мм (в среднем 1,8). Наряду с общей височной артерией это самая крупная ветвь и количество вторичных корковых ветвей получаемых в результате ее деления превышает все другие ветви. Зоной ее кровоснабжения была вся задненижняя поверхность височной и затылочной доли, иногда полюс затылочной доли и язычная извилина. Общая височная артерия выявлена в 100% наблюдений. В 20% от нее отходили все кортикальные ветви ЗМА, кроме гиппокампальной артерии. В остальных наблюдениях от общей височной артерии отходили средняя и задняя нижняя височные артерии. Во всех наблюдениях общая височная артерия отходила от Р2Рсегмента ЗМА. Диаметр составил 1,8-2,6 мм (в среднем 2,1). Теменно-затылочная артерия обнаружена на всех препаратах. Она отходила от Р2Р в 60% наблюдений и от Р3 - в 40%. Диаметр теменно-затылочной артерии составил 1,2-2,2 мм (в среднем 1,6). По ходу она отдавала мелкие веточки к подушке таламуса, среднему мозгу, латеральному коленчатому телу. Она является источником для ЗМВА и ЗЛВА, спленальных и пинеальных артерий. Артерия проходила в одноименной борозде и кровоснабжала заднюю треть парасагиттальной области, латеральную затылочную извилину, cuneus и precuneus. Шпорная артерия была представлена во всех наблюдениях и кровоснабжала язычную извилину и полюс затылочной доли. В 90% она отходила от ЗМА одним стволом, в 10% наблюдали ее удвоение. Диаметр шпорной артерии - 0,6-1,7 мм (в среднем 1,3). Проведенное исследование изменчивости ветвления корковых артерий ЗМА позволяет выделить несколько типов кровоснабжения заднемедиальных отделов ГМ (рис. 42 и 43, В). Первый тип (37% наблюдений) характеризуется отсутствием передней нижней височной артерии, а от общей нижней височной артерии отходили средняя и задняя височные артерии. Это наиболее распространенный тип ветвления ЗМА. 40 30 37% 30% 20 10 20% 13% 0 Рисунок 42 Иллюстрация типов строения коркового ветвления ЗМА 37% - 1 тип (нет передней нижней височной артерии), 20% - 2 тип (стандартное ветвление), 30% - 3 тип (передняя нижняя височная артерия отходит от Р2А ЗМА), 13% - 4 тип (наличие добавочной задней нижней височной артерии, исходящей от Р3-сегмента ЗМА) 79 А 5 4 3 2 1 В 1 тип 2 тип 1 3 тип 1 3 1 2 1 4 4 4 5 4 тип 2 5 4 5 5 3 5 Рисунок 43 Анатомический блок-препарат головного мозга на основании черепа с инъецированными латексом сосудами и схемы, иллюстрирующие типы ангиоархитектоники ЗМА А – Анатомический препарат, вид сверху, передние медиобазальные отделы височной доли отвернуты кпереди. Вывернут крючок гиппокампа и парагиппокампальная извилина, обнажены основные стволы Р2-сегмента ЗМА (3 тип ветвления ЗМА), В – Схема типов коркового ветвления ЗМА, 1 – гиппокампальная артерия, 2 – передняя нижняя височная артерия, 3 – общая нижняя височная артерия, 4 – средняя нижняя височная артерия, 5 – задняя нижняя височная артерия. Второй тип (20% наблюдений) характеризуется наличием всех артерий. Третий тип (30% наблюдений) характеризуется наличием самостоятельно отходящей от Р2А-сегмента ЗМА передней нижней височной артерии (рис. 43, А). Для четвертого типа (13% наблюдений) в отличие от первого, характерно наличие добавочной задней нижней височной артерии отходящей от теменно-затылочной артерии. 80 3.3 ХИРУРГИЧЕСКАЯ АНАТОМИЯ ВЕРХНЕЙ МОЗЖЕЧКОВОЙ АРТЕРИИ 3.3.1 Топография устья верхней мозжечковой артерии В проведенном исследовании изменчивости строения ВМА и её перфорирующих ветвей мы использовали классификацию A.L.Jr.Rhoton: ствол ВМА разделен на главный, ростральный и каудальный, сегменты ВМА поделены на передний и латеральный понтомезенцефалические, церебелломезенцефалический и кортикальный сегменты [210]. С небольшими изменениями эта классификация представлена в работе А. Rodríguez-Hernández и соавт. (2011) (рис. 44) [213]. А В 8 5 7 3 2 1 8 7 6 С 2 3 6 7 Рисунок 44 Анатомические блок-препаратыголовного мозга на основании черепа с инъецированными латексом сосудами и схема классификации ветвей ВМА А – Анатомический препарат ГМ. Медиобазальные отделы правой височной доли отвернуты, обнажены сегменты и стволы ВМА, В – Схема ветвления стволов ВМА, С – Анатомический препарат ГМ. Проведена диссекция церебелломезенцефалической щели, удален верхний червь мозжечка (lingula cerebelli, lobulus centralis et culmen vermis) обнажен церебелломезенцефалический сегмент ВМА (синие стрелки), 1 – главный ствол ВМА, 2 – ростральный ствол ВМА, 3 – каудальный ствол ВМА, 5 – передний понтомезенцефалический сегмент ВМА, 6 – латеральный понтомезенцефалический сегмент ВМА, 7 – церебелломезенцефалический сегмент ВМА, 8 – кортикальный сегмент ВМА. Устье ВМА всегда находится в передних отделах вырезки намета мозжечка или в переднем инцизуральном пространстве. В исследовании 100 гемисфер, ВМА в 78 случаях исходила как один ствол, в 22 случаях - как два ствола. Дупликатура ствола, расположенная билатерально была представлена в 2-х случаях. В 94 случаях ВМА отходили от базилярной артерии, 6 исходили от Р1-сегмента ЗМА и проходили над III нервом. Основной ствол ВМА (в случаях одностволового истока), и верхний ствол (в случаях дупликатуры), отходил от БА, 81 прилегая к устью ЗМА. Расстояние между устьями варьировало от 2 до 3,5 мм. Установлено, что расположение устья и переднего понтомезенцефалического сегмента ВМА зависит от расположения верхушки базилярной артерии, которое может быть высоким, нормальным и низким. Соответственно этому положение начального участка ВМА было выше свободного края намёта мозжечка в случае высокой бифуркации; было медиально свободному краю намета мозжечка при бифуркации БА, расположенной напротив спинки турецкого седла (СТС); и ниже в случаях, когда верхушка БА имела низкое расположение - на 3-7 мм ниже СТС. Положения верхушки БА относительно СТС зависят в свою очередь от показателей базилярного угла (БУ) и угла схождения пирамид (УСП). При БУ от 103°-110° и УСП от 115°125° верхушка БА была выше СТС на 2-5 мм. Соответственно этому расположение истока ВМА в ее проксимальных отделах было высоким. Такие краниальные показатели чаще соответствовали брахицефальной форме черепа. При нарастании БУ и уменьшении УСП соотношения были обратными. При узком черепе с УСП 88°-95° и пологом скате отмечено, что область верхушки БА располагается ниже СТС. Это затрудняет обзор задних отделов АКБМ из птерионального доступа, где бифуркация БА закрыта задним наклоненным отростком и СТС. Такое анатомическое расположение артерий наблюдалось у долихокранных черепов. 3.3.2 Бифуркация верхней мозжечковой артерии и модели кровоснабжения На изученном материале хода сосуда и образовании основных ветвей установлено, что ВМА образует основные три типа ветвления, отличающиеся характером расположения ветвей и регионами кровоснабжения. Первые два типа разветвления ВМА характерны для артерий, отходящих одним стволом. Главный ствол в этих случаях делится на два - ростральный и каудальный. При втором типе до бифуркации основного ствола на ростральный и каудальный всегда отходит дополнительная толстая ветвь, которая либо является только маргинальной и уходит на петрозальную поверхность мозжечка, либо поднимается к пластине четверохолмия, питая ее и давая множество мелких мезенцефальных сосудов. Диаметр основного ствола при I-м и II-м типах варьировал от 1,8 до 3,0 мм (в среднем 2,11). Диаметр рострального ствола составил от 1,2 до 2,2 мм (в среднем 1,7), диаметр каудального ствола варьировал от 0,5 до 1,5 мм (в среднем 1,1). При первом типе бифуркация располагалась на расстоянии от 4,0 до 39 мм (в среднем 22,3) от устья. Ростральный ствол в большинстве случаев был толще каудального. Расстояние от бифуркации ВМА до разветвления рострального ствола на основные чревные и гемисферные ветви было от 12 до 29 мм (в среднем 18). Каудальный ствол чаще сразу ветвился, причем первой его ветвью была маргинальная ветвь диаметром от 0,3 до 0,9 мм (в среднем 0,5). При 82 втором типе протяженность основного ствола до первой ветви была от 5,0 до 24 мм (в среднем 14,6). Ростральный ствол по диаметру был равен каудальному или был меньше его. Каудальный ствол давал только гемисферные ветви. Причем, если он был крупным, то давал больше ветвей, которые питали как свою область, так и территорию рострального ствола, а в некоторых случаях заходили на противоположную сторону. Первый тип кровоснабжения отмечен в 52% из 100 гемисфер, второй в 26% (рис. 42, А). Третий тип ветвления ВМА обнаружен в 22% из 100 гемисфер и формируется в случаях дупликатуры устья ВМА. Отмечено, что артерии как на стороне дупликатуры, так и на противоположной имеют меньший диаметр по сравнению с одностволовым истоком. Во всех случаях на стороне дупликатуры нижняя артерия имела меньший диаметр, чем верхняя. В 2-х гемисферах на стороне дупликатуры обе ВМА исходили от ЗМА, а в 2-х от ЗМА отходила только верхняя ВМА. Толщина верхней ветви была от 1,1 до 2,1 (в среднем 1,72). Диаметр нижней ветви был от 0,8 до 1,8 мм (в среднем 1,1) (рис. 45, В). А 1 2 4 3 В 1 1 2 1 3 2 4 1 3 3 1 2 4 1 тип 2 тип 3 тип 3 Рисунок 45 Анатомический блок-препарат головного мозга на основании черепа с инъецированными латексом артериями и схема типов ветвления ВМА А – Анатомический препарат ГМ. Обнажены сегменты и стволы ВМА (второй тип ветвления), В – Схема ветвления стволов ВМА, 1 – главный ствол ВМА, 2 – ростральный ствол, 3 – каудальный ствол, 4 – маргинальная ветвь. 83 Диаметр ВМА на противоположной стороне был от 1,2 до 2,3 мм (в среднем 1,84). Установлено, что нижняя ветвь не формировала рострального и каудального стволов, а являлась источником для перфорирующих прямых и циркумферентных артерий. Часто она являлась основной ветвью питающей латеральную поверхность ножки мозга и пластину четверохолмия, рассыпаясь на холмиках в мельчайшую сеть и анастомозируя здесь с длинными циркумферентными артериями и a.quadrigemina, исходящими из ЗМА (табл. 14). Таблица 14 Морфометрические характеристики стволов ВМА Тип ветвления верхней мозжечковой артерии, % Морфометрические данные Главный ствол диаметр, мм длина, мм Ростральный ствол диаметр, мм длина, мм Каудальный ствол диаметр, мм Маргинальная ветвь диаметр, мм локализация устья Данную I 52 2,0 - 3,0 (в среднем 2,4) II 26 1,8 - 2,2 (в среднем 1,9) III (двойной) 22 верхняя ВМА 1,1-2,1 (в среднем 1,72) нижняя ВМА 0,8-1,8 (в среднем 1,1) 18-35 4,0-39 (в среднем 22,3) 5,0 - 24 (в среднем 14,6) 1,5 - 2,2 (в среднем 1,7) 12 - 29 (в среднем 18) 1,1 - 1,5 (в среднем 1,0) 10 - 17 (в среднем 14) 0.9-1,8 0,5 - 1,2 (в среднем 0,9) 1,2 - 1,7 (в среднем 1,5) 0,8-1,1 0,3 - 0,9 каудальный ствол 0,3 -1,5 основной ствол 0,8 до 1,8 нижняя ВМА топографо-анатомическую особенность ветвления 17-25 маргинальной ветви необходимо учитывать при тракции петрозальной поверхности мозжечка или переднебоковой поверхности моста при доступах к петрокливальной щели, верхнему нейроваскулярному комплексу, верхним и средним отделам ската, при удалении менингиом задней черепной ямки, клипировании АА ВМА, АА верхушки и ствола БА, АА устья ПНМА, удалении каверном ствола, укладывания тифлоновой прокладки для лечения невралгии V нерва. Верхняя ВМА формировала главные стволы также как и при единственном стволе ВМА. Отмечено, что если на одной стороне был III-й тип ветвления ВМА, то на другой был II-й тип. Перфорирующие ветви отходят как от основного ствола ВМА, так и от ростральной и кудальной частей латерального понтомезенцефалического сегментов ВМА. Большинство стволов даёт от 3 до 8 перфорирующих веточек. 84 В 1\3 исследованных гемисфер проксимальная часть ВМА формировала мелкие сосуды, идущие в межножковую ямку вместе с aa. thalamoperforatаe от БА и ЗМА. Данную топографоанатомическую особенность необходимо учитывать при клипировании АА БА или АА устья ВМА. Длинные циркумферентные сосуды оканчивались в области четверохолмия и опускались до верхних и средних церебеллярных ножек. Верхняя мозжечковая артерия снабжала тенториальную поверхность, верхнюю часть субокципитальной поверхности и верхние 2/3 петрозальной поверхности мозжечка. Распространенной моделью кровоснабжения являлось сочетание 2-х чревных артерий с 3-мя гемисферными артериями. 3.3.3 Топография верхней мозжечковой артерии относительно черепных нервов и намёта мозжечка Проксимальная часть ВМА идёт под ЗМА и отделена от нее III-м нервом. Примерно 2\3 ВМА контактируют с III нервом в области его нижней поверхности. На 6 гемисферах из 100, когда ВМА отходила от ЗМА, контакт был на верхней поверхности нерва. Длина ВМА между её устьем и точкой контакта с нервом была в среднем 5 мм (варьировала 3-11) и длина нерва от места выхода из среднего мозга до ВМА в среднем составила 4 мм (варьировала 2,0-7,5). Диаметр артерии в точки контакта был в среднем 2,1 мм (варьировал 1,1-3 мм). Не было точки контакта в случаях, когда имелось низкое расположение истока ВМА. Данную анатомическую особенность необходимо учитывать при диссекции аневризм базилярной артерии и АА переднего понтомезенцефалического сегмента ВМА. Блоковый нерв идет между нижней поверхностью намета и ВМА. Во всех случаях IV нерв контактировал с артерией. Это происходит чаще на главном и ростральном стволах ВМА. Точка контакта ВМА с нервом находилась на расстоянии от 12 до 25 мм (в среднем 14) от места его выхода из tectum и на расстоянии и 18-26 мм от истока ВМА. Данная локализация точки контакта находилась в обводной цистерне. ВМА располагается сверху V нерва и формирует петлю, которая контактировала с нервом в половине случаев. Петля может состоять из главного ствола, каудального или рострального или из обоих стволов, или из маргинальных ветвей. Диаметр ВМА в точке контакта варьирует от 0,5 до 3,0 мм. Дистанция между истоком ВМА и точкой контакта с тройничным нервом варьирует от 20-39 мм (в среднем 27). Дистанция между сосудом и нервом в случаях отсутствия нейроваскулярного контакта варьировала от 4 до 12 мм (в среднем 6). Точка контакта с ВМА обычно располагается на верхней поверхности нерва. Часто несколько пучков нерва имеют вдавления от свисающей петли ВМА (табл. 15 и рис. 46). 85 Таблица 15 Топография сегментов ВМА (N = 100) Место контакта с (со) Морфометрические данные III нервом Сегмент ВМА ППМС IV нервом ЛПМС, ЦМС; Частично ППМС (сбоку) и КорС (снизу) Ствол ВМА ОС Диаметр в точке контакта, мм 1,1-3,0 (в среднем 2,1) % от всех ВМА 16 Чаще РС 0,9-2,2 (в среднем 1,5) 100 V нервом ЛПМС свободным краем намёта мозжечка ППМС, ЛПМС, КорС Петли ОС, КС ОС*, РС и Реже РС и МВ частично КС**, чревные ветви РС*** 0,5 - 3,0 50 100 Сегменты ВМА: ППМС - Передний понтомезенцефалический сегмет; ЛПМС - Латеральный понтомезенцефалический сегмент; ЦМС - Церебелломезенцефалический сегмент; КорС - Корковый сегмент; Стволы ВМА: ОС - Основной ствол; МВ - Маргинальная ветвь; РС - Ростральный ствол; КС Каудальный ствол, * случаи контакта ВМА с намётом мозжечка при высокой бифуркации БА, при БУ < 110°; ** - имеется контакт при широкой вырезки намета мозжечка, больше 32 мм; *** - имеется контакт при длинной ВНМ вырезки намета мозжечка, больше 56 мм. А В Рисунок 46 Анатомический блок-препарат головного мозга на основании черепа с инъецированными латексом артериями и венами, иллюстрирующий топографию ветвей ВМА к намету мозжечка и к тройничному нерву А – Анатомический препарат. Срез на уровне среднего мозга, намет справа отвернут, обнажены кортикальные сегменты ВМА (стрелки), В – Тот же препарат, увеличенный вид Х8. Касание V нерва главным стволом ВМА (зеленая стрелка). 86 Проксимальная часть ВМА располагается медиально по отношению к передней трети свободного края намета мозжечка. ВМА с высоким устьем находится выше уровня свободного края намета мозжечка. Около 20 % ВМА контактировали со свободным краем в передней трети вырезки намета мозжечка. В большинстве случаев – это главный ствол. Латеральный понтомезенцефалический сегмент и формируемые им петли всегда располагались субтенториально на расстоянии от 1 до 5 мм от свободного края намета мозжечка. Ветви ВМА, находящиеся в области церебелломезенцефалической щели, идут книзу и медиально по отношению к задней трети свободного края намета мозжечка. Начальные отделы коркового сегмента ВМА, идущие по верхнему червю в заднем пространстве ВНМ, всегда имели контакт со свободным краем намета мозжечка (рис. 47). А В 4 3 4 2 1 1 2 Рисунок 47 Анатомический блок-препарат головного мозга на основании черепа с инъецированными латексом сосудами, топография сегментов ВМА к намёту мозжечка А – Анатомический препарат ГМ. Срез на уровне среднего мозга, намет слева отвернут, обнажены межножковая, круральная, обводная и квадригеминальная цистерны и сегменты ВМА, В – Тот же препарат, удален ствол головного мозга, червь мозжечка и его петрозальная поверхность, частично удалена тенториальная поверхность мозжечка для демонстрации топографии латерального понтомезенцефалического и церебелломезенцефалического сегмента ВМА, который арахноидальными мембранами связан с притоками вен Галеновой группе. Видно как петля церебелломезенцефалического сегмента ВМА (желтая стрелка) по выходе из одноименной щели, повисла на базальной вене Розенталя, а затем в области верхнего червя перешла в кортикальный сегмент ВМА (зеленая стрелка), Сегменты ВМА: 1 - передний понтомезенцефалический сегмент, 2 - латеральный понтомезенцефалический сегмент, 3 - церебелломезенцефалический сегмент ВМА, 4 - кортикальный сегмент ВМА. Данную топографо-анатомическую особенность строения сегмента ВМА необходимо учитывать при доступах к пинеальному региону или при развитии ростральной дислокации содержимого ЗЧЯ в вырезку мозжечкового намета, где корковый сегмент ВМА ущемляется между дислоцирующимся верхним червем и свободным краем намета мозжечка. 87 3.4 Заключение к главе 3 Анатомическое исследование хирургической анатомии сегментов ВББ проведено на блок-препаратах головного мозга с инъецированным артериальным руслом, что позволило более детально рассмотреть топографию сегментов артерий и их перфорирующих сосудов к ключевым областям основания черепа: кливальной, петрокливальной и сфенопетрокливальной областям, значимых в базальной хирургии. Тип строения задних отделов АКБМ и топография верхушки базилярной артерии Нормальный тип строения задних отделов АКБМ встретился в 48%, гипоплазированный унилатеральный – 16%, билатеральный – 4%. Унилатеральный фетальный тип строения встретился в 20% и билатеральный фетальный – 12%. Положение верхушки БА отмечено на уровне спинки турецкого седла в 36%, выше – 40% и ниже в 24% случаев. Задняя мозговая артерия Диаметр Р1-сегмента ЗМА различается в зависимости от типа строения задних отделов АКБМ. При гипоплазированном унилатеральном типе диаметр Р1-сегмента ЗМА на стороне гипоплазированной ЗСА был всегда толще и составил в среднем 3,17 мм. Диаметр гипоплазированной ЗСА варьировал от 0,5-0,9 мм и был длиннее на 3-4 мм. При билатеральной гипоплазии диаметр Р1-сегмента ЗМА был в среднем 4,1 мм. При унилатеральном фетальном типе строения диаметр Р1-сегмента ЗМА в среднем составил 1,6 мм. Диаметр ЗСА был 2,3-3,4 мм. При билатеральном фетальном типе строения диаметр Р1сегмента ЗМА составил в среднем 1,63 мм с диаметром ЗСА 2,4-3,5 мм. При фетальной конфигурации III нерв лежит медиально ЗСА, находясь либо ниже либо на уровне ЗСА и Р1сегмента ЗМА. В исследовании выделены 3 типа строения проксимальной би-(три)фуркации ЗМА. В 60% (1 и 2 типы) бифуркация находится в обводной цистерне, сразу за крючком гиппокампа между ножкой мозга и латеральным коленчатым телом. При исследовании перфорирующих артерий, выявлено, что ЗСА отдает на своем протяжении в среднем до 8 перфорирующих артерий, прободающих парамедианную и заднюю перфорирующие субстанции. Их диаметр составил 0,05-0,5 мм с длиной до 19 мм. Наибольшее количество сосудов отходит от средней трети ЗСА и Р1-сегмента ЗМА, которые в 90% имеют «пучковый» тип строения. Задние таламоперфорирующие артерии отходили от задневерхней стенки Р1-сегмента ЗМА с диаметром в среднем 0,3 мм и длиной 4-12 мм. От задней и латеральной поверхностей дистальной трети БА отходили до 18 коротких огибающих перфорирующих артерий, диаметром до 0,5 мм. Таламоколенчатые артерии отходили в 15% наблюдений от Р2А, в 80 % - от Р2Р и в 5 % - от Р3 сегментов ЗМА в количестве 3-8. В 50% 88 аa.thalamogeniculatae и задние латеральные хороидальные артерии отходили общим стволом от бифуркации ЗМА. В 90% наблюдений аa. pedunculoperforatae отходят в количестве 2-11 артерий (в среднем 6) от Р2А-сегмента ЗМА. Устья длинных огибающих четверохолмных артерий в 75% были в области Р1 -сегмента ЗМА и только в 25% в области Р2А-сегмента ЗМА. Локализация устьев задних медиальных ворсинчатых артерий (ЗМВА) зависела от типа строения задних отделов АКБМ. При нормальном типе наибольший процент (43%) локализации устьев ЗМВА был в области Р2А-сегмента ЗМА, в 35,7% ЗМВА исходили от Р2Р, в 35,7% от Р3-сегмента ЗМА и только в 7% от Р1-сегмента ЗМА. Две ЗМВА были обнаружены в этом типе в 21,4% случаев, часто было сочетание двух Р3 или двух Р2Р-сегментов ЗМА. При гипоплазированном и фетальном типах строения отмечалось возрастание числа случаев локализации устьев ЗМВА от Р2А (до 56%), а также возрастание случаев локализации устьев ЗМВА в области Р1-сегмента ЗМА (до 31%, в фетальном типе). При фетальном типе строения Р1-сегмент ЗМА является источником ЗМВА, которые при этом типе в 12,5% могут быть удвоенными. В 65% случаев локализация устьев задних латеральные ворсинчатых артерии (ЗЛВА) был основной ствол ЗМА и в 35% другие источники. В проведенном исследовании изменчивости корковых ветвей ЗМА выделено четыре типа ангиоархитектоники, отличающихся наличием передней нижней височной артерии и добавочных артерий. Верхняя мозжечковая артерия В исследовании проведены измерения рострального каудального, главного стволов и маргинальных ветвей ВМА. Дупликатура ВМА встретилась в 22%. Устье ВМА в 94% располагалось в области верхушки БА, в 6% - на Р1-сегменте ЗМА над III нервом. Расположение устья и переднего понтомезенцефалического сегмента ВМА зависит от расположения верхушки БА относительно спинки турецкого седла, коррелирующее в свою очередь с черепными показателями (черепной индекс, угловые показатели рельефа основания черепа – угол схождения пирамид, базилярный угол). Установлено, что ВМА образует три типа ветвления, отличающиеся характером расположения основных стволов и регионами кровоснабжения. Выявлено, что перфорирующие ветви отходят как от основного ствола ВМА, так и от ростральной и кудальной частей латерального понтомезенцефалического сегмента ВМА. В 1\3 исследованных гемисфер проксимальная часть ВМА формировала мелкие сосуды, идущие в межножковую ямку вместе с aa. thalamoperforatаe от базилярной артерии и ЗМА. В исследовании описаны варианты положения петель ВМА относительно черепных нервов и свободного края намета мозжечка в области переднего инцизурального пространства вырезки намёта мозжечка. 89 ГЛАВА 4 РАСШИРЕННЫЕ БАЗАЛЬНЫЕ ДОСТУПЫ В ХИРУРГИИ СЛОЖНЫХ ТРУДНОДОСТУПНЫХ АНЕВРИЗМ ГОЛОВНОГО МОЗГА 4.1 Инфратемпоральный орбитозигоматический доступ (анатомическое обоснование) 4.1.1 Общая характеристика анатомического материала Анатомическое исследование проводили на 30 трупах, из которых 25 составили нефиксированные головы умерших от соматической патологии без патологии центральной нервной системы и 5 бальзамированные головы трупов. На всех анатомических препаратах моделировали орбитозигоматический доступ (ОЗД), оценивали нейроваскулярные взаимоотношения в подвисочной ямке, рельеф средней и передней черепных ямок (СЧЯ и ПЧЯ), конфигурацию глазницы. Определяли размеры наружной и внутренней апертур хирургической раны. При выполнении транскавернозных и транспетрозальных вариантов ОЗД для визуализации труднодоступных отделов внутренней сонной артерии (ВСА) в исследовании ставили задачу оценки базального осмотра сегментов АКБМ, которые включали: 1. А1-сегмент передней мозговой (ПМА) и передней соединительной артерии (ПСА); 2. Клиноидный сегмент внутренней сонной артерии (ВСА); 3. Верхушка базилярной артерии (БА), устья задней мозговой (ЗМА) и верхней мозжечковой артерий (ВМА); 4. Устье передней нижней мозжечковой артерии (ПНМА) из расширенных вариантов ОЗД (комбинированные орбитозигоматические \ петрозальные доступы). Доступы проводили на анатомических препаратах c использованием стандартного набора нейрохирургических инструментов, операционного микроскопа и высокоскоростного нейрохирургического костного бора. Микрохирургическую анатомию моделируемых доступов изучали с использованием операционного микроскопа МБС-10 и цифровой видеокамеры «Sony» HDR - CX 560 Е. Фотографии этапов ОЗД делали с 2-8 кратным увеличением. 4.1.2 Оценка параметров операционной раны Оценка параметров операционной раны из орбитозигоматического доступа проводилась путем измерения: 90 1. Проекционного угла (ПУ), определяющего доступность хирургической мишени и зависящего от выраженности зон перекрытия осмотра (латеральная стенка и крыша орбиты, дно средней черепной ямки и скуловая дуга, наклоненные отростки, зрительная распорка, спинка турецкого седла). Проекционный угол влиял на величину тракции ГМ. 2. Вертикального и горизонтального операционных углов осмотра сегментов АКБМ из сформированных хирургических промежутков (транскавернозного, трансклиноидного, транспетрозального) в зоне резекции костей основания черепа. Увеличения углов оценивали путем возможности отклонять операционную ось в зону отсутствующего орбитозигоматического комплекса в область подвисочной и крыловидно-нёбной ямок до бугра верхней челюсти и осуществление дополнительного объема осмотра сегментов АКБМ со стороны подвисочной ямки (инфратемпоральный осмотр). 3. Глубины раны, расстояние от самой удаленной точки, центрированной на интересующем сегменте АКБМ до границ костной резекции (рис. 48). Рисунок 48 Схема параметров операционной раны А – Проекционный угол на клиноидный сегмент ВСА. Обзор С5 ВСА перекрывает крыша орбиты и передний наклоненный отросток, В и С – Проекционный угол на латеральные отделы кавернозного синуса. Зона обзора перекрыта скуловой дугой (зеленая прямая стрелка) и латеральными отделами дна СЧЯ (фиолетовая изогнутая стрелка). ОЗД уменьшает проекционный угол и тракцию ГМ, позволяет увеличить вертикальные операционные углы (голубые изогнутые стрелки). Горизонтальный угол – зеленая изогнутая стрелка, проекционные углы – красные изогнутые стрелки, глубина раны – лиловые прямые стрелки, глубина раны: 1 – при подвисочных доступах, 2 – при зигоматических доступах, 3 – при ОЗД с резекцией дна СЧЯ. Исследовали объём и ракурс (снизу, спереди, сзади, сбоку, сверху) обнажения сегмента АКБМ и цистерн основания черепа в создаваемом хирургическом пространстве из вариантов ОЗД, птерионального доступа (ПТД), подвисочного доступа (ПВД). 91 4.1.3 Общая характеристика орбитозигоматического доступа С помощью OЗД появляется возможность открывать структуры ПЧЯ, СЧЯ, верхних отделов ската, крыловидно-нёбной и подвисочной ямок, пре- и постстилоидной частей окологлоточного пространства, передних отделов ярёмного отверстия. Орбитозигоматический доступ считается вариантом инфратемпоральных доступов и в сосудистой нейрохирургии позволяет визуализировать сегменты каротидного и вертебробазилярного бассейнов, структур верхнего и среднего ската. Для выхода к центральным отделам основания черепа ОЗД можно использовать самостоятельно либо сочетать с транскавернозными доступами для подхода к отделам параселлярной ВСА, петлям ВСА, межножковой цистерне, верхушке БА спереди, либо использовать ОЗД с транспетрозальными доступами для подхода к С2-С4 сегментам ВСА, верхушке БА сбоку, Р1- и Р2-сегментам ЗМА, ВМА, вентральному мосту, устью ПНМА, скату, препонтинной и церебеллопонтинной цистернам сбоку снизу и сзади (рис. 49). А В 3 1 2 Рисунок 49 Орбитозигоматический доступ – анатомо-топографические аспекты А – Основание черепа сверху, орбитозигоматический костный блок удален. Показаны три ключевых направления хирургических действий возможных из ОЗД: птериональное (синяя стрелка), петрозальное (зеленая стрелка), инфратемпоральное (красная стрелка), В – Основание черепа с инъецированными латексом сосудами. Периметры охвата сегментов АКБМ из базальных доступов: 1 – ОЗД с резекцией дна СЧЯ с птериональным и смешанным направлением осмотра, доступны осмотру сегменты передних отделов АКБМ; пре-ретрокаротидно осматривают верхушку БА, Р1ЗМА, устье ВМА; транссильвиевый трансхороидальный доступ обеспечивает подход к Р1, Р2ЗМА, ВМА; 2 – комбинированные транспетрозальные доступы выполняемые из ОЗД обеспечивают обзор: С2ВСА, С3ВСА, доступны дистальные сегменты задних отделов АКБМ; 3 – транскавернозные доступы обеспечивают обзор: С4ВСА, С5ВСА, верхушки БА, верхней и средней трети БА, устья ЗМА, ВМА, ПНМА. Орбитозигоматический доступ – это базальный доступ смешанного птерионального, петрозального и инфратемпорального направлений с мультилинейным осмотром параселлярного региона, верхнего ската, цистерн основания начиная от субкаллезного поля и хиазмальной цистерны до межножковой, ножковой, препонтинной, церебеллопонтинной и 92 обводной цистерн. Доступ позволяет менять операционные углы при осмотре крыши, задних и латеральных отделов кавернозного синуса, глазодвигательного треугольника и сегментов АКБМ от птерионального направления доступа с субфронтальной тракцией, претемпорального транссильвиевого (трансункальные или транслиминальные трансхороидальные варианты) или из вариантов комбинированных петрозальных резекций с вариантами подвисочных тракций. Верхушка БА доступна осмотру между III нервом и супраклиноидным отделом ВСА при птериональном осмотре, при подвисочном осмотре базилярная артерия доступна между медиобазальными отделами височной доли, III нервом и Р1-сегментом ЗМА. ОЗД обеспечивает широкую и многоосевую геометрию операционного поля с базальным осмотром сегментов АКБМ. Резекция латерального края орбиты обеспечивает подход к структурам подвисочной и крыловидно-нёбной ямок. Структуры ПЧЯ и параселлярная область визуализируются снизу, спереди, сбоку. Представлен базальный осмотр хиазмы, А1- и А2-сегментов ПМА, ПСА, оптикокаротидного и ретрокаротидного треугольников. Отсутствие латерального края орбиты и скуловой дуги дает возможность осмотреть ретроселлярную область и межножковую ямку. В варианте, где ОЗД комбинируют с вариантами петрозальных резекций, отсутствие орбитозигоматического комплекса, дна СЧЯ и височно-нижнечелюстного сустава позволяет максимально базально подойти к зонам ската, мосто-мозжечковому углу, артериальным сегментам ВББ. 4.1.4 Анатомическое обоснование применения орбитозигоматического доступа в хирургии труднодоступных церебральных артериальных аневризм Для анатомического обоснования применения ОЗД в хирургии АА ГМ мы выбрали 4 хирургические цели-мишени: комплекс А1-ПСА, клиноидный сегмент ВСА, верхушка БА и устье ПНМА. Комплекс А1-ПСА Выбор А1-ПСА для демонстрации преимуществ базального осмотра из ОЗД обусловлен медиальным расположением ПСА в проекции базальных отделов межполушарной щели и субкаллезного поля с зоной перекрытия оси осмотра орбитосфеноидом и прямой извилиной. При клипировании больших и гигантских АА А1-ПСА с передневерхним расположением купола аневризмы необходимо увеличить каудальный угол обзора, что позволяет хорошо визуализировать ПСА, А2-сегмент ПМА и шейку АА. Это имеет значение при резко ограниченном осмотре на фоне базального САК или при высоком расположении комплекса А1-ПСА. При использовании ОЗД отмечается увеличение вертикальных углов осмотра за счет резекции латеральной стенки орбиты (рис. 50). 93 1 11 12 10 13 2 14 14 5 15 9 6 18 18 20 4 8 19 7 7 17 16 3 Рисунок 50 Анатомический препарат - обзор А1-ПСА из ОЗД. Вид комплекса А1-ПСА-хиазма из ОЗД (передненижний обзор). 1 – зоны резекции крыши орбиты и скелетирования верхней глазничной щели, 2 – правая ВСА, 3 – правый М1-сегмент СМА, 4 – Р2Асегмент ЗМА, 5 – ВМА, 6 – А1-сегмент ПМА и передненижние диэнцефальные артерии, 7 – возвратные и переднемедиальные стриарные артерии (стрелка), 8 – соединение ПСА и правой А2-сегмент ПМА, 9 – орбитофронтальные артерии, 10 – правый II нерв, 11 – левая ВСА, 12 - левый II нерв, 13 – бифуркация левой ВСА; 14 – левый А1-сегмент ПМА; 15 – прозрачная перегородка; 16 – полюс височной доли, 17 – передняя и глубокая вены мозга (стриарный сегмент вены Розенталя), 18 – прямая извилина, 19 – передняя ворсинчатая артерия, 20 - III нерв. В таблице 16 представлены угловые параметры осмотра А1-ПСА из ОЗД в сравнении с углами доступности из пртерионального доступа. Таблица 16 Сравнение операционных углов из доступов к А1-сегменту ПМА и ПСА Вид хирургического доступа птериональный доступ орбитозигоматический доступ Углы доступности, в градусах Глубина раны, мм Вертикальный 12,5±3,5 (max 16) Горизонтальный 40±9,5 (max 49,5) 52-69 29,5±8,5 (max 38) 63±11,5 (max 74,5) 54-41 Сторона осмотра А1-ПСА Сверху сбоку Снизу спереди Проекционный угол на А1-ПСА – угол недоступного обзора хирургической цели со сторонами, располагающимися выше и ниже препятствия при ПТД, варьировал от 17-24,5° (в среднем 20), проекционный угол при ОЗД составил 5-12° (в среднем 9). Отмечено, что основной зоной костного перекрытия обзора были крыша и латеральная стенка орбиты. Клиноидный сегмент ВСА Доступ к С5 сегменту ВСА требует резекции переднего наклоненного отростка (ПНО), зрительной распорки, рассечении каротидных колец, каротидно- 94 окуломоторной мембраны, каротидного чехла, мобилизации устья глазной артерии, диссекции мембранного комплекса вокруг ВСА и соединительно-тканных границ венозных пространств в области крыши и латеральной стенки кавернозного синуса. Ось ОЗД проходит от латерального края глазницы, верхней глазничной щели по ПНО, резекция орбитозигоматического комплекса сразу переходит в резекцию малого крыла, его нижнего корешка (анатомически представленного зрительной распоркой), переднего наклоненного отростка и крыши зрительного канала. Рассечение дистального кольца (ДК) и мобилизация С5ВСА являются ключевыми и наиболее ответственными этапами трансклиноидных доступов (рис. 51). А В 20 17 2 1 16 19 18 6 3 18 4 10 5 7 11 11 6 9 16 8 19 14 15 20 13 15 17 12 Рисунок 51 Анатомические препараты - обзор С5 ВСА из ОЗД А – Вид параклиноидного региона из ОЗД после клиноидэктоми. Рассечены серповидная связка, зрительный чехол, дистальное кольцо, каротидно-окуломоторная мембрана и часть связочного аппарата намета мозжечка (передняя интерклиноидная связка, менинго-периорбитальная связка) для мобилизации клиноидного сегмента ВСА, В – Другой анатомический препарат. Проведена клиноидэктомия, вскрытие крыши зрительного канала. Рассечение серповидной связки и дистального кольца заметно расширяет оптикокаротидный треугольник и доступ к верхушке БА (стрелка). 1 – зрительный чехол, 2 – серповидная связка, 3 – левый зрительный нерв, 4 – правый зрительный нерв, 5 – левая ВСА, 6 – хиазма, 7 – А2-сегмент правой ПМА, 8 – А1-сегмент правой ПМА, 9 – ранняя височная ветвь М1-сегмента правой СМА, 10 – супраклиноидный отдел правой ВСА, 11 – верхушка БА, 12 – задняя петля правой С2ВСА, 13 – Грубера связка, 14 – Гассеров узел, 15 – М2-сегмент правой СМА, 16 – устье правой глазной артерии, находящееся на уровне дистального кольца, 17 – С5-сегмент правой ВСА, 18 – дистальное кольцо, 19 – латеральная стенка кавернозного синуса, 20 – верхняя глазничная щель. При клипировании АА каротидной полости необходим низкий подход к заднемедиальному сектору дистального кольца в области каротидного треугольника Umansky. Резекция ПНО и подход к каротидной полости через клиноидный треугольник Dolenc, клиноидные пространства обеспечивают мобилизацию передних отделов С5ВСА от зрительной 95 распорки и заднемедиальных отделов С5ВСА от каротидной борозды и сфеноидной части медиальной стенки кавернозного синуса (рис. 52). Орбитозигоматический доступ обеспечивает возможность низкого осмотра для острой диссекции дистального кольца от серповидной связки, интерклиноидной связки и мембран кавернозного синуса, ограничивающих медиальное и передненижнее венозные поля, сохраняя каротидный чехол и каротидно-окуломоторную мембрану интактными. Дистальное кольцо оставляют на адвентиции ВСА в виде манжетки, что сохраняет целостность венозных лакун кавернозного синуса и вен клиноидного сплетения. В А II 10 1 13 11 15 9 15 5 6 18 2 24 4 16 8 7 20 19 3 28 1 18 12 3 V1 14 V3 22 17 20 4 21 25 8 V2 26 27 23 Рисунок 52 Анатомические препараты - топография клиноидного сегмента ВСА А – Удалены наклоненные отростки, вскрыт кавернозный синус. Выделены интракраниальные отделы ВСА и каротидные кольца. Глазодвигательный нерв с мембранами, ограничивающими окуломоторную цистерну, выделен из верхней глазничной щели и латеральной стенки кавернозного синуса и отведён кзади, В – Положение С5 ВСА, каротидных колец, устья глазной артерии относительно сегментов АКБМ. 1 – глазная артерия, 2 – зрительный чехол, 3 – дистальное кольцо, 4 – проксимальное кольцо, 5 – Грубера связка, 6 – передняя петля ВСА, 7 – медиальная петля ВСА, 8 – кавернозный сегмент ВСА, 9 – верхушка базилярной артерии, 10 – межножковая ямка и таламоперфорирующие артерии, 11 – спинка турецкого седла, 12 – III нерв (отведен), 13 – С6-сегмент ВСА, 14 – Гассеров узел, 15 – задневерхнее венозное поле, 16 – передненижнее венозное поле, 17 – латеральное венозное поле, 18 - медиальное венозное поле, 19 – ПМА, 20 – СМА, 21 – ЗМА, 22 – ВМА, 23 – ствол БА, 24 – передняя ворсинчатая артерия, 25 – проксимальная бифуркация ЗМА, 26 – мост, 27 – мозжечок, 28 – ЗСА. В таблице 17 представлены угловые параметры осмотра С5 ВСА и дистального кольца из ОЗД с передней клиноидэктомией. Проекционный угол на С5 при ПТД варьировал от 22-28,5° (в среднем 24,5), проекционный угол при ОЗД составил 4-7° (в среднем 5,5). Обзор клиноидного сегмента закрывали зрительная распорка, крыша и латеральная стенка орбиты из ОЗД птерионального направления, и скуловая дуга, нижнемедиальные отделы верхней глазничной щели и Lateral Loop из ОЗД смешанного инфратемпорального направления. 96 Таблица 17 Сравнение операционных углов из доступов к клиноидному сегменту ВСА Вид хирургического доступа птериональный доступ с передней клиноидэктомией орбитозигоматический доступ с передней клиноидэктомией Углы доступности, в градусах Вертикальный Горизонтальный Глубина раны, мм 19,5±4,5 (max 24) 30±3,5 (max 33,5) 55-40 47,5±4,5 (max 52)* 61,5±3 (max 64,5)** 76,5±3,5 (max 80)*** 48±32,5 (max 80,5) 30-18 Сторона осмотра дистального кольца Сверху сбоку Спереди, сбоку, снизу * птериональное направление (центрирование на дистальное кольцо); ** темпорополярное смешанное направление (центрирование на проксимальное кольцо и треугольник Mullan); *** претемпоральный транссильвиев доступ - отклонение операционной оси до круглого отверстия (центрирование на треугольник Lateral Loop). Орбитозигоматический доступ в хирургии АА верхушки базилярной артерии Выбор ОЗД к верхушке БА обусловлен глубоким расположением БА, часто за спинкой турецкого седла и задним наклоненным отростком, что требует низкого подхода для диссекции АА от устьев ЗМА и ВМА, таламоперфорирующих артерий, III нерва и ЗНО (табл. 18). Таблица 18 Сравнение операционных углов из доступов к верхушке базилярной артерии Вид хирургического доступа птериональный доступ подвисочный доступ 9-13 10-15 Глубина раны, мм 69-53 15-21 18-25 64-55 22-28 50-42 35-42 37-32 28-36 (промежуток между V и VII+ VII); 35-40 (промежуток между III и IV); 50-65 (рассечение намёта мозжечка) 35-22 95-135 30-18 Углы доступности, в градусах Вертикальный 17-22 орбитозигоматический доступ * 25-35 орбитозигоматический транскавернозный доступ ** 23-30 (промежуток орбитозигоматический между V и С2 ВСА); доступ с передней 38-45 (хирургический петрозэктомией*** промежуток между IV и V) расширенный ОЗД с транспозицией С2ВСА **** 60-85 Горизонтальный * ретрокаротидное птериональное направление; ** птериональное направление через расширенный каротидно-окуломоторный хирургический промежуток (доступ по E.R. Seoane, 2000 [227], N. Sanai, 2008 [218]); *** подвисочное направление;**** смешанное (птериональное, инфра-темпоральное и подвисочное) направление ОЗД. 97 Орбитозигоматический доступ в хирургии АА передней нижней мозжечковой артерии Выбор устья ПНМА для оценки угловых параметров осмотра из ОЗД обусловлен сложностью подхода и клипирования АА ПНМА. Наряду с другими доступами (ретросигмовидные, крайне латеральные транскондилярные доступы, доступы Kawase, транспетрозальные транскохлеарные орбитозигоматический и транскавернозный ретротранслабиринтные доступ варианты обеспечивает доступов) базальный доступ к медиальным отделам ската (рис. 53). А В 11 8 1 V2 23 22 24 ЗМА 9 2 17 7 10 15 15 ПНМА ПА 25 V3 6 3 14 12 19 13 4 26 18 27 20 А1 28 22 16 21 4 5 ЗМА 5 1 2 6 Рисунок 53 Анатомические препараты головного мозга – топография устья ПНМА А – Направления хирургических доступов к устью ПНМА: 1 – орбитозигоматический транскавернозный доступ, 2 – расширенный орбитозигоматический преаурикулярный инфратемпоральный доступ с транспозицией ВСА, 3 – доступ Kawase, 4 – задний пресигмоводный петрозальный доступ, 5 – ретросигмовидный доступ, 6 – крайне латеральные транскондилярный доступ, В – Устье ПНМА из расширенного транскавернозного переднего транспетрозального доступа с транспозицией задней петли ВСА. В претемпоральной тракции исток ПНМА доступен осмотру в треугольнике Fukushima (стрелка). При передней петрозэктомии в треугольнике Kawase, резекции дна средней черепной ямки в треугольнике Glasscock, отведении задней петли каменистого отдела ВСА устье ПНМА доступно осмотру в субтемпоральной тракции между медиобазальными отделами височной доли, рассеченными краями намета и V нервом; со стороны подвисочной ямки устье ПНМА доступен между V, задней петлей отведенной ВСА и акустико-фациальной группой нервов. 1 – устье ПНМА, 2 – ВМА, 3 – ЗМА, 4 – блоковый нерв, 5 – мост, 6 – тройничный нерв, 7 – задняя петроклиноидная связка, 8 – глазодвигательный нерв, 9 – каротидно-окуломоторная мембрана, 10 – кавернозный сегмент ВСА, 11 – клиноидный сегмент ВСА, 12 – офтальмический сегмент ВСА, 13 – коммуникантный сегмент ВСА, 14 – хиазма, 15 – зрительный нерв, 16 – А2 ПМА, 17 – задняя петля каменистого сегмента ВСА, 18 – препонтинная цистерна, 19 – ЗСА, 20 – передняя ворсинчатая артерия, 21 – пирамида височной кости, 22 – угломер, 23 – передняя черепная ямка, 24 – дистальное кольцо, 25 – треугольник Kawase, 26 – треугольник Glasscock, 27 – стол БА, 28 – ПНМА. Орбитозигоматическую резекцию переднелатеральных отделов основания черепа для подхода к устью ПНМА можно сочетать не только с транскавернозными доступами, но и с различными вариантами темпорополярных экстрадуральных, инфратемпоральных и комбинированных транспетрозальных доступов. пераурикулярных 98 Выбор доступа обусловлен анатомической позицией аневризмы к БА, устью ПНМА, скату, каналу Дорелло, заднему наклоненному отростку и свободному краю намета мозжечка. Можно выбрать различную траекторию подхода. Если АА ПНМА лежит высоко, то используют ОЗД с резекцией заднего наклоненного отростка, что позволяет хорошо обнажать среднюю треть ствола базилярной артерии. Подвисочные комбинированные транспетрозальные (транслабиринтные и транскохлеарные) доступы обеспечивают прямой подход к средней трети БА. Сочетание ОЗД с петрозальными доступами дает преимущество в осмотре препонтинной и обводной цистерн, мостомозжечкового угла, устья ПНМА и оценке длины БА для проксимального контроля (табл. 19). Таблица 19 Сравнение операционных углов из доступов к устью ПНМА Вид хирургического доступа орбитозигоматический темпорополярный доступ с задним транскавернозным подходом в треугольниках Hakuba и Fukushima ретросигмовидный доступ задний петрозальный доступ орбитозигоматический доступ с комбинированными транспетрозальными доступами Углы доступности, в градусах Глубина раны, мм Вертикальный Горизонтальный 19-25 14-18 47-52 10-16,5 9-15 63-74 18-25 35-45 36-46 32-43 55-67 22-37 99 4.2 Передний петрозальный доступ (анатомическое обоснование) 4.2.1 Общая характеристика анатомического материала Анатомическое исследование проводили на 30 трупах, из которых 25 составили нефиксированные головы умерших от соматической патологии без патологии центральной нервной системы и 5 бальзамированные головы трупов. На всех головах моделировали передний петрозальный доступ (ППД). ППД выполняли из: 1. орбитозигоматического доступа (ОЗД), 2. подвисочного доступа; 3. расширенного преаурикулярного субтемпорального инфратемпорального орбитозигоматического доступа с транспозицией ВСА. Проводили морфометрию зон резекции верхушки пирамидки височной кости, объем доступности зон ската и петрокливальной щели из ППД у голов с разным черепным индексом. В исследовании ставили задачу оценки базального осмотра верхушки БА, устьев ЗМА и ВМА, верхней зоны ската из ППД. После проведения доступа вскрывали череп, извлекали головной мозг и измеряли угловые параметры основания черепа. Оценивали рельеф дна средней черепной ямки (выраженность узурации и прилегание твердой мозговой оболочки к кости), топографию ВСА по отношению к передней грани пирамидки височной кости и верхнему каменистому синусу, V2 и V3 корешкам тройничного нерва, борозде большого каменистого нерва. Измеряли толщину крыши внутреннего слухового прохода (ВСП), расстояние между корешками V и акустико-фациальной группой нервов. Доступ проводили на трупах и отсеченных головах, путем использования стандартного нейрохирургического инструмента, операционного микроскопа и высокоскоростного нейрохирургического костного бора. Микрохирургическую анатомию моделируемых доступов изучали с использованием операционного микроскопа МБС10 и цифровой видеокамеры «Sony» HDR-CX 560 Е. Фотографии этапов ППД делали с 2-8 кратным увеличением. 4.2.2 Оценка параметров операционной раны Оценка параметров операционной раны из ППД проводилась путем измерения: 1. На экстрадуральном этапе доступа измерялись размеры резецированного бором костного окна в треугольнике Kawase и крыши ВСП; Измерялись размеры обнаженной ТМО верхних и средних отделов ската. 2. На интрадуральном этапе ППД измеряли горизонтальный и вертикальный операционные углы. 100 3. Оценка глубины раны проводилась путем измерений расстояния от самой удаленной точки, центрированной на интересующем участке задних отделов АКБМ до границ базальной резекции. Исследовали объем и ракурс (снизу, спереди, сзади, сбоку, сверху) обнажения интересующего сегмента задних отделов АКБМ и цистерн основания черепа при ППД, выполненным из орбитозигоматического доступа, подвисочного доступа и из расширенного преаурикулярного переднего транспетрозального доступа с транспозицией ВСА у черепов с разными краниометрическими характеристиками. 4.2.3 Общая характеристика переднего петрозального доступа Передний петрозальный доступ (ППД) направлен сверху через переднюю поверхность каменистой части височной кости, образующую передние отделы дна СЧЯ и медиально от каменистого отдела ВСА (рис. 54 и 55). Как правило, ППД выполняется из подвисочного доступа, однако ППД можно комбинировать с орбитозигоматическим доступом, позволяющим наиболее широко обнажать структуры кливальной области и мосто-мозжечкового угла спереди, сбоку и сверху, а при рассечении кливальной ТМО и намета - сзади и снизу, отклоняя оперативную ось в зону подвисочной и крыловидно-нёбной ямок [224]. А В 6 3 1 11 15 14 2 8 3 2 1 7 5 4 12 10 9 13 С 4 Рисунок 54 Анатомические препараты основания черепа и схема переднего петрозального доступа (ППД) А – Границы треугольника Kawase (пунктир), В – Топография корешков тройничного нерва к треугольникам кавернозного синуса и дна СЧЯ, С – Схема резекции верхушки пирамиды височной кости и направление ППД (стрелка). 1 – большой каменистый нерв , 2 – лицевой ганглий (вскрыт), 3 – корешок V3, 4 – дугообразное возвышение, 5 – верхний каменистый синус, 6 – средняя оболочечная артерия, 7 – крыша внутреннего слухового прохода, 8 – треугольник Dolenc, 9 – треугольник Hakuba, 10 – глазодвигательный треугольник, 11 – треугольник Glasscock, 12 – треугольник Kawasе, 13 – пре- и постмеатальные треугольники Day-Fukushima, 14 – треугольник Mullan, 15 – треугольник Lateral Loop. 101 А В С 5 5 3 2 1 2 4 D E F 15 5 20 11 14 6 7 9 9 7 4 18 7 5 16 8 8 12 17 13 2 10 19 Рисунок 55 Анатомические препараты - моделирование переднего петрозального доступа (ППД) А – Экстрадуральный этап ППД. Отслоение ТМО от дна СЧЯ, обнажены латеральные границы треугольника Kawase, В – Резекции верхушки пирамиды височной кости и крыши внутреннего слухового прохода из ОЗД. Вскрыта периорбита (стрелка), микродиссектор установлен на вскрытый каротидный канал, С – тот же препарат, увеличенный вид (Х10), диссектор установлен на горизонтальный отдел каменистого сегмента ВСА. Обнажена ТМО петрокливальной области (стрелка), D – Увеличенный вид (Х10), диссектор установлен на меатальную ТМО (вскрыт треугольник DayFukushima), горизонтальный отдел каменистого сегмента ВСА, Е – Интрадуральный этап ППД, вскрыта лобно-височная ТМО и ТМО внутреннего слухового прохода, пересечен верхний каменистый синус, ТМО ската не вскрыта, свободно провисает. Обнажена боковая поверхность моста, V и VII+VIII нервы. Стрелкой обозначен ключевой микрохирургический промежуток (между V и VII+VIII нервами) к I зоне ската из ППД, F – Общий вид анатомического препарата после вскрытия черепа. Штрихом обозначена зона резекции. Стрелкой показано направление в область ската. 1 – большой каменистый нерв, 2 – корешок V3, 3 – дугообразное возвышение, 4 – средняя оболочечная артерия, 5 – ВСА, 6 – ТМО внутреннего слухового прохода, 7 – ТМО петрокливальной области, 8 – акустико-фациальная группа нервов, 9 – тройничный нерв, 10 – маргинальная ветвь ВМА, 11 – медиобазальные отделы височной доли, 12 – тенториальная поверхность мозжечка, 13 – средний мозг, 14 – глазодвигательный нерв, 15 – блоковый нерв, 16 – мамиллярные тела, 17 – межножковая ямка с верхушкой БА, 18 – Р2-сегмент ЗМА, 19 – намёт мозжечка отвернут, 20 – хиазма. Выполняя петрозальную резекцию из орбитозигоматического преаурикулярного инфратемпорального доступа с транспозицией ВСА осмотру становится доступна кливальная область со стороны СЧЯ - сверху и сбоку, и со стороны подвисочной ямки - снизу и сбоку. В таком базальном варианте передней петрозэктомии доступны обзору медиальные отделы среднего и нижнего ската, БА, устья ЗМА, ВМА, ПНМА, в расширенных вариантах (доступ Kawase дополненный резекцией дна СЧЯ, темпоромандибулярного сочленения, резекцией кости в треугольнике Glasscock с транспозицией каменистой части ВСА) обеспечивает доступ к стволу БА, вертебробазилярному сочленению вертебральной артерии с устьем ЗНМА, среднему 102 и нижнему скату (рис. 56). Глубина раны при осмотре ската со стороны подвисочной ямки небольшая, что позволяет менять углы зрения. Доступ позволяет осмотреть структуры межножковой, ножковой, обводной, церебеллопонтинной, препонтинной и премедулярной цистерн. ППД в преаурикулярном подвисочном варианте является передним доступом на foramen jugulare и каротидный канал, позволяя работать на пост- и престилоидных отделах окологлоточного пространства с хорошим обзором нервов каудальной группы, колец цервикальной ВСА (С1), яремной вены и луковицы, стилоидного отдела VII нерва. Доступ можно комбинировать с «Far-lateral approach» в супра- и транскондилярных вариантах с вариантами петрозальных резекций (от мастоидэктомии до транслабиринтного транскохлеарного доступа), обеспечивая дополнительный осмотр БА, вентральной поверхности ствола ГМ и медиальных отделов ската со стороны ЗЧЯ, подвисочной ямки, шеи. А 2 В 2 1 1 3 Рисунок 56 Анатомические препараты - моделирование преаурикулярного расширенного орбитозигоматического инфратемпорального петрозального доступа с транспозицией задней петли ВСА, секционный зал А – Резекция орбитозигоматического комплекса (стрелка 1), резекция дна СЧЯ в треугольниках Kawase и Glasscock, резекция темпоромандибулярного сочленения (стрелка 2), выделение задней петли каменистого сегмента ВСА. При отведении ВСА кпереди обнажается ТМО средней зоны ската (стрелка 3), В – Основание черепа после расширенного орбитозигоматического транспетрозального доступа. Стрелкой указан выделенный из каротидного канала каменистый сегмент ВСА. 1 – треугольник Kawase, 2 – треугольник Glasscock. 4.2.4 Анатомическое обоснование применения переднего петрозального доступа в хирургии труднодоступных церебральных артериальных аневризм В исследовании поставлена задача, показать влияние анатомических особенностей строения основания черепа на объём осмотра БА, проксимальных сегментов ЗМА и ВМА, зон ската и петрокливальной щели из ППД у голов трупов, включающих крайние формы строения 103 черепа. В исследовании из 30 голов 21 были мезоцефалами. Из них выделены суббрахицефальные и субдолихоцефальные головы, в количестве 7 и 14 голов трупов, соответственно. Из суббрахикранных голов трем проведен расширенный ППД с резекцией верхушки пирамиды височной кости, крыши ВСП, дна СЧЯ с транспозицией ВСА. Состав материала отражен в таблице 20. Таблица 20 Морфометрические характеристики черепа Форма черепа Долихоцефалия Брахицефалия Мезоцефалия субдолихокран суббрахикран Базиляр Угол Глубина ный схождения ската, угол,° пирамид,° мм 130 105 90 135 115-125 103-110 15-18 5-8 90-110 110-120 10-15 8-10 Глубина СЧЯ, мм Черепной индекс 10-12 > 22 Менее 0,69 Более 0,75 0,7 - 0,75 0,7 - 0,73 0,73 – 0,75 11-17 15-22 Кол-во трупов [N =30] 2 7 21 12 9 В процессе исследования сравнивалась возможность лучшего подхода к БА, устьям и проксимальным сегментам ЗМА и мозжечковых артерий, петрокливальной области, верхним и средним отделам ската при ППД из различных краниотомий в антропологической серии голов с разными черепными индексами. Манипуляции при ППД ограничены нижнечелюстным нервом (V3), каменистой частью ВСА и ВСП с меатальными сегментами VII и VIII нервов. Расстояние между горизонтальным сегментом каменистой части ВСА и передними отделами ВСП тем больше, чем череп удлиненнее с углом схождения пирамид менее 100°, с большим базилярным углом от 115° до 125° и глубиной СЧЯ не превышающей 10 до 12 мм. Резекция верхушки пирамидки височной кости у такого черепа позволит выйти на структуры мосто-мозжечкового угла, верхним отделам ската к заднелатеральным отделам кавернозного синуса. Отслойка ТМО на экстрадуральном этапе ППД не затруднена, так как узурация СЧЯ не выражена. Протяженность ВСП у долехоцефалов максимальна, достигает 10-14 мм, ориентация V нерва по отношению к акустико-фациальной группе нервов составляет от 45° и более градусов, что в хирургическом отношении обеспечивает адекватные манипуляции между этими нервами с достаточно большим хирургическим промежутком. У субдолихокрана и долихокрана акустико-фациальная группа нервов в ВСП занимает крайнезаднее положение. Крышу ВСП в данном случае можно вскрывать полностью и рассекать меатальную ТМО ВСП непосредственно переходя к рассечению намета и ТМО задней грани пирамиды, не боясь повредить VII и VIII нервы и прилежащие к ним сосуды (петли ПНМА), так как свободная от нервов часть ВСП занимает от 4 до 6,5 мм. Резекция крыши ВСП у долихоцефального черепа 104 проходит легко, так как толщина её небольшая (в нашем исследовании не превышала 4 мм), супрамеатальный бугорок не выражен (рис. 57). В С А Е 1 D 2 1 3 3 4 2 5 6 Рисунок 57 Анатомические препараты и схемы - передняя петрозэктомия и различие размеров зон резекции у голов с разным черепным индексом А – Правая височная кость, вид сверху, границы верхушки пирамиды височной кости, соответствующие треугольнику Kawase обведены штрихом, В и С – Морфометрия зон резекции верхушки пирамиды височной кости и крыши внутреннего слухового прохода. Стрелкой указана петрокливальная ТМО, обнаженная до канала Дорелло на длину 24 мм, D – Основание черепа после ППД, стрелка указана зона резекции, 1 – расстояние между V и VII+VIII нервами по СЧЯ, 2 – расстояние между V и VII+VIII нервами по ЗЧЯ, 3 – глубина резекции, протяженность до нижнего каменистого синуса (или канала Дорелло), Е – схемы размеров передней петрозэктомии в краниологической серии голов с крайними черепными индексами, 1 – схема височной кости с зоной резекции верхушки пирамиды височной кости, 2 – объём резекции у долихоцефала, 3 – череп с окципитопетальной долихокранной формой (чаще мужской череп), 4 - объём резекции у мезоцефала, 5 – объём резекции у брахицефала, 6 – череп с фронтопетальной брахиокранной формой (чаще женский череп). . У брахиоцефалов толщина ВСП достигает 8 мм, его протяженность короче, а расстояние между V и акустико-фациальной группой нервов минимальное, колеблется от 2 до 6 мм, что затрудняет хирургические манипуляции между V и VII,VIII нервами. Чаще у выраженных брахицефалов с ориентацией угла схождения пирамид от 120° до 135°, а также базилярного угла 100-110° встречается глубокая СЧЯ с глубиной более 25 мм. Отмечается выраженная 105 узурация латеральных отделов дна СЧЯ, что затрудняет экстрадуральный подход к треугольнику Kawase или при истонченной и разрывающейся ТМО делает отслойку ТМО невозможной. В таких ситуациях прибегают к интрадуральной резекции верхушки пирамидки височной кости или выбирают другой доступ. У брахицефального черепа расстояние от горизонтального сегмента каменистой части ВСА до верхнего каменистого синуса составляет 5-8 мм, что затрудняет апикальную резекцию (рис. 57, D). При выполнении резекции верхушки пирамиды височной кости и крыши ВСП мы оценивали параметры хирургического пространства с возможностью осмотра I и II зоны ската между V и VII+VIII нервами. После резекции измеряли расстояние между тройничным нервом и акустико-фациальной группой со стороны СЧЯ и это же расстояние со стороны ЗЧЯ (петрокливальная область) (табл. 21). Следует отметить, что у долихоцефала дном раны является VI нерв, а у брахицефала петрокливальная щель и нижний каменистый синус. Глубина ската меньше у брахицефалов, что облегчает подход ко II зоне ската, однако, большой УСП, небольшой промежуток между V и VII+VIII нервами и близкое расположение каменистой части ВСА к верхнему каменистому синусу затрудняют манипуляции. В исследовании на трёх женских брахицефальных головах выполнили расширенный передний транспирамидный доступ с резекцией верхушки пирамиды височной кости, крыши ВСП, резекцией дна СЧЯ латерально от каменистого отдела ВСА в треугольнике Glasscock с транспозицией ВСА. Таблица 21 Морфометрия рельефа СЧЯ и параметры резекции ППД Форма черепа Долихоцефал Брахицефал Мезоцефал Расстояние от ВСА до ВКС, мм 12-13 5-8 10-12 Толщина крыши ВСП, мм 4 5-8,2 4-6 Расстояние м\д V и VII+VIII по СЧЯ, мм 24-25 10-12 14-23 Расстояние м\д V и VII+VIII по ЗЧЯ, мм 15-17 9-11 7-12 ВСА - внутренняя сонная артерия, ВКС - верхний каменистый синус, ВСП - внутренний слуховой проход, СЧЯ - средняя черепная ямка, ЗЧЯ - задняя черепная ямка, м\д - между. 4.2.5 Топография нейроваскулярных структур из переднего петрозального доступа Резекция височной кости в треугольнике Kawase, крыши ВСП, при необходимости лабиринта, преддверья, сосцевидной пещеры, барабанной полости обеспечивает обнажение ТМО ЗЧЯ в верхней петрокливальной области, рассекая её и намет за V нервом доступ обеспечивает обзор структур мосто-мозжечкового угла, вентральных и боковых отделов моста, содержимого ножковой и обводной цистерн, латеральных отделов межножковой цистерны. 106 Доступ обеспечивает верхнебоковой обзор областей верхнего и среднего ската, ограниченный супраклиноидным отделом ВСА, III и V нервами (рис. 58). А В 1 С 15 5 3 2 19 7 1 3 15 20 9 2 4 10 5 6 12 6 11 15 8 23 13 17 7 17 16 13 19 13 14 D 18 E 17 F 1 21 15 21 14 11 11 а 21 22 19 19 в 13 13 14 13 14 Рисунок 58 Анатомические препараты обзора нейроваскулярных структур из переднего петрозального доступа (ППД) А – обзор вентральных отделов моста и препонтинной цистерны. Стрелка на устье ПНМА, В – верхнебоковой осмотр боковых отделов межножковой цистерны, круральной цистерны и препонтинной цистерны. Длина обнаженного ствола БА составляет 12 мм, С – заднебоковой осмотр боковых отделов моста и обводной цистерны, D – стандартные хирургические промежутки осмотра БА при ППД, а – обзор между V и VII+VIII нервами, в – обзор между V и III нервами, Е и F – глазодвигательный нерв удален для оценки положения верхушки БА относительно спинки турецкого седла. Отмечено низкое положение – верхушка БА находится ниже на 4,5 мм. 1 – коммуникантный сегмент ВСА, 2 – ЗСА, 3 – пучки таламоперфорирующих и премамиллярных артерий (ЗСА), 4 – таламоперфорирующие артерии, исходящие из Р1 ЗМА, 5 – Р2А ЗМА, 6 – Р2Р ЗМА, 7 – главный ствол ВМА, 8 – ростральный ствол ВМА, 9 – маргинальная ветвь ВМА, 10 – каудальный ствол ВМА, 11 – верхушка БА, 12 – устье ПНМА, 13 – мост, 14 – тройничный нерв, 15 – глазодвигательный нерв, 16 – стол БА, 17 – отвернутый намет, 18 – мозжечок, 19 – медиобазальные отделы височной доли, 20 – крючок гиппокампа, 21 – спинка турецкого седла, 22 – верхние отделы ската, 23 – средний мозг. Видны верхние отделы петрокливальной щели с нижним каменистым синусом, канал Дорелло с VI парой, отходящим в препонтинной цистерне от переднего отдела понтомедуллярной борозды, верхние и средние отделы БА, устье ПНМА, Р2-сегмент ЗМА, ростральные и каудальные стволы и петли ВМА. Доступен осмотру V нерв от моста до 107 Мекелевой полости. Транспозиция VII нерва обеспечивает подход к вентральным отделам ствола ГМ, стволу БА, к переднему и средним отделам ската. Если ППД выполняется из ОЗД, то межножковая цистерна доступна осмотру из птерионального направления в ретрокаротидном пространстве в транссильвиевом претемпоральном или трансункальном варианте. Резекция орбитозигоматического комплекса обеспечивает увеличения вертикального угла осмотра межножковой ямки. Меняя наклон операционной оси можно осмотреть вентральный мост, Р2 и Р3-сегменты ЗМА, латеральный понтомезенцефалический, церебелломезенцефалический сегменты ВМА, церебеллопонтинную цистерну, петли ПНМА, черепные нервы от II до каудальной группы нервов, кавернозный синус, глазодвигательный треугольник и ипсилатеральные отделы АКБМ. Межножковая цистерна и верхушка БА в подвисочном направлении переднего петрозального доступа доступна между III и V нервами. В исследовании угловых параметров ППД моделировалось два вида ключевых подходов к межножковой цистерне и медиальной поверхности ската. Первый подход включал ППД из ОЗД с транссильвиевым претемпоральным (трансункальным) доступом, обеспечивая смешанное направление осмотра – птериональное (по крылу основной кости), подвисочное (со стороны СЧЯ) и инфратемпоральное (со сторны подвисочной ямки). Артерии ВББ (верхушка БА, Р1-сегмент ЗМА и передний понтомезенцефалический сегмент ВМА) обнажались ретрокаротидно между III и V нервами, обеспечивая передненижний и боковой осмотр межножковой цистерны (рис. 58, А-В). Второй подход включал ППД из трансзигоматического подвисочного доступа к боковым отделам межножковой цистерны. Верхушка БА, Р1- и Р2 сегменты ЗМА, передний и латеральный понтомезенцефалические сегменты ВМА обнажались между медиобазальными отделами височной доли, намётом и задними отделами глазодвигательного треугольника, обеспечивая заднебоковой осмотр межножковой цистерны. Резекции скуловой дуги обеспечивала уменьшение проекционного угла и более базальный осмотр обводной, ножковой и латеральных отделов межножковой цистерн, чем при выполнении передней петрозэктомии из подвисочного доступа (рис. 58,С). Проводились замеры вертикального и горизонтального операционных углов и глубины раны с установкой угломера в зону квадрифуркации БА (табл. 22). Как видно из таблицы ППЭ увеличивает угол обзора БА при всех видах рассматриваемых доступов. Сочетание орбитозигоматической или зигоматической резекций с резекцией верхушки пирамидки височной кости дает многоплановый осмотр верхушки БА (особенно снизу), что важно при диссекции аневризм ВББ с целью идентификации перфорирующих артерий и сохранения их проходимости при клипировании АА верхушки БА. 108 Таблица 22 Сравнение угловых параметров доступов к верхушке базилярной артерии Вид хирургического доступа Углы доступности, в градусах Глубина раны, мм Вертикальный Горизонтальный подвисочный доступ орбитозигоматический доступ подвисочный доступ с передней петрозэктомией орбитозигоматический доступ с передней петрозэктомией орбитозигоматический доступ с передней петрозэктомией, резекцией в треугольнике Glasscock и транспозицией С2ВСА 15-21 17-22 18-30 18-25 22-28 25-35 55-65 42-50 50-60 35-45 35-50 22-35 60-85 95-135 18-30 Сравнение зон осмотра кливального региона (БА, верхний скат, петрокливальное сочленение, мост) из подвисочного доступа и переднего транспетрозального доступа в зоне резекции верхушки пирамиды височной кости приведены в таблице 23. Таблица 23 Сравнение зон осмотра моста и ската из доступов Хирургические доступы Границы осмотра Подвисочный доступ Передний петрозальный доступ Верхняя граница обзора Анатомический барьер Нижняя граница обзора Верхнелатеральные отделы моста Медиобазальные отделы всей височной доли Боковая поверхность моста Анатомический барьер Латеральная граница обзора Височная кость Нижний каменистый синус Боковая поверхность ножки мозга и петрозальная поверхность гемисферы мозжечка Ствол головного мозга и мозжечок Боковая поверхность моста Понтомезенцефалическая щель, Церебелломезенцефалическая щель, боковые отделы тенториальной поверхности гемисферы мозжечка Ствол головного мозга и мозжечок Вентральная поверхность моста, БА с устьем ПНМА Ствол головного мозга, канал Дорелло, VI нерв, петрокливальная щель, верхние отделы ската Анатомический барьер Медиальная граница обзора Анатомический барьер Верхушка пирамидки височной кости Передневентральные и Верхнелатеральные отделы моста Крючок гиппокампа Нижняя поверхность моста до понтомедулярного сочленения, клочок и сосудистое сплетения бокового выворота Люшка, VI нерв и БА 109 Как видно из таблицы 23 ППД в области резецированного костного окна увеличивается обзор структур ската, средних отделов БА, вентральной поверхности моста (рис. 59, С и D). В расширенных преаурикулярных инфратемпоральных вариантах в комбинации с орбитозигоматическим доступом передняя петрозэктомия позволяет наиболее широко обнажать зоны ската, ствол БА и устья мозжечковых артерий, что можно использовать для клипировании труднодоступных АА и реваскуляризирующих операций (рис. 59, А и В). А В 2 3 9 5 1 4 5 1 2 1 С D 7 1 12 7 10 9 11 8 5 7 3 7 5 4 6 8 3 4 Рисунок 59 Анатомические препараты - топографо-анатомические зоны доступности из переднего петрозального доступа А – блок-перпарат на основании черепа с инъецированными латексом сосудами. Стрелкой указано увеличение вертикального угла осмотра за счет уменьшения проекционного угла (резекция в треугольниках Kawase и Glasscock), В – верхнебоковой осмотр межножковой цистерны. В ретромамиллярное пространство установлен угломер. Резекция верхушки пирамиды височной кости увеличивает обзор вентральных и боковых отделов моста (штрих), С – трансзигоматический ППД на фиксированной голове трупа, зона ППЭ отмечена стрелкой. На вставке другой препарат с ППЭ, оценка зоны доступности верхушки БА, D – секционный зал, препарат основания черепа с инъецированными артериями. Резекция в треугольнике Kawase (стрелка) увеличит объем осмотра боковой поверхности моста (штрих). 1 – ВСА, 2 – V нерв, 3 – ВМА, 4 – ЗМА, 5 –вентральные отделы моста, 6 – VII+VIII нервы, 7 – корешок V3 (нижнечелюстной нерв), 8 – верхушка БА, 9 – петрокливальная ТМО, 10 – ствол БА, 11–VI нерв, 12 – корешок V2 (верхнечелюстной нерв). 110 4.3 Задний петрозальный доступ (анатомическое обоснование) 4.3.1 Общая характеристика анатомического материала Анатомическое исследование проводили на 25 нефиксированных головах умерших от соматической патологии людей без патологии центральной нервной системы. На всех головах моделировали задний петрозальный доступ (ЗПД), который выполняли из комбинированного теменно-височного ретро-пресигмовидного доступа. В исследовании ставилась задача оценки базального осмотра средней трети ствола БА с устьем ПНМА из заднего петрозального доступа. После выполнения доступа осуществляли вскрытие черепной коробки и измеряли дистанции между задней стенкой внутреннего слухового прохода, сигмовидным синусом, яремным отверстием, наружным отверстием водопровода преддверия, поддуговой ямкой и границами костной резекции. Исследовали возможности объема резекции сосцевидной части височной кости у черепов с разными краниометрическими характеристиками, измеряли высоту сосцевидного отростка, линейные размеры основания черепа (угол схождения пирамид и базилярный угол) и широтно-продольный показатель исследуемого черепа. Использовали стандартный нейрохирургический инструмент и высокоскоростной нейрохирургический костный бор. Микрохирургическую анатомию моделируемого ЗПД изучали с использованием операционного микроскопа МБС-10 и цифровой видеокамеры «Sony» HDR- CX560 Е. Фотографии делали с 2-8 кратным увеличением. 4.3.2 Оценка параметров операционной раны 1. На экстрадуральном этапе доступа измеряли размеры резецированного бором костного окна в треугольнике Trautman. Измеряли размеры обнаженной ТМО задней поверхности височной кости. 2. На интрадуральном этапе измеряли горизонтальный и вертикальный операционные углы. 3. Оценка глубины раны проводилась путем измерений расстояния от самой удаленной точки, центрированной на устье ПНМА до границ базальной резекции (заднее петрозальное транстенториальное направление). Исследовали объем и ракурс (снизу, спереди, сзади, сбоку, сверху) обнажения ствола БА, устья ПНМА, понтинного и понтомедулярного сегментов ПНМА, цистерн основания черепа при ЗПД у черепов с разными краниометрическими характеристиками. 111 4.3.3 Общая характеристика задних петрозальных доступов Варианты задних петрозальных пресигмовидных доступов отличаются объёмом резекции костных элементов от минимальной мастоидэктомии до расширенной резекции структур костного лабиринта, улитки и верхушки пирамиды височной кости, латеральных отделов основания черепа и орбиты. В этой группе доступов только разрушение структур внутреннего уха с транспозицией лицевого нерва, резекцией верхушки пирамиды височной кости и отведением ВСА обеспечивает широкий подход к сфенопетрокливальному региону и кливальной области. Концепция задних петрозальных доступов - это комбинированный супратранстенториальный подход к скату сзади и сбоку через зону резецированной части височной кости и сверху и сзади через рассеченный намет. Комбинации супра- и субтенториальных доступов (комбинированный височно-затылочный ретро-пресигмовидный доступ или варианты комбинированных орбитозигоматических пресигмовидных петрозальных доступов) позволяют обнажать смежные анатомические структуры СЧЯ, ЗЧЯ и подвисочной ямки. Рассечение пресигмовидной ТМО, верхнего каменистого синуса и намета с тракцией задних отделов височной доли кпереди от дренажа вены Labbe, позволяет мобилизировать синодуральный угол и сигмовидный синус, произвести их смещение кзади, тем самым увеличить угловые параметры осмотра зон ската. Подход к структурам средней зоны ската осуществляется пресигмовидно транстенториально преимущественно с субтемпоральным осмотром. Расширенные варианты доступа обеспечивают дополнительное обнажение зон ската, петрокливальной области, вентральных отделов моста в проекции костной резекции. Пресигмовидный доступ в ретролабиринтной модификации со скелетированием и отведением мастоидного сегмента лицевого нерва увеличивает доступ к зоне верхнего ската и к верхушке пирамиды височной кости. Обзор ещё больше увеличивается при транслабиринтном транскохлеарном доступе. При дополнении доступов апикальной резекцией расширяется обзор медиальных отделов ската, препонтинной цистерны, что невозможно из ретросигмовидного доступа или вариантов лабиринтных резекций. Рассечение намета от задних отделов верхнего каменистого синуса до IV нерва обеспечивает широкий обзор петрокливального региона. Доступны обзору боковые отделы переднего и область всего среднего инцизуральных пространств вырезки намета мозжечка. ЗПД не обеспечивает достаточный осмотр ярёмного отверстия, обзор корешков IX и X и XI нервов перекрывает ярёмная луковица (в отличие от ретросигмовидного доступа, который даёт достаточно хороший обзор цистернальных частей каудальной группы и входа их в ярёмное отверстие), однако в комбинации с последним или с вариантом крайне латеральных транскондилярных доступов ЗПД приобретает их преимущества. Доступ позволяет осмотреть 112 структуры обводной, круральной, латеральных отделов межножковой, препонтинной, церебеллопонтинной и понтомедуллярной цистерн. Обнажаются цистернальные части III и IV нервов на большом протяжении, ветви ЗМА и ВМА, корешок тройничного нерва и вход его в Меккелеву полость. Доступ хорошо обнажает средний нейроваскулярный комплекс и нервы мосто-мозжечкового угла [80,81,130,210,224]. Видна базилярная артерия с устьем ПНМА, канал Дорелло с отводящим нервом. Доступ обеспечивает заднебоковой обзор структур верхнего и среднего ската, от задних отделов глазодвигательного треугольника с местами пенетрации III и IV нервов до каудальной группы нервов (в ретросигмовидном направлении осмотра). 4.3.4 Анатомические аспекты заднего петрозального доступа (модификация) В проведенном исследовании мы решили модифицировать технику выполнения ЗПД с целью уменьшения тракционных повреждений ГМ при клипировании АА и возможностью адекватной санации цистерн основания при разрыаных АА. Представляемый трансмастоидный пресигмовидный доступ направлен сверху и медиально через сосцевидную часть височной кости со стороны СЧЯ, кпереди от сигмовидного синуса и синодурального угла. Сосцевидная часть - это задняя часть височной кости, пневматизация и количество трабекул которой варьирует в широких пределах. Сосцевидная полость расположена кзади и сверху от верхнего края наружного слухового прохода, между ним и передней частью верхней сосцевидной линией. Сосцевидная часть формирует одноименный отросток, служащий местом прикрепления мышечных групп. Внутренняя сторона сосцевидного отростка имеет борозду для сигмовидного синуса, который является задней границей сосцевидной полости и пересекает крышу полости на уровне верхнего каменистого синуса. Книзу сигмовидный синус изгибается медиально и кпереди, направляясь к яремному отверстию, верхняя часть которого соответствует яремной луковице и является нижней границей сосцевидной полости. Верхний каменистый и сигмовидный синусы образуют синодуральный угол, главный ориентир для проведения резекции сосцевидной полости. Медиальной границей сосцевидной полости являются структуры костного лабиринта, содержащего полукружные каналы, улитку и преддверье. Преддверье расположено в центральной части костного лабиринта, латерально внутреннему слуховому проходу (ВСП), медиально тимпанической полости, кзади от улитки и кверху от яремной луковицы. Полукружные каналы расположены сзади и сверху преддверья. Передняя часть латерального семициркулярного канала расположена над тимпаническим сегментом VII нерва и является ориентиром для определения локализации нерва. Задний семициркулярный канал обращен в ЗЧЯ. В проведенном исследовании его передняя часть была расположена кзади от ВСП на расстоянии от 5 до 8 мм (в среднем 6,5). Передний 113 семициркулярный канал обращен в СЧЯ и образует дугообразное возвышение. Задние части переднего и заднего семициркулярных каналов образуют общую ножку, которая открывается в преддверье. Лабиринтный сегмент VII нерва расположен между улиткой и семициркулярными каналами. Тимпанический сегмент VII нерва расположен над овальным окном и под латеральным семициркулярным каналом, на уровне которого тимпанический сегмент переходит в сосцевидный, который в свою очередь поворачивает вертикально вниз и пересекает сосцевидную часть височной кости, выходит через шилососцевидное отверстие. В исследовании поддуговая ямка находилась на расстоянии от 3 до 6 мм (в среднем 4,5) от задней стенки ВСП. Книзу и латерально от ВСП расположено наружное отверстие водопровода преддверия, имеющее косое расположение и открывающееся между листками ТМО на уровне заднего края заднего семициркулярного канала. Это главный ориентир для определения границ резекции, который предупреждает вскрытие заднего семициркулярного канала. В проведенном исследовании расстояние между ВСП и задним краем отверстия водопровода преддверия варьировало от 7 до 14,5 мм (в среднем 8,5) с меньшей протяженностью у черепов с широтнопродольным коэффициентом от 0,80 до 0,88. Расстояние между задним краем отверстия водопровода преддверия и верхним каменистым синусом варьировало от 4,5 до 12,5 мм (в среднем 7,0) с меньшими показателями для черепов с широтно-продольным коэффициентом от 0,70 до 0,75. Кратчайшее расстояние между задним краем отверстия водопровода преддверия и передним краем сигмовидного синуса варьировало от 5,0 до 16,5 мм (в среднем 9,0 мм) с большими показателями для черепов с широтно-продольным коэффициентом от 0,80 до 0,88. Обнаружено, что в области синодурального угла крыша над сигмовидным синусом глубже у черепов брахицефального типа, глубина составила от 14 до 22 мм. Хирургическое пространство, расположенное между верхним каменистым и сигмовидным синусами, яремной луковицей и костным лабиринтом получило название треугольника Trautman. Резекцию кости в этом треугольнике предложено выполнить со стороны СЧЯ. 4.3.5 Анатомическое обоснование применения заднего петрозального доступа в хирургии труднодоступных церебральных артериальных аневризм В нашем исследовании мы ставили задачу оценить возможности осмотра среднего кливального регионов, базилярной артерии с устьем ПНМА из заднего петрозального доступа у голов трупов, включающих крайние формы строения черепа. Женских голов было 15, мужских 10. В исследовании из 25 голов 18 были мезоцефалами. В исследовании крайними формами строения черепной коробки обладали 7 препаратов. В процессе исследования 114 сравнивалась возможность лучшего подхода к средним отделам ската и БА, устью ПНМА, петрокливальной области при ЗПД у голов с разными черепными индексами. 4.3.5.1 Исследование параметров операционной раны заднего петрозального доступа на экстрадуральном этапе операции Обычный ретролабиринтный пресигмовидный доступ направлен через латеральную поверхность сосцевидной части сразу позади наружного слухового прохода. Резекция кости производится в пределах треугольника Trautman (рис.60). А С D 7 8 4 3 В 1 4 Е 1 7 4 3 6 5 9 3 2 5 3 Рисунок 60 Анатомические препараты ЗПД и схемы треугольника Trautman А – Правая височная кость с резекцией сосцевидной части височной кости проведенной со стороны заднелатеральных отделов черепа. Показаны границы стандартного пресигмоводного доступа в треугольнике Trautman (7), В – Схема границ треугольника Trautman, сверху - верхний каменистый синус (1), спереди – мастоидный сегмент VII нерва (2), сзади – сигмовидный синус (3), 4 – VIII нерв, 5 – V нерв, С – Модифицированный пресигмовидный доступ, проведенной со стороны задних отделов дна СЧЯ (9). Параметры треугольника Trautman значительно больше, D – схема резекции (стрелки) при предлагаемом варианте резекции сосцевидной и тимпанической частей височной кости (8), Е – анатомический препарат основания черепа с зоной резекции при модифицированном ЗПД. Стрелкой показано пресигмовидное трансмастоидное направление к каналу Дорелло (6) между корешком тройничного нерва (4) и акустико-фациальной группой нервов (5). По данным A.L.Jr. Rhoton (2006) [210] размеры позволяющие манипулировать в данном промежутке без расширения (дополнительной резекции костного лабиринта и улитки, без транспозиции лицевого нерва) следующие: дистанция между костным лабиринтом и синодуральным углом вдоль верхнего каменистого синуса составляет 8 мм (варьирует от 6 до 9) справа и 7 мм (6-9) слева; дистанция между яремной луковицей и верхним каменистым синусом составляет 14 мм (варьирует от 10 до 19) справа и 16 мм (11 - 21) слева. 115 При проведении мастоидэтомии в предлагаемом варианте ЗПД объём обнаженной твердой мозговой оболочки ЗЧЯ больше, чем в обычно выполняемых доступах. Это обусловлено изменением направления оси резекции, то есть проведения резекции со стороны крыши сосцевидной полости. Сравнения параметров резекции обычного пресигмовидного заднего петрозального доступа и ЗПД в представленной модификации указаны в таблице 24. Таблица 24 Сравнение параметров резекции в треугольнике Trautman Параметры треугольника Trautman Основание треугольника Передняя сторона треугольника Задняя сторона треугольника Медиана треугольника Стандартный ретролабиринтный доступ, мм 6-9 (в среднем 8) справа 6-9 (в среднем 7) слева Модифицированный задний петрозальный доступ, мм 21-34 (в среднем 27) 10-19 (в среднем 14) справа 11-21 (в среднем 16) слева 17-21 (в среднем 18) 22-27 (в среднем 23) 12- 22 (в среднем 16) 4.3.5.2 Исследование параметров операционной раны заднего петрозального доступа на интрадуральном этапе операции После проведения экстрадуральной костной части доступа, твердую мозговую оболочку ЗЧЯ рассекали вдоль сигмовидного синуса в направлении яремной луковицы. Вскрывали ТМО в теменно-височной области, рассекали верхний каменистый синус, края которого лигировали. Накладывали мозговой шпатель на задние отделы височной доли и рассекали намет мозжечка кпереди от верхнего каменистого синуса до свободного края намёта мозжечка позади V. Далее накладывали второй мозговой шпатель сверху на мозжечок и осуществляли тракцию его петрозальной поверхности с обнажением структур церебеллопонтинного угла. Доступ обеспечивает подход к нервам акустико-фациальной и каудальной групп, тройничному и глазодвигательному нервам, блоковому нерву, который виден на всем протяжении церебральной ножки. Обнажаются церебеллярные сосуды, верхние и нижние каменистые вены. Из доступа осуществляется обзор структур ножковой, обводной, церебеллопонтинной цистерн. Понтинная и межножковая цистерны, как и структуры верхнего ската, глазодвигательного треугольника, базилярной артерии, задних отделов кавернозного синуса видны сзади и сбоку. Рассечение верхнего каменистого синуса и намета, мобилизация сигмовидного синуса, пресигмовидная тракция петрозальной поверхности мозжечка и тракция задних отделов височной доли обеспечивает косое супра-транстенториальное пресигмовидное 116 направление операционной оси к средним отделам ската. Верхний и средний петрокливальный регион обнажается сбоку, сзади и сверху, что обеспечивает обзор нижнего каменистого синуса, канала Dorello с входящим в него VI нервом сверху и сбоку. Если требуется осмотреть нижний скат и структуры церебеллопонтинного угла снизу, сзади и латерально комбинация с ретросигмовидным доступом позволяет осмотреть петрокливальную область со стороны ЗЧЯ. Таким образом, представленный вариант заднего петрозального доступа превращается в комбинированный ретро-пресигмовидный подвисочный транстенториальный доступ. Угловые показатели представленного ЗПД с центрированием на устье ПНМА в сравнении с ретросигмовидным и подвисочным доступами показаны в таблице 25. Таблица 25 Сравнение угловых параметров доступов к устью ПНМА Вид хирургического доступа Углы доступности, в градусах Вертикальный Горизонтальный Глубина раны, мм ретросигмовидный доступ 10-15 9-13 63-74 подвисочный транстенториальный доступ задний петрозальный доступ 12-22 35-40 55-65 18-25 30-45 36-46 В проведенном исследовании условия выполнения резекции сосцевидной части височной кости и условия тракции височной доли были лучшими у черепов с краниальными показателями соответствующие брахицефальной форме черепа. Большой угол схождения пирамид и небольшая глубина ската облегчали подход к кливальной области. Транслабиринтные и транскохлеарные петрозальные доступы, комбинированные орбитозигоматические пресигмовидные петрозальные доступы сопровождаются разрушением сенсорных структур внутреннего уха, дисфункцией или параличом лицевого нерва. В предложенном варианте модификации ЗПД резекции подвергается только мастоидная и тимпаническая часть височной кости со стороны задних отделов средней черепной ямки в пределах треугольника Trautman. Задний петрозальный доступ можно комбинировать с трансзигоматическими подвисочными, орбитозигоматическими инфратемпоральными доступами, обеспечивающими увеличения обзора прекливальных цистерн и ствола БА сверху, снизу и сбоку. Комбинация ЗПД с ретросигмовидным или крайне латеральными транскондилярными доступами обеспечит более широкое обнажение зон ската со стороны ЗЧЯ и шеи. Такие доступы востребованы для клипирования АА ствола БА и при проведении реваскуляризирующих операций. 117 4.4 Заключение к главе 4 При оценке угловых параметров операционной раны мы провели сравнение углов доступности сегментов АКБМ при использовании базальных и стандартных доступов. При доступах к комплексу А1-сегмент ПМА-ПСА использование ОЗД в отличие от классического птерионального доступа, увеличивает вертикальный операционный угол в 2 раза, горизонтальный в 1,5 раза, уменьшает глубину раны в 1,7 раза. Низкий осмотр пришеечной части АА ПСА является преимуществом ОЗД. При доступах к С5ВСА вертикальные операционные углы увеличиваются при использовании ОЗД от 2,2-3,3 раз, глубина раны уменьшается в 1,97 раз по сравнению с птериональным доступом. При доступах к верхушке БА стандартный ОЗД увеличивает вертикальный угол по сравнению с птериональным и подвисочным доступом в 1,8 раза и 1,08 раза соответственно. Горизонтальные углы также увеличиваются в 2 раза по сравнению с птериональным и в 1,2 раза по сравнению с подвисочным доступом. Из расширенных вариантов ОЗД мы рассмотрели два ключевых доступа к верхушке БА – транскавернозный ОЗД и ОЗД с передней петрозэктомией. По сравнению с птериональным доступом наиболее значительно увеличиваются вертикальные углы при ОЗД+ППЭ с еще большим увеличением в расширенных вариантах с транспозицией ВСА в 3,8 раза и 6,6 раза, соответственно. При доступах к верхушке БА орбитозигоматический транскавернозный доступ даёт увеличение вертикального угла в 1,67 раза, при расширенном ОЗД с транспозицией ВСА вертикальный угол увеличивается в 4,03 раза по сравнению с подвисочным доступом. Глубина хирургической раны уменьшается в 1,3 - 4 раза при использовании ОЗД и его вариантов по сравнению с птериональным доступом, при сравнении с подвисочным доступом глубина хирургической раны уменьшается в 1,5 -3,5 раза. При доступах к устью ПНМА мы сравнивали операционные углы при ретросигмовидном доступе и при орбитозигоматическом заднем транскавернозном доступе. При последнем вертикальные углы увеличиваются в 1,7 раза. Комбинированные орбитозигоматические транспетрозальные доступы к устью ПНМА увеличивают вертикальные и горизонтальные углы в 2,7 и 3,8 раза, соответственно. При сравнении заднего петрозального доступа к устью ПНМА с подвисочными доступами отмечается увеличение вертикального операционного угла в 1,3 раза, а по сравнению с ретросигмовидным доступом в 1,7 раза. Горизонтальный угол увеличивается в 3,4 по сравнению с ретросигмовидным. Глубина раны по сравнению с ретросигмовидным и подвисочным доступом уменьшается в 1,7 и 1,5 раза, соответственно. Сравнение средних 118 показателей угловых параметров операционной раны при использовании стандартных и расширенных базальных доступов приведены в таблице 26. Таблица 26 Операционные параметры хирургической раны Вид хирургического доступа Хирургическая цель А1ПМА-ПСА С5ВСА Верхушка БА Устье ПНМА Угловые параметры операционной раны ВУ ГУ ВУ ГУ Птериональный Птериональный доступ с передней клиноидэктомией 16 49,5 - - 11 12,5 Орбитозигоматический 38 74,5 24 - 33,5 - 19,5 25 52-80 80,5 Орбитозигоматический передний транскавернозный Орбитозигоматический задний транскавернозный Орбитозигоматический транскавернозный доступ с резекцией переднего и заднего наклоненных отростков Орбитозигоматический с передней петрозэктомией ВУ ГУ 30 38,5 26,5 41,5 32 57,5 Орбитозигоматический с комбинированным транспетрозальным доступом Расширенный ОЗД с транспозицией С2ВСА 72,5 115 Передний петрозальный 24 30 Задний петрозальный Подвисочный Ретросигмовидный 18 21,5 ВУ ГУ 22 16 37,5 61 21,5 17 13,3 40 37,5 12 ВУ – вертикальный угол, ГУ – горизонтальный угол. На основании проведенного анализа параметров операционной раны, можно утверждать, что базальный доступ позволяет открывать несколько анатомических областей, обеспечивает свободу хирургического действия, уменьшает тракцию головного мозга и глубину операционной раны. Выбор базального доступа обеспечивает визуализацию труднодоступного сегмента АКБМ, облегчает качественную дссекцию аневризмы, ремоделирование пришеечной части и клипирование АА. Широкое обнажение зон ската и ствола базилярной артерии с устьями мозжечковых артерий при использовании расширенных базальных доступов с резекцией дна СЧЯ (треугольник Lateral Loop), транспозицией ВСА обеспечивает возможность проведения реваскуляризирующих операций с надежным проксимальным контролем. 119 ГЛАВА 5 РАСШИРЕННЫЕ БАЗАЛЬНЫЕ ДОСТУПЫ В ЛЕЧЕНИИ СЛОЖНЫХ АРТЕРИАЛЬНЫХ АНЕВРИЗМ ГОЛОВНОГО МОЗГА 5.1 Характеристика больных со сложными артериальными аневризмами головного мозга, для лечения которых использовали расширенные базальные доступы В основе клинической апробации проведенной диссертационной работы лежит анализ лечения 8 больных со сложными артериальными аневризмами головного мозга, госпитализированных в отделение неотложной нейрохирургии Научно-исследовательского института скорой помощи им. Н.В. Склифосовского в период с 03.04.2013 по 20.02.2014. Больные были в возрасте от 31 до 72 лет. Средний возраст составил 52 лет. Из восьми больных со сложными артериальными аневризмами женщин было семь (87,5%), один - мужчина (12,5%). Всем больным проведено открытое хирургическое вмешательство с применением расширенных базальных доступов для подхода, диссекции и клипирования сложных артериальных аневризм головного мозга. Прооперированные больные со сложными артериальными аневризмами головного мозга представляли категорию больных с труднодоступными артериальными аневризмами (аневризмы параклиноидной локализации и аневризмы вертебробазилярного бассейна). Состав больных со сложными артериальными аневризмами головного мозга, пролеченных расширенными базальными доступами отражен в таблице 27. При поступлении больные обследовались по принятой в НИИ скорой помощи им. Н.В. Склифосовского методике, включающей исследование соматического и неврологического статуса. Всем больным проводили компьютерную томографию и церебральную ангиографию. Электроэнцефалографию и регистрацию акустических стволовых вызванных потенциалов проводили всем пациентам, транскраниальную допплерографию – 6 (75%) больным. Некоторым больным выполняли магнитно-резонансную томографию, магнитно-резонансную ангиографию, компьютерно-томографическую ангиографию. У пяти больных (63%) выявлена одна АА ГМ (NN 1,2,4-6), (табл. 27). У трёх пациентов (37%) выявлены множественные артериальные аневризмы головного мозга (NN 3,7 и 8). 120 У двух пациентов (25%) наблюдали сочетание АА с другим цереброваскулярным заболеванием (NN 1 и 5). У больного N1 были диагностированы низкая аневризма офтальмического сегмента правой ВСА и кавернома медиобазальных отделов правой лобной доли. У больного N5 с большой АА офтальмического сегмента левой ВСА диагностирована артериовенозная мальформация правой лобно-височной области. Среди прооперированных больных процент АА ВББ составил 50% (больные 3, 4, 7 и 8). Процент параклиноидных АА составил 50% (больные NN 1, 2, 5 и 6). Из 8 пациентов четверо больных (50%) оперированы в острый период после кровоизлияния, из которых 75% (больные 4,7 и 8) имели разорвавшиеся АА ВББ. Тяжесть состояния по шкале Hunt & Hess у больных, оперированных в острый период САК, составила II - 3 пациента, IV - 1 пациент. Таблица 27 Характеристика больных со сложными артериальными аневризмами головного мозга, прооперированных расширенными базальными доступами N п/п Пол/ возраст 1. Ж/43 2. Ж/31 3. Ж/67 4. Ж/72 5. М/38 6. Ж/58 7. Ж/51 8. Ж/55 Локализация АА, Особенности наблюдения Название операции с Исход использованием базального ШИГ доступа АА офтальмического сегмента Орбитозигоматический передний правой ВСА, острый период САК. транскавернозный доступ с Отл. Кавернома базальных отделов правой резекцией ПНО. Клипирование АА. (I) лобной доли Удаление каверномы. АА офтальмического Орбитозигоматический доступ Отл. сегмента левой ВСА передняя клиноидэктомия. (I) Клипирование АА. Множественные АА ГМ. АА Орбитозигоматический доступ с Отл. коммуникантного сегмента правой резекцией дна СЧЯ. Клипирование (I) ВСА и АА устья правой ВМА АА из ретрокаротидного промежутка АА устья левой ПНМА, Комбинированный задний Отл. острый период САК петрозальный доступ. Клипирование (I) АА из пресигмовидного промежутка АА офтальмического сегмента левой Орбитозигоматический передний Отл. ВСА. Артериовенозная транскавернозный доступ с (I) мальформация правой лобной доли резекцией ПНО. Клипирование АА АА офтальмического сегмента Орбитозигоматический доступ, Отл. левой ВСА резекция дна СЧЯ. Клипирование (II) АА. Широко-просветный анастомоз НСА-М2-сегмент СМА Множественные АА ГМ. АА Орбитозигоматический доступ, Хор. бифуркации правой СМА и АА устья резекция дна СЧЯ. Клипирование АА (II) правой ВМА. Острый период САК Множественные АА ГМ. АА верхушки Орбитозигоматический доступ, Отл. базилярной артерии и АА устья левой резекция дна СЧЯ. Клипирование АА (I) ВМА. Острый период САК Ж – женский пол, М – мужской пол, НСА – наружная сонная артерия. 121 5.2 Особенности клинико-неврологического и инструментального обследования больных со сложными артериальными аневризмами головного мозга Всем больным при поступлении проводили клиническое обследование по органам и системам, неврологический осмотр. Было определено наличие или отсутствие общемозговой, менингеальной и очаговой симптоматики. Тяжесть состояния пациентов при поступлении и перед операцией оценивали по классификации W. Hunt и R. Hess (приложение 2). Уровень бодрствования оценивали по шкале комы Глазго (ШКГ) (приложение 1). Функциональные исходы после проведенного хирургического лечения оценивали по шкале исходов Глазго (ШИГ) на момент выписки из стационара (приложение 5). Компьютерная томография. Компьютерная томография головного мозга проведена на аппарате «HI Speed ZX\i фирмы General Electric» (USA). Для оценки степени выраженности кровоизлияния нами была использована классификация кровоизлияния C.M. Fisher (приложение 3) [55,64]. При наличии внутримозговой гематомы определяли объём высокоплотной части гематомы, объем окружающей зоны пониженной плотности и общий объем патологического очага [55,64]. Для оценки степени тяжести внутрижелудочкового кровоизлияния была использована методика, предложенная D.A. Graeb [55,56]. Церебральная ангиография (ЦАГ). Ангиографическое исследование сосудов головного мозга выполнено всем пациентам на сериографе фирмы «Siemens XP AXIOM» (Германия) под потенцированным местным обезболиванием. При исследовании ангиограмм проводили анализ следующих параметров: сторону заполнения аневризмы; размер и форму аневризмы; направление купола аневризмы; выраженность и распространенность церебрального ангиоспазма. 3 D–КТ ангиография. Спиральная компьютерно-томографическая ангиография (СКТА) выполнена всем пациентам в режиме оттененного изображения поверхности (SSD) для оценки топографии пришеечной части артериальной аневризмы и направления ее купола к костям основания черепа [64]. Электроэнцефалография (ЭЭГ) и регистрация акустических стволовых вызванных потенциалов (АСВП) были выполнены всем пациентам. ЭЭГ регистрировали на нейрокартографе «МБН» (Россия). Нарушения ЭЭГ подразделяли на 4 типа по оригинальной методике, разработанной лабораторией клинической физиологии НИИ СП им. Н.В. 122 Склифосовского (приложение 4) [19]. Оценивали наличие на энцефалограмме межполушарной асимметрии и локальных изменений. АСВП регистрировали на нейромиографе «Нейро-МВН» (Россия). По полученным данным определяли уровень замедления проведения звукового сигнала. Транскраниальная допплерография. ТКДГ была выполнена на аппарате «MultiDop-P, DWL» (Германия). Наличие и выраженность ангиоспазма оценивали по величине систолической линейной скорости кровотока в ПМА, СМА. Критериями ангиоспазма рассматривали повышение систолической ЛСК в СМА более 120 см\сек. Невыраженным считали ангиоспазм при повышении систолической ЛСК по СМА от 120 до 200 см\сек. Увеличение скорости более 200 см\сек относили к выраженному ангиоспазму [25,30,57]. Кроме выраженности церебрального ангиоспазма оценивали его распространенность [24,34,57,64]. 5.3 Характеристика расширенных базальных доступов, проведенных для лечения сложных артериальных аневризм головного мозга Для лечения аневризм труднодоступной локализации 7 больным проведен инфратемпоральный орбитозигоматический доступ. У 4-х больных инфратемпоральный орбитозигоматический доступ был дополнен резекцией дна средней черепной ямки, у 4-х больных применен инфратемпоральный орбитозигоматический транскавернозный доступ с резекцией переднего наклоненного отростка, крыши канала зрительного нерва и зрительной распорки для подхода к пришеечной части низкой АА офтальмического сегмента ВСА. У одного пациента проведен задний петрозальный доступ. В 3 наблюдениях применены правосторонние, в 5-ти левосторонние базальные доступы. Зона обзора проксимального и дистального сегмента артерии, несущей АА, пришеечная часть и часть купола АА в каждом из прооперированных случаев была перекрыта костными структурами медиальных отделов основания черепа: передний наклоненный отросток и зрительная распорка – для офтальмических АА, больные NN 1,2,5 и 6 – смотреть таблицу 27; задним наклоненным отростком и спинкой турецкого седла – для АА верхушки БА и устьев ВМА, больные NN 3, 7 и 8; глубиной ската, пирамидой височной кости и ярёмным бугорком затылочной кости – для артериальных аневризм устья ПНМА - больной N4, а также связочным аппаратом намета мозжечка (передняя петроклиноидная связки, свободный край намета в области переднего инцизурального пространства вырезки намёта мозжечка) - больной N3 и индивидуальной анатомической изменчивостью строения сегментов АКБМ (фетальный тип 123 строения задних отделов АКБМ) больной N7 и короткий супраклиноидный отдел внутренней сонной артерии - больные NN 1 и 8. У одного пациента выполнена реваскуляризирующая операция с наложением широкопросветного анастомоза из лучевой артерии (больной N6). Из числа больных, прооперированных орбитозигоматическим доступом, у 4 пациентов выполнена передняя клиноидэктомия с диссекцией проксимального и дистальных каротидных колец для подхода к устью глазной артерии и пришеечной части артериальной аневризмы. У 3-х пациентов, прооперированных орбитозигоматическим доступом, выполнена резекция дна СЧЯ со скелетированием второй и третьей ветви тройничного нерва для обеспечения большей мобильности полюса височной доли при выполнении транссильвиевого претемпорального доступа к межножковой цистерне (больные NN 3, 7 и 8). Расширенный орбитозигоматический доступ с резекцией дна СЧЯ в области латеральной петли со скелетированием V2, V3 ветвей тройничного нерва, латеральной пластинки крыловидного отростка клиновидной кости выполнен у 1 пациента для обеспечения адекватного наложения широкопросветного анастомоза и размещения его за скуловой дугой. В качестве анастомоза была использована лучевая артерия-донор, которая проведена через подвисочную ямку в зону резекции латеральных отделов основания черепа и установлена в область резецированной латеральной петли дна средней черепной ямки (больной N6). 5.4 Применение расширенных базальных доступов у больных со сложными артериальными аневризмами головного мозга Клинический пример 1 Больная А., 43 года, номер истории болезни № 5594-13 (таблица N 22, больной 1). Диагноз: Аневризма офтальмического сегмента правой внутренней сонной артерии без разрыва, Н-К 0. Кавернозная мальформация правой лобной доли с кровоизлиянием, внутримозговая гематома правой лобной доли 4 см3, ШКГ - 15 баллов. Поступила в клинику 24.03.2013 г с жалобами на головную боль и головокружение. Из анамнеза заболевания известно, что больную с 2010 года беспокоили головные боли, лечилась консервативно, отмечались периоды ремиссии и обострения. В декабре 2012 года, а затем в январе 2013 года внезапно развивалась выраженная головная боль, которая на фоне консервативного лечения регрессировала в течение недели, за медицинской помощью не обращалась. В январе 2013 года амбулаторно выполнила МРТ головного мозга и МР ангиографию сосудов головного мозга, при которых была выявлена кавернозная мальформация в области 124 медиобазальных отделах правой лобной доли и выявлено аневризматическое расширение в области кавернозного и клиноидного отделов правой внутренней сонной артерии. За медицинской помощью не обращалась. 24.03.13 г. утром развилась выраженная головная боль, появилось выраженное головокружение, в связи, с чем в сопровождении родственников обратилась за медицинской помощью в НИИ СП им. Н.В. Склифосовского и была госпитализирована в нейрохирургическое отделение. Из анамнеза жизни наличие хронических заболеваний отрицает. Аллергоанамнез не отягощен. Состояние больной средней тяжести. Кожные покровы и видимые слизистые бледнорозового цвета. Дыхательная система: грудная клетка при пальпации безболезненна. Дыхание аускультативно везикулярное, проводится во все отделы легких, хрипов нет, ЧДД - 18 в минуту. Сердечнососудистая система: тоны сердца приглушены, ритм правильный, пульс 74 ударов в минуту. АД 110/70 мм.рт.ст. Пищеварительная система: живот мягкий, при пальпации безболезненный. Перистальтика сохранена. Мочевыделительная система: функции тазовых органов не нарушены. Неврологический статус: сознание ясное, больная ориентирована, ШКГ - 15 баллов. Общемозговая симптоматика в виде выраженной головной боли и головокружения. Менингеальный синдром сомнительный. Зрачки OD=OS, фотореакция, корнеальные рефлексы сохранены. Лицо симметричное, язык по средней линии. Сухожильные, периостальные рефлексы с конечностей D=S, оживлены. Парезов, расстройств чувствительности не выявлено. КТ головного мозга: кавернозная мальформация и гематома правой лобной доли общим объемом 4 см3. Смещения срединных структур головного мозга нет. МРТ головного мозга и МР ангиография сосудов головного мозга: патологии сосудов головного мозга не выявлено. Кавернозная мальформация правой лобной доли с кровоизлиянием. Церебральная ангиография: артериальная аневризма офтальмического сегмента правой внутренней сонной артерии (рис. 61, А). КТ ангиография сосудов головного мозга: аневризма офтальмического сегмента правой внутренней сонной артерии (рис. 61, В). Электроэнцефалография: умеренные нарушения электрической активности с незначительным акцентом справа. Негрубые нарушения функционального состояния структур диэнцефального уровня. Пароксизмальной активности не выявлено. Акустические стволовые вызванные потенциалы: нарушения проведения звукового сигнала не выявлено. 125 А В 8 7 5 6 4 3 1 2 Рисунок 61 Церебральные ангиограммы А – Правосторонняя каротидная ангиограмма в боковой проекции. Стрелкой указана аневризма офтальмического сегмента ВСА, В – Спиральная компьютерно-томографическая ангиография (SSDрежим) в заднебоковой проекции. Красной стрелкой указан купол аневризмы, находящейся ниже уровня переднего наклоненного отростка (желтая стрелка), дистального кольца, под связочным аппаратом намета. 1 – верхушка пирамиды височной кости, 2 – передняя петроклиноидная связка, 3 – зрительная распорка, 4 – менинго-периорбитальная связка, 5 – клиноидный сегмент ВСА, 6 – верхняя глазничная щель, 7 – интерклиноидная связка, 8 – задняя петроклиноидная связка. Рентгенография грудной клетки: корни легких структурные, очаговых теней в легких не выявлено. ЭКГ: без патологии. Была осмотрена терапевтом, невропатологом. Учитывая наличие у больной кавернозной мальформации правой лобной доли с кровоизлиянием и артериальной аневризмы правой внутренней сонной артерии, с целью предотвращения возможного развития жизнеугрожающих кровоизлияний из кавернозной мальформации и возможного разрыва аневризмы 10.04.12 была выполнена операция удаление кавернозной мальформации правой лобной доли и клипирование аневризмы офтальмического сегмента правой ВСА из правостороннего орбитозигоматического доступа (рис. 62). А В С 3 1 4 1 1 2 2 1 3 3 Рисунок 62 Выполнение инфратемпорального орбитозигоматического доступа А – Линии кожного разреза. Штрихом указана проекция орбитозигоматического комплекса. Белой стрелкой обозначена проекция глазного яблока и периорбиты, В – Выпиливание орбитозигоматического комплекса, С – общий вид экстрадурального этапа операции. 1 – латеральный край орбиты, 2 – скуловая дуга (отведена), 3 – периорбита, 4 – височная мышца. 126 Применение орбитозигоматического транскавернозного доступа при клипировании аневризмы офтальмического сегмента правой внутренней сонной артерии проиллюстрировано интраоперационными фотографиями на рисунках 63, А - 65. А 5 6 В С 2 1 15 16 3 10 2 21 1 15 3 11 7 17 2 7 15 16 14 9 22 8 14 4 D 19 10 1 E 13 F 11 3 20 20 7 2 9 12 15 4 16 21 22 21 12 3 20 8 11 7 13 13 18 7 20 17 10 6 6 Рисунок 63 Интраоперационная фотография и анатомические препараты правой параклиноидной области А – Вид параклиноидной области из орбитозигоматического доступа. Обнажены периорбита и верхняя глазничная щель. Штрихами обозначены проекции верхушки переднего наклоненного отростка, серповидной связки, дистального кольца, передней петроклиноидной связки и проекция мешка аневризмы (стрелка), В - F – Анатомические препараты и схема топографии треугольников крыши кавернозного синуса к офтальмическому и клиноидному сегментам ВСА, передней петли ВСА, устью глазной артерии и связочному аппарату намета мозжечка. 1 – передний наклоненный отросток, 2 – II нерв, 3 – офтальмический сегмент ВСА, 4 – клиноидный сегмент ВСА, 5 – периорбита, 6 – верхняя глазничная щель, 7 – передняя петроклиноидная связка, 8 – задняя петроклиноидная связка, 9 – интерклиноидная связка, 10 – менинго-периорбитальная связка, 11 – серповидная связка; 12 – зрительный чехол; 13 – окуломоторная цистерна; 14 – Грубера (петросфеноидная) связка; 15 – дистальное кольцо; 16 – проксимальное кольцо; 17 – устье глазной артерии, 18 – клиноидное пространство, 19 – треугольник Dolenc, 20 – треугольник Umansky, 21 – глазодвигательный треугольник, 22 – треугольник Hakuba. Инфратемпоральный орбитозигоматический доступ обеспечил базальный подход к параклиноидному региону и оптико-каротидному промежутку. Аневризма имела овальную форму с направлением купола вниз, латерально и кзади. Шейка АА находилась под дистальным кольцом, большая часть тела аневризмы находилась под передним наклоненным отростком, 127 занимая каротидный треугольник и переднемедиальные отделы крыши кавернозного синуса, вдаваясь нижнелатеральной стороной тела под переднюю петроклиноидную и интерклиноидную связки в области их конвергенции на верхушке и латеральных отделах переднего наклоненного отростка. Для подхода к пришеечной части аневризмы проведены: передняя клиноидэктомия, рассечение дистального и проксимального колец, передней петроклиноидной связки, серповидной связки и зрительного чехла (рис. 64). 4 A B 4 6 6 1 11 5 8 3 1 7 13 2 3 12 2 C D 6 6 1 1 7 7 5 10 9 9 3 15 3 2 14 2 Рисунок 64 Интраоперационные фотографии выполнения инфратемпорального орбитозигоматического переднего транскавернозного доступа для подхода к низкой аретриальной аневризме офтальмического сегмента правой ВСА А – Рассечение ТМО, покрывающей наружную поверхность переднего наклоненного отростка, В – Резекция верхушки и медиальных отделов переднего наклоненного отростка до зрительного канала, С – Диссекция зрительного чехла, серповидной связки и листка ТМО (стрелка), покрывающей внутреннюю поверхность переднего наклоненного отростка, которая прочно связана с дистальным кольцом, D – Острая диссекция дистального кольца от ТМО внутренней поверхности переднего наклоненного отростка. 1 – передний наклоненный отросток, 2 – II нерв, 3 – офтальмический сегмент правой ВСА, 4 – периорбита, 5 – передняя петроклиноидная связка, 6 – менинго-периорбитальная связка, 7 – серповидная связка; 8 – зрительный чехол; 9 – дистальное кольцо, 10 – вскрытое клиноидное пространство, 11 – треугольник Dolenc (голубой штрих), 12 – треугольник Umansky (красный штрих), 13 – ультразвуковой аспиратор, 14 – микродиссектор, 15 – микроножницы. Осуществлен подход к области залегания аневризмы через клиноидный треугольник Dolenc и образуемое им клиноидное пространство. Устье глазной артерии находилось ниже 128 дистального кольца на уровне верхних отделов клиноидного сегмента ВСА. После клиноидэктомии и мобилизации параклиноидного отдела ВСА обнаружена большая часть АА, которая протрузирует под связочный аппарат намёта мозжечка, который образуюет латеральные границы кавернозного синуса. После удаления латеральной части переднего наклоненного отростка и рассечения передней петроклиноидной связки, проведена дисекция задней стенки пришеечной части АА и клипирование шейки АА изогнутым клипсом (рис. 65). А В 8 1 8 12 12 4 10 17 9 9 4 3 6 3 6 7 11 17 13 18 5 14 5 2 С D 12 4 12 3 4 17 2 3 5 5 16 15 Рисунок 65 Интраоперационные фотографии клипирования аретриальной аневризме офтальмического сегмента правой ВСА из инфратемпорального орбитозигоматического переднего транскавернозного доступа А – Дистальное кольцо, плотно охватывающее адвентицию ВСА (стрелка), рассечено. Мобилизирован параклиноидный отдел ВСА. Ревизия в существенно расширенном оптико-каротидном пространстве. Видна часть аневризмы и устье глазной артерии, В – Большая часть аневризмы вдается под связочный аппарат намета и начальные отделы менинго-периорбитальной связки, образующих латеральные границы кавернозного синуса, С – Дисекция задней стенки пришеечной части аневризмы, D – Клипирование шейки аневризмы изогнутым клипсом. 1 – резецированный передний наклоненный отросток, 2 – II нерв, 3 – офтальмический сегмент ВСА, 4 – клиноидный сегмент ВСА, 5 – коммуникантный сегмент ВСА, 6 – передняя петроклиноидная связка, 7 – интерклиноидная связка, 8 – менинго-периорбитальная связка, 9 – рассечённое дистальное кольцо; 10 – ТМО внутренней поверхности переднего наклоненного отростка, 11 – устье глазной артерии, 12 – вскрыто клиноидное пространство в треугольнике Dolenc, 13 – расширенный оптико-каротидный промежуток в треугольнике Umansky, 14 – микродиссектор, 15 – клипсодержатель, 16 – клипс, 17 – аневризма, 18 – устье ЗСА. 129 Применение инфратемпорального орбитозигоматического транскавернозного доступа обеспечило возможность базального подхода к параклиноидному региону. При работе в передних отделов крыши и латеральных отделов кавернозного синуса использование переднелатерального базального доступа позволило провести переднюю клиноидэктомию, выделить большую часть артериальной аневризмы, провести аккуратную диссекцию дистального каротидного кольца от адвентиции ВСА и твердой мозговой оболочки, покрывающей передний наклоненный отросток, визуализировать устье глазной артерии и пришеечную часть АА. Орбитозигоматический доступ позволил увеличить претемпоральную тракцию и при необходимости изменять направление доступа, улучшая осмотр параклиноидного и параселлярного регионов, провести адекватное клипирование аневризмы с качеством окклюзии - Raymond I и исходом лечения Rankin 0, ШИГ-1. Клинический пример 2 Больная Л, 67 лет, номер истории болезни № 7552-13 (таблица N 22, больной 3). Диагноз: Множественные аневризмы головного мозга, мешотчатая артериальная аневризма супраклиноидного отдела правой ВСА (коммуникантного сегмента), аневризма правой верхней мозжечковой артерии, нетравматическое субарахноидально-вентрикулярное кровоизлияние от 20.04.2013, Fisher 4 ст., Hunt-Hess 4 ст. Graeb 3 балла, ШКГ 13 баллов. Гипертоническая болезнь 3ст., 3ст риск 4. ИБС, атеросклеротический кардиосклероз, атеросклероз периферических артерий. Пневмосклероз. Варикозная болезнь вен нижних конечностей, факосклероз, ангиопатия сетчатки по гипертоническому типу. Поступила в клинику 21.04.13 г. Жалобы при поступлении: на выраженную головную боль, головокружение, тошноту. Из анамнеза заболевания известно, что больная заболела остро 20.04.13 года, когда появились вышеперечисленные жалобы, возникло онемение и слабость правой нижней конечности. Бригадой СМП доставлена в ГКБ № 81 г. Москвы, где при КТ головного мозга выявлено нетравматическое субарахноидальное кровоизлияние. После консультации выездного нейрохирурга пациентка была переведена в НИИ СП им. Склифосовского для дообследования и возможного хирургического лечения. Из анамнеза жизни известно, что пациентка длительно страдает артериальной гипертонией, постоянно терапию не принимает; в анамнезе перенесла ОНМК неизвестной давности, аппендэктомию, гистерэктомию; длительное время страдает варикозной болезнью вен нижних конечностей. Аллергоанамнез не отягощен. Состояние больной тяжелое, кожные покровы и видимые слизистые бледно-розового цвета. Дыхательная система: дыхание самостоятельное, через естественные дыхательные пути, аускультативно жесткое, хрипов нет. ЧДД до 16 мин. Сердечнососудистая система: 130 гемодинамика стабильная, тенденция к артериальной гипертензии. АД – 140/90 мм рт ст. По монитору – синусовый ритм с частотой до 80 в минуту. Тоны сердца приглушены, ритмичные. Система пищеварения: живот не вздут, мягкий, при пальпации безболезненный. Мочевыделительная система: область почек без особенностей, симптом «поколачивания» отрицательный с обеих сторон, мочеиспускание по уретральному катетеру, моча визуально не изменена. Неврологический статус: уровень бодрствования – глубокое оглушение ШКГ 13 баллов. Вяла, сонлива. Афазии нет. Менингеальный синдром. Зрачки OS=OD, фотореакция и корнеальные рефлексы симметричное, язык чувствительных по живые. Глазодвигательных средней нарушений не линии. Рефлексы выявлено. нарушений с не конечностей Координаторные пробы выявлено. равны, Лицо парезов, (пальценосовую, пяточноколенную) выполняет с интенцией. В связи с тяжелым состоянием, пациентка была госпитализирована в нейрореанимационное отделение, где проводилась интенсивная консервативная терапия, обследование. КТ головного мозга (21.04.2013г.): субарахноидально-вентрикулярное кровоизлияние, внутрижелудочковое кровоизлияние 1 см3, Fisher 4 ст., Graeb 3 балла, отек – ишемия головного мозга. ВКК 2 – 19 %, начальная аксиальная дислокация. По данным церебральной дигитальной субтракционной панангиографии (21.04.2013г.): аневризма коммуникантного сегмента правой внутренней сонной артерии, аневризма правой верхней мозжечковой артерии (рис. 66). А В Рисунок 66 Церебральные ангиограммы А – Спиральная компьютерно-томографическая ангиография (SSD-режим), ангиограмма сверху и сзади. Стрелками указаны аневризма коммуникантного сегмента ВСА справа (красная стрелка) и аневризма правой ВМА (желтая стрелка), В – Спиральная компьютерно-томографическая ангиография (SSDрежим) во фронтальной проекции сзади. Стрелкой указана аневризма правой верхней мозжечковой артерии с широкой шейкой на эктазированном устье ВМА в области квадрифуркации базилярной артерии (белая стрелка). 131 При транскраниальной доплерографии (22.04.2013г.): по обеим среднемозговым артериям определяется фрагментарный кровоток. Электроэнцефалография (22.04.2013г.): выраженные нарушения электрической активности диффузного характера, с преобладание медленной патологической активности в правом полушарии (III – IV тип). Стволовые акустические потенциалы (22.04.2013г.): замедления проведения звукового сигнала по слуховым путям ствола мозга не выявлено. Осмотрена нейроофтальмологом (22.04.2013г.): OU – венозная полнокровие сетчатки. Учитывая наличие множественных аневризм головного мозга с разрывом, нетравматическое субарахноидально-вентрикулярное кровоизлияние от 20.04.2013г., пациентке показано выполнение оперативного вмешательства – клипирование аневризм головного мозга. Однако, в связи с развитием картины выраженного, распространенного декомпенсированного ангиоспазма от хирургического лечение решено отказаться до регресса признаков ангиоспазма, улучшения неврологического состояния. Продолжена комплексная интенсивная терапия в нейрореанимации. 03.05.2013г. по стабилизации состояния пациентка для дальнейшего лечения переведена в нейрохирургическое отделение, где продолжено лечение, на фоне которого отмечена положительная динамика в виде частичного регресса общемозговой, менингеальной симптоматики, регресса церебрального ангиоспазма. ТКДГ (07.05.2013г.): сохраняются признаки умеренного ангиоспазма по обеим средним мозговым артериям. ЭЭГ+АСВП (07.05.2013г.): по сравнению с записью от 29.04.2013 г. отмечается положительная динамика - сокращение индекса билатерально-синхронных дельта-колебаний, генерализованного характера, доминирующих в правом полушарии. Сохраняются выраженные изменения электрической активности диффузного характера с наличием билатеральносинхронных дельта-колебаний, преимущественно регистрируемых по передним отведениям без четкой сторонности (тип II). Замедления проведения слухового сигнала по слуховым путям ствола головного мозга не выявлено. КТ-ангиография интракраниальных артерий, КТ-перфузия головного мозга (09.05.2013г.): диффузная гипоперфузия (преимущественно подкорковых ядер и обеих височнозатылочных областей) в виде олигемии, гидроцефалия (ВКК2-29%), аневризма правой внутренней сонной артерии, аневризма правой верхней мозжечковой артерии. Консультирована офтальмологом: факосклероз, ангиопатия сетчатки гипертоническому типу. Рентгенография грудной клетки (08.05.2013): пневмосклероз. ЭКГ (07.05.2013): гипертрофия левого желудочка. по 132 13.05.2013 г. пациентке с множественными аневризмами сосудов ГМ (аневризма супраклиноидного отдела правой ВСА, аневризма правой ВМА), высоким риском повторных, опасных для жизни кровоизлияний из АА головного мозга, было проведено клипирование аневризмы правой внутренней сонной артерии и аневризмы правой верхней мозжечковой артерии из правостороннего орбитозигоматического доступа с резекцией дна СЧЯ (рис.67). А В С 2 4 2 4 1 5 8 7 6 3 9 10 Рисунок 67 Выполнение инфратемпорального орбитозигоматического доступа с резекцией дна средней черепной ямки А – Линии кожного разреза. Стрелкой указана проекция орбитозигоматического комплекса, В – Орбитозигоматический доступ завершен. Сфеноидальный край большого крыла клиновидной кости резецирован до верхней глазничной щели, вскрыта периорбита, латеральный край орбиты и скуловая дуга отведены на жевательной мышце (стрелка), С – Экстрадуральный этап операции. Резекция дна средней черепной ямки, скелетирование второй и третьей ветви тройничного нерва в крайнелатеральном треугольнике (Lateral Loop) для обеспечения базального доступа к межножковой цистерне. 1 – латеральный край орбиты, 2 – скуловая дуга, 3 – периорбита, 4 – височная мышца, 5 – корень скуловой дуги, 6 – дугообразное возвышение, 7 – средняя оболочечная артерия, 8 – третья ветвь тройничного нерва, 9 – высокоскоростной нейрохирургический бор с насадкой 3 мм, 10 – аспиратор. После завершения экстрадурального этапа операции проведено рассечение ТМО. Орбитозигоматический доступ обеспечил низкий базальный подход к оптикокаротидному пространству. Учитывая в анамнезе САК для снижения напряжения ткани мозга вскрыты хиазмальная и каротидная цистерны, перфорация прозрачной перегородки (рис. 68). А В С D Рисунок 68 Схема и интраоперационные фотографии подхода к оптико-каротидному треугольнику справа из орбитозигоматического доступа А – Схема ОЗД, В – Базальный осмотр оптико-каротидного треугольника. За счет отсутствующей латеральной стенки орбиты увеличился вертикальный угол осмотра (изогнутая стрелка), С – вскрытие хиазмальной и каротидных цистерн (стрелка), D – перфорация прозрачной перегородки (стрелка). 133 Претемпорально ретрокаротидно осуществлен подход к коммуникантному сегменту ВСА обнаружено, что в мембранные тяжи латеральной каротидно-офтальмической мембраны включена пришеечная часть аневризмы внутренней сонной артерии. Купол аневризмы ВСА припаян к заднелатеральным отделам глазодвигательного треугольника, передней петроклиноидной связке и находится под передними отделами свободного края намёта мозжечка. После диссекции шейки аневризмы пуговчатым зондом проведено клипирование аневризмы коммуникантного сегмента ВСА (рис. 69). А В 11 1 4 9 2 5 10 4 17 3 10 9 3 С D D 1 10 8 1 6 17 2 7 17 8 4 16 3 15 3 Рисунок 69 Интраоперационные фотографии клипирования артериальной аневризмы коммуникантного сегмента правой ВСА из инфратемпорального орбитозигоматического доступа с резекцией дна средней черепной ямки А – Острая диссекция латеральной каротидно-офтальмической мембраны от передней петроклиноидной связки. В мембранные тяжи включена пришеечная часть АА, В – Купол АА припаян к латеральным отделам глазодвигательного треугольника и находится под передними отделами свободного края намёта (стрелка), С – после диссекции шейки АА пуговчатым зондом проведено клипирование АА, D – Клипс на шейке АА (клипс1), аневризма вскрыта, обнажен вход в межножковую цистерну (стрелка). Видно правое мамиллярное тело с веточками таламоперфорирующих артерий. 1 – свободный край намета мозжечка в области переднего инцизурального пространства, 2 – III нерв, 3 – коммуникантный сегмент ВСА, 4 – передняя петроклиноидная связка, 5 – тяжи латеральной каротидно-офтальмической мембраны, 6 – вход в межножковую цистерну, 7 – правое мамиллярное тело, 8 – таламоперфорирующие артерии, 9 – нижние отделы латеральной щели, 10 – периорбита, 11 – микроножницы, 15 – клипсодержатель, 16 – клипс1, 17 – аневризма коммуникантного сегмента ВСА. 134 После этого осуществлен поворот головы на 45° с ротацией кзади на 15°. Осуществлен подход к межножковой цистерне в каротидно-окуломоторном промежутке. Проведена диссекция микроножницами мезенцефалического листка Лилиеквистовой мембраны. Обнажено ретромамиллярное пространство, видна артериальная аневризма устья ВМА (рис. 70). А В 10 10 4 4 3 5 3 19 1 клипс1 под шпателем 14 8 2 7 1 9 9 С D 10 10 17 18 4 16 3 1 14 12 16 2 15 17 11 15 13 13 5 Рисунок 70 Интраоперационные фотографии подхода к аневризме правой верхней мозжечковой артерии из инфратемпорального орбитозигоматического доступа с резекцией дна средней черепной ямки А – Обзор супраклиноидного отдела правой ВСА с клипсом1 на коммуникантном сегменте ВСА. Отсутствующий орбитозигоматический комплекс обеспечил базальный подход к межножковой цистерне в ретрокаротидном промежутке (стрелка), В – Коммуникантный сегмент внутренней сонной артерии вместе с клипсом1 осторожно отведён шпателем, обнажен каротидно-окуломоторный промежуток (стрелка). Видны мамиллярное тело, III нерв, заднелатеральные отделы глазодвигательного треугольника, С – Обнажено ретромамилярное пространство, видна аневризма ВМА с широкой шейкой, D – Выделена шейка АА. Обращает на себя внимание атеросклеротически изменённый и эктазированный проксимальный участок ВМА (передний понтомезенцефалический сегмент ВМА). 1 – свободный край мозжечка, 2 – III нерв, 3 – коммуникантный сегмент ВСА, 4 – передняя петроклиноидная связка, 5 – межножковая цистерна, 7 – правое мамиллярное тело, 8 – таламоперфорирующие артерии, 9 – нижние отделы латеральной щели, 10 – периорбита, 11 – пуговчатый зонд, 12 – аневризма верхнй мозжечковой артерии, 13 – эктазированная часть переднего понтомезенцефалического сегмента ВМА, 14 – мезенцефалический листок Лилиеквистовой мембраны, 15 – базилярная артерия, 16 – Р1-сегмент ЗМА, 17 – постаневризматическая часть переднего понтомезенцефалического сегмента ВМА, 18 – широкая шейка АА (отношение высота АА/ шейка АА <2), 19 – клипс1. 135 Проведена диссекция купола артериальной аневризмы правой ВМА микроножницами и пуговчатым зондом. Купол аневризмы правой верхней мозжечковой артерии направлен кверху, спаян с правым мамиллярным телом, III нервом, латеральными отделами квадрифуркации базилярной артерии и нижней поверхностью Р1-сегмента ЗМА. После выделения шейки аневризмы ВМА, аневризма клипирована прямым клипсом (рис. 71). А В 10 1 2 14 12 19 12 16 20 13 13 С D 10 18 4 18 3 8 13 2 1 16 17 15 9 Рисунок 71 Интраоперационные фотографии клипирования аневризмы правой верхней мозжечковой артерии из инфратемпорального орбитозигоматического доступа с резекцией дна средней черепной ямки А – Диссекция широкой пришеечной части аневризмы ВМА пуговчатым зондом, В – Клипирование прямым клипсом (клипс2), С – Прямой клипс2 на шейке АА ВМА. Стенки аневризмы коллапсированны (стрелка). Видна атеросклеротическая бляшка на расширенном устье ВМА, D – Общий вид после клипирования аневризм коммуникантного сегмента правой ВСА и правой верхней мозжечковой артерии. 1 – свободный край мозжечка, 2 – III нерв, 3 – коммуникантный сегмент ВСА, 4 – передняя петроклиноидная связка, 5 – межножковая цистерна, 7 – правое мамиллярное тело, 8 – таламоперфорирующие артерии, 9 – нижние отделы латеральной щели, 10 – периорбита, 11 – пуговчатый зонд, 12 – аневризма верхней мозжечковой артерии, 13 – атеросклеротическая эктазированная часть переднего понтомезенцефалического сегмента ВМА, 14 – постаневризматическая часть переднего понтомезенцефалического сегмента ВМА, 15 – базилярная артерия, 16 – Р1-сегмент ЗМА, 17 – клипс1, 18 – клипс2, 19 – пуговчатый зонд, 20 – клипсодержатель. 136 Орбитозигоматический доступ обеспечил возможность базального подхода к аневризме коммуникантного сегмента внутренней сонной артерии, купол которой находился под свободным краем намета и был спаян с передней петроклиноидной связкой и глазодвигательным нервом. Диссекция и клипирование таких аневризм требует более низкого подхода, чем это могут обеспечить обычные подвисочный или птериональный доступы. Аневризмы верхней мозжечковой артерии относятся к категории труднодоступных сложных аневризм. Орбитозигоматический доступ обеспечил низкий подход к межножковой цистерне, идентификацию сегментов вертебробазилярного бассейна, а при клипировании операционную ось позволил отклонить в зону отсутствующего сфено-орбитального комплекса в сторону периорбиты. За счет уменьшения проекционного угла увеличились вертикальные операционные углы и объем хирургической рабочей зоны в области межножковой цистерны. Применение ОЗД с резекцией дна СЧЯ позволила уменьшить проекционный угол на область опико-каротидного и каротидно-окуломоторного хирургических промежутков, а резекция латерального края глазницы позволила менять углы осмотра и осуществить надежное клипирование артериальных аневризм (качество клипирование по шкале Raymond I). 5.5 Результаты применения расширенных базальных доступов у больных со сложными артериальными аневризмами головного мозга По шкале исходов Глазго I – 88% (больные NN 1,2,3,4,5,6 и 8), II – 12% (больной N7) . У оперированных пациентов в острый период САК по шкале исходов Глазго исход I наблюдали у 75% (больные N 1,4 и 8). У больных, оперированных в холодном периоде после САК, тяжесть состояния по шкале исходов Глазго составила I –100% (больные 2,3,5 и 6). 137 5.6 Заключение к главе 5 В проведенном исследовании клинический опыт применения базальных доступов в лечении сложных артериальных аневризм ГМ показал, что использование резекции костей основания черепа обеспечивает наилучшую визуализацию труднодоступного сегмента АКБМ и подход к пришеечной части АА под максимально низким углом. За счет резекции костей основания черепа базальный доступ уменьшает проекционные углы, поэтому возрастают операционные вертикальные и горизонтальные углы, тем самым увеличивается хирургическая свобода операционного действия и доступность сложной АА. Проведенные базальные доступы создавали оптимальные условия для диссекции труднодоступного артериального сегмента несущего АА, обеспечивали аккуратную диссекцию шейки и купола аневризмы от прилежащих базальных структур головного мозга и черепа (наклоненные отростки, верхушка пирамиды височной кости, спинка турецкого седла, связочный аппарат намета мозжечка, представленный передней и задней петроклиноидной связкой, интерклиноидной связкой, мембранный комплекс стенок кавернозного синуса, петросфеноидная связка (связка Грубера), петролингвальная связка, менинго-периорбитальная связка, серповидная связка, мембранным комплексом перимезенцифальных цистерн и листков Лилиеквистовой мембраны, связочный аппарат внутренней сонной артерии, представленный каротидными кольцами – дистальным, проксимальным и латеральным, каротидно- окуломоторной мембраной, каротидным чехлом), которые в силу своего базального расположения доступны только при условии выполнения низкого нейрохирургического доступа с захватом костей медиальных отделов основания черепа. В проведенном исследовании применение орбитозигоматического доступа для клипирования труднодоступных аневризм обеспечивало видимые преимущества в обзоре структур базальных цистерн, параклиноидного и параселлярного регионов, зон ската и отделов петрокливальной щели по сравнению с птериональным доступом. На клиническом примере N1 - клипирование параклинноидной АА показано, что применение орбитозигоматического доступа позволило хорошо идентифицировать дистальное каротидное кольцо, серповидную связку, зрительный чехол, переднюю петроклиноидную и менинго-периорбитальные связки, конвергирующие на верхушке переднего наклоненного отростка, что позволило аккуратно рассечь наружный листок ТМО переднего наклоненного отростка, начиная от верхушки вдоль его медиального края и провести резекцию ПНО, тем самым оставляя интактными венозные коллекторы клиноидного пространства и передненижнего кавернозного поля. Орбитозигоматический доступ позволил максимально 138 низко провести клиноидэктомию в треугольнике Dolenc, идентифицировать внутренний листок переднего наклоненного отростка, рассечь его и дистальное каротидное кольцо, которые были плотно вплетены в переднелатеральный сектор адвентиции ВСА, что позволило мобилизировать границу перехода офтальмического в клиноидный сегмент и часть клиноидного сегмента ВСА. Орбитозигоматический доступ увеличил рабочую зону в треугольнике Umansky и позволил идентифицировать устье глазной артерии, расположенное ниже дистального кольца, выделить часть АА, расположенную в переднелатеральных отделах крыши кавернозного синуса и надежно клипировать шейку аневризмы (качество клипирование по шкале Raymond I). Следовательно, применение ОЗД является необходимым для лечения низких каротидно-офтальмических АА и аневризм параклиноидного региона. Анализируя результаты лечения артериальной аневризмы ВМА клинического случая N2, следует отметить, что резекция латеральной и верхней стенки орбиты при выполнении ОЗД увеличила угол осмотра межножковой ямки за счет уменьшения проекционного угла. Резекция скуловой дуги создала дополнительные возможности обзора верхушки базилярной артерии со стороны средней черепной и подвисочной ямок по сравнению с орбитокраниальной резекцией. Резекция же дна средней черепной ямки при выполнении ОЗД ещё больше увеличила обзор и обеспечила возможности наиболее базального осмотра структур межножковой ямки, идентификацию устьев ЗМА и ВМА, ретромамиллярного поля с таламоперфорирующими артериями, увеличивая угол обзора за счёт отклонения наружной апертуры раны в зону отсутствующего орбитозигоматического комплекса в сторону крыловидно-нёбной и подвисочной ямок. При диссекции аневризмы ВМА из ОЗД были хорошо видны листки Лилиеквистовой мембраны, перфорирующие артерии межножковой ямки, исходящие из ЗСА, Р1-сегмента ЗМА и верхушки базилярной артерии. Орбитозигоматический доступ обеспечил возможность осмотреть аневризму как из птерионального направления в ретрокаротидном промежутке, так и из подвисочных вариантов. Низкий доступ обеспечил хороший осмотр широкой пришеечной части артериальной аневризмы на эктазированном участке переднего понтомезенцефалического сегмента ВМА. Аневризма ВМА была клипирована из каротидноофтальмического промежутка (качество клипирование по шкале Raymond I). Из клинического опыта лечения сложных труднодоступных артериальных аневризм головного мозга можно сделать вывод, что доступность сегментов АКБМ и пришеечной части аневризмы, увеличение хирургической свободы и соответственно лучшие результаты при микрохирургическом выключении аневризмы из кровотока будут зависеть от выбора и проведения базального доступа с резекцией костей основания черепа. 139 ЗАКЛЮЧЕНИЕ Аневризмы считаются сложными, если имеют широкую шейку, большие размеры, атеросклеротически измененные или фузиформные стенки, отхождения ветвей из тела аневризмы, то есть такие характеристики аневризмы, которые не позволяют провести обычное клипирование шейки [64, 77, 135, 200]. Сложная аневризма часто не может быть достигнута из обычного хирургического доступа, из-за её труднодоступности, и не может быть вылечена с помощью эндоваскулярного метода из-за широкой шейки или других гемодинамических характеристик [64, 100, 156, 200, 218]. На современном этапе нейрохирургии, лечение такой патологии требует комбинации различных методов лечения - применение базальных доступов, этапное ремоделирование широкой шейки АА, клипирование и эндоваскулярное лечение в условиях гибридной рентген-операционной [70, 77, 111, 169, 171, 188, 190, 200, 245]. При использовании нейрохирургического доступа для подхода, визуализации и клипирования труднодоступных АА, например АА ВББ, существует проблема выбора вида и направления доступа к аневризме, обеспечивающего лучшие условия для диссекции и клипирования. При выборе доступа к труднодоступному сегменту АКБМ, несущему АА необходимо учитывать индивидуальное анатомическое строение сегментов АКБМ к рельефу основания черепа. Определение объема нейрохирургического вмешательства, характера предполагаемой тракции мозга и выбор определенного доступа, который обеспечил бы надежное выключение АА из кровотока с минимальным повреждением ткани мозга в ходе доступа, остаются проблемой открытой нейрохирургии при лечении сложных АА ГМ. Посттракционная травма ГМ в ходе стандартного доступа к сложной АА и часто неудовлетворительное качество окклюзии аневризмы являются основными факторами для выбора базального доступа. Мировые нейрохирургические клиники, которые используют для лечения сложных АА базальные доступы, имеют лучшие показатели качества лечения (ШИГ, шкала Rankin, шкала Raymond) c меньшим процентом инвалидности и летальности после нейрохирургического вмешательства. Для обоснования адекватности выбора доступа при микрохирургическом лечении АА конкретной локализации возникает необходимость сравнивать параметры операционной раны (проекционные углы, «углы атаки», глубина раны) используемого доступа с другими возможными подходами, оценить потенциал каждого из доступов и отдать предпочтение наиболее выгодным характеристикам операционной раны, которые обеспечит планируемый нейрохирургический доступ. Доступ с резекцией костей медиальных отделов основания черепа обеспечивает базальный подход к труднодоступному артериальному сегменту АКБМ, идентификацию 140 нейроваскулярных структур параклиноидной, параселлярной и петрокливальной областей – это связочный аппарат намета, мембраны базальных цистерн, каротидные кольца, петли и сегменты ВСА, треугольники кавернозного синуса и СЧЯ, петрокливальные треугольники и зоны ската. Работа с пришеечной частью АА является основной целью применения базального доступа при комбинированном лечении сложных аневризм, где базальный доступ даёт возможность ремоделировать шейку аневризмы для последующего этапа лечения. Для полной окклюзии сложной АА, ремоделирования АА или реваскуляризирующих операций применяют орбитозигоматические инфратемпоральные доступы, доступы Kawase, петрозальные доступы, расширенные варианты переднелатеральных доступов с резекцией дна СЧЯ и транспозицией ВСА, комбинированные заднелатеральные базальные доступы. Наиболее сложны для лечения аневризмы верхушки, ствола БА и устьев мозжечковых артерий. Переднелатеральные базальные доступы к АА БА проходят с резекцией костей латеральных отделов основания черепа (ОЗД), наклоненных отростков и спинки турецкого седла (орбитозигоматические транскавернозные базальные доступы). В работах E.R. Seoane et al., 2000 [227], A. Chanda et al., 2002 [96], V.V. Dolenc et al., 2003 [108], A.S. Youssef et al., 2004 [255], F.P. Hsu et al., 2005 [144], E.G. Figueiredo et al., 2006 [114], A.F. Krisht et al., 2007 [158], А. Yasuda et al., 2008 [253], A.Wu et al., 2010 [251], M.E. Sughrue et al., 2011 [238], A. Вanerjee et al., 2011[82] имеются исчерпывающие морфометрические и анатомо-топографические обоснования применения орбитозигоматических, орбитозигоматических (зигоматических) транскавернозных доступов в лечении аневризм верхушки БА и АА ВББ. Различные виды латеральных базальных доступов проходят с резекцией отделов височной кости, дна средней черепной ямки и ската. В работах М.А Horgan et al., 2000 [141, 142], L.F. Gonzalez et al., 2004, 2005 [125,127,128], H.J. Steiger et al., 2004 [237], L.N. Sekhar et al., 2006, 2008 [224,225], R. Siwanuwatn et al., 2006 [231], М.Wanibuchi et al., 2009 [246], N.C. Bambakidis et al., 2005, 2009 [80,81], S. Osawa et al., 2008 [194], Pichierri et al., 2010 [199], J. Mai et al., 2013[177], T. Fukushima et al., 2012 [121], B. Gross et al., 2012 [130], Е. Nossek et al., 2014 [191] рассматриваются различные виды и варианты петрозальных базальных доступов, комбинированных орбитозигоматических петрозальных и доступов со стороны СЧЯ к верхушке и стволу БА, Р1- и Р2-сегментам ЗМА, устью и сегментам ВМА и ПНМА. В ходе исследования мы изучили угловые параметры наиболее популярных базальных доступов (ОЗД, ППД и ЗПД) относительно конкретных труднодоступных сегментов АКБМ. В планировании базального доступа необходимы знания топографии аневризмы к костям основания черепа (наклоненные отростки, зрительная распорка, спинка турецкого седла, верхушка пирамиды и отделы височной кости, отделы ската и петрокливальная щель), расположения шейки и направления купола. 141 Однако не менее важно использовать такой доступ, который бы учитывал индивидуальное строение сегментов АКБМ и особенности строения рельефа основания черепа в каждом конкретном случае. Поскольку среди сложных АА с разрывом доля АА ВББ занимает 43%, где 19% - АА верхушки БА [108, 144, 218, 224], наше исследование было сосредоточено, прежде всего, на изменчивости строения задних отделов АКБМ, которое влияет не только на выбор базального доступа, но и выбор его определенного вида и направления. В ходе исследования строения ЗСА, базилярной и задней мозговой артерий выявлены три типа строения задних отделов АКБМ. Фетальный тип строения задних отделов АКБМ встретился в 32%, а в 24% верхушка БА находилась ниже уровня спинки турецкого седла. То есть в 1\3 исследуемого материала встретилось такое индивидуальное строение верхушки БА, которое требует применения доступа с резекцией костей основания черепа. В 10% наблюдений отмечено отклонение ствола БА латерально до нервов мосто-мозжечкового угла. Эти данные имеют значения для выбора стороны доступа или его направления. Установлено, что диаметр Р1-сегмента ЗМА различается в зависимости от типа строения задних отделов АКБМ. При гипоплазированном унилатеральном типе диаметр Р1-сегмента ЗМА на стороне гипоплазированной ЗСА был всегда толще и составил в среднем 3,17 мм. Диаметр гипоплазированной ЗСА варьировал от 0,5-0,9 мм и был длиннее на 3-4 мм. При билатеральной гипоплазии диаметр Р1-сегмента ЗМА был в среднем 4,1 мм. При унилатеральном фетальном типе строения диаметр Р1-сегмента ЗМА в среднем составил 1,6 мм. Диаметр ЗСА был 2,3-3,4 мм. При билатеральном фетальном типе диаметр Р1-сегмента ЗМА составил в среднем 1,63 мм с диаметром ЗСА 2,4-3,5 мм, при этом Р1-сегмент ЗМА чаще справой стороны был толще. Полученные данные говорят о плохом обзоре сегментов абнормального типа строения задних отделов АКБМ из стандартного птерионального доступа. При фетальной конфигурации III нерв лежит медиально ЗСА, находясь либо ниже либо на уровне ЗСА и Р1-сегмента ЗМА. Такая топография затрудняет диссекцию и клипирование АА верхушки БА, устьев ЗМА и ВМА из каротидно-офтальмического хирургического промежутка при использовании доступа переднелатерального направления. При фетальном типе строения необходим базальный доступ латерального направления (варианты орбитозигоматических задних транскавернозных доступов, доступы со стороны дна СЧЯ, петрозальная резекция) только в этом случае можно обойти фетально утолщенную ЗСА и подойти к области верхушки БА сбоку и сзади. В исследовании выделены 3 типа строения проксимальной би-(три)фуркации ЗМА, которые различаются выраженностью протрузии постбифуркационных стволов Р2Р-сегмента ЗМА под крючок гиппокампа и локализации бифуркации в перимезенцифальных цистернах. В 60% (1 и 2 типы) бифуркация находилась в обводной цистерне, основные ветви находились сразу за крючком гиппокампа, между ножкой мозга и латеральным коленчатым телом, что 142 необходимо учитывать при тракции медиобазальных отделов височной доли. В 39% (3 тип) бифуркация находилась на границе с пинеальным регионом в области верхушки намета мозжечка, что необходимо учесть при проведении задних подвисочных доступов, транстенториальных и комбинированных транспетрозальных доступов. При исследовании перфорирующих артерий, выявлено, что ЗСА отдаёт на своем протяжении в среднем до 8 перфорирующих артерий, прободающих парамедианную и заднюю перфорирующие субстанции. Их диаметр составил 0,05-0,5 мм с длиной до 19 мм. Наибольшее количество сосудов отходит от средней трети ЗСА и Р1-сегмента ЗМА, которые в 90% имеют «пучковый» тип строения. Задние таламоперфорирующие артерии отходили от задней и верхней стенок Р1сегмента ЗМА с диаметром в среднем 0,3 мм и длиной 4-12 мм. От задней и латеральной поверхностей дистальной трети БА отходят до 18 коротких огибающих перфорирующих артерий, диаметром до 0,5 мм. Эти топографо-анатомические данные необходимо учитывать при диссекции АА верхушки БА с задневерхним направлением купола. Аa. thalamogeniculatae отходят в 15% наблюдений от Р2А, в 80% - от Р2Р и в 5% - от Р3 сегментов ЗМА в количестве 3-8. Следовательно, в 80% таламоколенчатые артерии связаны с топографией ствола Р2Рсегмента ЗМА и областью его бифуркации (1 и 2 типы), данная топография важна для планирования трансхороидальных транслименальных доступов к Р2-сегменту ЗМА, резекции передней трети височной доли, транссильвиевых трансункальных доступах к АА верхушки БА и при тракции медиобазальных отделов височной доли. В 50% аa. thalamogeniculatae и задние латеральные ворсинчатые артерии отходят общим стволом от бифуркации ЗМА, что необходимо учесть при выполнении трансхороидальных доступов через височный рог бокового желудочка к ножковой и обводной цистернам, к Р2А- и Р2Р-сегментам ЗМА. В 90% наблюдений аa. pedunculoperforatae отходят в количестве 2-11 артерий (в среднем 6) от Р2Асегмента ЗМА, что необходимо учесть при доступах к ножковой цистерне при выполнении транссильвиевых, задних транскавернозных и претемпоральных доступов. В нашей работе описаны длинные и короткие огибающие ветви, исходящие из Р1- и Р2-сегментов ЗМА. При диссекции Р1-сегмента ЗМА и пришеечной части АА верхушки БА с направлением купола кзади необходимо помнить о локализации устьев длинных огибающих четверохолмных артерий, которые отходили в 75% от Р1- и только в 25% от Р2А сегмента ЗМА. Локализация устьев задних медиальных ворсинчатых артерий (ЗМВА) зависела от типа строения задних отделов АКБМ. При нормальном типе наибольший процент (43%) локализации устьев ЗМВА был в области Р2А-сегмента ЗМА, в 35,7% ЗМВА исходили от Р2Р, в 35,7% от Р3-сегмента ЗМА и только в 7% от Р1-сегмента ЗМА. Две ЗМВА были обнаружены в этом типе в 21,4% случаев, часто было сочетание двух Р3 или двух Р2Р-сегментов ЗМА. Когда же имелся абнормальный (гипоплазированный и фетальный) тип строения задних отделов АКБМ 143 отмечалось возрастание числа случаев локализации устьев ЗМВА от Р2А (до 56%), а также возрастание случаев локализации устьев ЗМВА в области Р1-сегмента ЗМА (до 31% при фетальном типе строения задних отделов АКБМ). Следовательно, в 1\3 случаев при фетальном типе строения тонкий и гипоплазированный Р1-сегмент ЗМА является источником ЗМВА, которые при этом типе строения задних отделов АКБМ в 12,5% могут быть удвоенными, что необходимо учитывать при подходах и клипировании АА верхушки БА с наличием у больного фетального типа строения. При этом типе строения часто встречался двойной Р3-сегмент ЗМА. При гипоплазированном типе строения задних отделов АКБМ отмечено также увеличение случаев двойных задних медиальных ворсинчатых артерий (до 30%). В 65% случаев локализация устьев задних латеральных ворсинчатых артерий была представлена основным стволом ЗМА, в 35% - другие источники. Эти данные следует учитывать при подвисочных и трансхороидальных доступах. В проведенном исследовании изменчивости корковых ветвей ЗМА выделены 4-е типа ангиоархитектоники, отличающихся наличием передней нижней височной артерии и добавочных артерий. В 37% отсутствовала передняя нижняя височная артерия. Следовательно, передние отделы медиобазальной поверхности височной доли и парагиппокампальной извилины, крючок гиппокампа, регион энторинального поля, семилунарной и обводной извилин кровоснабжаются передними ункальными артериями, исходящими от передней ворсинчатой артерии, М1-сегмента СМА и ВСА. Эти данные следует учитывать при диссекции аневризм ВСА и СМА, транссильвиевых претемпоральных и трансхороидальных доступах, при резекции крючка (трансункальные доступы) и полюса височной доли. В исследовании проведены измерения рострального каудального, главного стволов и маргинальных ветвей ВМА. Диаметр основного ствола ВМА варьировал от 1,8 до 3,0 мм (в среднем 2,11). Диаметр рострального ствола составил от 1,2 до 2,2 мм (в среднем 1,7), диаметр каудального ствола варьировал от 0,5 до 1,5 мм (в среднем 1,1). Дупликатура ВМА встретилась в 22%. Устье ВМА в 94% располагалось в области верхушки БА, в 6% - на Р1-сегменте ЗМА над III нервом. Основной ствол ВМА (в случаях одностволового истока), и верхний ствол (в случаях дупликатуры), отходил от БА, прилегая к устью ЗМА, что необходимо учесть при клипировании аневризм верхушки БА. Установлено, что расположение устья и переднего понтомезенцефалического сегмента ВМА зависит от расположения верхушки БА относительно спинки турецкого седла (СТС), которое в свою очередь зависит от показателей базилярного угла (БУ) и угла схождения пирамид (УСП). При БУ от 103°-110° и УСП от 115°-125° верхушка БА была выше СТС на 2-5 мм. Соответственно этому расположение устья ВМА и ее проксимальных отделов было высоким. Такие краниальные показатели чаще соответствовали брахицефальной форме черепа. При нарастании БУ и уменьшении УСП соотношения были 144 обратными. При узком черепе с УСП 88°-95° и пологим скатом отмечено, что область верхушки БА располагается ниже СТС. Это затрудняет обзор задних отделов АКБМ из птерионального доступа, где бифуркация БА закрыта задним наклоненным отростком и СТС. Такое анатомическое расположение артерий наблюдалось у долихокранных черепов. На изученном материале хода сосуда и образовании основных ветвей установлено, что ВМА образует три типа ветвления, отличающиеся характером расположения основных стволов, ветвей и регионами кровоснабжения. Выявлено, что перфорирующие ветви отходят как от основного ствола ВМА, так и от ростральной и кудальной частей латерального понтомезенцефалического сегмента ВМА. В 1\3 исследованных гемисфер проксимальная часть ВМА формировала мелкие сосуды, идущие в межножковую ямку вместе с aa. thalamoperforatаe от БА и ЗМА. Данную топографо-анатомическую особенность необходимо учитывать при клипировании аневризм БА или АА устья ВМА. В исследовании описаны варианты положения петель ВМА относительно черепных нервов и свободного края намета мозжечка в области переднего инцизурального пространства. Данную анатомическую особенность необходимо учитывать при диссекции аневризм базилярной артерии и АА переднего понтомезенцефалического сегмента ВМА. В 1\4 случаев встретилось удвоенное устье ВМА, при этом нижняя ветвь, как правило, была маргинальной, что важно учитывать при тракции петрозальной поверхности мозжечка при выполнении задних петрозальных доступов и комбинированных пресигмовидных транстенториальных доступов. Выявленные анатомо-топографические особенности строения дистальных отделов базилярной артерии, задней мозговой и верхней мозжечковой артерий и топография их к костям основания черепа позволят оптимально подойти к выбору нейрохирургического доступа к труднодоступным АА вертебробазелярного бассейна. При оценке угловых параметров базальных доступов выявлено, что при доступах к А1сегменту ПМА и ПСА использование ОЗД в отличие от классического птерионального доступа, увеличивает вертикальный операционный угол в 2 раза, горизонтальный в 1,5 раза, уменьшает глубину раны в 1,7 раза. Проекционный угол из-за резекции костей орбитозигоматического комплекса уменьшается в 2,2 раза, тем самым осмотр ПСА осуществляется спереди и снизу в отличие от птерионального доступа, где ПСА представлена сбоку и сверху. Низкий осмотр пришеечной части АА ПСА является преимуществом ОЗД. При доступах к клиноидному сегменту ВСА вертикальные операционные углы увеличиваются при использовании ОЗД от 2,2-3,3 раз, уменьшается глубина раны в 1,97 раз по сравнению с птериональным доступом. Осуществляется низкий осмотр передней петли ВСА, облегчая идентификацию каротидных колец, каротидно-окуломоторной мембраны, каротидного чехла, переднелатеральных отделов крыши кавернозного синуса. Увеличение вертикальных углов в группе вариантов ОЗД 145 объясняется уменьшением проекционного угла в 4,5 по сравнению с птериональным доступом и возможностями менять направления осмотра, отклоняя операционную ось в сторону подвисочной и крыловидно-нёбной ямок. Наибольший вертикальный угол достигается при ОЗД смешанного направления с резекцией дна СЧЯ, отклонением операционной оси до треугольников Mullan и Lateral Loop с целью проведения адекватной мобилизации С5 ВСА, например при транскавернозном доступе к межножковой цистерне и АА БА [87, 96, 113, 114, 144, 191, 227, 246, 255]. При доступах к верхушке БА при использовании орбитозигоматического доступа значительно возрастает вертикальный угол осмотра за счет нивелирования проекционного угла. Стандартный ОЗД увеличивает вертикальный угол по сравнению с птериональным и подвисочным доступом в 1,8 раза и 1,08 раза соответственно. Горизонтальные углы также увеличиваются в 2 раза по сравнению с птериональным доступом и в 1,2 раза по сравнению с подвисочным доступом. Расширенные варианты ОЗД – транскавернозный ОЗД и ОЗД с передней петрозэктомией (ППЭ) по сравнению с птериональным доступом увеличивают вертикальные углы при подходах к верхушке БА со значительным увеличением в расширенных вариантах ОЗД и транспозицией ВСА от 3,8 до 6,6 раза. По сравнению с подвисочными доступами транскавернозный ОЗД дает увеличение вертикального угла в 1,67 раза, при расширенных вариантах ОЗД с транспозицией ВСА вертикальный угол увеличивается в 4,03 раза. Расширенные варианты ОЗД используют также для обнажения ствола БА и ската. Горизонтальные углы осмотра также увеличиваются в расширенных вариантах ОЗД в 1,8-5,3 раз по сравнению с подвисочным доступом. Горизонтальный угол в транскавернозном варианте ОЗД к верхушке БА по сравнению с птериональным доступом увеличивается в 3,8 раз, при сочетании ОЗД с ППЭ угол увеличивается в 4,6 раз. При использовании расширенного ОЗД с транспозицией ВСА горизонтальный угол увеличивается в 9,2 раза. Глубина хирургической раны уменьшается в 1,3-4 раза при использовании ОЗД и его вариантов по сравнению с птериональным доступом, при сравнении с подвисочным доступом глубина хирургической раны уменьшается в 1,5-3,5 раз. Устье ПНМА располагается чаще на границе I и II зон ската, медиально от канала Дорелло. Стандартные доступы к устью ПНМА включают подвисочный транстенториальный и ретросигмовидный доступ (РС). В обоих доступах высока частота посттракционных травм ГМ, а при использовании РС возрастает частота при клипировании АА ПНМА повредить прямые и циркумферентные перфорирующие артерии моста, исходящие из средней трети ствола БА. С развитием хирургии основания черепа стали доступны базальные артериальные сегменты, такие как устье ПНМА. В современной сосудистой нейрохирургии при высоко расположенном устье ПНМА (I зона) используются орбитозигоматические и задние транскавернозные орбитозигоматические доступы [64, 80, 125, 224]. При низко расположенном 146 устье ПНМА (II зона) используют передний петрозальный доступ (ППД), задний петрозальный доступ (ЗПД) и комбинированные орбитозигоматические транспетрозальные доступы [130, 224]. В нашем исследовании при сравнении угловых параметров заднего транскавернозного ОЗД с РС вертикальные углы увеличиваются в 1,7 раз. Устье ПНМА доступно сбоку и спереди при орбитозигоматическом транскавернозном подходе, в отличие от ретросигмовидного доступа, где на фоне тракции вентральных отелов моста устье открывается сзади, и обзор закрывает канал Дорелло с VI парой, которые находятся латерально от средней линии ската и ствола БА. Комбинированные орбитозигоматические петрозальные доступы увеличивают вертикальные и горизонтальные углы в 2,7 и 3,8 раза, соответственно. Наименьшая глубина раны была при использовании комбинированных орбитозигоматических транспетрозальных доступов. Глубина раны была меньше в 3,3 раза по сравнению с ретросигмовидным доступом. При сравнении параметров операционной раны при ЗПД к устью ПНМА с височными доступами отмечается увеличение вертикального операционного угла в 1,3 раза и по сравнению с ретросигмовидным доступом в 1,7 раза. Горизонтальный угол при ЗПД увеличивается в 3,4 по сравнению с ретросигмовидным, с подвисочными доступами эти углы одинаковы. Глубина раны по сравнению с ретросигмовидным и подвисочным доступом уменьшается в 1,7 и 1,5 раза, соответственно (рис. 72). Птериональный доступ на ПСА, С5 ВСА, верхушку БА 80 70 60 50 40 ПСА 30 С5ВСА 20 БА ПНМА 10 0 Варианты ОЗД на ПСА, С5 ВСА, верхушка БА, устье ПНМА Расширенные ОЗД (ОЗД+ППЭ, ОЗД+ЗПД, ОЗД с транспозицией ВСА) на БА и устье ПНМА Передний петрозальный доступ на верхушку БА Задний петрозальный доступ на устье ПНМА Ретросигмовидный доступ на устье ПНМА Подвисочный доступ на верхушку БА и устье ПНМА Рисунок 72 Оценка доступности сегментов АКБМ, С5ВСА и устья ПНМА по вертикальным операционным углам из хирургических доступов По оси ординат – градусы. Диаграммы наглядно иллюстрируют разницу по вертикальным операционным углам при использовании базальных доступов по сравнению со стандартными доступами (птериональный, подвисочный, ретросигмовидный). 147 Таким образом, выявленные анатомо-топографические параметры операционной раны при расширенных базальных доступах к сегментам АКБМ (операционные углы, глубина раны, хирургические промежутки), полученные при моделировании расширенных базальных доступов, позволяют оптимально определить доступность отдельных сегментов АКБМ сложной локализации (параклиноидные отделы ВСА, верхушка базилярной артерии, проксимальные сегменты задней мозговой и верхней мозжечковой артерий, устье передней нижней мозжечковой артерии) в зависимости от вида и направления базального доступа В проведенной работе мы предложили вариант заднего петрозального доступа. Предложенный трансмастоидный пресигмовидный доступ проводится через крышу сосцевидной полости, образующей задние отделы дна средней черепной ямы. Обнажение и дальнейшее рассечение ТМО задней черепной ямы происходит в треугольнике Траутмана, который в предложенном варианте пресигмовидного доступа имеет значительные размеры, что позволяло проводить тракцию петрозальной поверхности мозжечка и обеспечивает пресигмовидный обзор структур церебеллопонтинного угла. С выполнением тенториотомии, пересечением верхнего каменистого синуса, отведением сигмовидного синуса кзади супратранстенториальный подход позволяет хорошо осматривать петрокливальный регион, устье ПНМА с минимальной или умеренной тракцией височной доли. В исследование входил клинический материал, включающий использование расширенных базальных доступов для клипирования труднодоступных артериальных аневризм ГМ. Мы продемонстрировали приемлемые результаты в лечении сложных труднодоступных АА при использовании базальных доступов. На основании всего проведенного исследования мы можем сделать вывод, что базальные доступы улучшают показатели хирургического лечения больных с труднодоступными артериальными аневризмами головного мозга. Базальный доступ по сравнению с обычным птериональным доступом, способствует лучшей визуализации труднодоступного сегмента АКБМ, несущего АА, увеличивает вертикальные операционные углы, уменьшает проекционные углы и глубину операционной раны, открывает одновременно несколько анатомических областей, что увеличивает диапазон хирургического действия, обеспечивает проксимальный контроль и уменьшает тракцию головного мозга. Доступ с резекцией костей основания черепа обеспечивает базальный обзор пришеечной части артериальной аневризмы снизу, тем самым повышает шансы успешного клипирования аневризмы или ремоделирования шейки для проведения последующего этапа при комбинированном лечении сложной артериальной аневризмы головного мозга. 148 ВЫВОДЫ 1. Разработана оригинальная методика получения блок-препаратов головного мозга в твердой мозговой оболочке с сохранением медиальных отделов костей основания черепа и целостности базальных сегментов АКБМ для разработки подходов к труднодоступным артериальным аневризмам головного мозга и моделирования вариантов базальных доступов. 2. Выявлены индивидуальные анатомические особенности строения сегментов ВББ фетальный тип строения задних отделов АКБМ в 32%, расположение верхушки БА ниже уровня спинки турецкого седла в 24%, что предполагает использование базальных доступов. Выделены 3 типа строения проксимальной би-(три)-фуркации ЗМА, которые различаются выраженностью протрузии постбифуркационных стволов Р2Р-сегмента ЗМА под крючок гиппокампа и локализацией бифуркации в перимезенцифальных цистернах, что важно при проведении подвисочных, транстенториальных и комбинированных петрозальных доступов. Верхняя мозжечковая артерия образует три типа ветвления, отличающиеся характером расположения основных стволов, ветвей и регионами кровоснабжения. Перфорирующие ветви отходят от основного ствола ВМА, ростральной и кудальной частей латерального понтомезенцефалического сегмента ВМА. 3. Установлено, что перфорирующие артерии отходят от средней трети ЗСА и Р1сегмента ЗМА и в 90% имеют «пучковый» тип строения. Задние таламоперфорирующие артерии отходят от задней и верхней поверхностей Р1-сегмента ЗМА. Короткие огибающие перфорирующие артерии отходят от задней и латеральной поверхностей дистальной трети БА. Таламоколенчатые артерии в 80% связаны с топографией ствола Р2Р-сегмента ЗМА и областью его проксимальной бифуркации, что нужно учитывать при планировании трансхороидальных транслименальных доступов к Р2-сегменту ЗМА, транссильвиевых трансункальных доступах к АА верхушки БА. 4. Локализация устьев задних медиальных ворсинчатых артерий зависит от типа строения задних отделов АКБМ. При фетальном типе в 31% устье задних медиальных ворсинчатых артерий расположено в области Р1-сегмента ЗМА, что нужно учитывать при подходе и клипировании АА верхушки БА с наличием у больного фетального типа строения. Устья задних латеральных ворсинчатых артерий в 35% расположены в области Р2Р-сегмента ЗМА, что следует учитывать при выполнении подвисочных и трансхороидальных доступов. 5. Использование орбитозигоматических доступов при подходах к клиноидному сегменту ВСА увеличивает вертикальные операционные углы в 2,2-3,3 раза, уменьшает глубину раны в 1,97 раз по сравнению с птериональным доступом. При доступах к А1-сегменту 149 ПМА-ПСА использование орбитозигоматического доступа в отличие от классического птерионального доступа, увеличивает вертикальный операционный угол в 2 раза, горизонтальный в 1,5 раза, уменьшает глубину раны в 1,7 раза. 6. Транскавернозный орбитозигоматический доступ и орбитозигоматический доступ с передней петрозэктомией по сравнению с птериональным доступом увеличивают вертикальные углы при подходах к верхушке БА до 3,8 раз, с резекцией костей основания черепа в треугольниках Kawase и Glasscock с транспозицией задней петли каменистого сегмента ВСА - в 6,6 раз. Орбитозигоматический транскавернозный доступ к верхушке БА увеличивает вертикальные углы в 1,67 раз, при расширенных вариантах доступа с транспозицией ВСА в 4,03 раза по сравнению с подвисочными доступами. При использовании заднего транскавернозного орбитозигоматического доступа при подходах к устью ПНМА вертикальные углы возрастают в 1,7 раза, комбинированные петрозальные доступы при подходах к устью ПНМА увеличивают вертикальные и горизонтальные углы в 2,7 и 3,8 раза, соответственно по сравнению с ретросигмовидным доступом. 7. Разработанная модификация заднего петрозального доступа к средней трети БА и устью ПНМА позволяет оптимально учитывать особенности строения рельефа основания черепа при клипировании труднодоступных АА ВББ. При использовании заднего петрозального доступа к устью ПНМА вертикальный угол увеличивается в 1,3 раза по сравнению с подвисочным доступом, в 1,7 раза по сравнению с ретросигмовидным доступом, горизонтальный угол увеличивается в 3,4 по сравнению с ретросигмовидным доступом, глубина раны уменьшается в 1,7 и 1,5 раза по сравнению с ретросигмовидным и подвисочным доступами, соответственно. 150 РЕКОМЕНДАЦИИ В ПРАКТИКУ 1. Блок-препараты головного мозга в твердой мозговой оболочке на вырубленном основании черепа с инъецированными латексом сосудами по предложенной методики забора анатомического материала могут быть использованы для изучения микрохирургической анатомии артерий каротидного бассейна и ВББ, а также позволяют моделировать базальные нейрохирургические доступы с учетом полученных анатомических особенностей строения. 2. Использование расширенных базальных доступов при клипировании АА верхушки БА, устьев ЗМА и ВМА должно быть показано в случаях фетального типа строения задних отделов АКБМ и при низком залегании верхушки БА. 3. При проведении инфратемпорального ОЗД голова больного должна быть повернута на 45-60° в противоположную сторону, при проведении расширенного ОЗД с резекцией дна средней черепной ямки или при сочетании ОЗД с передней петрозэктомией голова должна быть ротирована в противоположную сторону на 90° и кзади на 15-20°. Положение головы зависит от обзора того топографического региона, который является целью доступа: параклиноидный регион - при низких офтальмических АА ВСА; переднее инцизуральное пространство вырезки намета мозжечка - при АА БА, АА устьев ВМА и ЗМА; межножковая цистерна и перпонтинная цистерна - при низких АА верхушки БА, АА устьев ПНМА. 4. При формировании кожно-апоневротического лоскута необходимо предотвратить повреждение лобной ветки лицевого нерва, проходящей в поверхностном листке глубокой фасции путем рассечения фасции, покрывающей височную мышцу и отводя её вместе с кожноапоневротическим лоскутом. 5. При выпиливании орбитозигоматического костного лоскута необходимо иметь костный бор с диаметром головки до 3 мм во избежание большого диастаза при сопоставлении и последующих осложнений (остеомиелит, ложный сустав). 6. Для резекции наклоненных отростков необходимо наличие высокоскоростного бора или ультразвукового деструктора. Рассечение твердой мозговой оболочки, покрывающей передний наклоненный отросток, и связочного аппарата намёта мозжечка (передняя петроклиноидная связка, менингопериорбитальная связка) следует проводить Т-образно на некотором расстоянии от краев ПНО и его верхушки, тем самым препятствуя вскрытию венозных коллекторов крыши кавернозного синуса. 7. При проведении расширенных базальных доступов латерального направления желательно установить поясничный дренаж для создания оптимальных условий для тракции височной доли. На экстрадуральном этапе при проведении доступов со стороны средней 151 черепной ямки (доступы Kawase, расширенные комбинированные петрозальные доступы, доступы с транспозицией ВСА) при резекции бором верхушки пирамиды височной кости и крыши внутреннего слухового прохода (треугольники Kawase, Day-Fukushima) следует меатальную и кливальную твердую мозговую оболочку оставлять интактными, так как при её повреждении, поступающий в рану ликвор будет препятствовать адекватной резекции кости. 8. При петрозальных доступах (ППД и ЗПД) верхний каменистый синус надежнее перевязывать и пересекать, а рассеченный намёт мозжечка прошивать и отводить на лигатурах, тем самым увеличивая внутреннюю апертуру раны. 9. Вид подвисочного доступа и место тракции височной доли лучше уточнить в доорерационный период по МРТ, 3D КТ снимкам, ориентируясь на место расположение би(три)фуркации Р2Р-сегмента ЗМА во избежание посттракционных травм ГМ. 10. Для резекции верхушки пирамиды височной кости, мастоидной и тимпанической частей височной кости необходимо иметь высокоскоростной бор с алмазными головками разных диаметров 2-5 мм и форм (лепестковая, круглая и др.), что обеспечит аккуратное удаление кости. 11. Пластику дефектов после расширенных петрозальных доступов можно проводить апоневрозом, рассеченной и отведенной на ножке височной мышцей, абдоминальным жиром. 152 СПИСОК СОКРАЩЕНИЙ А1, А2… – сегменты ПМА АА – артериальная аневризма АКБМ – артериальный круг большого мозга БА – базилярная артерия БУ – базилярный угол ВББ – вертебробазилярный бассейн ВМА – верхняя мозжечковая артерия ВСА – внутренняя сонная артерия ГМ – головной мозг ЗМА – задняя мозговая артерия ЗПД – задний петрозальный доступ ЗСА – задняя соединительная артерия КС – кавернозный синус М1, М2… – сегменты СМА ОЗД – орбитозигоматический доступ ПМА – передняя мозговая артерия ПНМА – передняя нижняя мозжечковая артерия ПНО – передний наклоненный отросток ППД – передний петрозальный доступ ПСА – передняя соединительная артерия Р1, Р2… – сегменты ЗМА САК – субарахноидальное кровоизлияние СМА – средняя мозговая артерия СТС – спинка турецкого седла СЧЯ – средняя черепная ямка ТКДГ – транскраниальная допплерография ЦАГ – церебральная ангиография ШИГ – шкала исходов Глазго ШКГ – шкала комы Глазго УСП – угол схождения пирамид ЭЭГ – электроэнцефалография Hunt & Hess – шкала тяжести САК 153 СПИСОК ЛИТЕРАТУРЫ 1. Беков, Д.Б. Атлас артерий и вен головного мозга человека [Текст] / Д.Б. Беков, С.С. Михайлов.- М.: Медицина, 1979.-286с.: ил. 2. Боровиков, В.П. Statistica: искусство анализа данных на компьютере [Текст] / В.П. Боровиков.- СПб. : Питер, 2001.- 656с.: ил. 3. Буров, С.А. Возможности декомпрессивной краниотомии в лечении злокачественных форм массивного ишемического инсульта [Текст] / С.А. Буров, А.С. Никитин // Нейрохирургия. – 2011. - № 3. - С. 82-87. 4. Васильев, С.А. Хирургическое лечение артериальных аневризм головного мозга, осложненных кровоизлиянием в желудочки [Текст]: автореф. дис. ... канд. мед. наук / С.А. Васильев.- Москва, 2002.- 30с. 5. Винокуров, А.Г. Хирургические доступы при аневризмах головного мозга [Текст] / А.Г. Винокуров, В.В. Крылов // Хирургия аневризм головного мозга: руководство в 3-х т. / под ред. В.В. Крылова.- М.: Изд-во Т.А. Алексеева, 2011.-Т.2.-С. 12-87. 6. Годков, И.М. Факторы риска интраоперационных осложнений в хирургии церебральных аневризм [Текст]: автореф. дис. ... канд. мед. наук / И.М. Годков.- Москва, 2009.30с. 7. Григорук, С.П. Особенности ангиографической диагностики сочетанного атеросклеротического поражения церебральных и венечных артерий [Текст] / С.П. Григорук // Украинский нейрохирургический журнал. – 2006. – № 3. – С.22-26 8. Григорян, Ю.А. Кальцифицированная гигантская аневризма средней мозговой артерии [Текст] / Ю.А. Григорян, А.А. Лебедев // Журнал вопросы нейрохирургии им. Н.Н. Бурденко.2000.- № 3. - С.33-35. 9. Данилов, В.И. Внутричерепные нетравматические кровоизлияния: диагностика и показания к хирургическому лечению [Текст] / В.И. Данилов // Неврологический вестник. 2005. - Т. XXXVII, вып. 1-2. - С.77-84. 10. Дашьян, В.Г. Раннее хирургическое лечение артериальных аневризм головного мозга, сопровождающихся внутричерепной гематомой [Текст]: автореф. дис. … канд. мед. наук / В.Г. Дашьян. – Москва, 2001. – 27с. 11. Дзяк, Л.А. Артериальные аневризмы и артериовенозные мальформации [Текст] / Л.А.Дзяк, Н.А.Зорин.- Днепропетровск: Пороги, 2003.- 138с.: ил. 12. Добровольский, Г.Ф. Методологические основы топографической нейропатоморфологии мозга, основания черепа, шейного отдела позвоночника и структурных 154 элементов системы ликворообращения [Текст] / Г.Ф. Добровольский.- М.: Компания Спутник, 2003.- 50с.: ил. 13. Добровольский, Г.Ф. Функциональная морфология системы ликворообращения [Текст] / Г.Ф. Добровольский.- М.: Компания Спутник, 2006.-115с.: ил. 14. Добровольский, Г.Ф. Микрохирургическая анатомия параселлярного подпаутинного пространства в норме и при субарахноидальном кровоизлиянии артерии [Текст] / Г.Ф. Добровольский, Н.В. Хуторной // Нейрохирургия.-2009.-№3.- С.17-29. 15. Евзиков, Г.Ю. Рентгенанатомическое строение передних отделов артериального (Виллизиева) круга головного мозга при аневризмах передней соединительной артерии [Текст] / Г.Ю. Евзиков, А.Г. Захаров, В.В. Крылов // Журнал вопросы нейрохирургии им. Н.Н. Бурденко.- 1995. - № 3. - С.5-7. 16. Евзиков, Г.Ю. Хирургическое лечение артериальных аневризм передней соединительной артерии в остром периоде кровоизлияния [Текст]: автореф. дис. …канд. мед. наук / Г.Ю. Евзиков.- Москва, 1995. - 37с. 17. Завалишин, Е.Е. Хирургическое лечение аневризм вертебробазилярного бассейна [Текст]: автореф. дис. ... канд. мед. наук / Е.Е. Завалишин.- Москва, 2013.-35с. 18. Захаров, А.Г. Ангиографическая диагностика сосудистого спазма при разрывах аневризм головного мозга [Текст] / А.Г. Захаров, В.В. Крылов // Журнал вопросы нейрохирургии им. Н.Н. Бурденко. - 1993. - № 6.- С.3-5. 19. Информативность ЭЭГ в остром периоде субарахноидального кровоизлияния вследствие разрыва внутричерепных артериальных аневризм [Текст] / В.В. Лебедев, Н.С. Куксова, В.В. Крылов, М.Ю. Мятчин // Журнал вопросы нейрохирургии им. Н.Н. Бурденко. 1989.- № 5.- С.44-49. 20. Коновалов, А.Н. Атлас нейрохирургической анатомии [Текст] / А.Н. Коновалов, С.М. Блинков, М.В. Пуцилло.- М.: Медицина, 1990.- 336с.: ил. 21. Коновалов, А.Н. Компьютерная томография в нейрохирургической клинике [Текст] / А.Н. Коновалов, В.Н. Корниенко.- М.: Медицина, 1985.- 476с.: ил. 22. Коновалов, А.Н. Хирургическое лечение артериальных аневризм головного мозга [Текст] / А.Н. Коновалов.- М.: Медицина, 1973. - 328 с.: ил. 23. Корниенко, В.Н. КТ- и МРТ-ангиография: их роль в диагностике артериальных аневризм головного мозга в остром и подостром периодах субарахноидального кровоизлияния [Текст] / В.Н. Корниенко, Т.В. Белова, И.Н. Пронин // Материалы III съезда нейрохирургов России.- СПб., 2002.-С.658-659. 24. Корниенко, В.Н. Диагностическая нейрорадиология [Текст] / В.Н. Корниенко, И.Н.Пронин. - М.: Мед. Лит., 2006.-1326с. 155 25. Крылов, В.В. Прогноз исхода ранних операций при разрывах аневризм сосудов головного мозга [Текст]: автореф. дис. ... канд. мед. наук / В.В. Крылов.- Москва, 1988.- 30 с. 26. Крылов, В.В. Хирургическое лечение больных с разрывами аневризм вертебробазилярного бассейна [Текст] / В.В. Крылов, Е.Е. Завалишин // Нейрохирургия. – 2010. - № 2. – С. 14-25. 27. Крылов, В.В. Моделирование гемодинамических изменений в артериях и артериальных аневризмах головного мозга при сосудистом спазме [Текст] / В.В. Крылов, А.В. Природов, И.В. Архипов [и др.] // Нейрохирургия. – 2013. - №4. – С. 16-25. 28. Крылов, В.В. Сосудистый спазм при субарахноидальном кровоизлиянии [Текст] / ВВ. Крылов, С.А. Гусев, Г.П. Титова.- М.: Медицина, 2001.- 208с.: ил. 29. Крылов, В.В. Гемодинамические факторы, образования, роста и разрыва аневризм головного мозга [Текст] / В.В. Крылов, И.М. Годков // Неврологический журнал. – 2011. - № 1. – С. 4-9. 30. Крылов, В.В. Хирургическое лечение артериальных аневризм головного мозга, осложненных внутричерепной гематомой [Текст] / В.В. Крылов, В.Г. Дашьян // Нейрохирургия. – 2002. - № 2. – С. 9-15. 31. Крылов, В.В. Декомпрессивная краниотомия в комплексной интенсивной терапии злокачественных форм массивного ишемического инсульта [Текст] / В.В. Крылов, А.С. Никитин // Журнал неврологии и психиатрии им С.С. Корсакова. – 2013. - № 1.- С. 15-22. 32. Крылов, В.В. Гидроцефальный синдром при нетравматических внутричерепных кровоизлияниях [Текст] / В.В. Крылов // Нейрохирургия. — 2000. — № 1-2. — С. 72-78. 33. Крылов, В.В. Лекции по нейрореанимации [Текст] / В.В. Крылов, С.С. Петриков, А.А. Белкин. - М.: Медицина, 2009. - 189 с.: ил. 34. Крылов, В.В. Отдаленные результаты хирургического лечения аневризм головного мозга в остром периоде кровоизлияния [Текст] / В.В. Крылов, С.А. Буров // Нейрохирургия. – 2000. - № 4. – С. 61-66. 35. Крылов, В.В. Гидроцефалия при разрыве аневризм головного мозга [Текст] / В.В. Крылов, А.А. Эдин // Журнал вопросы нейрохирургии им. Н.Н. Бурденко. - 1993.- № 3.- С.3034. 36. Крылов, В.В. Компьютерная томография головного мозга при разрыве внутричерепных артериальных аневризм [Текст] / В.В. Крылов, В.В. Лебедев, А.И. Ишмухаметов // Журнал вопросы нейрохирургии им. Н.Н. Бурденко.-1991.-№ 4.-С.25-30. 37. Крылов, В.В. Микрохирургия аневризм виллизиева многоугольника [Текст] / В.В. Крылов, В.В. Ткачев, Г.Ф. Добровольский.- М.: Антидор, 2004.-159с.: ил. 156 38. Крылов, В.В. Раннее хирургическое лечение внутричерепных артериальных аневризм при сосудистом спазме и ишемии мозга [Текст] : автореф. дис. ... д-ра мед. наук / В.В. Крылов.Москва, 1994.- 56с. 39. Крылов, В.В. Принципы микрохирургии аневризм головного мозга аневризм [Текст] / В.В. Крылов, А.Г.Винокуров // Хирургия аневризм головного мозга: руководство в 3-х т. / под ред. В.В. Крылова.- М.: Изд-во Т.А. Алексеева, 2011.-Т. 2.- С. 87-161. 40. Крылов, В.В. Хирургия аневризм базилярной артерии [Текст] / В.В. Крылов, В.Г. Дашьян, А.Г.Винокуров // Хирургия аневризм головного мозга: руководство в 3-х т. / под ред. В.В. Крылова.- М.: Изд-во Т.А. Алексеева, 2011.- Т.2 .- С. 339-380. 41. Лебедев, В.В. Неотложная нейрохирургия: руководство для врачей [Текст] / В.В. Лебедев, В.В. Крылов. – М.: Медицина, 2000. – 568 с.: ил. 42. Лебедев, В.В. Компьютерная томография в неотложной хирургии [Текст] / В.В. Лебедев, В.В. Крылов.- М.: Медицина, 2005. – 315 с.: ил. 43. Лучевая диагностика сосудистых мальформаций и артериальных аневризм головного мозга [Текст] / под ред. Г.Е. Труфанова.- СПб.: Элби, 2006.-224с.: ил. 44. Лукьянчиков, В.А. Тактика хирургического лечения аневризм сосудов головного мозга у больных пожилого возраста в остром периоде субарахноидального кровоизлияния [Текст]: автореф. дис. ... канд. мед. наук / В.А. Лукьянчиков.- Москва, 2010.-31с. 45. Макхамов, К.Э. Ротационная ангиография с трехмерной реконструкцией сосудов в диагностике артериальных аневризм головного мозга [Текст] / К.Э. Макхамов, Ф.З. Джалилов, Н.Г. Дадамянц [и др.] // Нейрохирургия. – 2011. – № 4. – С. 30-34. 46. Мельникова, Е.А. Роль интраоперационных факторов в формировании когнитивных расстройств у больных после разрыва аневризм [Текст] / Е.А. Мельникова, В.В. Крылов // Нейрохирургия. - 2009.- № 4. - С. 19-24. 47. Микрохирургия аневризм головного мозга / под ред. В.В. Крылова. – М.: Новое время, 2011. - 536с.: ил. 48. Мухаметжанов, Д.Ж. Микрохирургия латеральных и заднелатеральных доступов к основанию черепа [Текст]: автореф. дис. ... д-ра мед. наук / Д.Ж. Мухаметжанов.- Москва, 1998.- 50с. 49. Петриков, С.С. Внутричерепное давление, церебральная перфузия и метаболизм в остром периоде внутричерепного кровоизлияния [Текст] / С.С. Петриков, В.В. Крылов // Журнал вопросы нейрохирургии им. Н.Н. Бурденко.- 2009. - № 1.- С11-17. 50. Пятнадцатилетний опыт хирургического лечения церебральных аневризм в остром периоде субарахноидального кровоизлияния [Текст] / В.В. Крылов, В.Г. Дашьян, А.В. Природов [и др.] // Современные методы лечения больных с артериальными аневризмами и 157 артериовенозными мальформациями: материалы гор. науч.-практ. конф.- М.: НИИ СП им. Н.В. Склифосовского, 2007.- (Труды ин-та, Т.200).-С.З-6. 51. Практическая нейрохирургия: руководство для врачей [Текст] / под общ. ред. Б.В. Гайдара.- СПб.: Гиппократ, 2002 .- 648с. 52. Превентивное временное клипирование магистральных артерий мозга при хирургическом лечении артериальных аневризм [Текст] / В.В. Крылов, Г.Ю. Евзиков, В.Н. Шелковский [и др.] // Журнал вопросы нейрохирургии им. Н.Н. Бурденко.- 1997.- № 1.- С.7-11. 53. Рекомендательный протокол ведения больных с субарахноидальным кровоизлиянием вследствие аневризм сосудов головного мозга [Текст] / А.Н. Коновалов, М.А. Пирадов, В.В. Крылов [и др.] // Журнал вопросы нейрохирургии им. Н.Н. Бурденко. – 2006. – № 3. – С. 3-10. 54. Сазон-Ярошевич, А.Ю. Анатомо-клиническое обоснование хирургических доступов к внутренним органам [Текст] / А.Ю. Сазон- Ярошевич.- М.: Медицина, 1954.-180 с.: ил. 55. Сенько, И.В. Микрохирургия аневризм комплекса передней мозговой артерии и передней соединительной артерии в остром периоде кровоизлияния [Текст]: автореф. дис. ... канд. мед. наук / И.В. Сенько.- Москва, 2012.-28 с. 56. Сенько, И.В. Микрохирургическая анатомия передней мозговой и передней соединительной артерий [Текст] / И.В. Сенько, Г.Ф. Добровольский, В.В. Крылов // Нейрохирургия. - 2012.- №1 – С.18-23. 57. Спиранский, В.С. Основы медицинской краниологии [Текст] / В.С. Спиранский.- М.: Медицина, 1988.- 288 с.: ил. 58. Сосудистый спазм при субарахноидальном кровоизлиянии: клинический атлас [Текст] / В.В. Крылов, С.А. Гусев, Г.П. Титова, А.С. Гусев.- М.: Макцентр, 2000.-191 с. 59. Тиссен, Т.П. Возможности спиральной компьютерной томографии в нейрохирургии [Текст] / Т.П. Тиссен, И.Н. Пронин, Т.В. Белова // Нейрохирургия. – 2001. – № 1. – С. 25-55. 60. Ткачев, В.В. Топографо-анатомическое обоснование контрлатерального птерионального доступа в хирургии аневризм сосудов головного мозга [Текст]: автореф. дис. ... канд. мед. наук / В.В. Ткачев.- М., 2002. - 34с. 61. Токарев, А.С. Хирургическое лечение аневризм внутренней сонной артерии в остром периоде кровоизлияния [Текст]: автореф. дис. ... канд. мед. наук / В.В. Токарев.- Москва, 2013.32с 62. Топографическая анатомия межножковой цистерны и эндоскопическая вентрикулоцистерностомия в области дна III желудочка [Текст] / А.А. Суфианов, А.П. Зайцев, Г.З. Суфианова [и др.] // Журнал вопросы нейрохирургии им. Н.Н. Бурденко.- 2007. - № 1.С.40-44. 158 63. Хамидова, Л.Т. Допплерографическая оценка церебральной гемодинамики у больных с разрывами артериальных аневризм головного мозга [Текст]: автореф. дисс. … канд. медицинских наук / Л.Т. Хамидова. – Москва, 2012. – 24с. 64. Хирургия аневризм головного мозга: руководство в 3-х т. [Текст] / под ред. В.В. Крылова.- М.: Изд-во Т.А. Алексеева, 2011-2012. 65. Хирургия опухолей основания черепа [Текст] / под ред. А.Н. Коновалова.- М.: Медицина, 2004.-372 с.: ил. 66. Холин, А.В. Магнитно-резонансная томография при заболеваниях центральной нервной системы [Текст] / А.В. Холин. – СПб., 2007. – 253с. 67. Хуторной, Н.В. Микрохирургические подходы в хирургии аневризм артериального круга большого мозга [Текст]: автореф. дис. ... канд. мед. наук / Н.В. Хуторной.- Москва, 2012.30 с. 68. Черекаев, В.А. Комбинированный орбитозигоматический-транссинусо-фронтальный доступ к распространенной менингиоме основания черепа [Текст] / В.А. Черекаев, А. Х. Бекяшев, А. И. Белов // Журнал вопросы нейрохирургии им. Н.Н. Бурденко. – 2004. – № 1. – С. 40 – 41. 69. Abdulrauf, S.I. Cerebral Revascularization Techniques in Extracranial-to- Intracranial Bypass Surgery [Text] / S.I. Abdulrauf; ed M.G. Yasargil. - Elsevier Saunders, 2011. – 377 р. 70. Alexander, B.L. The combined approach to intracranial aneurysm treatment [Text] / B.L. Alexander, H.A. Riina [et al] // Surg. Neurol. - 2009. - Vol. 72, N. 6. - Р. 596–606. discussion 606 71. Aguiar, Р. Carotid Cave Aneurysm [Text] / Р. Aguiar // Neurosurgery Quarterly. - 2008. - Vol. 18, N 4. - Р. 239-245. 72. Alaywan, M. Fronto-temporal approach with orbito-zygomatic removal. Surgical anatomy [Text] /М. Alaywan, М. Sindou // Acta Neurochir. (Wien). - 1990. -Vol. 104, N. 3. - P. 79-83. 73. Al-Mefty, O. The petrosal approach for the resection retrochiasmatic craniopharingiomas [Text] / О.Al-Mefty // Operative Neurosurgery. – 2008. - Vol. 62. - Suppl. 2.- Р. 331-336. 74. Andaluz, N. Anatomic and clinical study of the orbitopterional approach to anterior communicating artery aneurysms [Text] / N. Andaluz // Neurosurgery. - 2003. - Vol. 52, N. 4. - Р. 1140–1149. 75. Andaluz, N. Aneurysms of the Ophthalmic (C6) Segment of the Internal Carotid Artery [Text] / N. Andaluz, M. Zuccarello // Neurosurgery Quarterly. - 2005. - Vol. 15, N. 2. - Р. 91–102. 76. Andaluz, N. Anterior communicating artery aneurysms surgery through the orbitopterional approach: long term follow-up in a series of 75 consecutive patients [Text] / N. Andaluz, M. Zuccarello // Skull Base. - 2008. - Vol. 18, N. 4.- Р.265-274. 159 77. Andaluz, N. Treatment strategies for complex intracranial aneurysms: review of a 12-year experience [Text] / N. Andaluz, M. Zuccarello // Skull Base. - 2011. - Vol. 21, N.4. - Р. 233-242. 78. Ardeshiri, A. Subtemporal approach to the Tentorial Incisura. Normative Morphometric Date Based on magnetic Resonance Imaging Scans [Text] / А. Ardeshiri, А. Ardeshiri // Operative Neurosurgery. – 2006. - Vol. 58. - Suppl. 2.- Р. 22-28. 79. Aziz, К.M. Petroclival meningiomas: Predictive parameters for transpetrosal approaches [Text] / К.М. Aziz [et al.] // Neurosurgery.-2000.-Vol.47, N. 3.-P.139-152. 80. Bambakidis, N.C. Combined skull base approaches to the posterior fossa. Technical note [Text] / N.C. Bambakidis, F. Gonzalez, R.F. Spetzler // Neurosurg. Focus. - 2005.-Vol. 19, N. 2 (Е8). P. 1-9. 81. Bambakidis, N.C. Management of anterior inferior cerebellar artery aneurysms: an illustrative case and review of literature [Text] / N.C. Bambakidis, R.F. Spetzler // Neurosurg. Focus. - 2009.-Vol. 26, N. 5 (Е6). - P. 43-52. 82. Вanerjee, А. When Is Posterolateral Orbitotomy Useful in a Pterional Craniotomy? A Morphometric Study [Text] / А. Banerjee, А. Nanda // Skull Base. - 2011. - Vol. 21, N. 3. - Р. 147152. 83. Behari, S. Fronto-temporo-orbitozygomatic craniotomy and "half-and-half" approach for basilar apex aneurysms [Text] / S. Behari, R. Das // Neurol. India. - 2009. - Vol. 57, N. 4. - Р. 438-446. 84. Bendok, B.R. Adenosine for temporary flow arrest during intracranial aneurysm surgery: a single-center retrospective review [Text] / B.R. Bendok, D.K. Gupta // Neurosurgery. – 2011. - Vol. 69, N.4. - Р. 815-820. 85. Beretta, F. Image-guided anatomical and morphometric study of supraorbital and transorbital minicraniotomies to the sellar and perisellar regions: comparison with standard techniques [Text] / F.Beretta, N.Andaluz // J. Neurosurg. - 2010. - Vol. 113, N. 5. - Р. 975 - 981. 86. Bilsky, M.H. Craniofacial resections for cranial base malignancies involving infratemporal fossa [Text] / M.H. Bilsky // Operative Neurosurgery. – 2005. - Vol. 57, Suppl. 3. - Р. 339-347. 87. Blackburn, S.L. Endovascular and Surgical Treatment of Unruptured MCA Aneurysms: Meta-Analysis and Review of the Literature/ S. L. Blackburn, A.M. Abdelazim// Stroke Res. Treat.2014. - Vol.2014. - P. 348147 88. Bodily, K.D. Stent-assisted coiling in acutely ruptured intracranial aneurysms: a qualitative, systematic review of the literature [Text] / K.D. Bodily, H.J. Cloft// AJNR Am. J. Neuroradiol. - 2011. - Vol. 32, N.7. - Р. 1232-1236. 89. Buell, T. Optimizing the management of aneurysmal subarachnoid hemorrhage: Lessons learned and future directions [Text] / T. Buell, D. Ding // J. Neuro. Rural. Pract. - 2014 - Vol. 5, N. 2. Р. 108–110. 160 90. Byrne, J.V. Tentorial Dural Fistulas: Endovascular Management and Description of the Medial Dural-Tentorial Branch of the Superior Cerebellar Artery [Text] / J.V. Byrne, М. Garcia // AJNR Am. J. Neuroradiol. - 2013.-Vol. 34, N. 9.- Р-1798-1804. 91. Cavalcanti, D.D. Quantitative Anatomic Study of the Transciliary Supraorbital Approach: Benefits of Additional Orbital Osteotomy? [Text] / D.D. Cavalcanti, U. Garcia-Gonzalez // Operative Neurosurgery. - 2010. - Vol. 66, Suppl. 2. - Р. 205-210. 92. Chalouhi, N. Stent-assisted coiling versus balloon remodeling of wide-neck aneurysms: comparison of angiographic outcomes [Text] / N. Chalouhi, R.M. Starke // AJNR Am. J. Neuroradiol. - 2013. - Vol. 34, N.10. - Р. 1987-1992. 93. Chalouhi, N. Stent-assisted coiling of intracranial aneurysms: predictors of complications, recanalization, and outcome in 508 cases. [Text] / N. Chalouhi, P. Jabbour // Stroke. - 2013. - Vol. 44, N.5. - Р. 1348-1353. 94. Chalouhi, N. Single-center experience with balloon-assisted coil embolization of intracranial aneurysms: safety, efficacy and indications. [Text] / N. Chalouhi, P. Jabbour // Clin. Neurol. Neurosurgery. - 2013. - Vol. 115, N.5. - Р. 607-613. 95. Chalouhi, N. In-stent stenosis after stent-assisted coiling: incidence, predictors and clinical outcomes of 435 cases [Text] / N. Chalouhi, R. Drueding, R.M. Starke // Neurosurgery. - 2013. - Vol. 72. - Р. 390-396. 96. Chanda, A. Anatomical study of the orbitozygomatic transsellar-transcavernous- transclinoidal approach to the basilar artery bifurcation [Text] / A. Chanda, A. Nanda // J. Neurosurg. - 2002. - Vol. 97, N. 2. - Р. 151-160. 97. Chang, S.W. Quantitative comparison of Kawase`s approach versus the retrosigmoid: Approach Implication for tumor involving both Middle and Posterior fossae [Text] / S.W. Chang, A. Wu // Operative Neurosurgery. – 2009. - Vol. 64, N. 1. - Р. 44-52. 98. Changes in case fatality of aneurysmal subarachnoid haemorrhage over time, according to age, sex and region: a meta-analysis [Text] / D. Nieuwkamp, L.E. Setz, A. Algra [et al.] // Lancet Neurol. - 2009. - Vol. 8, N. 7. - P.635 - 642. 99. Chitale, R. Treatment of ruptured intracranial aneurysms: comparison of stenting and balloon remodeling [Text] / R. Chitale, N. Chalouhi // Neurosurgery. – 2013. - Vol. 72, N. 6. - Р. 953-959. 100. Choudhri, O. Combined Endovascular and Microsurgical Management of Complex Cerebral Aneurysms [Text] / O. Choudhri, N. Mukerji // Front Neurol. - 2013.-Vol. 4. - Р.108-115. 101. Cunha, А. The Orbitopterional Approach for Large and Giant Middle Cerebral Artery Aneurysms [Text] / А. Cunha [et al.] // Skull Base. - 2010.-Vol. 20, N. 4. - Р.261-267. 161 102. D`Ambrosio, A.L. Quantification of the frontotemporal orbitizygomatic approach using a three-dimensional visualization and modeling application [Text] / A.L. D`Ambrosio, J. Mocco // Operative Neurosurgery. – 2008. - Vol. 62, N. 1.- Р. 251-261. 103. Day, J.D. The Middle Fossa Approach and Extended Middle Fossa Approach [Text] / J.D.Day // Operative Neurosurgery. - 2012. - Vol.70, N. 4. - Р.192-201. 104. Dayoub, H. The Relationship between the zygomatic arch and the floor of the Middle Cranial Fossa A Radiographic Study [Text] / H. Dayoub, W. Schueler // Operative Neurosurgery. – 2010. Vol. 66, N. 2. - Р. 363-369. 105. Delgado, A. J. E-052 Initial Institutional Experience with the Sceptre XC Balloon for the Endovascular Treatment of Cerebral Aneurysms [Text] / AJ. Delgado, Y. Kadkhodayan // J Neurointerv. Surg. – 2014. - Vol. 6, N 1. - Р. 62-63. 106. Diaz, O.M. Middle cerebral artery aneurysms: a single-center series comparing endovascular and surgical treatment [Text] / O.M. Diaz, L. Rangel-Castilla // World Operative Neurosurgery. – 2014. - Vol. 81, N. 2. - Р. 322-329. 107. Ding, D. E-046 thromboembolic and haemorrhagic complications associated with endovascular coil embolization of ruptured basilar apex aneurysms [Text] / D. Ding , D. Raper // J Neurointerv Surg. – 2014. - Vol. 6, N. 1. - Р. 59-62. 108. Dolenc, V.V. Microsurgical anatomy and surgery of the central skull base [Text] / V.V. Dolenc. - New York, Wien. Springer, 2003 - 384 р. 109. Dzierzanowski, J. Morphometry of the pterional and pterional-orbitozygomatic approaches to the basilar artery bifurcation by the use of neuronavigation systems: a new technical concept [Text] / J. Dzierzanowski, Р. Słoniewski // Folia. Morphol. (Warsz.) – 2008. - Vol. 67, N. 4.- Р. 267-272. 110. Evans, J.J. Bypass grafting and revascularization in the management of posterior circulation aneurysms [Text] / J.J. Evans, L.N. Sekhar // Neurosurgery. – 2004. - Vol. 55, N. 3. - Р. 1036–1049. 111. Fandino, J. The concept of a hybrid operating room: applications in cerebrovascular surgery [Text]/ J. Fandino, P. Taussky // Acta Neurochir. -2013. - Vol. 115.- Р.113-117. 112. Fernandez-Miranda, J.C. Microvascular anatomy of the medial temporal region: Part I: Its Application to Arteriovenous malformation surgery [Text] / J.C. Fernandez-Miranda, Е. de Oliveira // Operative Neurosurgery. – 2010. - Vol. 67, N. 1. - Р. 237-276. 113. Figueiredo, E.G. Anatomical and quantitative description of the transcavernous approach to interpeduncular and prepontine cisterns. Technical note [Text] / E.G. Figueiredo, J.M. Zabramski // J. Neurosurg. - 2006. - Vol. 104, N. 1.- Р.957–964. 114. Figueiredo, E.G. Comparative Analysis of anterior petrosectomy and transcavernus Approaches to retrosellar and upper clival basilar artery aneurysms [Text] / E.G. Figueiredo, Р. Deshmukh // Operative Neurosurgery. – 2006. - Vol. 58, Suppl. 1. - Р. 13-21. 162 115. Figueiredo, E.G. Quantitative anatomic study of three surgical approaches to the anterior communicating artery complex [Text] / E.G. Figueiredo, Р. Deshmukh // Operative Neurosurgery. – 2005. - Vol. 56, N. 2. - Р. 397-405. 116. Fischer, G. The Keyhole concept in aneurism surgery: results of the past 20 years [Text] / G. Fischer // Operative Neurosurgery. - 2011.-Vol.68, N. 1.- Р.45-51. 117. François, Р. Anterior transpetrosal and subtemporal transtentorial approaches for pontine cavernomas [Text] / Р. François, М. Ismail // Acta Neurochirurgica. – 2010. - Vol. 152, N 8. - Р. 13211329. 118. Froelich, S. Exposure of the distal cervical segment of the internal carotid artery using the trans-spinosum corridor: cadaveric study of surgical anatomy [Text] / S. Froelich, K.A. Aziz // Operative Neurosurgery. – 2008. - Vol. 62, Suppl. 2.- Р. 354-362. 119. Froelich, S. Extension the One-piece orbitozygomatic Frontotemporal approach to the clenoid fossa: Cadaveric Study [Text] / S. Froelich, K.A. Aziz // Operative Neurosurgery. – 2008. - Vol. 62, Suppl. 2. - Р. 312-317. 120. Fujitsu, K. Zygomatic approach for lesions in the interpeduncular cistern [Text] / К.Fujitsu, Т. Kuwabara // J. Neurosurg. – 1985. - Vol. 62, N. 1. - Р. 340-343. 121. Fukushima, Т. Fukushima Manual of Skull Base Dissection (Third Edition). [Text] / Т.Fukushima - New York, AF Neuro Video, Inc. Printing: i WORD Co, LTD, 2012. - 427 р. 122. Gao, X. Wingspan stent-assisted coiling of intracranial aneurysms with symptomatic parent artery stenosis: experience in 35 patients with mid-term follow-up results [Text] / X. Gao , G. Liang // Eur. J. Radiol. – 2012. - Vol. 81, N. 5. - Р. 750-756. 123. Geyik, S. Stent-assisted coiling in endovascular treatment of 500 consecutive cerebral aneurysms with long-term follow-up [Text] / S. Geyik, K. Yavuz // AJNR Am. J. Neuroradiol.- 2013. Vol. 34, N. 11. - Р. 2157-2162. 124. Golshani, K. Stent-assisted coil emboilization of ruptured intracranial aneurysms: a retrospective multicenter review [Text] / K. Golshani, A. Ferrel // Surg. Neurol. Int. - 2012. - Vol. 3. Р. 84-98. 125. Gonzalez, L.F. Anteroinferior cerebellar artery aneurysms: surgical approaches and outcomes-a review of 34 cases [Text] / L.F. Gonzalez, M.J. Alexander // Neurosurgery. – 2004. - Vol. 55, N. 6. - Р. 1025-1035. 126. Gonzalez, L.F. Distinction between paraclinoid and cavernous sinus aneurysms with computed tomographic angiography [Text] / L.F. Gonzalez, M.T. Walker // Neurosurgery. – 2003. Vol. 52, N. 5. - Р. 1131-1139. 127. Gonzalez, L.F. Skull base approaches to the basilar artery [Text] / L.F. Gonzalez, S. Amin- Hanjani // Neurosurg. Focus. - 2005. - Vol.19, N. 2 (Е3). - P. 1-12. 163 128. Gonzalez, L.F. Working area and angle of attack in three cranial base approaches: Pterional, orbitozygomatic, and maxillary extension of the orbitozygomatic approach [Text] / L.F. Gonzalez, N.R. Crawford, M.A. Horgan // Neurosurgery. – 2002. - Vol. 50, N. 4. - Р. 550-557. 129. Goto, T. Falcotentorial meningioma: surgical outcome in 14 patients [Text] / T. Goto, K. Ohata // J. Neurosurg. - 2006. - Vol. 104, N. 1. - Р.47-53. 130. Gross, B.A. Petrosal approaches to posterior circulation aneurysms [Text] / B.A. Gross, D. Tavanaiepour, O. Al-Mefty // Neurosurg. Focus - 2012.-Vol. 33, N. 2 (Е9). - P. 1-10. 131. Gross, В.А. Petrosal approaches to brainstem cavernous malformations [Text] / В.А. Gross, I.F. Dunn // Neurosurg. Focus. - 2012.-Vol. 33, N. 2 (Е10).-P.1-9. 132. Hacein-Bey, L. Complex intracranial aneurysms: combined operative and endovascular approaches [Text] / L. Hacein-Bey, E.S. Connolly // Neurosurgery - 1998. - Vol. 43, N. 6. - P. 1312 1313. 133. Hafez, A. Preservation of the superior petrosal sinus during the petrosal approach. Technical note [Text] / A. Hafez, R. Nader, O. Al-Mefty // J. Neurosurg. – 2011. - Vol. 114, N. 3. - Р. 12941298. 134. Hakuba, A. The orbitozygomatic infratemporal approach: A new surgical technique [Text] / А. Hakuba, S. Liu // Surg. Neurol. - 1986.-Vol. 26, N. 2.- P. 271-276. 135. Hanel, R.A. Surgical treatment of complex intracranial aneurysms [Text] / R.A. Hanel, R.F. Spetzler // Neurosurgery. - 2008.-Vol. 62, Suppl. 3.- P. 1289-1299. 136. Hasegawa, T. Anatomical Variation of the Straight Sinus/Straight sinus on MRI [Text] / T. Hasegawa // Surg.Neurol. - 1991. - Vol. 36. - Р. 354-359. 137. Hentschel, S.J. Malignat Tumors of the anterolateral Skull Base [Text] / S.J. Hentschel [et al.] // Neurosurgery. – 2010. - Vol. 66, N. 1.- Р. 102-112. 138. Hetts, S.W. Stent-assisted coiling versus coiling alone in unruptured intracranial aneurysms in the matrix and platinum science trial: safety, efficacy, and mid-term outcomes [Text] / S.W. Hetts, A. Turk// AJNR Am. J. Neuroradiol. - 2014. - Vol. 35, N.4. - Р. 698-705. 139. Hoh, B.L. Combined surgical and endovascular techniques of flow alteration to treat fusiform and complex wide-necked intracranial aneurysms that are unsuitable for clipping or coil embolization [Text] / B.L. Hoh, CM. Putman // J. Neurosurg. – 2001. - Vol. 95, N. 1. - Р. 24-35. 140. Hokama, M. Microsurgical anatomy of the ophthalmic artery and the distal dural ring for the juxta-dural ring aneurysms via the pterional approach [Text] / M. Hokama, K. Hongo // Neurol. Res. – 2001. - Vol. 23, N. 4. - Р. 331-335. 141. Horgan, M.A. Classification and quantification of the petrosal approach to the petroclival region [Text] / M.A. Horgan, G.J. Anderson // J. Neurosurg. – 2000. - Vol. 93, N. 3. - Р. 108-112. 164 142. Horgan, M.A. Surgical approach for the treatment of the aneurysms of the P2 segment of the posterior cerebral artery [Text] / M.A. Horgan, R.F. Spetzler // Neurosurgery. – 2000. - Vol. 47. - Р. 365 (comment). 143. Horiuchi, T. Relationship between the ophthalmic artery and the dural ring of the internal carotid artery. Clinical article. [Text] / T. Horiuchi, Y. Tanaka // J. Neurosurg. – 2009. - Vol. 111, N. 1. - Р. 119-123. 144. Hsu, F.P. Orbitozygomatic approach to basilar apex aneurysms [Text] / F.P. Hsu, R.E. Clatterbuck // Neurosurgery. – 2005. - Vol. 56, N. 3. - Р. 172-177. 145. Huynh-Le, P. Surgical anatomy of the ophthalmic artery: Its origin and proximal course [Text] / Р. Huynh-Le, Y. Natori // Operative Neurosurgery. – 2005. - Vol. 57, Suppl. 3. - Р. 236 - 241. 146. Hwang, J. S. Endovascular coiling versus neurosurgical clipping in patients with unruptured intracranial aneurysm: a systematic review [Text] / J. S. Hwang, M. K. Hyu // BMC Neurol.- 2012.Vol. 12. - Р. 99-113. 147. Ikeda, K. Orbitozygomatic temporopolar approach for a high basilar tip aneurysm associated with a short intracranial internal carotid artery: A new surgical approach [Text] / K. Ikeda, J. Yamashita // Neurosurgery. – 1991. - Vol. 28, N. 4. - Р. 105-110. 148. Iwashita, T. Aneurysm originating from the fenestration of the posterior cerebral artery: case report [Text] / T. Iwashita, Y. Tanaka, K. Hongo // Neurosurgery. – 2002. - Vol. 50, N. 4. - Р. 881884. 149. Joo, W. Microsurgical Anatomy of the Carotid Cave [Text] / W. Joo, T. Funaki // Operative Neurosurgery. - 2012. - Vol. 70, N. 1.- Р. 300-312. 150. Johnston, S.C. Predictors of rehemorrhage after treatment of ruptured intracranial aneurysms: the Cerebral Aneurysm Rerupture After Treatment (CARAT) study [Text] / S.C. Johnston, CF. Dowd // J. Neurosurg.– 2008.- Vol.39, N. 1.- Р.120-125. 151. Kawase, T. Transpetrosal approach for aneurysms of the lower basilar artery [Text] / T. Kawase, S. Toya // J. Neurosurg.– 1985.- Vol.63, N. 4.- Р.857-861. 152. Kawase, T. Surgical approaches for vertebro-basilar trunk aneurysms located in the midline [Text] / T. Kawase // Acta Neurochir. (Wien) – 1996. - Vol. 138, N. 2. - Р. 402-410. 153. Khan, S.H. Comparison of coil types in aneurysm recurrence [Text] / S.H. Khan, C. Nichols // Clin. Neurol. Neurosurgery. - 2012. - Vol. 114, N. 1. - Р.12-16. 154. Kim, J.M. Microsurgical Anatomic Features and Nomenclature of the Paraclinoid Region [Text] / J.M. Kim, A. Romano // Neurosurgery. – 2000. - Vol. 46, N. 3. - Р. 670-682. 155. Kim, B.M. Clinical presentation and outcomes of coil embolization of remnant or recurred intracranial aneurysm after clipping [Text] / B.M. Kim, D.J. Kim // Neurosurgery. – 2010. - Vol. 66, N. 6. - Р. 1128-1233. 165 156. Kim L.J. Multimodality treatment of Complex Unruptured cavernous and paraclinoid aneurysms [Text] / L.J. Kim, F. Tarig // Neurosurgery. - 2014. - Vol. 74, N.1. - Р. 51-61. 157. Kobayashi, S. Juxta-dural ring aneurysms of the internal carotid artery [Text] / S. Kobayashi [et al.] // J. Clin. Neurosci. – 1995. - Vol. 2, N. 4. - Р. 345-349. 158. Krisht, A.F. Results of microsurgical clipping of 50 high complexity Basilar Apex Aneurysms [Text] / А.F. Krisht [et al.] // Neurosurgery. – 2007. - Vol. 60, N. 2. - Р. 242 - 252. 159. Krisht, A.F. Surgical Clipping of Complex Basilar Apex Aneurysms: A Strategy for Successful Outcome Using the Pretemporal Transzygomatic Transcavernous Approach [Text] /A.F. Krisht, P. Kadri // Operative Neurosurgery. – 2005. - Vol. 56, Suppl. 2. - Р. 261-273. 160. Krisht, A.F. Transcavernous approach to diseases of the anterior upper third of the posterior fossa [Text] / A.F. Krisht [et al.] // Neurosurgical Focus. – 2005. - Vol. 19, N. 2 (Е) - Р.1-10. 161. Kulwin, С. Anterior clinoidectomy: Description of an alternative hybrid method and a review of the current techniques with an emphasis on complication avoidance [Text] / C. Kulwin [et al.] // Surg. Neurol. Int. – 2011. - Vol. 2. - Р. 140. 162. Kumar, S.G. Intradural anterior petrosectomy for petroclival meningiomas: a new surgical technique and results in 5 patients [Text] / S.G. Kumar // J. Neurosurg. – 2012. - Vol. 117, N. 6. - Р. 1007-1012. 163. Kusumi, M. Microplate-Bridge technique for watertight Dural closures in combined Petrosal Аapproach [Text] / М. Kusumi, Т. Fukushima // Operative Neurosurgery. – 2012. - Vol. 70, Suppl. 2. Р. 264-269. 164. Kusumi, M. The Middle Fossa Approach for total resection of petrous apex cholesterol granulomas: use of vascularized galeofascial flap preventing Recurrence [Text] / М. Kusumi, Т. Fukushima // Oper. Neurosurg. – 2013. - Vol. 72, Suppl. 1. - Р. 72-86. 165. Kyoshima, K. Interdural origin of the ophthalmic artery at the dural ring of the internal carotid artery. Report of two cases [Text] / K. Kyoshima, S. Oikawa // J. Neurosurg. – 2000. - Vol. 92, N. 3. - Р. 488-489. 166. Lang, J. Skull base and related structures. Atlas of Clinical Anatomy [Text] / J. Lang - Stuttgart: Schattauer, 1995.-330 p. 167. Langevin, C.J. Lateral Transzygomatic Approach to sphenoid wing meningiomas [Text] / C.J. Langevin, M.M. Hanasano // Operative Neurosurgery. – 2010. - Vol. 67, N. 2.- Р. 377-384. 168. Lawson, M.F. Stent-associated flow remodeling causes further occlusion of incompletely coiled aneurysms [Text] / M.F. Lawson, W.C. Newman // Neurosurgery. – 2011. - Vol. 69. - Р. 598603. 166 169. Lawton, M.T. Combined microsurgical and endovascular management of complex intracranial aneurysms [Text] / M.T. Lawton, R.O. Sanchez-Mejia // Neurosurgery. – 2003. - Vol. 52, N 2. - Р. 263-274. 170. Li, H. Clipping versus coiling for ruptured intracranial aneurysms: a systematic review and meta-analysis[Text] / H. Li, R. Pan // Stroke.– 2013. - Vol. 44, N. 1. - Р. 29-37. 171. Lim, Y.C. Combined endovascular and microsurgical procedures as complementary approaches in the treatment of a single intracranial aneurysm [Text] / Y.C. Lim, Y.C. Shin // J. Korean Neurosurg. Soc. - 2008. - Vol. 43, N.1 - Р. 21-25. 172. Little, A.S. Quantitative analysis of exposure anatomic of staged of orbitozygomatic and retrosigmoid craniotomies for lesions of the clivus with supratentorial extension [Text] / A.S. Little [et al.] // Operative Neurosurgery. – 2008. - Vol. 62, N. 2. - Р. 318-324. 173. Little, A.S. Brain retraction and thickness of cerebral neocortex: An automated technique for detecting retraction-Induced anatomic changes using MRI [Text] / A.S. Little [et al.] // Operative Neurosurgery. – 2010. - Vol. 67, N. 1. - Р. 277- 282. 174. Liu J.K. The combined transmastoid retro- and infralabyrinthine transjugular transcondylar transtubercular high cervical approach for resection of glomus jugular tumors [Text] / J.K. Liu, T. Sameshima // Operative Neurosurgery. – 2006. - Vol. 59, N. 1. - Р. 115-125. 175. Lubicz, B. Balloon-assisted coiling of intracranial aneurysms is not associated with a higher complication rate [Text] / B. Lubicz, F. Lefranc / Neuroradiology. - 2008.-Vol. 50, N. 9. - Р. 769-776. 176. Lyness, L. Clipping of distal superior cerebellar artery aneurysm with preservation of the parent vessel: a case report [Text] / L. Lyness // Br. J. Neurosurg. – 2012. - Vol. 26, N. 1. - Р. 83-85. 177. Mai, J.C. Flow diversion radial artery bypass graft coupler with terminal basilar Artery occlusion for complex basilar apex Aneurysms: operative nuances [Text] / J.C. Mai, F. Tarig // Operative Neurosurgery. – 2013. - Vol. 72, Suppl. 1. - Р. 116 - 126. 178. Mariniello, G. Lateral orbitotomy for removal of sphenoid wing meningiomas invading the orbit [Text] / G. Mariniello, F. Maiuri // Operative Neurosurgery. – 2010. - Vol. 66, N. 2. - Suppl. 1.Р. 287-292. 179. Mathiesen, T. Effects of using combined transpetrosal surgical approaches to treat petroclival meningiomas [Text] / T. Mathiesen, A. Gerlich // Neurosurg. – 2008. - Vol. 62, N. 6. - Suppl. - Р.982992. 180. Matsuyama, T. Mobilization of the Internal carotid artery for basilar artery aneurysm surgery. Technical note [Text] / T. Matsuyama, T. Shimomura, Y. Okumura // J. Neurosurg. – 1997. - Vol. 86. Р. 394 - 397. 181. Mc Dougall, C.G. The Barrow Ruptured Aneurysm Trial [Text] / C.G. McDougall, R.F. Spetzler, J.M. Zabramski // J. Neurosurg. – 2012. - Vol. 116, N.1. - Р. 135-144. 167 182. Mc Laughlin, N. Use of stent-assisted coil embolization for the treatment of wide-necked aneurysms: A systematic review [Text] / N. Mc Laughlin, D.L. Mc Arthur // Surg. Neurol. Int. – 2013. - Vol. 30, N.4. - Р. 43-51. 183. Modi, J. Balloon-Assisted Rapid Intermittent Sequential Coiling (BRISC) Technique for the Treatment of Complex Wide-Necked Intracranial Aneurysms [Text] / J. Modi, M. Eesa // Interv. Neuroradiol. - 2011. - Vol.17, N.1. - Р. 64-69. 184. Molyneux, A. International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial [Text] / A. Molyneux, R. Kerr, I. Stratton // The Lancet. – 2002. - Vol. 360, N. 9342. - Р. 1267–1274. 185. Molyneux, A. Risk of recurrent subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the International Subarachnoid Aneurysm Trial (ISAT): long-term follow-up [Text] / A. Molyneux, R.Kerr, I.Stratton // Lancet Neurol. – 2009. - Vol. 8, N. 5. - Р. 427-433. 186. Moret, J. The "Remodelling Technique" in the Treatment of Wide Neck Intracranial Aneurysms. Angiographic Results and Clinical Follow-up in 56 Cases Note [Text] / Interv. Neuroradiol. - 1997.- Vol. 30, N. 3. - Р. 21-35. 187. Murayama, Y. Combined surgical and endovascular treatment of complex cerebrovascular diseases in the hybrid operating room / Y. Murayama, H. Arakawa // J. Neurointerv. Surg. – 2013.Vol. 1, N. 5. - Р. 489-493. 188. Nakamura, M. Microsurgical clipping of previously coiled intracranial aneurysms [Text] / M. Nakamura, G.R. Montibeller // Clin. Neurol. Neurosurg.- 2013. - Vol. 115, N.8.- Р.1343-1349. 189. Nathal, Е. Surgical Treatment of Paraclinoid Aneurysms [Text] / E. Nathal, G. Castillo // Schmidek and Sweet's Operative Neurosurgical Techniques Indications Methods and Results / ed. A. Quiñones-Hinojosa.- 6th ed.-Philadelphia, Saunders, Elsevier Inc, 2012. - Vol. l. - Р. 855 - 871. 190. Nishido, H. Analysis of complications and recurrences of aneurysm coiling with special emphasis on the stent-assisted technique [Text] / H. Nishido, M. Piotin // AJNR Am. J. Neuroradiol. 2014. - Vol. 35, N.2. - Р. 339- 344. 191. Nossek, E. Internal Maxillary artery - Middle Cerebral Artery Bypass: Infratemporal Approach for Subcranial-Intracranial (SC-IC) Bypass [Text] / E. Nossek [et al.] // Neurosurgery. 2014. - Vol. 75, N. 1.- Р.87-95. 192. Origitano, T.C. Combined anterior and anterolateral approaches to the cranial base complication analysis avoidance and management [Text] / T.C. Origitano, G. J. Petruzzelli // Operative Neurosurgery. - 2006. - Vol. 58, Suppl. 2. - Р.327-337. 193. Osawa, S. Microsurgical and endoscopic anatomy of the Vidian Canal [Text] / S. Osawa, A.L. Jr. Rhoton // Operative Neurosurgery. - 2009. - Vol. 64, Suppl. 2. - Р. 385 - 412. 168 194. Osawa, S. Microsurgical anatomy and surgical exposure of the Petrous segment of the internal carotid artery [Text] / S. Osawa, A.L. Jr. Rhoton // Operative Neurosurgery. – 2008. - Vol. 63, Suppl. 2. - Р.210 - 239. 195. Ozveren, M.F. Meningovenous Structures of the Petroclival Region: Clinical Importance for Surgery and Intravascular Surgery [Text] / M.F. Ozveren, K. Uchida, S. Aiso // Neurosurgery. - 2002. - Vol. 50, N. 4. - Р. 829-837. 196. Pierot, L. CLARITY Investigators Remodeling technique for endovascular treatment of Ruptured Intracranial Aneurysms had a higher rate of adequate postoperative occlusion tnan did conventional coil embolization with comparable safety [Text] / L. Pierot, C. Cognard // Radiology. 2011. - Vol. 258. - Р. 546-5310. 197. Pierot, L. Endovascular treatment of unruptured intracranial aneurysms: comparison of safety of remodeling technique and standard treatment with coils [Text] / L. Pierot, L. Spelle // Radiology. 2009. - Vol. 251, N. 3. - Р. 846-855. 198. Piеrot, L. Safety and efficacy of balloon remodeling technique during endovascular treatment of intracranial aneurysms: critical review of the literature [Text] / L. Piеrot, C. Cognard, L. Spelle// AJNR Am. J. Neuroradiol. - 2012. - Vol. 33, N. 1. - Р. 12-17. 199. Pichierri, A. Endoscopic Assistance in the Epidural subtemporal approach and Kawase approach: Anatomic Study [Text] / A. Pichierri, E. d`Avella // Operative Neurosurgery. – 2010. - Vol. 67, N. 3. - Suppl.1. - Р. 29-37. 200. Piotin, M. Balloons and Stents in the Endovascular Treatment of Cerebral Aneurysms: Vascular Anatomy Remodeled [Text] / M. Piotin, R. Blanc // Front. Neurol. - 2014.- Vol. 5. - Р. 41-50. 201. Piotin, M. Stent-assisted coiling of intracranial aneurysms: clinical and angiographic results in 216 consecutive aneurysms [Text] / M. Piotin, R. Blanc // Stroke. - 2010.- Vol. 41,N. 1. - Р. 110-115. 202. Pontius, A.T. Extended orbitozygomatic approach to the skull base to improve access to the cavernous sinus and optic chiasm [Text] / A.T. Pontius, Y. Ducic // Otolaryngol. Head Neck Surg. – 2004. - Vol. 130. - Р. 519-525. 203. Post, N. Role of uncal resection in optimizing Transsylvian access to the Basilar Apex: Cadaveric Investigetion and Preliminary clinical experience in eight patients [Text] / N. Post, S.M. Russell // Operative Neurosurgery. – 2005. - Vol. 56, Suppl. 2. - Р. 274-280. 204. Powers, C.J. Transient Adenosine-Induced Asystole During the surgical treatment of anterior circulation cerebral aneurysms: technical note [Text] / C.J. Powers, D.R. Wright // Operative Neurosurgery. - 2010. - Vol. 67, N. 2. - Р.461- 470. 205. Prevedello, D. Extradural Endoscope-Assisted subtemporal posterior clinoidectomy: a cadaver investigation study [Text] / D. Prevedello, C.D. Pinherio-Neto // Operative Neurosurgery. 2010. - Vol. 67, N. 1. - Р. 43-48. 169 206. Ramina, R. Reconstruction of the cranial base in surgery for jugular foramen tumors [Text] / R. Ramina [et al.] // Operative Neurosurgery. – 2005. - Vol. 56, Suppl. 2. - Р. 337-343. 207. Raymond, J. Long-term angiographic recurrences after selective endovascular treatment of aneurysms with detachable coils tumors [Text] / J. Raymond, F. Guilbert // Stroke. – 2003. - Vol. 34. Р. 1398-13403. 208. Raza, S.M. Frontozygomatic Titanium Cranioplasty in Frontosphenotemporal («Pterional») craniotomy [Text] / S.M. Raza, Q-A. Thai // Operative Neurosurgery. – 2008. - Vol. 62, Suppl. 1. - Р. 262-265. 209. Reisch, R. A. Topographic microsurgical anatomy of the paraclinoid carotid artery [Text] / R. Reisch, A. Perneczky // Neurosurg. Rev. – 2002. - Vol. 25, N. 3. - Р. 177-183. 210. Rhoton, A.L.Jr. Cranial Anatomy and surgical approaches, Neurosergery [Text] / A.L. Jr. Rhoton. – Lippincott Williams $ Wilkins, 2006.- 746 p. 211. Roche, P.H. Temporopolar epidural transcavernous transpetrous approach. Technique and indications [Text] / P.H. Roche, P. Mercier // Neurochirurgie. – 2007. - Vol. 53, N. 1. - Р. 23-31. 212. Roche, P.H. The combined petrosal approach. Anatomical principles, surgical technique and indications [Text] / P.H. Roche, H.D. Fournier, T. Sameshima // Neurochirurgie. - 2008. - Vol. 54, N. 1. - Р. 1-10. 213. Rodríguez-Hernández, A. Segmental anatomy of cerebellar arteries: a proposed nomenclature. Laboratory investigation [Text] / A. Rodríguez-Hernández, A.L. Jr. Rhoton, M.T. Lawton // J. Neurosurg. - 2011. - Vol. 115, N. 2. - Р.387-397. 214. Rodríguez-Hernández, A. Superior cerebellar artery-posterior cerebral artery bypass: in situ bypass for posterior cerebral artery revascularization [Text] / A. Rodríguez-Hernández, C. Huang, M.T. Lawton // J. Neurosurg. – 2013. - Vol. 118, N. 5. - Р. 1053-1057. 215. Rodríguez-Hernández, A. Current management of middle cerebral artery aneurysms: surgical results with a "clip first" policy [Text] / A. Rodríguez-Hernández, ME Sughrue // Neurosurgery. – 2013. - Vol. 72, N. 3. - Р. 415-427. 216. Safavi-Abbasi, S. The craniocaudal extension of posterolateral approaches and their combination: A Quantitative anatomic and clinical analysis [Text] / S. Safavi-Abbasi [et al.] // Operative Neurosurgery. - 2010. - Vol. 66, Suppl. 1.- Р.54-64. 217. Salma, A. Extradural endoscop-assisted subtemporal posterior clinoidectomy: a cadaver investigation study [Text] / A. Salma, S. Wang // Operative Neurosurgery. – 2010. - Vol. 67, Suppl. 1. - Р. 43-48. 218. Sanai, N. The current role of microsurgery for posterior circulation aneurysms: a selective approach in the endovascular era [Text] / N. Sanai, P. Tarapore // Neurosurgery. - 2008. - Vol. 62, N.6. - Р.1236-1249. 170 219. Santiago-Dieppa, D.R. Endovascular and Surgical Options for Ruptured Middle Cerebral Artery Aneurysms: Review of the Literature [Text] / D.R. Santiago-Dieppa, J.S. Pannell // Stroke Res Treat. - 2014. - Vol. 6. - Р.176-179. 220. Santillan, A. Balloon-assisted coil embolization of intracranial aneurysms is not associated with increased periprocedural complications [Text] / A. Santillan, Y.P. Gobin // J. Neurointerv. Surgery.-2013. - Vol. 5, Suppl. 3. - Р. 56-61. 221. Scholz1, M. Skull Base Approaches in Neurosurgery [Text] / M.Scholz1, R. Parvin, J. Thissen // Head & Neck Oncology. – 2010. - Vol. 2. - Р. 16-25. 222. Schramm, J. Surgery for temporal mediobasal tumors: experience based on a series of 235 patients [Text] / J. Schramm [et al.] // Neurosurg. – 2008. - Vol. 62, N. 5.- Suppl. - Р. 1272-1282. 223. Schwartz, M.S. Quantification of increased exposure resulting from orbital rim and orbitozygomatic osteotomy via the frontotemporal transsylvian Approach [Text] / M.S. Schwartz // J. Neurosurg. – 1999. - Vol. 91. - Р. 1020-1026. 224. Sekhar, L. N. Atlas of neurosurgical techniques. Brain [Text] / L.N. Sekhar, R.G. Fessler. – New York, Stuttgart: Thieme Medical, 2006. - 1074p. 225. Sekhar, L. N. Cerebral revascularization for ischemia aneurisms and cranial base tumors [Text] / L.N. Sekhar, S.K. Natarian // Neurosurg. – 2008. - Vol. 62, N. 6. - Suppl. 3. - Р.1373-1410. 226. Sen, C.N. Lateral transcondylar approach [Text] / C.N. Sen [et al.] // Neurosurgery. – 2010. - Vol. 66, N. 3. - Suppl. - A104-A112. 227. Seoane, E.R. The pretemporal transcavernous approach to the interpeduncular and prepontine cisterns: microsurgical anatomy and technique application [Text] / E.R. Seoane, H. Tedeschi, E. de Oliveira // Neurosurg. – 2000. - Vol. 46, N. 3. - Р. 891-899. 228. Shapiro, M. Safety and efficacy of adjunctive balloon remodeling during endovascular treatment of intracranial aneurysms: a literature review [Text] / M. Shapiro, J. Babb, T. Becske // AJNR Am. J. Neuroradiol. - 2008. - Vol. 29. - Р. 1777-1781. 229. Shapiro, M. Stent-supported aneurysm coiling: a literature survey of treatment and follow-up [Text] / M Shapiro, T. Becske// AJNR Am. J. Neuroradiol. - 2012. - Vol. 33, N1. - Р. 159-163 230. Shimitzu, S. Mac Carty keyhole and inferior orbital fissure in orbitozygomatic craniotomy [Text] / S. Shimitzu, N. Tanriover // Oper. Neurosurg. – 2005. - Vol. 57, Suppl. 1. - Р. 152-159. 231. Siwanuwatn, R. Quantitative analysis of working area and angle of attack for the retrosigmoid, combined petrosal and transcochlear approaches to the petroclival region [Text] / R. Siwanuwatn, P. Deshmukh // J.Neurosurg. - 2006. - Vol. 104, N 1. - Р.137-142. 232. Skrap, M. Use of the arachnoid membrane of the cerebellopontine angle to transpose the superior cerebellar artery in microvascular decompression for trigeminal neuralgia: technical note [Text] / M. Skrap, F. Tuniz // Oper. Neurosurg. – 2010. - Vol. 66, Suppl. 1. - Р. 88-91. 171 233. Spetzler, R.F. Giant aneurysms [Text] / R.F. Spetzler, H.A. Riina // Neurosurg. – 2001. - Vol. 49, N3. - Р. 902 - 908. 234. Spetzler, R.F. The Barrow Ruptured Aneurysm Trial: 3-year results [Text] / R.F. Spetzler, CG. Mc Dougall // J. Neurosurg. - 2014. - Vol. 120, N 2. - Р.581. 235. Spelle, L. Remodeling Technique in the Treatment of Intracranial Aneurysms: Indications, Limits and Non-indications [Text] / L. Spelle, M. Piotin// Interv. Neuroradiol. - 2008. - Vol. 14, Suppl. 1. - Р. 52–59. 236. Spiotta, A.M. An analysis of inflation times during balloon-assisted aneurysm coil embolization and ischemic complications [Text] / А.М. Spiotta, Т. Bhalla // Stroke. - 2011. - Vol. 42. - Р. 1051-1055. 237. Steiger, H.J. Custom-tailored transdural anterior transpetrosal approach to ventral pons and retroclival regions [Text] / H.J. Steiger, D.Hanggi, W. Stummer // J. Neurosurg.– 2006. - Vol. 104, N 1. - Р. 38-46. 238. Sughrue, ME. Giant Intracranial Aneurysms: Evolution of Management in a Contemporary Surgical Series [Text] / ME. Sughrue, D. Saloner // Neurosurg. – 2011. - Vol. 89, N8. - Р.1281 - 1271. 239. Terasaka, S. Basilar trunk aneurysm surgically treated with anterior petrosectomy and external carotid artery-to-posterior cerebral artery bypass: technical note [Text] / S. Terasaka, K. Itamoto // Neurosurg. – 2002. - Vol. 51, N5. - Р.1083 - 1088. 240. Tubbs, R.S. Refined and simplified surgical landmarks for the MacCarty Keyhole and Orbitozygomatic Craniotomy [Text] / R.S. Tubbs [et al.] // Operative Neurosurg. – 2010. - Vol. 66, Suppl. 2. - Р. 230-233. 241. Ulm, A.J. Microsurgical and angiographic anatomy of middle cerebral artery aneurysms prevalence and significance of early branch aneurysms [Text] / A.J. Ulm, G.L. Fautheree // Oper. Neurosurg. – 2008. - Vol. 62, Suppl. 2.- Р. 344-353. 242. Ulm, A.J. Microsurgical approaches to the perimesencephalic cisterns and related segments of the posterior cerebral artery: comparison using a novel application of image Guidance [Text] / A.J. Ulm, G. Tanriover // Neurosurg. – 2004. - Vol. 54, N 6. - Р. 1313-1328. 243. van Furth, W.R. The orbitozygomatic Approach [Text] / W.R.van Furth // Oper. Neurosurg. - 2006. - Vol. 58, Suppl. 1. - Р. 103-107. 244. Vilela, M.D. Temporomandibular Joint-preserving Preauricular subtemporal-infratemporal Fossa Approach Surgical technique and Clinical Application [Text] / M.D. Vilela, R.C. Rostomily // Neurosurg. - 2004. - Vol. 55, N 1. - Р.143-154. 245. Waldron, J.S. Microsurgical management of incompletely coiled and recurrent aneurysms: trends, techniques, and observations on coil extrusion [Text] / J.S. Waldron, V.V. Halbach, M.T. Lawton // Neurosurgery. – 2009. - Vol. 64, Suppl. 2. - Р. 301-315. 172 246. Wanibuchi, M. Preauricular Transzygomatic Anterior Infratemporal Fossa approach [Text] / M.Wanibuchi, A.H. Friedman, T. Fukushima // Photo Atlas of Skull Base Dissection / ed. M.Wanibuchi. - New York: Thieme Medical, 2009. – Р.166-206. 247. Wanibuchi, M. Trigeminal Schwannomas: Skull Base Approaches and Operative results in 105 Patients [Text] / M. Wanibuchi, T. Fukushima // Operative Neurosurgery. – 2012. - Vol. 70, Suppl. 1. - Р. 132-144. 248. Warren, W.L. Transciliary orbitofrontozygomatic approach to lesions of the anterior cranial fossa [Text] / W.L. Warren, G.G. Grant // Operative Neurosurgery. – 2009. - Vol. 64, Suppl. 2. - Р. 324-330. 249. Weil, A.G. Tentorial branch of the superior cerebellar artery [Text] /A.G. Weil, N. Mc Laughlin [et al] // Surg. Neurol. Int. – 2011. - Vol. 2 - Р.71. 250. Wu, A. Quantitative analysis of variants of the Far-lateral approach: Сondylar fossa and Transcondylar exposures [Text] / A. Wu, J.M. Zabramski // Oper. Neurosurg. – 2010. - Vol. 66, Suppl. 2. - Р. 191-198. 251. Wu, A. Through the Choroidal Fissure: А Quantitative anatomic comparison of 2 incisions and trajectories (Transsylvian Transchoroidal and Lateral Transtemporal) [Text] / A. Wu, S.W. Chang // Oper. Neurosurg. – 2010. - Vol. 66, Suppl. 2. - Р. 221-229. 252. Yasargil, M.G. Microneurosurgery (vol.1-2) [Текст] / M.G. Yasargil. - Stuttgart – New York: Georg Thieme Verlag, 1984. - 757p.: ill. 253. Yasuda, A. Microsurgical anatomy and approaches to the cavernous sinus. [Text] / A. Yasuda, A. Campero, C. Martins // Neurosurg. – 2008. - Vol. 62, N 6. - Suppl. 3. - Р.1240-1263. 254. Yoshida, K. Epidural anterior petrosectomy with subdural visualization of sphenobasal vein via the anterior transpetrosal approach-technical case report [Text] / K. Yoshida, S. Ichimura // Neurosurg. Rev. - 2012. - Vol. 35, N. 4.- Р. 609-613. 255. Youssef, A.S. The carotid-oculomotor window in exposure of upper basilar artery aneurisms: A Cadaveric Morphometric Study [Text] / A.S. Youssef, K.M. Agazzi // Neurosurg. – 2004. - Vol. 54, N 5. - Р. 1181 -1189. 256. Zabramski, J.M. Orbitozygomatic Craniotomy. Technical note [Text] / J.M. Zabramski, T. Kiris // J. Neurosurg. – 1998. - Vol. 89, N3. - Р. 336-341. 257. Zhao, K.J. Y-configuration stent placement (crossing and kissing) for endovascular treatment of wide-neck cerebral aneurysms located at 4 different bifurcation sites [Text] / KJ. Zhao, PF. Yang // AJNR Am. J. Neuroradiol. - 2012. - Vol. 33, N7. - Р. 1310- 1316. 258. Zhao, J.C. Transzygomatic Extended Middle Fossa Approach for upper petroclival skull base lesion [Text] / J.C. Zhao, J.K. Liu // Neurosurg. Focus. - 2008. - Vol. 25, N. 6 (Е5) (Е5). – P. 7-13. 173 ПРИЛОЖЕНИЯ Приложение 1 Классификация нарушений уровня бодрствования по шкале комы Глазго (1974г.) Количество баллов* Открывание глаз Речевые функции – – 6 – 5 4 спонтанное 3 спонтанная развернутая речь Двигательная реакция выполняет все инструкции локализует боль произношение отдельных фраз не локализует боль на звук отдельные слова патологические сгибания 2 на боль невнятное бормотание патологические разгибания 1 отсутствует отсутствует отсутствует Максимальное количество баллов – 15. Ясное сознание – 15 баллов Умеренное оглушение – 13-14 баллов Глубокое оглушение – 11-12 баллов Сопор – 9-10 баллов Умеренная кома – 6-8 баллов Глубокая кома – 4-5 баллов Терминальная кома – 3 балла Teasdale G., Jennet B. Assessment of coma and impaired consciousness: a practical scale // Lancet.- 1974.-Vol.304 (7872)- p. 81-84. 174 Приложение 2 Классификация степени тяжести состояния больных с САК по шкале W. Hunt-R.Hess (1968г.) Степень Клиническая картина I Бессимптомное течение или слабая головная боль и легкая ригидность мышц затылка II Умеренная ригидность мыщц затылка или сильная головная боль, симптомы раздражения черепных нервов III Оглушение, сонливость, спутанность сознания, выраженный менингеальный синдром, умеренный неврологический дефицит IV Сопор, выраженный менингеальный синдром, умеренный или выраженный гемипарез, ранняя церебрационная ригидность V Кома разной глубины, децеребрационная ригидность. Примечание. При наличии серьезного общего заболевания (гипертоническая болезнь, сахарный диабет, тяжелый атеросклероз, хроническое обструктивное заболевание легких) или выраженного церебрального ангиоспазма оценку степени тяжести состояния больного увеличивают на одну ступень. Hunt W, Hess R. Surgical risk as related to time of intervention in the repair of intracranial aneurysms // Journal of Neurosurgery.-1968.- №28 (1).-p. 14–20. 175 Приложение 3 КТ-шкала базальных субарахноидальных кровоизлияний по C.M. Fisher (1980г.) Количество крови по данным КТ Степень I II Кровь в субарахноидальном пространстве не определяется Диффузное базальное кровоизлияние с толщиной сгустка* <1мм III Локализованный сгусток и\или толщина сгустка* >1мм IV Внутримозговые и внутрижелудочковые свертки с диффузным САК или без него Примечание. * - толщина сгустка крови в субарахнодильных пространствах (межполушарная щель, островковая цистерна, охватывающая цистерна). Fisher C.M., Kistler J.P.; Davis J.M. Relation of Cerebral Vasospasm to Subarachnoid Hemorrhage Visualized by Computerized Tomographic Scanning // Neurosurgery.-1980.№6 (1).-p. 1–9. 176 Приложение 4 Характер изменений ЭЭГ при разрыве церебральных аневризм по В.В. Лебедеву, В.В. Крылову, Н.С. Куксовой (1996г.) Типы ЭЭГ Характер изменений I Существенных отклонений от физиологической нормы нет II Умеренные нарушения электрической активности головного мозга, в затылочных отведениях регистрируются полиморфный α-ритм, в предцентральных отведениях доминирует активность α-θ диапазона III Выраженные нарушения электрической активности головного мозга, α-ритм нарушен, на фоне полиморфной активности α-θ диапазона регистрируются вспышки высокоамплитудных билатерально-синхронных медленных волн длительностью более 1мс IV Грубые нарушения электрической активности головного мозга, по всем отведениям доминирует активность билатеральносинхронного характера преимущественно δ-диапазона Лебедев В.В., Крылов В.В., Холодов С.А., Шелковский В.Н. Хирургия аневризм головного мозга в остром периоде кровоизлияния.- М.: Медицина, 1996.- с34-35. Лебедев В.В., Куксова Н.С., и др. Информативность ЭЭГ в остром периоде субарахноидального кровоизлияния вследствие разрыва внутричерепных артериальных аневризм// Вопросы нейрохирургии. – 1989.- №5. – С.44-49. 177 Приложение 5 Модифицированная классификация исходов заболевания по шкале исходов Глазго (1975г.) Количество баллов Значение 1 полное выздоровление, возвращение к нормальной жизни, несмотря на незначительные неврологические нарушения 2 умеренная инвалидизация, способность передвигаться в общественном транспорте, работать в местах для инвалидов 3 грубая инвалидизация, требуется ежедневный уход 4 вегетативное состояние 5 смерть Jennett B., Bond M. Assessment of outcome after severe brain damage: a practical scale // Lancet .- 1975.-Vol.305 (7905)- p. 480-484.