ФУЗИФОРМНАЯ АНЕВРИЗМА ЗАДНЕЙ МОЗГОВОЙ АРТЕРИИ
реклама
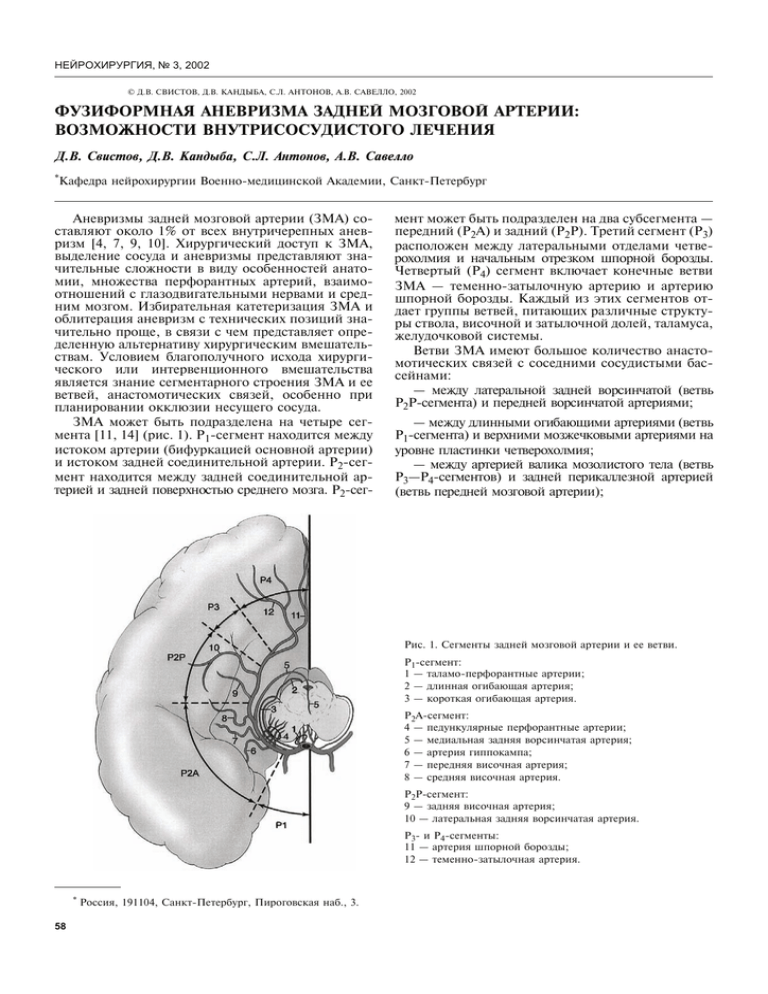
ɇȿɃɊɈɏɂɊɍɊȽɂəʋ © Д.В. СВИСТОВ, Д.В. КАНДЫБА, С.Л. АНТОНОВ, А.В. САВЕЛЛО, 2002 ФУЗИФОРМНАЯ АНЕВРИЗМА ЗАДНЕЙ МОЗГОВОЙ АРТЕРИИ: ВОЗМОЖНОСТИ ВНУТРИСОСУДИСТОГО ЛЕЧЕНИЯ Д.В. Свистов, Д.В. Кандыба, С.Л. Антонов, А.В. Савелло *Кафедра нейрохирургии Военно-медицинской Академии, Санкт-Петербург Аневризмы задней мозговой артерии (ЗМА) составляют около 1% от всех внутричерепных аневризм [4, 7, 9, 10]. Хирургический доступ к ЗМА, выделение сосуда и аневризмы представляют значительные сложности в виду особенностей анатомии, множества перфорантных артерий, взаимоотношений с глазодвигательными нервами и средним мозгом. Избирательная катетеризация ЗМА и облитерация аневризм с технических позиций значительно проще, в связи с чем представляет определенную альтернативу хирургическим вмешательствам. Условием благополучного исхода хирургического или интервенционного вмешательства является знание сегментарного строения ЗМА и ее ветвей, анастомотических связей, особенно при планировании окклюзии несущего сосуда. ЗМА может быть подразделена на четыре сегмента [11, 14] (рис. 1). Р1-сегмент находится между истоком артерии (бифуркацией основной артерии) и истоком задней соединительной артерии. Р2-сегмент находится между задней соединительной артерией и задней поверхностью среднего мозга. Р2-сег- мент может быть подразделен на два субсегмента — передний (Р2А) и задний (Р2Р). Третий сегмент (Р3) расположен между латеральными отделами четверохолмия и начальным отрезком шпорной борозды. Четвертый (Р4) сегмент включает конечные ветви ЗМА — теменно-затылочную артерию и артерию шпорной борозды. Каждый из этих сегментов отдает группы ветвей, питающих различные структуры ствола, височной и затылочной долей, таламуса, желудочковой системы. Ветви ЗМА имеют большое количество анастомотических связей с соседними сосудистыми бассейнами: — между латеральной задней ворсинчатой (ветвь Р2Р-сегмента) и передней ворсинчатой артериями; — между длинными огибающими артериями (ветвь P1-сегмента) и верхними мозжечковыми артериями на уровне пластинки четверохолмия; — между артерией валика мозолистого тела (ветвь P3—P4-сегментов) и задней перикаллезной артерией (ветвь передней мозговой артерии); Рис. 1. Сегменты задней мозговой артерии и ее ветви. Р1-сегмент: 1 — таламо-перфорантные артерии; 2 — длинная огибающая артерия; 3 — короткая огибающая артерия. Р2А-сегмент: 4 — педункулярные перфорантные артерии; 5 — медиальная задняя ворсинчатая артерия; 6 — артерия гиппокампа; 7 — передняя височная артерия; 8 — средняя височная артерия. Р2Р-сегмент: 9 — задняя височная артерия; 10 — латеральная задняя ворсинчатая артерия. Р3- и Р4-сегменты: 11 — артерия шпорной борозды; 12 — теменно-затылочная артерия. * Россия, 191104, Санкт-Петербург, Пироговская наб., 3. ɋɅɍɑȺɂɂɁɉɊȺɄɌɂɄɂ — между нижними височными ветвями ЗМА и верхними височными ветвями средней мозговой артерии. Клиническое наблюдение Под нашим наблюдением в июне 2001 г. находился пациент П., 35 лет. Госпитализирован в нейрохирургическое отделение в связи с выявленной на догоспитальном этапе крупной неразорвавшейся аневризмой правой ЗМА. Из анамнеза известно, что на протяжении последних месяцев больного беспокоили непостоянные головные боли неопределенной периодичности, локализации, малой интенсивности. В целях исключения органического заболевания головного мозга пациенту выполнена МРТ и МР-ангиография головного мозга (Magnetom Vision, Siemens). При МРТ в области вырезки намета мозжечка справа в проекции гиппокампа выявлено образование округлой формы гетерогенной интенсивности с артефактами, характерными для низкоскоростного потока (рис. 2). При МР-ангиографии в проекции патологического образования выявлены изменения сигнала потока в ЗМА, свидетельствующие об ее патологическом расширении (рис. 3). Размеры образования составили 10u17 мм. На основании данных исследования заподозрена крупная частично тромбированная аневризма правой ЗМА. В связи с превышением размеров аневризмы границы 10 мм пациенту предложено оперативное лечение. 4 июня 2001 г. выполнена церебральная ан- Рис. 2. МРТ (Т2) больного П. Образование округлой формы гетерогенной интенсивности в области вырезки намета мозжечка справа в проекции гиппокампа. È ­ Рис 3. МРА (3D TOF) больного П.: а — в аксиальной, б — в боковой проекциях. В окружности — патологический сигнал потока в полости аневризмы. ɇȿɃɊɈɏɂɊɍɊȽɂəʋ È ­ Рис. 4. Вертебральная ангиография больного П. в передне-задней (а) и боковой (б) проекциях. Виден участок сужения просвета артерии перед впадением ее в аневризму (стрелка). гиография с одномоментной тотальной эмболизацией аневризмы отделяемыми микроспиралями. Предоперационная подготовка включала пероральный прием аспирина (375 мг в сутки) и тиклопедина (250 мг в сутки) за два дня до операции. Премедикация: промедол 2% 1,0 мл; димедрол 1% 2,0 мл; дикам 0,5% 2,0 мл. Вмешательство выполнялось под местной анестезией. Произведена катетеризация левой бедренной артерии интродьюсером IVA5F. Диагностическим катетером 5F Vertebralis (Cordis) проведена церебральная панангиография. Выявлен вариант отхождения левой позвоночной артерии от дуги Рис. 5. Аневризмография. Стрелками обозначены рентгеноконтрастные маркеры микрокатетера. В полости аневризмы уровень контрастного вещества, из полости аневризмы контрастируются ветви ЗМА. аорты. Диагностирована крупная аневризма правой ЗМА (рис. 4) на границе Р2А- и Р2Р-сегментов. Размеры аневризматического мешка составили (с учетом коэффициента магнификации) 14u10u8 мм. У входа в полость аневризмы отмечен выраженный стеноз Р2-сегмента правой ЗМА (стрелка), из-за чего контрастирование дистальных ветвей артерии оказалось недостаточным для того, чтобы точно определить тип аневризмы: мешотчатая или фузиформная. При правосторонней каротидной ангиографии отмечено усиленное контрастирование дистальных сегментов корковых ветвей теменного ствола правой средней мозговой артерии, что дало основание надеяться на развитые корковые коллатерали с ветвями ЗМА. По обменному проводнику 0,035” в левую позвоночную артерию установлен направляющий катетер Envoy Cerebral 5F (Cordis). В условиях тотальной гепаринизации (8,000 ед. дробно) в сосудистое русло введен микрокатетер Vasco10 (BALT), который при помощи микропроводника SOR009 последовательно проведен во внутричерепной сегмент левой позвоночной артерии, основную артерию, правую ЗМА. На этапе преодоления устья правой передненижней мозжечковой артерии пациентом отмечено преходящее головокружение. Кончик микрокатетера установлен в полости аневризмы, выполнена аневризмография (рис. 5), при которой контрастированы ветви ЗМА, исходящие из аневризматического мешка, что позволило предположить фузиформный тип строения аневризмы. Последовательно, в порядке убывания размеров, в полость аневризмы введены и сброшены платиновые микроспирали SPID10u300P10; SPID7u300P10; SPID6u200P10. Первая микроспираль, установленная в куполе аневризмы, выпала одной из петель в просвет Р2Р-сегмента ЗМА без нарушения его проходимости (рис. 8, в). После частичной окклюзии полости аневризмы контрольная аневриз- ɋɅɍɑȺɂɂɁɉɊȺɄɌɂɄɂ È Рис. 6. Этапная аневризмография: Р2Р-сегмент ЗМА (стрелки) исходит из аневризматического мешка — аневризма фузиформная. мография подтвердила фузиформное строение аневризмы (рис. 6). В дальнейшем в полость аневризмы установлены еще четыре микроспирали, размерами 5u150, 5u100, 4u120 и 4u80 мм, в результате чего удалось добиться ее полной облитерации (рис. 7) с нарушением проходимости правой ЗМА на границе Р2А- и Р2Р-сегментов. Контрастирование проксимальных ветвей ЗМА не нарушено. Несмотря на нарушение проходимости ЗМА, зрительных нарушений не отмечено. При контрольной вертебральной ангиографии (рис. 8) аневризма полностью облитерирована, ­ m Рис. 7. Контрольная суперселективная ангиография: аневризма и несущая артерии облитерированы. Рис. 8. Контрольная вертебральная ангиография в переднезадней (а, в) и боковой (б) проекциях: аневризма не контрастируется, проходимость правой ЗМА нарушена; петля микроспирали выпала в просвет Р2Р-сегмента правой ЗМА. ɇȿɃɊɈɏɂɊɍɊȽɂəʋ Рис. 9. Контрольная правосторонняя каротидная ангиография (боковая проекция): ретроградное заполнение ветвей правой ЗМА до Р2Р сегмента (стрелки). дистальные сегменты и ветви правой ЗМА не контрастируются. Для оценки дистального сосудистого русла бассейна правой ЗМА выполнена контрольная каротидная ангиография (рис. 9), при которой выявлено ретроградное контрастирование ветвей правой ЗМА через корковые анастомозы с угловой ветвью правой СМА. Течение послеоперационного периода неосложненное. Очаговой неврологической симптоматики, выпадений полей зрения не отмечено. Проводилась симптоматическая и дезагрегантная терапия (аспирин 375 мг в сутки). Пациент выписан из стационара на 3-и сутки после операции, через неделю вернулся на производство. При контрольной ангиографии через полгода аневризма по-прежнему не контрастируется, расположение витков спиралей в полости аневризмы не изменилось, симптоматика отсутствует. Обсуждение Особенностями настоящего наблюдения являются сочетание крупной неразорвавшейся аневризмы вертебробазилярного бассейна с вариантом строения левой позвоночной артерии; наличие стеноза артерии, несущей аневризму; отсутствие зрительных расстройств, несмотря на тромбирование несущего аневризму сосуда. Отхождение левой позвоночной артерии от дуги аорты в нашей ангиографической практике составило 0,2%. Клинические проявления этого анатомического варианта варьируют от бессимптомного течения до картины недостаточности кровообращения в вертебробазилярном бассейне, рецидивирующих субарахноидальных кровоизлияний (САК). В настоящем случае анатомический вариант строения позвоночной артерии не имеет собственного значения. Прямолинейный же ход сосуда благоприятствовал его катетеризации направляющим катетером, что позитивно сказалось на манипулировании микрокатетером во внутричерепном сосудистом русле. Стенозирование магистральных артерий при крупных аневризмах описано, преимущественно, по отношению к экстрадуральным сегментам ВСА. Оно, как правило, связано с деформацией артерии крупным, частично тромбированным мешком аневризмы. Применительно к ЗМА подобные изменения сосуда встречены нами впервые. Вероятно, гемодинамически значимый (более 70%) стеноз основного ствола правой ЗМА послужил «тренирующим» фактором для развития коллатералей между дистальными ветвями ЗМА и СМА в зоне смежного кровоснабжения. Благодаря наличию этих связей окклюзия артерии не повлекла за собой зрительных нарушений. При контрольной ангиографии отчетливо видно, что контрастирование Р2Р-сегмента правой ЗМА распространяется непосредственно до клубка микроспиралей в полости аневризмы. Предоперационная нагрузка больного дезагрегантами и оперативное вмешательство на фоне тотальной гепаринизации позволили избежать тромбоэмболических осложнений, связанных с разрушением тромба в полости крупной аневризмы. Следует обсудить ряд вопросов, касающихся лечебной тактики в подобных случаях: — оправданно ли решение о хирургическом лечении неразорвавшейся аневризмы у пациента молодого возраста? — оправдан ли выбор способа лечения? В последние годы количество работ, посвященных выявлению и хирургическому лечению неразорвавшихся аневризм, растет. Успехи в этой области неоспоримы. Реализация программ скрининга потенциальных пациентов из групп риска, диагностика семейных аневризм позволила снизить частоту первичных САК в ряде регионов Японии и Финляндии. В результате анализа медицинской информации, опубликованной в электронных средствах печати J.W. Brennan и M.L. Schwarz сформулировали рекомендации (с позиций критериев «доказательной» медицины) по ведению пациентов с неразорвавшимися аневризмами, приведенные в таблице [1]. Таким образом, наш пациент относится к группе больных, которым оперативное лечение могло быть рекомендовано в качестве меры первичной профилактики САК. Выбор способа выключения аневризмы из кровотока продиктован тем обстоятельством, что микрохирургическое открытое вмешательство все же несет в себе существенный риск операционной травмы, ишемических и инфекционных осложнений. С учетом диагностированного фузиформного строения аневризмы реконструктивное клипирование оказалось бы невозможным, так что речь могла идти только о треппинге аневризмы, т.е. по ходу вмешательства возникла бы необходимость препариро- ɋɅɍɑȺɂɂɁɉɊȺɄɌɂɄɂ вать Р2Р- и Р3-сегменты артерии, расположенные внутри от купола аневризмы, что чревато риском дисциркуляторных нарушений в ипсилатеральной ножке мозга. Так что внутрисосудистый метод, по нашему мнению, является оптимальным в данной ситуации. Отказ от применения разделяемых баллонов для окклюзии полости аневризмы был вызван тем обстоятельством, что несущая артерия имела ярко выраженное сужение у входа в полость аневризмы, так что была труднопроходима даже для ригидного микрокатетера диаметром 0,6 мм. Возможность провести латексный баллон (изготовленный кустарно или тем более фабрично) через просвет пораженного в такой степени сосуда представляется сомнительной. Стандарты Данных для создания стандартов лечения неразорвавшихся аневризм недостаточно. Консервативное лечение Аневризмы <10 мм без предшествующих кровоизлияний (группа 1*) Асимптомные аневризмы 15—25 мм у больных > 45 лет (группы 1 и 2**) Рекомендации Оперативное лечение Аневризмы >10 мм у больных <45 лет (группы 1 и 2) Симптомные аневризмы у пациентов, получающих консервативное лечение Гигантские аневризмы Оперативное лечение может быть избрано Аневризмы <10 мм (группа 2) с учетом возраста, преморбидного состояния, локализации Возможность выбора Оперативное или консервативное лечение может быть избрано Аневризмы >10 мм, независимо от группы, в возрасте 54—64 лет (с учетом локализации аневризмы, состояния пациента) Аневризмы <10 мм у больных 45—64 лет (группа 2) Группа 1 — пациенты, не имевшие в анамнезе САК. Группа 2 — пациенты с анамнезом САК при разрыве аневризм иной локализации. В конечном итоге, ход операции и ее ближайший результат подтверждают правоту выбранной тактики. Окончательный результат вмешательства будет оценен через 6 мес в ходе контрольного обследования. Аневризмы ЗМА тяготеют к проксимальным сегментам артерии [5, 7, 9]. Они имеют ряд специфичных морфологических признаков, отличающих их от аневризм иных локализаций. Чаще страдают люди молодого возраста (38 лет), тогда как средний возраст пациентов с аневризмами передних отделов артериального круга составляет 50—60 лет [5]. Также для аневризм данной локализации характерной является высокая частота крупных и гигантских (23% среди аневризм ЗМА против 3—5% для аневризм других локализаций) [4, 8]. В сообщении С.Drake [3] частота гигантских аневризм составила 42%; М.Yasargil [12] — 50%; E.Ciceri, Н.Pia [9] — 24%. САК является наиболее частым вариантом манифестации аневризм ЗМА и наблюдается в 50— 80% наблюдений [5, 7, 9]. До половины случаев аневризм ЗМА, особенно крупных, гигантских и «серпантинных» являются случайными находками и не сопровождаются неврологическими нарушениями. В общем, «серпантинные» аневризмы наиболее характерны для вертебробазилярного бассейна и поражают, преимущественно, пациентов молодого возраста [5, 6, 7, 9]. Они могут проявлять себя признаками масс-эффекта, приводя к эпилептическим припадкам или фокальным выпадениям [13]. В серии E.Ciceri [2] у одного из пациентов отмечены мнестические нарушения, у другого — нарушения сна и потеря памяти в результате компрессии ствола мозга и гиппокампа. Н.Pia [9] сообщает о высокой частоте (27%) зрительных нарушений при аневризмах ЗМА с преобладанием глазодвигательных нарушений и гемианопсии. В серии E.Ciceri [2] у пяти пациентов (25%) имели место глазодвигательные или зрительные нарушения вследствие компрессии глазодвигательного нерва (3), хиазмы (1). У одного пациента имело место сочетание аневризмы ЗМА и АВМ затылочной доли с гомонимной гемианопсией. Сочетание аневризм ЗМА с различными сосудистыми аномалиями считается достаточно характерным. В 43% случаев отмечены сопутствующие АВМ, множественные аневризмы, болезнь Мойя-Мойя, расслаивающая аневризма ВСА [2], что свидетельствует о гемодинамической природе мешотчатых аневризм. По мнению E.Ciceri [2], методом выбора в лечении мешотчатых аневризм ЗМА является избирательная внутрисосудистая облитерация отделяемыми микроспиралями Guglielmi, с сохранением проходимости несущей артерии. Эмболизация микроспиралями небольших аневризм с узкой шейкой является безопасной процедурой со стойким ангиографическим эффектом. Так же как и при аневризмах иной локализации, крупные аневризмы с широкой шейкой являются не лучшим объектом для эмболизации, хотя технические сложности (вывих спирали в несущую артерию, слабое заполнение аневризмы эмболизирующим материалом) могут быть преодолены путем применения техники ассистирующей баллон-окклюзии, имплантации сетчатого стента, применения 3D-спиралей. Сохранение антеградного кровотока в ЗМА является одной из наиболее важных задач при хирургическом лечении аневризм, однако это условие недостижимо при лечении фузиформных или «серпантинных» аневризм, когда окклюзия артерии является основным условием выключения аневризмы. Нарушение кровообращения в бассейне ЗМА со стойкими зрительными нарушениями является одним из наиболее грозных осложнений подобной тактики. Следует отметить, что частота подобных осложнений относительно низка и составляет, по данным E.Ciceri ɇȿɃɊɈɏɂɊɍɊȽɂəʋ [2], 14,2%, что связано с богатым коллатеральным кровоснабжением бассейна ЗМА. К сожалению, оценить функциональные способности корковых путей коллатерального кровоснабжения до операции возможно только путем применения тест-окклюзии артерии двупросветным баллоном с измерением окклюзионного давления, что, по нашему представлению, в подобной ситуации представляет не меньший риск, чем вмешательство на аневризме. Наибольшую статистику по внутрисосудистому лечению аневризм ЗМА приводит E.Ciceri [2]. Из 20 наблюдений в 14 аневризмы были выключены из кровотока с сохранением проходимости несущей артерии. В остальных аневризма была окклюзирована вместе с артерией. Эти наблюдения относились к разряду фузиформных и «серпантинных» аневризм. Отмечено одно техническое осложнение в виде перфорации мешотчатой аневризмы, закончившееся благополучно. При контрольных ангиографических исследованиях пациентов, оперированных с применением «реконструктивной» техники реканализации аневризм не отмечено. При аневризмах, выключенных из кровотока с несущей артерией, контрольные МРТ выявляют тромбоз и сморщивание аневризмы. Клинические исходы благоприятны: 95% больных выписаны с состоянием I по шкале исходов Глазго, летальных исходов не было. Осложнения отмечены в 15%: перфорация аневризмы во время операции (без неврологических нарушений); два случая стойких неврологических нарушений после окклюзии несущей артерии. В заключении следует отметить, что избирательное внутрисосудистое лечение аневризм ЗМА с применением отделяемых микроспиралей является доступным, относительно безопасным и эффективным способом лечения, в том числе у больных с неразорвавшимися, крупными и фузиформными аневризмами. ЛИТЕРАТУРА 1. Brennan J.W., Schwarz M.L. Recommendations for unruptured aneurysms // Neurosurgery. — 2000. — Vol. 47, № 12. — Р. 1359—1372. 2. Ciceri E.F., Klucznik R.P., Grossman R.G., et al. Aneurysms of the Posterior Cerebral Artery: Classification and Endovascular Treatment // AJNR. — 2001. — Vol. 22, № 1. — Р. 27—34. 3. Drake C.G. Giant intracranial aneurysms: experience with surgical treatment in 174 patients.// Clin / Neurosurg. — 1979. — Vol. 26, № 1. — P. 12—95. 4. Drake C.G. Giant posterior cerebral aneurysms: 66 patients. In: Drake CG, Peerless SJ, Hirnesniemi JA, eds. Surgery of Vertebrobasilar Aneurysms: London, Ontario, Experience on 1767 Patients. New York: Springer Verlag. — 1996. — P. 230—248. 5. Ferrante L., Acqui M., Trillo’ G., et al. Aneurysms of the posterior cerebral artery: do they present specific characteristics? //Acta Neurochir (Wien). — 1996. — Vol. 138, № 10. — P. 840—852. 6. Fukamachi A., Hirato M., Wakao T., Kawafuchi J. Giant serpentine aneurysm of the posterior cerebral artery. //Neurosurgery. — 1982. — Vol. 11, № 3. — P. 271—276. 7. Gerber C.J., Neil-Dwyer G. A review of the management of 15 cases of aneurysms of the posterior cerebral artery.// Br. J. Neurosurg. — 1992. — Vol. 6, № 4. — P. 521—527. 8. Lempert T.E., Halbach V.V., Higashida R.T., et al. Endovascular treatment of pseudoaneurysms with electrolitically detachable coils.// AJNR — 1998. — Vol. 19, № 6. — P. 907—911. 9. Pia H.W., Fontana H. Aneurysms of the posterior cerebral artery. Locations and clinical pictures. //Acta Neurochir (Wien). — 1977. — Vol. 38, № 1. — P. 13—35. 10. Sakata S., Fujii K., Matsushima T., et al. Aneurysms of the posterior cerebral artery: report of eleven cases-surgical approaches and procedures. // Neurosurgery. — 1993. — Vol. 32, № 2. — P. 163—167. 11. Seoane E.R., Tedeschi H., de Oliveira E., et al. Management strategies of posterior cerebral artery aneurysms: a proposed new surgical classification. // Acta Neurochir. (Wein). — 1997. — Vol. 139, № 3. — P. 325—331. 12. Yasargil M.G. Microneurosurgery. Vol 2. Stuttgard: George Thieme Verlag. — 1984. — P. 260—269. 13. Yacubian E.M., Rosemberg S., da Silva H.C., et al. Intractable complex partial seizures associated with posterior cerebral artery giant aneurysm: a case report. // Epilepsia. — 1994. — Vol. 36, № 12. — P. 1317—1320. 14. Zeal A.A., Rhoton A.L. Microsurgical anatomy of the posterior cerebral artery. // J. Neurosurg. — 1978. — Vol. 48, № 4. — P. 534—559.

