7. Термодинамика Vp VVpA ) ( AU Q ` AQU AU Q U Q 0 T
реклама

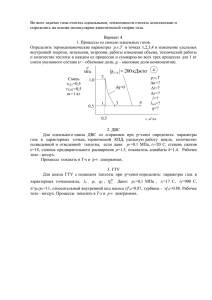
7. Термодинамика Работа идеального газа. Первый закон термодинамики. В термодинамике движение тела как целого не рассматривается, и речь идет о перемещении частей макроскопического тела (чаще – газа) относительно друг друга. При совершении работы меняется объем тела, а его скорость остается раной нулю. Но скорости молекул тела меняются, поэтому меняется температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется - поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура. При расширении работа газа положительна. При сжатии - отрицательна. Работу при изобарном процессе (p = const ) можно рассчитать по формуле: A p (V2 V1) p V, где A — работа газа (Дж); A' — работа над газом (Дж), причем A = –А'; P — давление газа (Па); ΔV = V2 –V1 — изменение объема (м3); V2 и V1 — конечный и начальный объемы газа соответственно (м3). Если объем увеличивается, то ΔV > 0 и A > 0, а A' < 0, если объем уменьшается, то ΔV < 0 и A < 0, а A' > 0. ГЕОМЕТРИЧЕСКОЕ ИСТОЛКОВАНИЕ РАБОТЫ В изобарном процессе площадь под графиком в координатах (p,V) численно равна работе (вспомните перемещение на графике скорости): В общем случае надо процесс разбить на малые части и сосчитать элементарные работы, а затем их сложить (процесс интегрирования): Таким образом, в любом процессе работа над газом численно равна площади фигуры в осях (p,V), ограниченной графиком, осями и перпендикулярами к крайним точкам графика. В изохорном процессе объем не меняется, следовательно, в изохорном процессе работа не совершается! Если рассматривать все тела, участвующие в процессе, и учитывать изменение и механической, и внутренней энергии всех тел, то в итоге получим, что полная энергия - величина постоянная. Это закон сохранения полной энергии. В термодинамике он носит название первого закона (или первого начала) и формулируется следующим образом: количество теплоты Q, сообщенное системе извне, расходуется на увеличение ее внутренней энергии ΔU и на работу A, совершаемую системой против внешних сил: Q U A Есть и другая формулировка первого закона термодинамики: изменение внутренней энергии системы ΔU происходит частично за счет сообщенного системе количества теплоты Q и частично – за счет работы А', произведенной над системой внешними телами: U Q A' При изобарном процессе (р U A. = const) Q При изохорном процессе (V = const) A = 0, поэтому Q счет теплообмена. При изотермическом процессе (T = const, T U , т.е. внутренняя энергия системы изменяется только за 0 ) ΔU = 0, поэтому Q количество теплоты идет на совершение ею работы. A , т.е. все полученное системой Процесс, при котором передача теплоты настолько ничтожна, что ею можно пренебречь, называется адиабатическим. При таком процессе Q=0, A U , т.е. работа совершается системой за счет за счет убыли ее внутренней энергии. Либо работа внешних сил идет на увеличение внутренней энергии, температура системы возрастает. Адиабатный процесс может быть осуществлен либо в теплоизолированной системе, либо очень быстро (чтобы не успеть передать тепло, например, взрыв). Используется для получения жидких газов.