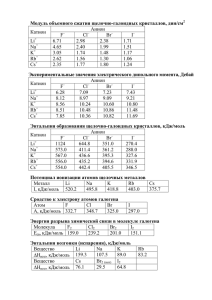
Найти точную молярную массу металла, если приближенное
реклама

1. Найти точную молярную массу металла, если приближенное значение ее 64 г/моль, а эквивалентная масса равна : a) 31,77 г/моль; б) 32,69 г/моль. 2. Какова последовательность заполнения электронами таких подуровней, для которых сумма (n+1) равна последовательно 6,7 и 8? 3. Вычислите процентное содержание растворенных веществ для растворов, содержащих : а) 1моль NH3 в 3 молях воды ; б)1/20 моля KMnO4 в 200г воды; в) 50 г H2SO4 в 50 молях воды. 4. Реакция горения сероуглерода идет по уравнению CS2 + 3O2 = CO2 +2SO2 + Q кДж При получении 4,48 л двуокиси углерода, измеренной при нормальных условиях, выделяется 18,79 кДж тепла. Вычислить теплоту реакции. 5. Масса 2л SO2 равна 12,8 г. Вычислить число молей SO2 в 1 л. 6. В какую сторону сдвинется равновесие вследствие увеличения температуры в нижеуказанных системах N2+O2 2TO -180 кДж N2+3Н2 2NH3 + 88 кДж PCl5 PCl3 + Cl2 – 130 кДж 7. Составьте уравнения реакций с помощью ионно-электронных схем или схем электронного баланса I2 + SO2 + H2O Н2SO4 +….. 8. Какова продолжительность электролиза 250 мл 6%-ного раствора HgCl2 (p=1,05)? Сила тока 5,8 А. 9. Какую навеску железной проволоки ,содержащей около 98% железа, следует взять для определения железа, если оно осаждается в виде Fe (OH)3 ? 10. На титрование раствора NaCl пошло 19,95 мл раствора AgNO3 c TAgNO3/Cl =0,03640.Сколько Cl содержал раствор?