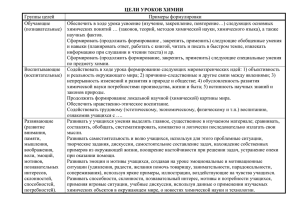
Лекция 4. Химическая кинетика. Основы химической термодинамики. Химическое равновесие. (Сл.1) Рассматриваемые вопросы: 1. Средняя и истинная скорость химической реакции. 2. Факторы, от которых зависит скорость реакции. 3. Теория катализа. Химические реакции протекают с различными скоростями. (Сл.2) Некоторые из них полностью заканчиваются за малые доли секунды (взрывы, реакции между ионами в растворах, биохимические реакции), другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания несколько лет (процессы ржавления железа, ферментация вина), десятилетий и еще более длительных отрезков времени (период полураспада урана 4,5 млрд.лет). Кроме того, одна и та же реакция может в одних условиях, например, при повышенных температурах, протекать быстро, а в других, — например, при охлаждении, — медленно; при этом различие в скорости одной и той же реакции может быть очень большим. Знание скоростей химических реакций имеет очень большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта. Изучением скоростей химических реакций и механизмов их протекания занимается химическая кинетика. (Сл.3) При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции). Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной — система, состоящая из нескольких фаз. (Сл.4) Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге). Другим примером гомогенной системы может служить раствор нескольких веществ в одном растворителе. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором. Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, горение серы идет на поверхности порошка (твердой фазы) серы, потому что только здесь соприкасаются друг с другом оба реагирующие вещества. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно. (Сл.5) Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы. Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов. Для увеличения скорости взаимодействия твердые вещества, участвующие в гетерогенной реакции измельчают, чтобы увеличить площадь поверхности частиц. Например, уголь для приготовления пороха растирают в порошок. Жидкость для реакции с газом распыляют в мельчайшие капельки: так, дизельное топливо (смесь углеводородов) впрыскивают в камеру, где оно встречается с воздухом, через специальное устройство, обеспечивающее распыление. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы. (Сл.6) Другое определение скорости реакции в гомогенной системе: скоростью реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее за единицу времени. Vгомог = ± Δ С/ Δt – математическое выражение этого определения. Это определение средней скорости за определенный промежуток времени. На слайде 7 показано изменение концентрации продукта реакции во времени. За определенные промежутки времени происходит изменение концентрации образующегося в ходе реакции продукта, что и находит свое отражение в формуле для средней скорости. (Сл.8) Мгновенная скорость показывает скорость в данный момент времени. Она равна первой производной концентрации по времени или в графическом выражении тангенсу угла касательной в данной точке. Как уже говорилось, при практическом использовании химических реакций весьма важно знать, с какой скоростью будет протекать данная реакция в тех или иных условиях, и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью. (Сл.9) От чего же зависит скорость реакции? В первую очередь – от природы веществ: одни вещества реагируют мгновенно, другие – медленно. Например, если рассматривать процесс взаимодействия щелочных металлов с водой, то литий, будучи самым неактивным, реагирует с водой достаточно спокойно, натрий бегает по поверхности воды, а рубидий, более активный из перечисленных металлов воспламеняется в воде. (Сл.10) Затем – от концентрации реагентов: чем она больше, тем чаще будут сталкиваться частицы. В середине XIX в. (1865 г. – Н.Н. Бекетов, 1867 г. – К. Гульдберг, П. Вааге) был сформулирован основной постулат химической кинетики, называемый также законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед формулами веществ в уравнении реакции: (Сл.11) Для реакции aA + bB = cC + dD, υ = k [A]а · [B] b, где υ – скорость химической реакции; [А] – концентрация вещества А; [В] – концентрация вещества В; k – константа скорости реакции; а и b – коэффициенты в уравнении реакции. Константа скорости реакции равна скорости реакции при концентрациях, равных 1. К – индивидуальна для каждой реакции, зависит от температуры, природы реагирующих веществ и присутствия катализатора, но не зависит от концентрации веществ. Например, для реакции 2 NO(г) + O2(г) = 2 NO2(г) v = k[NO]2[O2] В реакциях с участием газов скорость V реакции сильно зависит от давления, т.к. с изменением давления изменяется их концентрация. Для гетерогенных реакций скорость существенно зависит от поверхности раздела фаз (дисперсности – степени измельчения твердой фазы). В закон действующих масс не входят концентрации твердых веществ, т. к. реакции с твердыми веществами протекают на их поверхности, где «концентрация» вещества постоянна. Для гетерогенных реакций самый важный фактор – площадь контакта реагентов (она напрямую зависит от степени измельчения). (Сл.12) В-третьих, скорость реакции зависит от температуры. Повышение температуры также будет ускорять реакцию: чем выше температура, тем выше энергия частиц, которые вступают в химические превращения. Приблизительная зависимость скорости от температуры определяется правилом Вант-Гоффа. При повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза. На слайде 12 представлено математическое выражение правила Вант-Гоффа. Температурный коэффициент гамма определяется экспериментально и для большинства реакций составляет 2-4. Более точная зависимость скорости реакции от температуры определяется уравнением Аррениуса. (Сл.13) Определяет зависимость константы скорости реакции от температуры. Коэффициент Ко показывает число эффективных соударений между частицами, которые приводят к осуществлению химической реакции. Молекулярно-кинетическая теория газов и жидкостей дает возможность подсчитать число соударений между молекулами тех или иных веществ при определенных условиях. Если воспользоваться результатами таких подсчетов, то окажется, что число столкновений между молекулами веществ при обычных условиях столь велико, что все реакции должны протекать практически мгновенно. Однако в действительности далеко не все реакции заканчиваются быстро. Только примерно 25% соударений (для газообразных реагентов) являются эффективными, то есть приводят к образованию продукта реакции. Для того чтобы произошла реакция, т. е. чтобы образовались новые молекулы, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным — не приведет к образованию новой молекулы. Если же кинетическая энергия сталкивающихся молекул достаточна для ослабления или разрыва связей, то столкновение может привести к перестройке атомов и к образованию молекулы нового вещества. В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Энергию активации выражают в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами. На Сл.14 показан механизм протекания реакции между иодом и водородом и соответствующая этому процессу энергетическая диаграмма. Как видно, максимум энергии соответствует переходному активированному комплексу, который затем быстро распадается на продукты реакции. С ростом температуры число активных молекул возрастает. Отсюда следует, что и скорость химической реакции должна увеличиваться с повышением температуры. Действительно, при возрастании температуры химические реакции протекают быстрее. Наконец, в присутствии веществ-катализаторов тоже достигается рост скорости реакции. Катализаторами являются вещества, не расходующиеся в реакции, но оказывающие влияние на её скорость. Явление изменения скорости реакции под действием катализаторов называется катализом, а сами эти реакции являются каталитическими. Различают положительный и отрицательный катализ. Положительным называют катализ, при котором скорость возрастает, отрицательным — при котором она убывает. Примером положительного катализа, то есть ускорения реакции, может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного — снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия. Нитрит натрия является также одним из консервантов продуктов переработки сельскохозяйственной продукции, замедляющий процессы гниения. Вещества, замедляющие химическую реакцию, называются ингибиторами. Однако принято говорить о катализе преимущественно как о процессе, ускоряющем реакции. Действие катализатора обусловлено снижением величины энергии активации химического взаимодействия. Под воздействием катализаторов реакции могут ускоряться в миллионы и более раз. Более того, некоторые реакции без катализаторов вообще не реализуются. Очень многие процессы в промышленности являются каталитическими. Биохимические реакции в живой клетке идут в присутствии ферментов – биологических катализаторов. Рассмотрим процесс дегидратации этанола, который без катализатора практически не осуществим. С2Н5ОН → С2Н4 + Н2О. Однако в присутствии концентрированной серной кислоты реакция протекает с достаточно высоким выходом. На Сл.16 представлена диаграмма, на которой показано, как меняется Еа в присутствии катализатора. Мы видим существенное снижение Еа в присутствии катализатора, что делает процесс осуществимым. (Сл.18) Различают гомогенный и гетерогенный катализ. При гомогенном катализе катализатор и реагенты образуют одну фазу (газ или раствор), а при гетерогенном катализе – катализатор находится в системе в виде самостоятельной фазы. Примером гомогенного катализа служит реакция окисления сернистого газа до серного ангидрида в присутствии оксида азота (II). Реагенты и катализатор в данном случае находятся в одном фазовом состоянии – газообразном. 2SO2(г) + O2(г) – [NO(г)]→ 2SO3. Примером гетерогенного катализа является та же реакция при контактном способе получения серной кислоты в присутствии твердого оксида ванадия: 2SO2(г)+ O2(г) – (V2O5(тв))→ 2SO3. Здесь катализатор – твердое вещество. Контрольные вопросы 1.Какие вопросы являются предметом изучения химической кинетики? 2. Как определяется скорость гомогенной химической реакции? 3. Как определяется скорость гетерогенной реакции? 4. От каких факторов зависит скорость химической реакции? 5. Как зависит скорость реакции от концентрации реагирующих веществ? 6. Как зависит скорость реакции от температуры? 7. Что такое энергия активации? 8. Какие вещества называют катализаторами? 9. В чем заключается механизм действия катализатора?