Образовательный минимум Четверть 2
advertisement

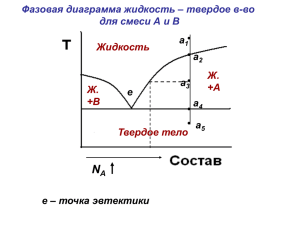
Образовательный минимум Четверть Предмет Класс 2 Химия 11 Химические реакции Химическая реакция – это процесс, в результате которого из одних веществ образуются другие вещества. Скорость химической реакции- изменение концентрации одного их реагирующих веществ в единице объема за единицу времени (гомогенная реакция) или изменение концентрации одного из реагирующих веществ на единицу поверхности за единицу времени (гетерогенная реакция). Формула v=C2-C1/t2-t1=∆C/∆t Химическое равновесие- состояние реакционной системы, в котором скорости прямой и обратной реакции равны. Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, оказать какоелибо воздействие, то равновесие смещается в сторону той реакции, которая ослабит это воздействие. Катализ-изменение скорости химической реакции под действием катализаторов. Катализаторы-простые или сложные вещества, изменяющие скорость химической реакции, участвующие в промежуточных стадиях процесса, но не расходующиеся в нём. Экзотермические реакции – реакции, протекающие с выделением теплоты. Эндотермические реакции – реакции, идущие с поглощение теплоты. Реакции разложения – это реакции, в результате которых из одного сложного вещества образуются два и более новых веществ. Реакции соединения – это реакции, в результате которых из двух или нескольких веществ образуется одно более сложное вещество. Обратимые реакции – химические реакции, которые протекают в двух противоположных направлениях. Реакции замещения - это реакции, в результате которых атомы простого вещества замещают атомы в сложном веществе. Реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями. Гетерогенные реакции – реакции, которые протекают в неоднородной среде (жидкостьтвердое, газ-жидкость, газ-твердое вещество) Правило Я.Х.Вант-Гоффа. При повышении температуры на каждые 10 0С скорость химической реакции возрастает в 2-4 раза (эта величина называется температурным коэффициентом). Химическое равновесие-состояние химического обратимого процесса, при котором скорость прямой реакции равна скорость обратной реакции.