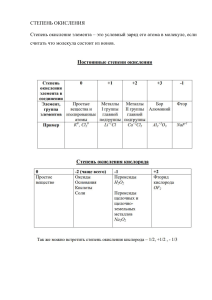
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Термины, определения, понятия Окислительно-восстановительные реакции – это реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим, другими словами – это реакции, в результате которых изменяются степени окисления элементов. Степень окисления – это заряд атома элемента в соединении, вычисленный из условного предположения, что все связи в молекуле являются ионными. Степень окисления принято указывать арабской цифрой над символом элемента со знаком плюс или минус перед цифрой. Например, если связь в молекуле HCl ионная, то водород и хлор ионы с зарядами (+1) и (– 1 1 1), следовательно H Cl . Для того чтобы рассчитать степень окисления любого элемента, необходимо пользоваться следующими правилами: 1. Степень окисления атомов в простых веществах равна нулю: 0 0 0 0 0 H 2 , Cl 2 , O 2 , C, Me (металл в свободном состоянии). 2. Степень окисления (+1) во всех соединениях имеют щелочные металлы (IA группа) и водород, за исключением гидридов активных металлов, где степень окисления водорода равна (–1), например 1 1 2 1 Na H, Сa H 2 . 3. Степень окисления +2 во всех соединениях имеют щелочноземельные металлы (II A группа). 4. Кислород имеет степень окисления (–2), во всех соединениях, 1 1 2 1 2 1 кроме пероксидов ( H 2 O 2 , Ba O 2 ) и фторида кислорода O F 2 . 5. Алгебраическая сумма степеней окисления всех частиц в молекуле равна нулю, а в ионе – заряду иона 1 1 H Cl → +1–1 = 0, 5 2 NO 3 ( N O 3 ) 1 5 3 (2) 1. 6. Степень окисления иона элемента равна заряду иона: 2 1 Сa Cl 2 Ca2+ + 2Cl1–. 7. Не следует путать понятия «валентность» и «степень окисления». Так в N2, NH3, N2H4, NH2OH валентность (ковалентность) азота равна трем, так как азот образует три ковалентные связи, а степень окисления 0 -3 -2 -1 различна: N 2 , N H 3 , N 2 H 4 , N H 2 OH . Используя выше указанные правила, рассчитаем степени окисления хрома в K2Cr2O7, хлора в NaClO, серы в H2SO4, азота в NH4NO2: х 1 х 1 х 2 х 1 х 2 K 2 Cr 2 O7 K 2 Cr 2 O 7 , Na Cl O Na Cl O, 2(+1) + 2·х + 7(–2) = 0, +1 + х + (–2) = 0, х 2 H 2 S O 4 H 2 S O 4 , 2(+1) + х + 4(–2) = 0, х = +6; х = +1; х = +6; Окисление и восстановление. Окислением называется отдача электронов, в результате чего степень окисления элемента повышается. Восстановлением называется присоединение электронов, в результате чего степень окисления элемента понижается. Окислительные и восстановительные процессы тесно связаны между собой, так как химическая система только тогда может отдавать электроны, когда другая система их присоединяет (окислительновосстановительная система). Присоединяющая электроны система (окислитель) сама восстанавливается (превращается в соответствующий восстановитель), а отдающая электроны система (восстановитель), сама окисляется (превращается в соответствующий окислитель). Пример 1. Рассмотрим реакцию: 0 1 1 0 K Cl 2 K Cl K 1е Cl 2 2e восстановитель окислитель K 1 окисленная форма ( окислитель ) 1 2Cl восстановленная форма ( восстановитель ) Число электронов, отдаваемых атомами восстановителя (калия), равно числу электронов, присоединяемых молекулами окислителя (хлора). Поэтому одна молекула хлора может окислить два атома калия. Уравнивая число принятых и отданных электронов, получаем: 2 K 1e K процесс окисления вос ль 1 Сl 2 2 e 2Cl процесс восстановл ения ок ль Суммарное уравнение : 2К Cl 2 2K 2Cl 2K Cl 2 2KCl К типичным окислителям относят: 1. Элементарные вещества – Cl2, Br2, F2, I2, O, O2. 2 2. Соединения, в которых элементы проявляют высшую степень окисления (определяется номером группы) – 7 6 6 5 5 7 K Mn O 4 , K 2 Cr 2 O 7 , H 2 S O 4 , H N O 3 , K Cl O 3 , K Cl O 4 , 7 5 K I O 4 , K I O 3 и т.д. 3. Катион Н+ и ионы металлов в их высшей степени окисления – Sn4+, Cu2+, Fe3+ и т. д. К типичным восстановителям относят: 1. Элементарные вещества – металлы (наибольшая восстановительная способность у щелочных металлов), Н2, С, СО. 2. Соединения, в которых элементы проявляют низшую степень 3 2 1 1 2 окисления – N H 3 , H 2 S , H I , H Cl, K 2 S и т.д. 3. Ионы металлов низшей степени окисления – Sn2+, Cu+, Cr3+, Fe2+. Окислительно-восстановительная двойственность. Соединения высшей степени окисления, присущей данному элементу, могут в окислительно-восстановительных реакциях выступать только в качестве окислителей, степень окисления элемента может в этом случае только понижаться. Соединения низшей степени окисления могут быть, наоборот, только восстановителями; здесь степень окисления элемента может только повышаться. Если же элемент находится в промежуточной степени окисления, то его атомы могут, в зависимости от условий, принимать электроны, выступая в качестве окислителя или отдавать электроны, выступая в качестве восстановителя. Так, например, степень окисления азота в соединениях изменяется в пределах от (– 3) до (+5) (рисунок 1): + -3 NH3, NH4OH только восстановители -2 -1 0 +1 +2 +3 +4 Соединения с промежуточными степенями окисления азота могут выступать в качестве окислителей, восстанавливаясь до низших степеней окисления, или в качестве восстановителей, окисляясь до высших степеней окисления +5 HNO3, соли HNO3 только окислители Рисунок 1 – Изменение степени окисления азота Метод электронного баланса уравнивания окислительновосстановительных реакций заключается в выполнении следующего правила: число электронов, отданных всеми частицами восстановителей, все3 гда равно числу электронов, присоединенных всеми частицами окислителей в данной реакции. Пример 2. Проиллюстрируем метод электронного баланса на приме0 0 3 2 ре окисления железа кислородом: Fe O 2 Fe 2 O 3 . вос-ль ок-ль Fe0 – 3ē = Fe+3 – процесс окисления; O2 + 4ē = 2O–2 – процесс восстановления. В системе восстановителя (полуреакция процесса окисления) атом железа отдает 3 электрона (Приложение А). В системе окислителя (полуреакция процесса восстановления) каждый атом кислорода принимает по 2 электрона – в сумме 4 электрона. Наименьшее общее кратное двух чисел 3 и 4 равно 12. Отсюда железо отдает 12 электронов, а кислород принимает 12 электронов: 4 3 12 Fe 3e Fe 3 O 2 4 e 2O 2 4Fe 3O 2 4Fe 3 2O 2 , 4Fe 3O 2 2Fe 2 O 3 . Коэффициенты 4 и 3, записанные левее полуреакций в процессе суммирования систем, умножаются на все компоненты полуреакций. Суммарное уравнение показывает, сколько молекул или ионов должно получиться в уравнении. Уравнение составлено верно, когда число атомов каждого элемента в обеих частях уравнения одинаково. Метод полуреакций применяется для уравнивания реакций, протекающих в растворах электролитов. В таких случаях в реакциях принимают участие не только окислитель и восстановитель, но и частицы среды: молекулы воды (Н 2О), Н+ и ОН– – ионы. Более правильным для таких реакций является применение электронно-ионных систем (полуреакций). При составлении полуреакций в водных растворах вводят, при необходимости, молекулы Н2О и ионы Н+ или ОН–, учитывая среду протекания реакции. Слабые электролиты, малорастворимые (Приложение Б) и газообразные соединения в ионных системах записываются в молекулярной форме (Приложение В). Рассмотрим в качестве примеров взаимодействия сульфата калия и перманганата калия в кислой и щелочной среде. Пример 3. Взаимодействие сульфата калия и перманганата калия в кислой среде: 4 7 4 2 окислитель восстановитель 6 K Mn O 4 K 2 S O 3 H 2SO 4 Mn SO 4 K 2 S O 4 H 2 O Определим изменение степени окисления элементов и указываем их в уравнении. Высшая степень окисления марганца (+7) в KMnO4 указывает, что KMnO4 – окислитель. Сера в соединении K2SO3 имеет степень окисления (+4) – это восстановленная форма по отношению к сере (+6) в соединении K2SO4. Таким образом, K2SO3 – восстановитель. Реальные ионы, в которых находятся элементы изменяющие степень окисления и их исходные полуреакции принимают следующий вид: MnO 4 Mn 2 SO 32 SO 24 Цель дальнейших действий заключатся в том, чтобы в данных полуреакциях вместо стрелок, отражающих возможное направление реакции, поставить знаки равенства. Это можно будет сделать тогда, когда в левой и правой частях каждой полуреакции будут совпадать виды элементов, число их атомов и суммарные заряды всех частиц. Чтобы добиться этого, используют дополнительные ионы или молекулы среды. Обычно это ионы Н+, ОН– и молекулы воды. В полуреакции MnO 4 Mn 2 число атомов марганца одинаково, однако не равно число атомов кислорода, поэтому в правую часть полуреакции вводим четыре молекулы воды: MnO 4 Mn 2 4Н 2 О . Проведя аналогичные действия (уравнивая кислород) в системе SO 32 SO 24 , получаем SO 32 Н 2 О SO 24 . В обеих полуреакциях появились атомы водорода. Их число уравнивают соответствующим добавлением в другой части уравнений эквивалентным числом ионов водорода. MnO 4 8Н Mn 2 4Н 2 О SO 32 Н 2 О SO 24 2Н Теперь уравнены все элементы, входящие в уравнения полуреакций. Осталось уравнять заряды частиц. В правой части первой полуреакции сумма всех зарядов равна +2, в то время как слева заряд +7. Равенство зарядов осуществляется добавлением в левой части уравнения пяти отрицательных зарядов в виде электронов (+5 ē). Аналогично, в уравнении второй полуреакции необходимо вычесть слева 2 ē. Теперь можно поставить знаки равенства в уравнениях обеих полуреакций: MnO 4 8Н 5е Mn 2 4Н 2 О – процесс восстановления; SO 32 Н 2 О 2 е SO 24 2Н – процесс окисления. 5 В рассматриваемом примере отношение числа электронов, принимаемых в процессе восстановления, к числу электронов, высвобождающихся при окислении, равно 5 ׃2. Для получения суммарного уравнения реакции надо, суммируя уравнения процессов восстановления и окисления, учесть это соотношение – умножить уравнение восстановления на 2, а уравнение окисления – на 5. 2 MnO 4 8Н 5е Mn 2 4Н 2 О 5 SO 32 Н 2 О 2 е SO 24 2Н Умножая коэффициенты на все члены уравнений полуреакций и суммируя между собой только правые и только левые их части, получаем окончательное уравнение реакции в ионно-молекулярной форме: + 2MnO 4 16Н 10е 2Mn 2 8Н 2 О 5SO 32 5Н 2 О 10е 5SO 24 10Н 2MnO 4 16Н 5SO32 5Н 2О 10 е 10е 2Mn 2 8Н 2О 5SO24 10Н Сокращая подобные члены, методом вычитания одинакового количества ионов Н+ и молекул Н2О, получаем: 2MnO 4 6Н 5SO 32 2Mn 2 3Н 2 О 5SO 24 Суммарное ионное уравнение записано правильно, есть соответствие среды с молекулярным. Полученные коэффициенты переносим в молекулярное уравнение: 2K Mn O 4 5K 2 S O 3 3H 2SO 4 2Mn SO 4 6K 2 S O 4 3H 2 O Пример 4. Взаимодействия сульфата калия и перманганата калия в щелочной среде: 7 4 окислитель восстановитель 6 6 K Mn O4 K 2 S O3 КОН K 2 Mn O4 K 2 S O4 H 2O Определяем степени окисления элементов, изменяющих степень окисления (Mn+7 → Mn+6, S+4 → S+6). Реальные ионы, куда входят данные элементы ( MnO 4 MnО 24 , SO 32 SO 24 ). Процессы (полуреакции) окисления и восстановления: 2 MnO 4 1е MnО 24 – процесс восстановления 1 SO 32 2ОН 2 е SO 24 Н 2 О – процесс окисления Суммарное уравнение: 2MnO 4 SO 32 2ОН 2MnО 24 SO 24 Н 2 О 6 В суммарном ионном уравнении есть соответствие среды. Переносим коэффициенты в молекулярное уравнение: 7 4 6 6 2K Mn O4 K 2 S O3 2КОН 2К 2 Mn O4 K 2 S O4 H 2O . Реакции окисления-восстановления делятся на следующие типы: – межмолекулярного окисления-восстановления; – самоокисления-самовосстановления (диспропорционирования); – внутримолекулярного окисления – восстановления. Реакции межмолекулярного окисления-восстановления – это реакции, когда окислитель находится в одной молекуле, а восстановитель – в другой. Пример 5. При окислении гидроксида железа во влажной среде происходит следующая реакция: 2 3 2 0 Fe(OH ) 2 О 2 Н 2 О Fe(OH) 3 восстановитель окислитель 4 Fe(OH)2 + OH– – 1ē = Fe(OH)3 – процесс окисления; 1 О2 + 2Н2О + 4ē = 4OH– – процесс восстановления. Для того чтобы убедиться в правильности записи электронноионных систем необходимо произвести проверку: левая и правая части полуреакций должны содержать одинаковое количество атомов элементов и зарядность. Затем, уравнивая количество принятых и отданных электронов, суммируем полуреакции: 4Fe(OH)2 + 4OH– + O2 +2H2O = 4Fe(OH)3 + 4OH– 4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3 Реакции самоокисления-самовосстановления (реакции диспропорционирования) – это реакции, в ходе которых часть общего количества элемента окисляется, а другая часть – восстанавливается, характерно для элементов, имеющих промежуточную степень окисления. Пример 6. При взаимодействии хлора с водой получается смесь соляной и хлорноватистой (НСlО) кислот: 0 Cl 2 1 1 H 2 O HCl HCl O окислитель восстановитель Здесь и окисление и восстановление претерпевает хлор: 1 Cl2 + 2H2O – 2ē = 2HClO +2H+ – процесс окисления; 1 Cl2 + 2ē = 2Cl– – процесс восстановления. 2Cl2 + 2H2O = 2HClO + 2HCl Пример 7. Диспропорционирование азотистой кислоты: 7 3 H N O 2 H N O 3 NO H 2 O окислитель восстановитель 3 В данном случае окисление и восстановление претерпевает N в составе HNO2: 1 HNO2 H 2 O 2e NO3 3H вос ль 2 HNO2 H 1e NO H 2 О ок ль Суммарное уравнение: HNO2 + 2HNO2 + H2O + 2H+ = NO 3 + 3H+ + 2NO + 2H2O 3HNO2 = HNO3 + 2NO + H2O Реакции внутримолекулярного окисления-восстановления – это процесс, когда одна составная часть молекулы служит окислителем, а другая – восстановителем. Примерами внутримолекулярного окислениявосстановления могут быть многие процессы термической диссоциации. Пример 8. Термическая диссоциация NH4NO2: 3 3 0 N H N O N 2 4H 2 O 4 2 в ль ок ль Здесь ион NH 4 окисляется, а ион NO 2 восстанавливается до свободного азота: 1 2NH 4 – 6 ē = N2 + 8H+ 1 2NО 2 + 8Н+ + 6 ē = N2 + 4H2O 2NH 4 + 2NO 2 + 8H+ = N2 + 8H+ + N2 + 4H2O 2NH4NO2 = 2N2 + 4H2O Пример 9. Реакция разложения бихромата аммония: 3 6 0 3 ( N H 4 ) 2 Сr 2 O 7 N 2 Cr 2 O 3 4H 2 O в ль ок ль 1 2NH 4 – 6 ē = N2 + 8H+ 1 Сr2О 72 + 8Н+ + 6 ē = Cr2O3 + 4H2O 2NH 4 + Сr2О 72 + 8H+ = N2 + 8H+ + Cr2O3+ 4H2O (NH4)2Сr2О7 = N2 + Cr2O3 + 4H2O 8 Окислительно-восстановительные реакции с участием более двух элементов изменяющих степень окисления. Пример 10. Примером служит реакция взаимодействия сульфида железа с азотной кислотой, где в ходе реакции три элемента (Fe, S, N) изменяют степень окисления: FeS2 + HNO3 Fe2(SO4)3 + NO + … Уравнение записано не до конца и использование электронно-ионных систем (полуреакций) позволит закончить уравнение. Рассматривая степени окисления участвующих в реакции элементов, определяем, что в FeS2 два 5 элемента (Fe, S) окисляются, а окислителем является N O 3 ( N ), который восстанавливается до NO: Fe2+ → Fe3+ –1 6 2 → SO 4 ( S ) S Записываем полуреакцию окисления FeS2: FeS2 → Fe3+ + SO 24 Наличие двух ионов Fe3+ в Fe2(SO4)3 предполагает удвоения числа атомов железа при дальнейшей записи полуреакции: 2FeS2 → 2Fe3+ + 4 SO 24 Одновременно уравниваем число атомов серы и кислорода, получаем: 2FeS2 + 16Н2O → 2Fe3+ + 4 SO 24 . 32 атома водорода, введением в левую часть уравнения в составе 16 молекул Н2О уравниваем добавлением эквивалентного числа ионов водорода (32 Н+) в правую часть уравнения: 2FeS2 + 16Н2O → 2Fe3+ + 4 SO 24 + 32Н+ Зарядность правой части уравнения +30. Для того чтобы в левой части было тоже самое (+30) необходимо вычесть 30 ē: 1 2FeS2 + 16Н2O – 30 ē = 2Fe3+ + 4 SO 24 + 32Н+ – окисление; 10 NО 3 + 4Н+ + 3 ē = NО + 2H2O – восстановление. 2FeS2+16Н2O+10NО 3 +40Н+ = 2Fe3++ 4 SO 24 + 32Н+ + 10NО + 20H2O 2FeS2+10НNО3 + 30Н+= Fe2(SO4)3 + 10NО + SO 24 + 32Н+ + 4H2O Н2SO4+30Н+ Сокращаем обе части уравнения на одинаковое число ионов (30 Н+) методом вычитания и получаем: 2FeS2+10НNО3 = Fe2(SO4)3 + 10NО + Н2SO4 + 4H2O 9 Энергетика окислительно-восстановительных реакций. Условием самопроизвольного протекания любого процесса, в том числе и окислительно-восстановительной реакции является неравенство ∆G < 0, где ∆G – энергия Гиббса и чем меньше ∆G, т.е. чем больше его отрицательное значение, тем более реакционноспособнее окислительновосстановительная система. Для реакций окисления-восстановления: ∆G = –n·F·ε, где n – число электронов, передаваемое восстановителем окислителю в элементарном акте окисления-восстановления; F – число Фарадея; ε – электродвижущая сила (Э.Д.С.) окислительно-восстановительной реакции. Электродвижущая сила окислительно-восстановительной реакции определяется разностью потенциалов окислителя и восстановителя: ε = Еок – Ев, В стандартных условиях: ε° = Е°ок – Е°в. Итак, если условием самопроизвольного протекания процесса является неравенство ∆G° < 0, то это возможно, когда n·F·ε° > 0. Если n и F числа положительные, то необходимо, чтобы ε° > 0, а это возможно, когда Е°ок > Е°в. Отсюда следует, что условием самопроизвольного протекания окислительно-восстановительной реакции является неравенство Е°ок > Е°в. Пример 11. Определите возможность протекания окислительновосстановительной реакции: 0 Сu восстановитель 1 2 0 2H Cl Cu Cl 2 H 2 окислитель Определив степени окисления элементов, изменяющих степень окисления, запишем полуреакции окислителя и восстановителя с указанием их потенциалов: Сu – 2ē = Сu2+ Е°в = +0,34 В 2Н+ + 2ē = Н2 Е°ок = 0,0 В Из полуреакций видно, что Е°ок < Е°в, это говорит о том, что рассматриваемый процесс термодинамически невозможен (∆G° > 0). Данная реакция возможна только в обратном направлении, для которого ∆G° < 0. Пример 12. Рассчитайте энергию Гиббса и константу равновесия реакции восстановления перманганата калия сульфатом железа (II). 7 2 K Mn O 4 Fe S O 4 окислитель восстановитель 2 3 H 2SO 4 Mn SO 4 Fe 2 (S O 4 ) 3 K 2 S O 4 H 2 O 10 Полуреакции окислителя и восстановителя: 2 MnO 4 8Н 5е Mn 2 4Н 2 О 5 2Fe2+ – 2 ē = 2Fe3+ Е°ок = +1,52В Е°в = +0,77 В 2MnO 4 16Н 10Fe2 2Mn 2 10Fe3 8Н 2 О ∆G° = –n·F·ε° = –n·F(Е°ок – Е°в), где n = 10, так как восстановитель отдает 10 ē, окислитель принимает 10 ē в элементарном акте окисления-восстановления. ∆G° = –10·69500(1,52–0,77) = –725000 Дж, ∆G° = –725 кДж. Учитывая, что стандартное изменение энергии Гиббса связано с ее константой равновесия (Кс) соотношением: ∆G° = –RTlnКс или n·F·ε = RTlnКс, где R = 8,31 Дж·моль–1·К–1, F 96500 Кл·моль–1, Т = 298 К. Определяем константу равновесия для данной реакции, проставив в уравнении постоянные величины, переведя натуральный логарифм в десятичный: n 10 (1,52 0,77) lg K c 127, 0,059 0,059 Кс = 10127. Полученные данные говорят о том, что рассматриваемая реакция восстановления перманганата калия реакционноспособна (∆G° = – 725 кДж), процесс протекает слева направо и практически необратима (Кс = 10127). Вопросы для самоконтроля 1) Какие реакции называются окислительно-восстановительными? 2) Что такое степень окисления? Что такое валентность? Всегда ли совпадает степень окисления с валентностью? 3) Определите степень окисления каждого элемента в веществах и распишите на ионы: Al, H2, МnO, H2O, Al2O3, НСl, Н2SO4, KOH, Al(OH)3 CuCl2, KMnO4, K2SO3, K2Cr2О7, Сr2(SО4)3 Na[Al(OH)4] 4 2 Например, K 2 C O3 2K CO32 . 4) Определите среду реакций: а) 2K Mn O 4 5K 2 S O3 3H 2SO 4 2Mn SO 4 6K 2 S O 4 3H 2O б) 2K Mn O 4 K 2 S O 3 2КОН 2К 2 Mn O 4 K 2 S O 4 H 2 O 11 5) Определите процесс (окисление, восстановление), окислитель и 7 2 4 6 6 3 0 восстановитель в схемах: Mn Mn , S S , Cr Cr , 2 J J 2 . 0 2 Напишите электронную схему. Например, Fe Fe : Fe0 – 2 ē → Fe+2 – процесс окисления, Fe0 – восстановитель, отдает ē. 6) Составьте полуреакцию процесса (окисление, восстановление) для схем: 6 4 7 в кислой среде: MnO4–( Mn )→ Mn2+, SO32–( S )→ SO42–( S ), – 7 2– 6 4 6 в щелочной среде: MnO4 ( Mn )→ MnO4 ( Mn ), SO3 ( S ) → SO4 ( S ). 2– 2– 3 Например, NО 2 ( N )→ N2: 2NО 2 + 8Н+ + 6 ē = N2 + 4H2O 7) Определите тип реакций: а) H2S + 8HNO3 → H2SO4 + 8NO2 + 4H2O б) 2Pb(NO3)2 → 2PbO + 4NO2 + O2 в) 3HNO2 → HNO3 + 2NO +H2O 8) Какие вещества чаще всего выступают в роли окислителей, а какие в роли восстановителей? Приведите примеры типичных окислителей и восстановителей. Тестовые задания Вариант 1 1. В каком из предложенных соединений S проявляет низшую степень окисления: 1) H2SO4 2) H2S 3) S 4) SO2 2. Какой элемент окисляется в ходе реакции N2 + 3H2 + 2H2O = 2NH4OH? 1) N 2) H 3) O 4) ни один из элементов не окисляется 3. Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции: HBr + H2SO4 → SO2 + Br2 + H2O. 1) 10 2) 9 3) 7 4) 22 12 4. Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 1) –532 кДж 2) 178 кДж 3) 705 кДж 4) –22 кДж Вариант 2 1. В каком из предложенных соединений Mn проявляет низшую степень окисления: 1) Mn2SO4 2) Mn 3) MnO2 4) HMnO4 2. Какой элемент окисляется в ходе реакции FeCl3 + KJ = FeCl2 +J2 + KCl? 1) Fe 2) K 3) Cl 4) J 3. Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции Сu HNO 3 разб Cu ( NO 3 ) 2 NO H 2 O . 1) 10 2) 6 3) 20 4) 12 4. Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 5) 275 кДж 6) 177 кДж 7) –359 кДж 8) –267 кДж Вариант 3 1. В каком из предложенных соединений Cr проявляет низшую степень окисления: 1) Cr(OН)3 2) Na2CrO4 3) CrO 4) CrO3 2. Какой элемент окисляется в ходе реакции H2S + Cl2 + H2O → H2SO4 + HCl? 1) N 2) H 3) O 4) ни один из элементов не окисляется 13 3. Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции P + HNO3 + H2O → H3PO4 + NO 1) 4 2) 15 3) 8 4) 18 4. Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 5) 1563 кДж 6) 968 кДж 7) –1983 кДж 8) –235 кДж Вариант 4 1. В каком из предложенных соединений N проявляет низшую степень окисления: 1) NH3 2) N2 3) NO2 4) N2O 2. Какой элемент окисляется в ходе реакции H2S + HNO3 S + NO2 + H2O? 1) N 2) H 3) S 4) ни один из элементов не окисляется 3. Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции Pb + HNO3 → Pb(NO3)2 + NO + H2O. 1) 11 2) 3 3) 20 4) 5 4. Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 1) 125 кДж 2) –576 кДж 3) –629 кДж 4) 954 кДж Вариант 5 1. В каком из предложенных соединений Cl проявляет низшую степень окисления: 14 1) Cl2 2) HCl 3) HClO4 4) Cl2 2. Какой элемент окисляется в ходе реакции I2 + Cl2 + H2O HIO3 + HCl? 5) Сl 6) I 7) H 8) O 3. Найдите сумму коэффициентов в уравнении окислительноt Cu ( NO3 ) 2 NO 2 H 2O. восстановительной реакции Cu HNO 3 конц 9) 8 10) 10 11) 11 12) 7 4. Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 13) –430,0 кДж 14) 901 кДж 15) 705 кДж 16) –89 кДж Вариант 6 1. В каком из предложенных соединений О проявляет низшую степень окисления: 1) H2О 2) O2 3) NaOH 4) BaO2 2. Какой элемент окисляется в ходе реакции MnO2 + KClO3 + KOH K2MnO4 + KCl + H2O? 1) Cl 2) K 3) H 4) Mn 3. Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции HI + Н2SO4 → I2 + H2S + H2O. 1) 3 2) 18 3) 4 4) 2 15 4. Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 1) –645 кДж 2) –270 кДж 3) 1023 кДж 4) 170 кДж Вариант 7 1. В каком из предложенных соединений I проявляет низшую степень окисления: 1) I2 2) HIO3 3) HIO4 4) HI 2. Какой элемент окисляется в ходе реакции P + HIO3 + H2O H3PO4 + HI? 1) I 2) H 3) P 4) ни один из элементов не окисляется 3. Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции Cl 2 KI I 2 KCl . 1) 4 2) 2 3) 6 4) 3 4. Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 1) –160 кДж 2) –450 кДж 3) 654 кДж 4) 90 кДж Вариант 8 1 В каком из предложенных соединений Ti проявляет низшую степень окисления: 1) Ti2O3 2) TiCl4 3) Ti(SO4)2 4) TiO 2 Какой элемент окисляется в ходе реакции KMnO4 + HCl = MnCl2 + KCl + Cl2 + H2O? 1) K 2) Cl 16 3) Mn 4) H 3 Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции Na H 2SO 4 ( pазб) Na 2SO 4 H 2 . 1) 6 2) 4 3) 5 4) 3 4 Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 1) – 532 кДж 2) 654 кДж 3) 308 кДж 4) –987 кДж Вариант 9 1 В каком из предложенных соединений Fe проявляет низшую степень окисления: 1) FeO 2) Fe2O3 3) Fe(OH)3 4) Fe2(SO4)3 из элементов не окисляется 2 Какой элемент окисляется в ходе реакции HI + H2SO4 I2 + H2S + H2O? 1) I 2) S 3) H 4) ни один из элементов не окисляется 3 Найдите сумму коэффициентов в уравнении окислительноt CaSO 4 H 2S H 2 O. восстановительной реакции Ca H 2SO 4( конц ) 1) 5 2) 9 3) 18 4) 22 4 Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 1) 654 кДж 2) –95 кДж 3) –2393 кДж 4) 1093 кДж Вариант 10 1 В каком из предложенных соединений N проявляет низшую степень окисления: 1) NH4OH 2) NO 3) HNO3 17 4) N2O5 2 Какой элемент окисляется в ходе реакции Fe(OH)2 + H2O + O2 Fe(OH)3? 1) Fe 2) H 3) O 4) ни один из элементов не окисляется 3. Найдите сумму коэффициентов в уравнении окислительноt MgSO 4 H 2S H 2O. восстановительной реакции Mg H 2SO 4( конц ) 5) 6 6) 18 7) 9 8) 10 4. Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 9) – 1679 кДж 10) 568 кДж 11) 165 кДж 12) –2069 кДж Вариант 11 1 В каком из предложенных соединений Br проявляет низшую степень окисления: 1) H2BrO3 2) HBr 3) KBrO 4) Br2 2 Какой элемент окисляется в ходе реакции NH3 + Cl2 = N2 + HCl? 1) Cl 2) N 3) H 4) ни один из элементов не окисляется 3 Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции PbO 2 HCl PbCl 2 Cl 2 H 2 O . 1) 10 2) 2 3) 7 4) 9 4 Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 1) –17 кДж 2) –654 кДж 3) 273 кДж 4) 69 кДж Вариант 12 18 1 В каком из предложенных соединений P проявляет низшую степень окисления: 1) PH3 2) P2O5 3) PCl3 4) P2O3 2 Какой элемент окисляется в ходе реакции Pt + HNO3 + HCl PtCl4 + NO + H2O? 1) N 2) Pt 3) Cl 4) H 3 Найдите сумму коэффициентов в уравнении окислительновосстановительной реакции J2 + Cl2 + H2O → 2HJO3 + HCl. 1) 12 2) 24 3) 20 4) 18 4 Рассчитать энергию Гиббса ∆G° для реакции из предыдущего вопроса. 1) 31 кДж 2) 213 кДж 3) –164 кДж 4) –274 кДж Правила техники безопасности Перед началом выполнения лабораторной работы студент должен ознакомиться с правилами техники безопасности при работе с растворами и приборами. Список рекомендованной литературы 1. Глинка Н. Л. Общая химия : учеб. пособие для вузов /Н. Л. Глинка ; под общ. ред. А. И. Ермакова. – 30-е изд., перераб. и доп. – М. : Интеграл-Пресс, 2010. – 728 с. 2. Глинка Н.Л. Задачи и упражнения по общей химии : учеб. пособие для вузов / Н. Л. Глинка ; под общ. ред. В. А. Рабиновича, Х. М. Рубиной. – 25-е изд., стереотип. – М. : Интеграл-Пресс, 2006. – 240 с. 3. Ахметов Н. С. Общая и неорганическая химия : учебник для вузов / Н. С. Ахметов. – 3-е изд., перераб. и доп. – М. : Высш. шк., 1998. – 743 с. 4. Коровин Н. В. Общая химия : учебник для вузов / Н. В. Коровин. – М. : Высш. шк., 2000. – 558 с. 19 Приложение А Стандартные окислительно-восстановительные потенциалы Таблица А.1 – Окислительно-восстановительные потенциалы металлов Окисленная форма +n ē Восстановленная форма Е0, В Ag+ +1ē Ag +0,80 Al3+ +3ē Al –1,66 Au2+ +2ē Au + 1,70 Au3+ +3ē Au + 1,50 Bа2+ +2ē Bа – 2,90 Be2+ +2ē Be –1,97 Bi3+ +3ē Bi + 0,215 Ca2+ +2ē Ca –2,79 Cd2+ +2ē Cd –0,403 Co3+ +ē Co2+ +1,96 Co3+ +3ē Co +0,46 Co2+ +2ē Co –0,29 Cr3+ +ē Cr2+ –0,41 Cr3+ 3ē Cr –0,74 Cr2+ +2ē Cr –0,91 Cu2+ +2ē Cu +0,345 Cu+ +ē Cu +0,531 Cs+ +ē Cs – 2,923 Fe3+ +ē Fe2+ +0,771 Fe3+ +3ē Fe –0,058 Fe2+ +2ē Fe –0,473 2H+ +2ē H2 0,000 2Hg2+ +2ē Hg22+ +0,907 Hg2+ +2ē Hg +0,850 Hg22+ +2ē Hg +0,792 K+ +ē K – 2,924 Li+ +ē Li – 3,045 20 Продолжение таблицы А.1 Окисленная форма +n ē Восстановленная форма Е0, В Mg2+ +2ē Mg –2,37 Mn3+ +ē Mn2+ +1,51 Mn2+ +2ē Mn –1,17 Mo3+ +3ē Mo –0,20 Na+ +ē Na – 2,714 Ni2+ +2ē Ni –0,228 Pb2+ +2ē Pb –0,126 Pb4+ +2ē Pb2+ +1,66 Pb4+ +4ē Pb +0,77 Pt2+ +2ē Pt + 1,19 Rb+ +ē Rb – 2,925 Sb3+ +3ē Sb +0,20 Sn2+ +2ē Sn –0,14 Sn4+ +2ē Sn2+ +0,15 Sn4+ +4ē Sn +0,01 Ti2+ +2ē Ti –1,603 V3+ +ē V2+ –0,255 V2+ +2ē V –1,18 V3+ +3ē V –0,87 Zn2+ +2ē Zn –0,764 Zr4+ +4ē Zr – 1,58 Таблица А.2 – Окислительно-восстановительные потенциалы элементов 0 ЭлеОкисленная Восстановленная +nē E ,B мент форма форма Ag Ag+ Ag2+ AgI 1ē 1ē 1ē Ag Ag+ Ag + I– A g ( S 2 O 3 ) 32 AgBr 1ē 1ē A g + 2 S 2 O32 Ag + Br– AgIO3 1ē A g + I O3 +0,35 AgBrO3 1ē A g + B r O3 +0,55 21 +0,80 +2,00 –0,15 +0,01 +0,10 Ag2CrO4 2ē 2 A g + C r O42 +0,44 Ag2MoO4 2ē 2 A g + M o O42 +0,49 AgNO2 1ē A g + N O2 +0,56 AgC2H3O2 1ē A g + C 2 H 3 O2 +0,64 Ag2SO4 2ē Ag2S 2ē 1ē 1ē 2 A g + S O42 2Ag + S2– Ag + 2CN– Ag + CN– A g ( C N )2 AgCN А.2 Al Аu Аs +0,65 –0,69 –0,31 –0,01 A g ( S O 3 ) 32 Ag2О + Н2О 2AgО + Н2О Ag2О3 + Н2О 1ē 2ē 2ē 2ē A g + 2 S O32 2Ag + 2ОН– Ag2О + 2ОН– 2AgО + 2ОН– Ag2CO3 2ē 2 A g + C O32 +0,47 A g ( N H 3 ) 2 AgCl Al3+ 1ē 1ē 3ē Ag + 2NH3 Ag + Cl– Al +0,37 +0,22 –1,66 Al(OH)3 3ē Al + 3OН– –2,29 Al(OH)3 + 3 H+ 3ē Al + 3H2O –1,40 A O H 4 3ē Al +4OН– –2,35 H 2 A l О3 + H 2 O 3ē Al +4OН– –2,35 AlO2– +4Н+ 3ē Al + 2H2O –1,26 AlF63– 3ē Al +6F– –2,07 Au+ 1ē Au +1,68 Au3+ 3ē Au +1,50 A u B r 4 Au + 4Br– +0,87 A u B r 2 3ē 1ē Au + 2Br– +0,96 A u C l 4 3ē Au + 4Cl– +1,00 A u ( C N S ) 4 3ē Au + 4CNS– +0,66 Au(OH)3 + 3H+ 3ē Au + 3H2O +1,45 A s О 2 + 2 Н 2 О 3ē As + 4ОН– –0,68 22 +0,30 +0,34 +0,57 +0,74 Элемент Ba B Be Bi Br Ca Cd Окисленная форма A s О 34 + 2 Н 2 О H 3 A s О4 + 2 H + Ba2+ BO33– + 6H+ +nē Восстановленная форма E ,B 2ē A s О 2 + 4 О Н – –0,67 2ē HAsO2 +2H2O +0,56 2ē 3ē Ba –2,91 –0,17 B 3H O B 3H O 2 0 3ē 3ē 2ē 2ē 3ē 2ē 3ē B + 4F Be Be + 4ОН– Bi 2BiO+ + 2H2O Bi + H2O –0,87 –1,04 –1,85 –2,62 +0,22 +1,59 +0,32 B i C l 4 Bi2O3 +3H2O BiOCl +2H+ 3ē Bi + 4Cl– +0,16 6ē 3ē –0,46 +0,16 NaBiO3 + 4H+ 2ē NaBiO3 + 6H+ 2ē Br2 2НВrO + 2H+ НВrO + H+ 2ВrO– + 2H2О ВrO– + H2О В r O 3 + 5 H + 2ē 2ē 2ē 2ē 2ē 4ē 2Bi +6ОН– Bi + H2O + Cl– BiO+ + Na+ + 2H2O Bi3+ + Na+ + 3H2O 2Br– Br2 + 2H2O Br– + H2O Br2 + 4ОН– Br– + 2ОН– НВrO + 2H2O В r O 3 + 2 H 2 О 4ē ВrO– +4ОН– +0,54 2 В r O 3 + 1 2 H + 10ē Br2 + 6H2O +1,52 2 В r O 3 + 6 H 2 О 10ē Br2 + 12ОН– +0,50 В r O 3 + 6 H + 6ē Br– +3H2O +1,45 В r O 3 + 3 H 2 О 6ē Br– + 6ОН– +0,61 Ca2+ Са(ОН)2 Cd2+ Cd3+ 2ē 2ē 2ē 3ē Ca Са + 2ОН– Cd Cd –2,79 –3,03 –0,40 –2,40 H3BO3 + 3H BF4– Be2+ Be(OH)42– Bi3+ Bi2O4 +4H+ BiO+ +2H+ + 23 2 – +1,18 +1,84 +1,09 +1,60 +1,34 +0,45 +0,76 +1,45 Элемент Cl Co Cr Окисленная форма Сd(NH3)42+ СdCO3 Сd(ОН)2 Сd(CN)42– Cl2 Cl2 + 2H+ ClO2 + H+ 2HClO + 2H+ 2ClO– + 2H2O HClO + H+ HClO2 + 2H+ ClO– + H2O 2HClO2 + 6H+ HClO2 + 3H+ ClO2–+ H2O ClO2– + 2H2O ClO3– + H2O 2ē 2ē 2ē 2ē 2ē 2ē 1ē 2ē 2ē 2ē 2ē 2ē 6ē 4ē 2ē 4ē 2ē Восстановленная форма Cd + 4NH3 C d + C O 32 Сd + 2ОН– Cd + 4CN– 2Cl– 2HCl HClO2 Cl2 + H2O Cl2 + 4OH– Cl– + H2O HClO + H2O Cl– + 2OH– Cl2 + 4H2O Cl– + 2H2O ClO– + 2OH– Cl– + 4OH– C l O 2 + 2 O H – –0,59 –0,74 –0,81 –1,03 +1,36 +0,99 +1,27 +1,63 +0,40 +1,50 +1,64 +0,89 +1,63 +1,56 +0,66 +0,77 +0,33 C l O 3 + 6 H + 6ē Cl– + 3H2O +1,45 2 C l O 3 + 1 2 H + 10ē Cl2 + 6H2O +1,47 C l O 3 + 3 H + 2ē HClO2+ H2O +1,21 C l O 3 + 3 H 2 O 6ē Cl– + 6OH– +0,63 C l O 4 + H 2 O 2ē C l O 3 + 2 O H – +0,36 C l O 4 + 2 H + 2ē C l O 3 + H 2 O +1,19 2 C l O 4 + 1 6 H + 14ē Cl2 + 8H2O +1,39 C l O 4 + 8 H + 8ē Cl– + 4H2O +1,38 C l O 4 + 4 H 2 O Co2+ Co3+ Co3+ Co(OH)3 Co(OH)2 СoCO3 Co(NH3)63+ Cr2+ 8ē 2ē 3ē 1ē 1ē 2ē 2ē 1ē 2ē Cl– +8OH– Co Co Co2+ Co(OH)2 + OH– Co + 2OH– Co + CO32– Co(NH3)62+ Cr +0,56 –0,28 +0,46 +1,96 +0,17 –0,71 –0,64 +0,10 –0,91 +nē 24 0 E ,B Элемент Cu F Fe Окисленная форма 3+ Cr Cr3+ Cr(OH)2 Cr(OH)3 C r O 2 + 2 H 2 O 3ē 1ē 2ē 3ē 3ē Восстановленная форма Cr Cr2+ Cr + 2OH– Cr + 3OH– Cr + 4OH– –0,74 –0,41 –1,40 –1,30 –1,20 C r 2 O 72 + 1 4 H + 6ē 2Cr3+ + 7H2O +1,33 C r O 42 + 8 H + Cr(OH)4– C r O 42 + 2 H 2 O 3ē 3ē 3ē Cr3+ + 4H2O Cr + 4OH– C r O 2 + 4 O H – +1,48 +1,20 –0,17 C r O 42 + 4 H 2 O Cu2+ Cu+ Cu2+ CuI CuBr CuCl Cu2+ + Cl– Cu2+ + Br– Cu2+ + I– Cu2+ + 2CN– 3ē 2ē 1ē 1ē 1ē 1ē 1ē 1ē 1ē 1ē 1ē Cr(OH)3 + 5OH– Cu Cu Cu+ Cu + I– Cu + Br– Cu + Cl– CuCl CuBr CuI C u ( C N ) 2 –0,13 +0,34 +0,53 +0,15 –0,18 +0,03 +0,14 +0,54 +0,64 +0,86 +1,12 C u ( C N ) 2 Cu2O + H2O CuCNS Cu(NH3)2+ 1ē 2ē 1ē 1ē –0,43 –0,36 –0,27 –0,12 2Cu(OH)2 2ē F2 Fe3+ Fe2+ Fe3+ Fe(OH)3 Fe(OH)2 FeO42–+ 8H+ Fe(CN)63– FeS 2ē 3ē 2ē 1ē 1ē 2ē 3ē 1ē 2ē Cu + 2CN– 2Cu + 2OH– Cu + CNS– Cu + 2NH3 Cu2O+ 2OH– + H2O 2F– Fe Fe Fe2+ Fe(OH)2 + OH– Fe + 2OH– Fe3+ + 4H2O Fe(CN)64– Fe + S2– +nē 25 0 E ,B –0,08 +2,87 –0,06 –0,47 +0,77 –0,56 –0,88 +1,9 +0,34 –1,0 Элемент H Hg I K Li Окисленная форма Fe(CO3) Fe2S3 FeO42–+ 2H2O 2H+ 2H+ (pH = 7) H+ 3H+ + As 2H2O H2 H2O2 + H+ HO2–+ H2O Hg2+ Hg22+ 2Hg2+ HgI42– HgBr42– HgS Hg(CN)42– HgO + H2O I2 I3– 2 I C l 2 2HIO + 2H+ 2IO– + 2H2O HIO + H+ IO– + H2O IO3– + 5H+ IO3–+ 2H2O 2IO3– + 12H+ 2IO3– + 6H2O IO3– + 6H+ IO3– + 3H2O H5IO6 + H+ H 3 I O 62 K+ Li+ +nē 2ē 2ē 3ē 2ē 2ē 1ē 3ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 4ē 4ē 10ē 10ē 6ē 6ē 2ē 2ē 1ē 1ē 26 Восстановленная форма Fe + CO32– 2FeS + S2– FeO22– + 4OH– H2 H2 H(Г) AsH3 H2 + 2OH– 2H– 2H2O 3OH– Hg 2Hg Hg22+ Hg + 4I– Hg + 4Br– Hg + S2– Hg + 4CN– Hg + 2OH– 2I– 3I– I2 + 4Cl– I2 + 2H2O I2 + 4OH– I– + H2O I– + 2OH– HIO + 2H2O IO– + 4OH– I2 + 6H2O I2 + 12OH– I– + 3H2O I– + 6OH– IO3– + 3H2O IO3– + 3OH– K Li 0 E ,B –0,75 –0,67 +0,9 0,00 –0,41 –2,1 –0,6 –0,82 –2,25 +1,77 +0,88 +0,85 +0,79 +0,91 –0,04 +0,21 –0,72 –0,37 +0,1 +0,53 +0,53 +1,06 +1,45 +0,45 +0,99 +0,49 +1,14 +0,14 +1,19 +0,21 +1,08 +0,26 +1,60 +0,70 –2,93 –3,04 Элемент Mg Mn Mo N Окисленная форма 2+ Mg Mg(OH)2 Mn2+ Mn3+ Mn(OH)2 Mn(OH)2 +2 H+ Mn(OH)3 Mn(OH)3 + 3H+ MnO2 + 2H2O MnO2 + 4H+ MnO42– + 4H+ MnO42–+ 2H2O MnO4– + 2H2O MnO4– M n O 4 + 4 H + 2ē 2ē 2ē 1ē 2ē 2ē 1ē 1ē 2ē 2ē 2ē 2ē 3ē 1ē 3ē Восстановленная форма Mg Mg +2OH– Mn Mn2+ Mn + 2OH– Mn +2 H2O Mn(OH)2 + OH– Mn2+ + 3H2O Mn(OH)2 + 2OH– Mn2+ + 2H2O MnO2 + 2H2O MnO2+ 4OH– MnO2+ 4OH– MnO42– MnO2 + 2H2O –2,37 –2,69 –1,17 +1,51 –1,18 –0,73 –0,1 +1,80 –0,05 +1,23 +2,26 +0,60 +0,59 +0,56 +1,69 M n O 4 + 8 H + MnCO3 Mo3+ MoO42–+ 4H2O H2MoO4 + 6H+ H2MoO4 + 2H+ N2 + 8H+ N2 + 8H2O 2HNO2 + 4H+ 2HNO2 + 6H+ HNO2 + 7H+ N O 2 + H 2 O 5ē 2ē 3ē 6ē 6ē 1ē 6ē 6ē 4ē 6ē 6ē 1ē Mn2+ + 4H2O Mn2+ + CO32– Mo Mo + 8OH– Mo + 4H2O MoO2+ + 2H2O 2 N H 4 2NH4OH + 6OH– N2O + 3H2O N2 + 4H2O NH4+ + 2H2O NO + 2OH– +1,51 –1,48 –0,2 –1,05 0,0 0,40 +0,26 –0,74 +1,29 +1,44 +0,86 –0,46 2 N O 2 + 4 H 2 O 6ē N2 + 8OH– +0,41 N O 2 + 6 H 2 O N2O + 2H+ N2O + H2O 2NO + 4H+ 2NO + 2H2O N2O4 + 2H+ N2O4 6ē 2ē 2ē 4ē 4ē 2ē 2ē NH4OH + 7OH– N2 + H2O N2 + 2OH– N2 + 2H2O N2 + 4OH– 2HNO2 2NO2 –0,15 +1,77 +0,94 +1,68 +0,94 +1,07 +0,88 +nē 27 0 E ,B Элемент Na Ni O Окисленная форма N2O4 + 4H+ N2O4 + 8H+ N2O4 + 4H2O NO3–+ 3H+ NO3–+ H2O NO3–+ 2H+ NO3–+ H2O NO3–+ 4H+ NO3–+ 2H2O 2NO3– + 4H+ 2NO3– + 12H+ NO3–+ 10H+ NO3– + 7H2O N2H4 + 4H2O Na+ Ni2+ Ni(OH)2 Ni(OH)3 NiO2 + 4H+ NiO2 +2H2O NiS NiCO3 O2 + 4H+ O2 + 2H+ O2 + 4H+ (pH=7) O2 + 2H2O O2 + H2O O2 + H+ H2O2 + H+ OH + H+ O2 4ē 8ē 8ē 2ē 2ē 1ē 1ē 3ē 3ē 2ē 10ē 8ē 8ē 2ē 1ē 2ē 2ē 1ē 2ē 2ē 2ē 2ē 4ē 2ē Восстановленная форма 2NO + 2H2O N2 + 4H2O N2 + 8OH– HNO2 + H2O NO2–+ 2OH– NO2 + H2O NO2 + 2OH– NO + 2H2O NO + 4OH– N2O4 + 2H2O N2 + 6H2O NH4+ + 3H2O NH4OH + 9OH– 2NH4OH + 2OH– Na Ni Ni + 2OH– Ni(OH)2 + OH– Ni + 2H2O Ni(OH)2 + 2OH– Ni + S2– Ni + CO32– 2H2O H2O2 +1,03 +1,35 +0,35 +0,94 +0,01 +0,80 –0,86 +0,96 –0,14 +0,80 +1,24 +0,87 –0,12 +0,10 –2,71 –0,25 –0,72 –0,12 +1,68 +0,49 –0,83 –0,45 +1,23 +0,68 4ē 2H2O +0,81 4ē 2ē 1ē 1ē 1ē 1ē 4OH– HO2 + OH– H O 2 H2O + OH H2O O 2 +0,40 –0,07 –0,13 +0,72 +2,8 –0,56 H O 2 + H 2 O 1ē OH + 2OH– –0,24 H O 2 + H 2 O 2ē 3OH– +0,88 O 2 + H 2 O 1ē O H – + H O 2 +0,4 +nē 28 0 E ,B Элемент P Pb S Окисленная форма O3 + 2H+ O3 + H2O O(Г) + 2H+ OH H2O2 H2O2 + 2H+ P + 3H+ P + 3H2O PO43–+ 2H2O H3PO4 + 2H+ H3PO3 + 2H+ H3PO4 + 5H+ H3PO2 + H+ H 2 P O 2 HPO32– + 2H2O Pb2+ Pb+4 Pb+4 PbO + 2H+ PbO + H2O H P b O 2 + H 2 O PbO2 + H2O PbO2 + 4H+ PbO2 + S O 24 + 4 H + PbCO3 PbS PbCl2 PbBr2 PbI2 PbSO4 Pb(OH)42– S S + 2H+ 2H2SO3 + 2H+ 2ē 2ē 2ē 1ē 2ē 2ē 3ē 3ē 2ē 2ē 2ē 5ē 1ē 1ē Восстановленная форма O2 + H2O O2 + 2OH– H2O OH– 2OH– 2H2O PH3 PH3 + 3OH– HPO32–+ 3OH– H3PO3 + H2O H3PO2 + H2O P + 4H2O P + 2H2O P +2OH– +2,07 +1,24 +2,42 +2,0 +0,88 +1,78 +0,06 –0,89 –1,12 –0,27 –0,50 –0,41 –0,51 –2,05 2ē 2ē 4ē 2ē 2ē 2ē 2ē 2ē 2ē H 2 P O 2 + 3 O H – Pb Pb Pb2+ Pb + H2O Pb + 2OH– Pb + 3OH– PbO + 2OH– Pb2+ + 2H2O –1,57 –0,12 +0,77 +1,66 +1,25 –0,58 –0,54 +0,28 +1,45 2ē PbSO4 + 2H2O +1,68 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 2ē 4ē Pb + CO32– Pb + S2– Pb + 2Cl– Pb + 2Br– Pb + 2I– P b + S O 24 Pb + 4 OH– S2– H2S S2O32–+ 3H2O –0,50 –0,95 –0,26 –0,28 –0,36 –0,35 –0,54 –0,46 +0,14 +0,40 +nē 29 0 E ,B Элемент Sb Si Sn Окисленная форма 2H2SO3 + H+ H2SO3 + 4H+ SO2 + 4H+ 4H2SO3 + 4H+ 2SO32– + 3H2O 2SO32– + 2H2O SO42– + 4H+ SO42–+ H2O SO42– + 8H+ SO42– + 4H2O SO42– + 10H+ SO42– + 4H2O 2SO42– + 4H+ S2O82– S2O42– + 4H+ S4O62– S2Cl2 SO2 + 4H+ Sb3+ SbO+ + 2H+ SbO2– + 2H2O Sb2O5 + 6H+ Sb2O5 + 2H+ Sb2O3 + 6H+ Sb + 3H+ SiO2 + 4H+ H2SiO3 + 4H+ SiO32– + 3H2O SiF62– Sn2+ Sn4+ Sn4+ H S n O 2 + H 2 O Sn(OH)42– SnO32– 3H2O Sn(OH)62– +nē 2ē 4ē 4ē 6ē 4ē 2ē 2ē 2ē 6ē 6ē 8ē 8ē 2ē 2ē 2ē 2ē 2ē 4ē 3ē 3ē 3ē 4ē 2ē 6ē 3ē 4ē 4ē 4ē 4ē 2ē 2ē 4ē 2ē 2ē 2ē 2ē 30 Восстановленная форма – HS2O4 + 2H2O S + 3H2O S + 2H2O S4O62– + 6H2O S2O32–+ 6OHS2O42– + 4OHH2SO3 + H2O SO32– + 2OHS + 4H2O S + 8OHH2S + 4H2O S2– + 8OHS2O62– + 2H2O 2SO42– 2H2SO3 2S2O32– 2S + 2ClS + 2H2O Sb Sb + H2O Sb + 4OH2SbO+ + 3H2O Sb2O4 + H2O 2Sb + 3H2O SbH3 Si + 2H2O Si + 3H2O Si + 6OHSi + 6FSn Sn2+ Sn Sn + 3OHSn + 4OH– Sn2+ + 6OH– HSnO2– 0 E ,B –0,08 +0,45 +0,45 +0,51 –0,58 –1,12 +0,17 –0,98 +0,36 –0,75 +0,31 –0,68 –0,22 +2,11 +0,57 +0,08 +1,23 +0,45 +0,20 +0,21 –0,66 +0,58 +0,48 +0,15 –0,51 –0,86 –0,79 –1,70 –1,2 –0,14 +0,15 +0,01 –0,91 –0,90 –0,82 –0,90 Элемент V Zn Окисленная форма SnS SnF62– 2ē 4ē Восстановленная форма +H2O+3OH– Sn + S2– Sn + 6F– V3+ 1ē V2+ –0,25 V2+ 2ē V –1,18 V3+ 3ē V –0,87 V(OH)4+ + 4H+ 5ē V + 4H2O –0,25 VO2+ + 2H+ 1ē V3+ + 3H2O +0,36 V(OH)4+ + 2H+ 1ē VO2+ + 3H2O +1,00 VO2+ + 2H+ 1ē VO2+ + H2O +1,00 3 H V 6 O 17 + 16H2O 30ē 6V + 33OH– –1,15 Zn2+ 2ē Zn –0,76 Zn(OH)2 2ē Zn + 2OH– –1,24 ZnO22– + 2H2O 2ē Zn + 4OH– –1,21 ZnS 2ē Zn + S2– –1,44 Zn(CN)42– 2ē Zn + 4CN– –1,26 ZnCO3 2ē Zn + CO32– –1,06 Zn(NH3)42+ 2ē Zn + 4NH3 –1,03 Zn(OH)42– 2ē Zn + 4OH– –1,22 +nē 31 0 E ,B –0,94 –0,25 Таблица Б.1 – Таблица растворимости веществ Р H М − Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg+ Hg2+ Pb2+ Sn2+ Cu2+ Р Р Р Р Р Р Р Р Р Р Р H Р Р Р Р Р Р Р Р Р Р Р Р Р − Н Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р − Р Р Р Р Р Р Р Р М М Р Н Н Н Н Н Н Р Р Р Н Р М Р Р Н Н Р Н М Н Н Н Н Р Р Р Р Р Н Р Р Н Н Р Н Р Н Н Н Н Р Р Р Р Р Н Р Р М М − − Р Н Н − Н Р Р Р − М Н Р Р Н Н − − Р Н Н − − Р Р Р − Р Н Р Р Н Н Н Н Р Н Н Н Н Р Р Р − Р Н Р Р Н Н − − Р Н Н − Н Р Р Р − Р Н Р Р Р Н Н Н Р Н Н Н − Р Р Р Н Р Н Р Р Р Н Н Н Р Н Н Н − Р Р Р Н Р Н Р Р М М Н Н Р Н Н Н Н Р Р Р Н Р Н Р Р М М Н Н Р Н Н Н Н Р Р Р М Р − Н Н Р Р Н Н М Н Н Н − Р Р М Н Р − Н Н − − Н − М Н Н Н − Р Р − М М − Р М − − Н − Р Н Н Н − Р Р Р М Р Н М М Н Н Н Н Н Н Н Н Н Р Р Р Н Р Н Р Р Р Н Н − Р Н Н − − − P Р − Р Н Р Р Н Н Н − Р Н Н − Н Р Р Р М Р − вещество растворимое (более 1 г на 100 г воды) − вещество нерастворимое в воде (менее 0,01 г на 100 г воды) − вещество малорастворимое в воде (менее 0,01 – 1 г на 100 г воды) − вещество разлагается водой или не существует Приложение Б 40 OH− Сl− Br− I− F− S2− SO32− SO42− PO3− PO43− CO32− SiO32− NO2− NO3− MnO4− CrO42− CH3COO− H+ Анионы Растворимость веществ в воде при температуре 25 °С Катионы