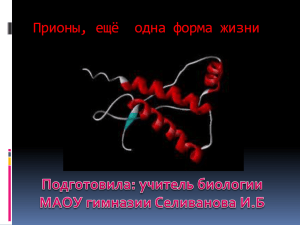
Амилоиды – белки, образующие фибрилярные нити 1. Функциональные амилоиды 2. Токсичные амилоиды 3. Инфекционные амилоиды Подобным образом выглядят все амилоиды Свойства амилоидов 1. N-концевые последовательности амилоидов обогащены аспарагином, глутамином и другими аминокислотами, способными образовывать β-слои, взаимодействие между которыми приводит к формированию агрегатов. Образующийся нитевидный белковый агрегат способен катализировать присоединение к себе мономерных молекул того же белка, сопряженное с их структурной перестройкой. Его также можно рассматривать как одномерный кристалл. 2. Благодаря многочисленным водородным связям между полипептидными цепями амилоиды очень прочные. По прочности на разрыв сравнимы со сталью. Амилоиды устойчивы к протеазам, что вызывает их накопление в тканях и отложение в виде бляшек. Амилоиды устойчивы к целому ряду химических агентов. 3. Образование амилоидов происходит в несколько стадий. На начальной лаг-фазе образуются префибриллярные олигомеры. На стадии элонгации образуется ядро фибриллы. Затем фибриллы собираются в геометрической прогрессии, пока амилоидогенный предшественник не исчерпается. Образующиеся фибриллы состоят из двух или более протофиламентов. Внутри каждого протофиламента субъединицы имеют поперечное β-ядро, соответствующее β-листам, ориентированным перпендикулярно длинной оси фибриллы. Префибриллярные олигомеры, образующиеся в лаг-фазе токсичны как in vitro, так и in vivo. Важно отметить, что токсичные префибриллярные олигомеры не являются уникальными для пептидов и белков, образующих амилоиды. Они также могут быть получены из последовательностей, которые не образуют амилоиды естественным путем. Подразумевается, что реакции сборки амилоида обладают потенциалом образования токсичных структур независимо от амилоидогенного предшественника. Анализ механизмов токсичности показал, что клеточные мембраны являются основной мишенью для префибриллярных олигомеров, при этом проницаемость мембран приводит к повышению внутриклеточного Ca 2+ , индукции окислительного стресса и гибели клеток. Функциональные амилоиды не обладают токсичностью. Это обеспечивается рядом механизмов: 1. Количество амилоидогенных пептидов и белков строго регулируется на уровне их экспрессии и протеолиза белковпредшественников. 2. Быстрая сборка фибрилл снижает выработку любых потенциально токсичных префибриллярных олигомеров. 3. Ряд дополнительных белков способствуют сборке амилоида, гарантируя, что она происходит только тогда и там, где это необходимо. Эти молекулы могут также способствовать быстрой 4. Сборка и хранение амилоидов в сборке фибрилл и предотвращать мембраносвязанных органеллах нежелательные взаимодействия с предотвращает нежелательные другими клеточными взаимодействия с другими клеточными компонентами. компонентами. 5. Функциональные амилоиды могут разбираться в физиологических условиях с помощью шаперонов или под воздействием более высокого pH, что гарантирует возможность удаления фибрилл, когда они больше не нужны. Функциональные амилоиды. Функциональные бактериальные амилоиды образуют структурный каркас бактериальных биопленок и обеспечивают выживание бактерий наряду с устойчивостью к антибиотикам. Образование функциональных амилоидов происходит внеклеточно, что отличается от большинства внутриклеточных амилоидов. Исследования показали, что функциональные амилоиды взаимодействуют с компонентами, обнаруженными во внеклеточном матриксе, такими как липиды мембран и полимеры биопленки. Функциональные бактериальные амилоиды, образующие биопленки, обладают уникальными структурными характеристиками. Благодаря множеству идентифицированных партнеров по взаимодействию они становятся сложными и важными компонентами биопленок. Aplysia californica - вид морских брюхоногих моллюсков Ключевое понимание формирования памяти у беспозвоночных было получено в результате исследований морских слизней Aplysia californica. Память и обучение связано с синаптической пластичностью (это способность изменять силу или эффективность передачи сигнала в синапсах). У беспозвоночных условно выделяют две формы синаптической пластичности: кратковременную и долговременную, связанную с формированием кратковременной и долговременной памяти соответственно. Кратковременная память опосредуется фосфорилированием некоторых уже существующих белков и укреплением имеющихся синаптических связей. Долговременная требует синтеза новых мРНК и белков и часто сопровождается установлением новых синаптических связей. На модели изолированного нейрона аплизии было показано, что единичный импульс нейромедиатора серотонина вызывает кратковременное синапсспецифическое запоминание, а два и более — долговременное. Это позволило предположить, что первый импульс активировал транскрипцию мРНК, необходимых для запоминания, которые отправлялись во все синапсы, но были неактивными, «спящими». Второй импульс активировал эти мРНК в отдельно взятом синапсе. В поиске такого активатора Нобелевский лауреат Эрик Кандель с сотрудниками обратили внимание на белок СРЕВ (cytoplasmic polyadenylation element binding protein) Активация происходит вследствие удлинения полиаденинового хвоста, сигналом для чего служит связывание CPEB с последовательностью в 3' нетранслируемой части мРНК. Оказалось, что CPEB необходим для долговременной, но не кратковременной памяти, и его синтез намного увеличивается при стимуляции нейрона нейромедиатором серотонином. Далее обнаружилась удивительная вещь: по своей структуре CPEB являлся амилоидом. Всё это позволило предположить, что переход CPEB в полимерное состояние является ключевым событием в формировании долговременной памяти. Гомологичные белки CPEB, образующие амилоиды и связанные с формированием долговременной памяти есть у человека CPEB3. Амилоидные фибриллы локализованы в меланосомах, специализированной органеллы, присутствующей в коже и глазах, которая действует как место синтеза пигмента меланина. Считается, что фибриллы являются каркасом для синтеза меланина и изолирует образующиеся токсичные промежуточные продукты.. Стресс (ацидоз, и тепловой шок) индуцируют образование амилоидных тельц (Ательца) в ядре. Множество белков (>180) собираются в А-тельцах, включая белки, участвующие в развитии клеточного цикла и синтезе ДНК, что приводит к переходу клеток в спящее состояние. Удаление стрессора приводит к разборке А-телец. Многие пептидные гормоны хранятся в виде амилоидных фибрилл в кислом просвете секреторных гранул эндокринных клеток. Высокая плотность амилоидных фибрилл придает гранулам характерное плотное ядро. Однако при секреции гранул фибриллы диссоциируют в мономерную форму пептидного гормона из-за воздействия более высокого внеклеточного pH. Антимикробные пептиды играют центральную роль во врожденном иммунном ответе на инфекцию. Они имеют ряд общих характеристик с пептидами и белками, образующими амилоиды Токсичные амилоиды Podospora anserina — нитчатый аскомицетный гриб, который колонизирует навоз травоядных животных, таких как лошади, кролики, коровы и овцы. Амилоид [Het-s], контролируюет вегетативную несовместимость у Podospora. При скрещивании штаммов содержащих и не содержащих амилоид, образующиеся после мейоза споры погибают. [Het-s] широко распространен в природных популяциях Podospora. Таким образом, амилоид обеспечивает репродуктивную изоляцию. Августа Детер пациентка Алоиса Альцгеймера, который 1907 г. первый описал болезнь старческого слабоумия или деменции. Амилоидогенные белки в норме растворимы (мономерны). Их превращение в амилоид является причиной более 30 болезней человека, например болезней Альцгеймера и Паркинсона. Эти болезни обычно появляются в зрелом возрасте (после 65 лет). Они неинфекционны, но пока не излечимы. Считается, что повышенные уровни амилоидогенных пептидов и белков за счет их повышенной экспрессии, снижения деградации или их комбинации являются ключевым фактором в развитии амилоидозов. Болезнь Альцгеймера связана с повышенными уровнями мономерных пептидов Aβ , что может приводить к их агрегации. В мозге людей, погибших от болезни Альцгеймера обнаруживается, возбудитель пародонтита — Porphyromonas gingivalis. В экспериментах на мышах показано, что эта инфекция приводила к колонизации мозга бактериями и увеличению вырабатывания бета-амилоида (Aβ) — обычно ассоциируемых именно с болезнью Альцгеймера Действительно, учитывая антимикробную активность Aβ и роль, приписываемую воспалению при болезни Альцгеймера, не исключают, что образование амилоида и клеточная токсичность при болезни Альцгеймера могут быть результатом перепроизводства пептидов Aβ при нарушенной регуляции иммунного ответа на инфекцию или воспаление. Инфекционные амилоиды (прионы). Дрожжи и грибы обладают весьма прочной клеточной стенкой, предотвращающей проникновение какой-либо инфекции, и потому прионы могут передаваться лишь от родителей к потомкам, а также при скрещивании. Прионы низших эукариот в большинстве случаев не только не представляют существенного вреда для клеток хозяина, но и могут быть даже полезны. У дрожжей прионное состояние фактора терминации трансляции eRF3 (также известное как детерминант [PSI+]) позволяет супрессировать нонсенс-мутации. Это мутации, создающие стоп-кодоны внутри белок-кодирующих областей, что определяет преждевременное завершение синтеза соответствующего белка. В прионном состоянии белок eRF3 малоактивен, что позволяет проскочить стоп-кодон и синтезировать белок полностью. Появление PSI+-фактора – увеличение копий гена sup35 (в норме является терминатором трансляции) или повышенная экспрессия, то есть усиленный синтез его генных продуктов. Для выяснения этого вопроса использовали клетки, несущие одну, а не несколько копий плазмиды с встроенным в нее геном sup35. Для этого в ту же плазмиду вшили центромер – последовательность ДНК одной из хромосом дрожжей. Именно центромеры в хромосомах отвечают за их однокопийное состояние и точное распределение при делении клетки. Кроме того, заменили собственный промотор гена sup35 на промотор гена, отвечающего за утилизацию галактозы. Такой промотор является индуцибельным и "запускает" экспрессию гена на галактозе, но не работает на глюкозе. Достаточно было клетки с такой плазмидой поместить на галактозу, и в них появлялся ψ-фактор. Следовательно, появление Ψ-фактора является результатом усиленной экспрессии гена sup35. Таким образом, загадочный Ψ-фактор – это белковый продукт гена sup35 присутствующий в клетках в большой концентрации. Увеличение экспрессии гена sup35 может быть обусловлено мутациями в регуляторной области, приводящими к увеличению его транскрипции. Ключевую роль в размножении прионов дрожжей играет шаперон Hsp104, который дробит прионные нити на более короткие фрагменты, выдергивая из нитей отдельные белковые молекулы. Эти мелкие фрагменты растут так же хорошо, как и большие, и обладают даже большей инфекционностью. Вероятно, главное отличие прионов от неинфекционных амилоидов состоит в повышенной подверженности прионов фрагментации. Следует отметить, что номинально действие Hsp104 направлено на разборку и уничтожение всяческих агрегатов, однако без него дрожжевые прионы не поддерживаются и быстро исчезают из растущей культуры дрожжей. Гомолог Hsp104 у животных и человека отсутствует, но аналогичная активность, видимо, существует. Рид Уикнер обратил внимание на сходство между упомянутыми цитогенами дрожжей и прионами позвоночных. Прионами Стэнли Прусинер назвал инфекционное начало белковой природы. Прионы человека переносят заболевания нервной системы, известные как куру, или смеющаяся смерть, болезнь Кройцфельда-Якоба, болезнь Герштонна-ШтросслераШейнкера и др. Прионы являются переносчиками болезни овец, известной как скрэпи, или почесуха, а также сходных заболеваний у коз, оленей, мышей, хомяков и некоторых других млекопитающих. В последнее время сходное заболевание было обнаружено у крупного рогатого скота и получило название "сумасшествие коров". Во всех этих случаях болезнь переносит белок, обнаруживаемый у больных в нервной ткани в повышенной концентрации и обладающий устойчивостью к протеолитическим ферментам. Это и есть прион. Первым из всех упомянутых заболеваний человека была открыта в 60-х годах болезнь куру и определена ее инфекционная природа. Это открытие принадлежит крупному вирусологу, биофизику, антропологу, медику и молекулярному биологу – Даниэлю Карлтону Гайдузеку (чаще на русский язык его имя переводят как Гайдушек). Инфекционное начало куру передавалось между членами племени Форе в Новой Гвинее в результате ритуального каннибализма. В 1976 году Гайдушек был удостоен Нобелевской премии по физиологии и медицине (вместе с Б.С. Бламбергом) за "открытие новых механизмов происхождения и распространения инфекционных заболеваний". Ребёнок на тяжёлой стадии болезни куру. Он не мог ни стоять, ни сидеть без поддержки Болезнь Крейтцфельдта-Якоба имеет инфекционный характер. Заражение может произойти при пересадке зараженных прионами тканей, через нейрохирургический инструмент и препараты крови, при введении некоторых гормональных препаратов (человеческого гонадотропина для лечения бесплодия). Болезнь Крейтцфельдта-Якоба прионной природы может развиваться после употребления в пищу мяса заболевших животных (коровы) или носителей инфекции (овец и коз). Синдром Герстмана — Штраусслера — Шейнкера (Gerstmann-Sträussler-Scheinker syndrome) — очень редкое, обычно семейное, смертельное нейродегенеративное заболевание, поражающее пациентов в возрасте от 20 до 60 лет. Причиной всех этих заболеваний является повышенная концентрация белка PRPC. Он меняет конформацию и превращается в прион PrPSc Центральная догма молекулярной биологии Ф. Крика с дополнениями Конрад Хэл Уоддингтон Участок эпигенетического ландшафта, показывающий перепады высоты стенок (порогов устойчивости) креода в местах ответвления аберративных долин: А1, А2 — аберративные долины; N — главная долина (креод) Под воздействием генетических и эпигенетических сигналов клетке будет задана траектория онтогенеза (развития), и она станет специализированной — клеткой сердца, печени и т.д. В 1998 году Р. Паро и Д. Кавалли проводили опыты с трансгенными линиями дрозофил, подвергая их тепловому воздействию. После этого дрозофилы меняли цвет глаз, и этот эффект — уже без внешнего влияния — сохранялся у нескольких поколений. Как обнаружилось, хромосомный элемент Fab7 обеспечивал эпигенетическую наследственность в процессе как митоза, так и мейоза. Соотношения между строением эпигенетического ландшафта и характером повреждающего воздействия: а — уклонение развития на боковую долину за счет сильного внешнего воздействия (длинная стрелка); б — такое же уклонение под действием сильной мутации, вызывающей нарушение креода; в — промежуточное состояние