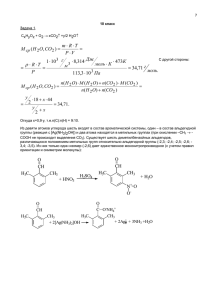
ОЛИМПИАДНЫЕ ЗАДАНИЯ ПО ХИМИИ
реклама
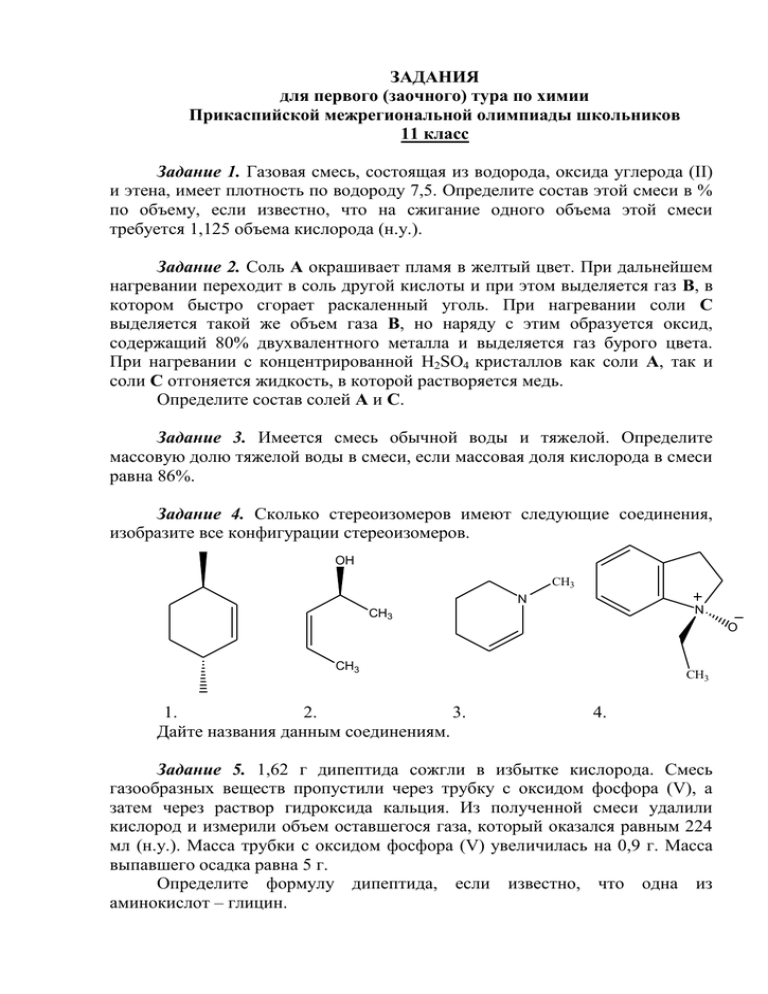
ЗАДАНИЯ для первого (заочного) тура по химии Прикаспийской межрегиональной олимпиады школьников 11 класс Задание 1. Газовая смесь, состоящая из водорода, оксида углерода (ІІ) и этена, имеет плотность по водороду 7,5. Определите состав этой смеси в % по объему, если известно, что на сжигание одного объема этой смеси требуется 1,125 объема кислорода (н.у.). Задание 2. Соль А окрашивает пламя в желтый цвет. При дальнейшем нагревании переходит в соль другой кислоты и при этом выделяется газ В, в котором быстро сгорает раскаленный уголь. При нагревании соли С выделяется такой же объем газа В, но наряду с этим образуется оксид, содержащий 80% двухвалентного металла и выделяется газ бурого цвета. При нагревании с концентрированной H2SO4 кристаллов как соли А, так и соли С отгоняется жидкость, в которой растворяется медь. Определите состав солей А и С. Задание 3. Имеется смесь обычной воды и тяжелой. Определите массовую долю тяжелой воды в смеси, если массовая доля кислорода в смеси равна 86%. Задание 4. Сколько стереоизомеров имеют следующие соединения, изобразите все конфигурации стереоизомеров. OH CH3 N N CH3 O CH3 1. 2. 3. Дайте названия данным соединениям. CH3 4. Задание 5. 1,62 г дипептида сожгли в избытке кислорода. Смесь газообразных веществ пропустили через трубку с оксидом фосфора (V), а затем через раствор гидроксида кальция. Из полученной смеси удалили кислород и измерили объем оставшегося газа, который оказался равным 224 мл (н.у.). Масса трубки с оксидом фосфора (V) увеличилась на 0,9 г. Масса выпавшего осадка равна 5 г. Определите формулу дипептида, если известно, что одна из аминокислот – глицин. Задание 6. При растворении 6,84 г в горячей воде красных кристаллов оксихлорида, формируется осадок из одноводного кристаллогидрата B. При прокаливании 4,64 г вещества B может быть получено вещество G лимонножелтого цвета. Вещество G служит катализатором в процессе гидрогенизации и крекинга углеводородов, а также используется в качестве жёлтого пигмента при окраске изделий из стекла и керамики. Вещество G реагирует с CCl4 при 300 ˚C до образования 7,94 г темно-фиолетового соединения D, при нагревании которого в атмосфере сухого HI образуется коричневый аморфный диамагнитный порошок E, а также молекулярный йод. Известно, что только 1/4 атомов йода из вещества E дает осадок с Ag+. а) Определите все химические соединения А – Е. б) Напишите все сопутствующие уравнения реакций. в) Изобразите структурные формулы соединений А и D. Определите гибридизацию центрального атома в данных соединениях, которые образуют связи с хлором той же длины. Задание 7. С древних времён известно, что газы, полученные при нагревании белка с известью, окрашивают деревянную палочку, смоченную кислотой, в ярко-красный цвет. Вещество, участвующее в этой реакции (Х), может быть получено следующим образом: белок H2O, нагр. CH2 H2N CH2 C COOH -H2O, нагр. COOH пироглутаминовая кислота H нагр. Ca(OH)2, Y K металл X H2/Pd Z Напишите химические реакции, с помощью которых можно осуществить данные превращения. Изобразите структуры соединений Х – Z. Задание 8. Элементы с порядковыми номерами 110-112 были открыты в 1994-1996 годах на ускорителе тяжелых ионов в г. Дармштадте Германии в количестве одного, трех и одного атомов соответственно. Новые элементы образовались при бомбардировке ионами свинцовой и висмутовой мишеней в результате следующих реакций: 208 269 ... Pb Uun n 110 ; 209 272 ... Bi Uuu n 111 ; 208 277 ... Pb Uub n 112 . Составьте полные уравнения ядерных реакций. Объясните, что означают трехбуквенные символы новых элементов. Задание 9. Получение алканов по методу Фишера-Тропша протекает на кобальтовом катализаторе по схеме: CO + H2 ↔ CnH2n+2 +H2O. Оксид углерода (II) и водород в объемном соотношении 1:2 ввели в реакцию при 180 °С, при этом образовалась смесь метана, этана и пропана в молярном соотношении 3:2:2. Вычислите во сколько раз изменилось общее давление в системе, если синтез проходил при неизменных температуре и объеме, при этом прореагировало 10% CO. Задание 10. Cеребристо-белая монета в 2 венгерских форинта сделана из сплава, содержащего только медь и никель. Любознательный химикэкспериментатор (который не знал, что законы Венгрии запрещают уничтожать монеты) взвесил монету в 2 венгерских форинта (3,1422 г) и полностью растворил ее в концентрированной азотной кислоте в течение 4 часов под тягой. При этом образовался бурый газ, другие газообразные продукты не выделялись. Далее он отобрал 1 см3 этого сине-зеленого раствора в колбу для титрования, добавил 20 см3 5% уксусной кислоты и 2 г твердого KI. Затем подождал около 5 минут. Раствор приобрел коричневый цвет, и выделился светлый осадок. Затем химик оттитровал его раствором Na2S2O3 концентрацией 0,023 моль/дм3. Средний объем до достижения точки эквивалентности составил 16,11 см3. Рассчитайте массовые доли элементов в монете.