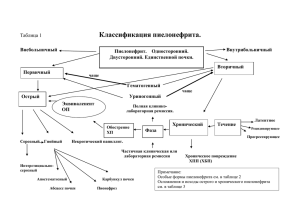
Государственное образовательное учреждение высшего профессионального образования «Алтайский государственный медицинский университет Росздрава». Неймарк А.И., Яковец Я.В., Манатова Г.А. ИНФЕКЦИИ МОЧЕПОЛОВОЙ СИСТЕМЫ Методическое пособие – Барнаул 2011– Печатается по решению Центрального координационно- методического совета ГОУ ВПО Алтайский государственный медицинский университет Рецензент: доктор мед. наук, профессор Е.И. Буевич Методическое пособие рекомендовано для студентов старших курсов, врачей - урологов, курсантов, клинических ординаторов, аспирантов. А.И. Неймарк, Я.В. Яковец, Г.А. Манатова, 2011 Эпидемиология Воспалительные заболевания органов мочевой системы составляют 2/3 всей урологической патологии. Самым частым из неспецифических воспалительных заболеваний органов мочевой системы является острый и хронический пиелонефрит. Кроме того, к этой группе заболеваний относятся пионефроз, паранефрит, забрюшинный фиброз (болезнь Ормонда), цистит, парацистит, уретрит, простатит, везикулит, эпидидимит, орхит, баланит, баланопостит, кавернит. В последние годы констатируется заметный рост заболеваемости неспецифическими воспалительными заболеваниями среди всех возрастных групп, особенно среди детей и молодежи. Факт, что пиелонефрит является самым частым заболеванием почек во всех возрастных группах доказывает большая его частота выявления на аутопсиях: в 8-20% всех вскрытий. Существуют различия заболеваемости пиелонефритом среди мужчин и женщин в разные возрастные периоды. Общепризнанно в целом преобладание женщин среди больных пиелонефритом. В возрасте от 2 до 15 лет девочки болеют пиелонефритом в 6 раза чаще, чем мальчики, почти такое же соотношение между мужчинами и женщинами в молодом и среднем возрасте. В пожилом возрасте пиелонефрит возникает чаще у мужчин. Эти различия связаны со свойственными возрастным периодам и представителям разного разного пола факторами нарушения уродинамики и инфицирования мочевых путей. У молодых женщин ведущее значение придается воспалительным заболеваниям гениталий, дефлорационному циститу и гестационному пиелонефриту, у пожилых мужчин – аденоме предстательной железы. важную роль играет возрастная физиологическая перестройка органов мочевыводящей системы: снижение эластичности тканей, их тонуса, появление дискенезии, что ведет к расстройству уродинамики. Большая распространенность хронического пиелонефрита, значительные трудопотери в связи с его обострениями и осложнениями, частая заболеваемость женщин детородного возраста, что ограничивает их репродуктивность и ведет к рождению детей, предрасположенных к заболеванию почек, - все это определяет огромную социальную значимость проблемы диагностики, лечения и профилактики хронического пиелонефрита. Собственные данные Нами проведен анализ заболеваемости острым гнойным пиелонефритом в г.Барнауле за период с 2004 по 2006 годы. Выяснено, что имеется существенный прирост заболеваемости (рис.1): Рисунок 1.Заболеваемость острым гнойным пиелонефритом в г. Барнауле в 2004-2006 гг. 30 25 20 2004 15 2005 10 2006 5 0 острый гнойный пиелонефрит Средний возраст заболевших, напротив, имеет тенденцию к уменьшению: в 2004 г. составил 34,8 лет, в 2005г – 33,7 лет, в 2006 г – 31,2 года. При этом отмечен прирост заболеваемости за счет возрастной группы моложе 25 лет (в основном 18-19 лет) (рис.2). Рис.2. Возрастные характеристики больных различными формами пиелонефрита 16 14 12 10 8 18-25 лет 6 26-50 лет 4 старше 50 лет 2 0 2004 2005 2006 Заболеваемость острым гнойным пиелонефритом среди лиц мужского пола за период наблюдения не изменилась (в среднем мужчины составляют 10,8%). По характеру воспалительного процесса преобладают множественные карбункулы почек (за 2004 г. – 14, 2005 г. – 20, 2006 г. – 26) и прирост заболеваемости связан именно с увеличением больных с карбункулами почек. В то же время количество выявленных абсцессов почек остается достаточно стабильным (2004 г. – 2, 2005 г. –3, 2006 г. – 3). Среди выявленных причин гнойного пиелонефрита можно выделить мочекаменную болезнь (2004 г. – 4, 2005 г. – 4, 2006 г. – 3), что наиболее характерно для мужчин и лиц пожилого возраста; беременность (2004 г. – 0, 2005 г. – 3, 2006 г. – 3), что наиболее характерно для женщин в возрасте 20-30 лет; гнойные заболевания мягких тканей (фурункулез), характерные для лиц обеих полов в возрасте от 20 до 50 лет. Проведенные исследования показали, что заболеваемость острым гнойным пиелонефритом в г. Барнауле за последние 3 года возрастает. Прирост заболеваемости происходит за счет женщин молодого возраста (до 25 лет, чаще 18-19 лет) с преобладанием карбункулов почек. Рассмотрим заболеваемость внутриклеточными инфекциями (инфекциями, передающимися преимущественно половым путем - ИПППП) (рис. 3). 95,7 100 95 90 81,9 2005 2006 85 80 75 ИПППП на 100.000 населения К росту заболеваемости ИПППП приводят следующие факторы: Раннее начало половой жизни Изменение норм сексуального поведения Частая смена половых партнеров Недостаточная информированность о правилах и средствах контрацепции Частота встречаемости основных возбудителей ИПППП – хламидий, микоплазм и уреаплазм колеблется в следующих пределах: M.hominis – 10-50%, U.urealiticum – 30-44% Ch.trachomatis – 30-50-75% (в зависимости от возрастных групп) U.urealiticum регистрируется у 80% женщин с симптомами генитальной инфекции, у 51% женщин с нарушениями репродуктивной функции, обнаруживаются у больных с такими инфекциями, как герпес и кандидамикоз. При этом у женщин регистрируются более высокие титры, чем у мужчин. В большинстве случаев ИПППП Бессимптомные инфекции, поэтому, протекают бессимптомно. играют существенную роль в передаче возбудителя при половых контактах. Хламидии по классификации относятся к бактериям и имеют следующие характеристики: Не способны синтезировать АТФ и ГТФ, поэтому являются облигатными внутриклеточными паразитами – «энергетические паразиты» Имеют РНК, ДНК, клеточную стенку и рибосомы – занимают промежуточное положение между риккетсиями и вирусами Грамотрицательные бактерии Род Микоплазма включает 100 видов и только 4 вида – M. pneumonie, M. hominis, M. genitalium, M. Incognitis - патогенны для человека. Род Уреаплазма включает 3 вида и только 1 вид U. urealiticum – патогенен для человека. Уреаплазмы и микоплазмы не являются ни бактериями, ни вирусами Не имеют клеточной стенки(трехслойная отграничивающая мембрана) Проходит через бактериальные фильтры Способны паразитировать (персистировать) на мембране клеток хозяина Имеют ДНК и РНК Грамотрицательны Хламидии при персистенции в организме человека нарушают проходимость каналикулярной системы половых путей, повреждают эпителиальные клетки, участвующие в процессе сперматогенеза, и запускают иммунологические реакции с образованием антиспермальных антител (АСА). Chlamydia trachomatis способна прикрепляться к сперматозоидам, кторые могут служить переносчиками инфекции. Поэтому, хламидиоз оказывает существенное влияние на фертильность мужчин, приводя к развитию уретрита, везикулита и простатита. Микоплазмы и уреаплазмы, в свою очередь, при взаимодействии со сперматозоидом нарушают их подвижность, появляются незрелые формы, изменяется спирализация, возникают пушистые хвостики (адсорбция множества уреаплазм на хвостовой части сперматозоида), ингибируется процесс их пенетрации в яйцеклетку. Размножение этих возбудителей происходит внутриклеточно и очень интенсивно. Цикл развития занимает около 6 суток. Микоплазмы и уреаплазмы способны изменять метаболизм клеток хозяина нарушают обмен аминокислот синтез белков и нуклеиновых кислот привносят новую генетическую информацию увеличивают количество свободной арахидоновой кислоты приводят к активации синтеза простагландинов Они препятствуют фагоцитозу либо перевариванию их в фагоцитах. Последние становятся разносчиками инфекции, что генерализует последнюю. Они способны оказывать цитотоксическое действие на лимфоциты и подавлять активацию естественных Т-киллеров. При иммунологическом обследовании таких пациетов обнаруживаются аутоиммунные антитела, храктерные для аутоиммунных процессов. Микоплазмы, уреаплазмы и хламидии выделяются у больных с острым геморрагическим циститом и острой абактериальной пиурией, а также выделяются из мочевых камней при мочекаменной болезни (в 20% случаев). Проникновение в более глубокие отделы мочевыводящей системы приводит к развитию уретрального синдрома. Персистирующая урогенитальная инфекция, по данным лаборатории гемостаза Алтайского государственного медицинского универсистета, приводит к изменениям в системе гемостаза: повышению уровня фактора Виллебрандта, накоплению продуктов деградации фибрина, выраженной агрегации тромбоцитов, активации фибринолитической системы. В органа и системах при проведении гистологических исследований выявлены пролиферативные, дистрофические и некротические изменения во всех органах. Урологическая инфекция включает в себя множество различных клинических синдромов, у каждого из которых - своя этиология, эпидемиология, диагностика, своя стратегия терапии и прогнозы. Развитие и течение урологических инфекций определяется взаимодействием микроорганизмов и микроорганизмом в определенных условиях среды (географической, социальной и т.д.). Микроб не только является “пусковым фактором”, имеет значение вид микроорганизма, его доза, путь проникновения, наличие факторов колонизации, инвазии, агрессии. Со стороны макроорганизма - состояние барьерных и защитных факторов - как местных, так и общих. Урологические инфекции - оппортунистические (от латинского opportunity, что значит “склонный к заболеваниям”). Оппортунистические урологические инфекции протекают в виде пиелонефрита, околопочечных абсцессов, цистита, простатита и уретрита. Все эти заболевания могут осложняться уросепсисом. ИМП относятся к наиболее распространенным заболеваниям как в амбулаторной, так и во внутрибольничной практике. Наиболее частым проявлением НИМП является острый цистит. Встречаемость острого цистита у женщин составляет 0,5-0,7 эпизодов заболевания на 1 женщину в год. Распространенность острого цистита в России, по расчетным данным, составляет 26-36 млн случаев в год. Заболеваемость острым циститом у взрослых мужчин крайне низка и составляет 6-8 эпизодов в год на 10000 мужчин в возрасте 21-50 лет. Острый пиелонефрит является самым частым заболеванием почек во всех возрастных группах. В целом, среди больных острым пиелонефритом преобладают женщины. Частота возникновения острого пиелонефрита значительно ниже, чем острого цистита, и составляет в России, по расчетным данным, 0,9-1,3 млн случаев ежегодно. К группе повышенного риска по диагностике ИПППП относятся больные циститами, пиелонефритами и мочекаменной болезнью, а также больные с уретритами, простатитами и бесплодием. Пиелонефрит – инфекционно-воспалительный процесс неспецифической этиологии, при котором в патологический процесс вовлекаются лоханка почки, чашечки и почечная паренхима с поражением в первую очередь и преимущественно межуточной ее ткани. В конечной стадии он распространяется на кровеносные сосуды и клубочки. До 60-х годов 20-го века был распространен термин «пиелит». Пиелит означает наличие воспалительного процесса только в почечной лоханке, поэтому возникла необходимость в более точном определении процесса, происходящего в почке при ее воспалении. В настоящее время пиелит рассматривается как начальная стадия пиелонефрита, при которой преимущественное поражение имеет чашечно-лоханочная система. При этом лоханка, являясь частью почки, не может вовлекаться в патологический процесс изолированно. На возможность вовлечения в воспалительный процесс и паренхимы почки – перехода воспаления со слизистой оболочки почечной лоханки на паренхиму – указывал еще Bartels (1877). Поэтому, в 70-х годах (1974 год – классификация Н. А. Лопаткина - Родомана) появился термин «пиелонефрит» - самое частое заболевание во всех возрастных группах. Появление понятия позволило и классифицировать эту патологию: Кроме того, можно выделить и ряд редких форм пиелонефрита, например, эмфизематозный пиелонефрит (впервые сообщение о нем сделано Келли и Макколлуму в 1898 г., а подробно описан Винстедом в 1952 г.). Развитие эмфизематозных пиелонефритов возможно, если этиологическим фактором является микроорганизм, способный к активному газообразованию – B. paracoli, Ps.aeroginosa, Pp.vulgaris. Факторы риска развития ИМП Риск развития ИМП зависит от возраста, пола пациента, наличия сопутствующих заболеваний и патологии мочевыводящих путей. У женщин риск ИМП в 30 раз выше, чем у мужчин, что связано с особенностями анатомического строения мочеполовых органов. В возрасте от 2 до 15 лет девочки болеют ИМП в 6 раз чаще, чем мальчики, почти такое же соотношение между мужчинами и женщинами наблюдается в молодом и среднем возрасте, в то время как в пожилом возрасте ИМП чаще возникают у мужчин. Существенным фактором риска развития острого цистита у женщин является частота половых актов и характер применяемых контрацептивов: частота возникновения острого цистита выше при использовании диафрагм и спермицидов. Во время беременности повышается риск возникновения ИМП, которые развиваются у 4-10% беременных, при этом у 2530% рожениц выявляется бактериурия. У женщин в постменопаузальном периоде частота развития НИМП составляет 20%. Частота заболеваемости пиелонефритом находится в тесной зависимости от пола и возраста. Женщины молодого и среднего возраста и девочки страдают пиелонефритом в 5 раз чаще, чем мальчики и мужчины. Клинически это заболевание регистрируется у женщин чаще, чем у мужчин. Однако, по данным патологоанатомических исследований частота смертности от этой патологии одинакова среди мужчин и женщин: пиелонефрит выявляется в 8-20% вскрытий. По данным ряда авторов (Smith и др.) это обусловлено тем, что у женщин чаще проявляются острые и рецидивирующие формы пиелонефрита, а у мужчин высока смертность в пожилом возрасте от тяжелых форм пиелонефрита. Более высокая заболеваемость пиелонефритом у женщин связана с особенностями анатомии и физиологии этой части населения Земли. Имеются 3 критических периода: раннее детство, замужество и беременность. Частота заболеваемости пиелонефритом во время беременности, по данным разных авторов, колеблется от 3-5% до 8-11%. Острый пиелонефрит в больничных условиях встречается в 14% случаев, а хронический – в 33% (А.Я.Пытель, 1998). При этом первичный пиелонефрит регистрируется в 16%, а вторичный – у 84%. Первичный пиелонефрит еще называют неосложненным, а вторичный – осложненным, или обструктивным, поскольку в основе вторичного пиелонефрита лежат органические или функциональные изменения органов мочевой системы. Классификация инфекций мочевыводящих путей По локализации инфекции мочевыводящих путей (ИМП) распределяются на инфекции верхних и нижних мочевыводящих путей. По характеру течения они подразделяются на неосложненные и осложненные (рис. 1). К инфекциям нижних мочевыводящих путей относятся острый цистит и уретрит, к инфекциям верхних мочевыводящих путей - пиелонефрит (острый и хронический). Травмы органов мочеполового тракта, их контакт с инфицированными органами малого таза Гематоге нный путь Пиелонефриты Околопочечные абсцессы Циститы Простатиты уретриты Наиболее частый путь – восходящий через уретру Уросепсис Септический шок Токсический шок Пиелонефрит (односторонний или двусторонний) вторичный острый хронический Латентная фаза абсцесс карбункул апостематозный Фаза активного воспаления Некротиче ский пиелит гнойный Фаза ремиссии серозный первичный Сморщивание почки или пионефроз Рис.4. Классификация инфекций мочевых путей. Этиология Пиелонефрит- заболевание бактериальной природы, однако специфического возбудителя не существует. Наиболее часто этиологическим агентом пиелонефрита являются бактерии – грамположительные и грамотрицательные условные патогены, многие из которых принадлежат нормальной микрофлоре человека, заселяющей кожу и слизистые оболочки. При этом преобладание кишечной палочки и видов протея среди возбудителей пиелонефрита связывают с анатомической близостью и общностью кровообращения мочевыделительной системы, кишечника и гениталий. Остается высоким процент выделений Ps. aeruginosa - около 19%, что объясняется тем, что высевается эта культура преимущественно у больных с осложненными формами пиелонефрита – на фоне мочекаменной болезни, аномалий развития почек, доброкачественной гиперплазии простаты. Вирулентность условнопатогенных микроорганизмов невелика. Они вызывают пиелонефрит в тех случаях, когда у больного имеет место снижение иммунного статуса и (или) неспецифической резистентности. Это позволяет условным патогенам, достигнув критического числа 10 КОЕ/мл, вызвать развитие клинически выраженного процесса. При наличии повышенной вирулентности (например, у госпитальных штаммов) величина критического числа может снижаться. В случаях острого пиелонефрита величина титра бактериурии прямо коррелирует с выраженностью клинических проявлений заболевания: чем ярче выражена клиническая симптоматика, тем выше титр возбудителя. При хронизации процесса (хронический пиелонефрит) величина критического числа снижается и может быть ниже диагностического титра (10 КОЕ/мл). Говоря о виде и характере инфекции, необходимо отметить то, что в настоящее время редко определяется один вид микроорганизмов, вызывающих пиелонефрит. Повсеместно распространены ассоциации нескольких микроорганизмов (микст - инфекция). Кроме того, необходимо помнить о роли протопластов и l-форм бактерий – возбудителей пиелонефрита. Это происходит в результате потери бактериями – в результате воздействия различных неблагоприятных условий (неадекватная антибактериальная терапия, повышенный титр антибактериальных антител, даже изменение рН мочи)- клеточной стенки. При этом микроорганизмы становятся более устойчивыми к внешним воздействиям, перестают расти на обычных питательных средах, что делает практически невозможным их идентификацию, а при возникновении благоприятных условий происходит их превращение в обычные вегетативные формы и возникает рецедив заболевания. Естественно, что пиелонефрит, вызванный протопластными формами микроорганизмов, хуже поддается лечению, часто способствует переходу острого процесса в хронический. В последние годы особенно возросла роль госпитальных (нозокомиальных) штаммов микроорганизмов в качестве возбудителей пиелонефрита. Это связано с возможностью инфицирования мочевых путей в процессе инвазивных диагностических манипуляций, таких как катетеризация мочевого пузыря, мочеточника и лоханки. Кроме того, многие операции на почках и мочевом пузыре заканчиваются их дренированием через естественные мочевые пути или транскутанно, создавая условия для внедрения госпитальных штаммов. Развитие в последние годы эндоскопических методов лечения, трансуретральной хирургии и литотрипсии снизило долю открытых урологических операций. В настоящее время до 70% больных с заболеваниями мочевого пузыря и конкрементами различной локализации лечатся вышеуказанными методиками. Неосложненные инфекции мочевыводящих путей (НИМП) развиваются у больных при отсутствии обструктивных уропатий и структурных изменений в почках и мочевыводящих путях (т.е. разных форм мочекаменной болезни, поликистоза почек, аномалий развития и расположения почек, стриктуры мочеточника, стриктуры уретры, пузырномочеточникового рефлюкса, доброкачественной гиперплазии предстательной железы с нарушением пассажа мочи из верхних мочевыводящих путей и др.), а также при отсутствии серьезных сопутствующих заболеваний. В полной мере к ним относятся только острый цистит и острый пиелонефрит у небеременных женщин, без обструктивных уропатий и неврологических дисфункций. Осложненные инфекции мочевыводящих путей (ОИМП) возникают у пациентов с различными обструктивными уропатиями, на фоне инструментальных (инвазивных) методов обследования и лечения, у больных с серьезными сопутствующими заболеваниями (сахарный диабет, нейтропения). ОИМП могут приводить к развитию тяжелых гнойно-септических осложнений, бактериурии, сепсису. В настоящее время в урологии широко применяются эндоскопические хирургические вмешательства, их доля в урологической практике достигает 60-70%. Так ТУР называют «золотым стандартом» в лечении ДГПЖ, не менее широко используется контактная литотрипсия. В урологии важную роль отводят различным инструментальным методам обследования и лечения. Несмотря на появление новых современных методов диагностики (ультразвуковое сканирование, компьютерная томография, допплерография и т.п.), в большинстве случаев нельзя обойтись без цистоскопии, катетеризации почки, установки внутреннего катетера типа «стент». Существует целый перечень факторов, способствующих возникновению и прогрессированию гнойносептической инфекции мочевыводящих путей. Инструментальные (инвазивные) методы обследования и лечения: Катетеризация мочевого пузыря; бужирование уретры; цистоскопия; катетеризация почки. • Эндоскопические хирургические вмешательства: Чрескожные пункционные нефролитолапаксии, трансуретральные уретротомии, трансуретральные электрорезекции предстательной железы. • Высокая частота инфицирования госпитальными штаммами бактерий, полирезистентными к антибактериальным препаратам Увеличение в составе больных урологического стационара лиц пожилого и старческого возраста • Иммунодефицит • Азотемия • Полиорганная недостаточность Еще в 1964 году была предложена классификация хирургических ран (National Research Council, 1964), которая остается актуальной и на сегодняшний день. Раны выделяют: • • • • Чистые Условно-чистые Контаминированные Грязные По этой классификации эндоскопические вмешательства и инструментальные методы обследования относятся к условно-чистым и контаминированным т.е требуют проведения антибиотикопрофилактики! Частота развития инфекций МВП после трансуретральных вмешательств достаточно высока. По данным самого крупного исследования, в рамках всемирного контроля за нозокомиальной инфекцией (SENIC), ИМВП являются наиболее частыми (42%) в структуре послеоперационных осложнений. Так, R.Appel с соавт. приводят следующие данные: частота ИМВП после ТУР ДГПЖ -11,2%, ТУР опухоли мочевого пузыря-38,7%, цистоскопия-4,7%. M.Aspi с соавт. (2003) установили, что у 91% больных, перенесших трансуретральные вмешательства, выделяли условно-патогенные и патогенные бактерии. По данным смоленской государственной медицинской академии «…даже в случае стерильной мочи, наблюдается колонизация бактериями уретры и простаты. Вероятно, этим объясняется высокая до 60% частота развития ИМВП после трансуретральных вмешательств». В нашей клинике был проведен анализ осложнений после проведения на базе урологического отделения ГБ №11 эндоскопических вмешательств и инструментальных методов обследования (в 2003-2004). Осложнением считались те случаи, когда у больных было зафиксировано повышение температуры тела (от субфебрильной и выше). Также изучались клинические проявления (дневники лечащего врача), данные лабораторных показателей и дополнительных методов обследования. С диагнозом доброкачественной гиперплазии простаты и выполненной трансуретральной резекцией проанализировано 90 историй, в 57 отмечены осложнения (рис.5). Рис. 5. манипуляций Процент осложнений при проведении эндоскопических 36,7 с осложнениями без осложнений 63,3 При проведении контактной литотрипсии из 110 случаев, в 38 отмечены осложнения (длительность повышения температуры от суток до четырех) (рис.6) . 35 с осложнениями без осложнений 65 Рис. 6. Количество осложнений при проведении контактной литотрипсии. При поведении ретроградной пиелографии – изучено 50 историй, в 8 случаях были отмечены осложнения, катетеризации почки – изучено 60 историй, в 4 - осложнения. При бужировании уретры: проанализировано 33 истории, в 12 – осложнения. Важность выделения осложненных и неосложненных ИМП определяется этиологическим фактором и разными подходами к лечению. Однако необходимо учитывать, что в ряде наблюдений НИМП могут протекать с выраженными симптомами интоксикации, что требует госпитализации. Как известно, в результате госпитальной инфекции происходит селекция полирезистентных штаммов (в среднем 66,7% штаммов – полирезистентны) микроорганизмов, с которыми очень трудно справиться в процессе лечения. Микробной флоре и путям ее проникновения в почку посвящены исследования В.И.Зяблинова (1883), К.Я.Степанова (1899), М.Н.Москалева (1913). Еще А.П.Фрумкин (1939) указывал, что бактериурия сама по себе не ведет к возникновению воспалительного процесса в почке. Пиелонефрит возникает при наличии благоприятных условий – нарушении функции или повреждении почки. Однако, дальнейшие исследования – не только урологические, но и микробиологические – показали, что вид и характер бактериальной флоры имеют большое значение в развитии пиелонефрита. Так, белый и золотистый плазмокоагулирующие стафилококки, β-гемолитический стрептококк способны вызвать гнойно-воспалительный процесс даже в неизмененной почке, тогда как другие микроорганизмы, как правило, вызывают пиелонефрит при наличии местных или общих предрасполагающих факторов. Наиболее частыми возбудителями пиелонефрита являются синегнойная палочка, протей, энтерококк, стафилококк, синегнойная палочка. Первичное заражение стафилококком или кишечной палочкой находится в прямой зависимости от расположения первичного очага инфекции в организме. Стафилококк повинен в возникновении пиелонефрита в тех случаях, когда очаг инфекции находится вне мочевых путей. У тех больных, у которых инфекция проникла в верхние мочевые пути из нижних, преобладает колибациллярная флора. В последние годы в качестве возбудителей пиелонефрита высевается часто протей или синегнойная палочка, что объясняется подавлением обычной флоры современными антибактериальными средствами – антибиотиками и химиопрепаратами. В ходе лечения изменяются флора и ее чувствительность к антибиотикам, поэтому возникает необходимость в повторных посевах мочи и антибиотикограммах. При неблагоприятных условиях – изменение рН мочи, лечение антибиотиками и химиопрепаратами – некоторые микроорганизмы, в основном кишечная палочка и протей, теряют свою оболочку и переходят в так называемые L-формы или протопласты, которые более устойчивы к внешним воздействиям. В окружении гипертонических жидкостей протопласты не растворяются, живут и сохраняют способность начать вновь синтезировать клеточную стенку. Кроме того, они могут проходить через стадию сферопластов – тех клеток, неполноценная клеточная стенка которых содержит материал, способный воссоздать при определенных условиях размножающиеся бактериальные тела. Поскольку мозговое вещество почки является гипертоническим, протопласты здесь могут выжить. Уроинфекция чаще всего полиэтиологична: среди возбудителей представлены все классы микроорганизмов. Следовательно, в настоящее время хорошо изучены различные аспекты инфицирования почек, угроза которого существует практически при любом остром заболевании, бактериальной природы и при наличии очагов хронической инфекции, особенно в мочеполовой системе. В пользу этого утверждения свидетельствует нередко встречающаяся в таких случаях транзиторная бактериурия. Уточнены виды микроорганизмов, вызывающих уроинфекцию, и некоторые факторы их нефропатогенности: тропизм к паренхиме почек, феномен прилипания грамотрицательных бактерий к эпителию мочевых путей благодаря специальным ворсинкам, сходство микробных антигенов с антигенами человека системы АВО, обнаруженное у 44-56% штаммов кишечной палочки, способность размножаться в кислой среде. Источники уроинфекции могут быть как эндогенными (флора, постоянно обитающая в организме человека), так и экзогенными. Возбудителями пиелонефрита могут выступать не только бактериальная флора, но грибы, вирусы. Экзогенные источниками является флора, попадающая в организм человека из внешней среды или ятрогенно: микрофлора попадает из периуретральной, перианальной области, вводится при инструментальных методах диагностики и лечения. При этом имеет место восходящий путь инфекции через уретру. Эндогенные источники: при травмах органов мочеполового тракта, при их контакте с инфицированными органами малого таза, при проникновении микробов из кишечника - гематогеным путем. Следовательно, выделяют следующие 3 пути проникновения инфекции в почку: гематогенный Пути проникновения инфекции в почку восходящий По По просвету стенке Наиболее часто микроорганизмы проникают в почку гематогенным путем из очага инфекции в организме, который может располагаться как вне мочевых путей (тонзиллит, фурункулез, инфицированная рана, кариозные зубы и т.д.), так и в них (уретрит, цистит) и половых органах (эпидидимит, сальпингоофорит, простатит,). Лимфогенный путь проникновения инфекции в принципе невозможен, в связи с тем, что пути оттока лимфы направлены от органа – лимфатическая система является естественным дренажем -, а не по направлению к нему. При проникновении инфекции возникает состояние агрессии микрофлоры по отношению к макроорганизму, на что последний отвечает унифицированной реакцией – воспалением, которое в свою очередь заканчивается рубцеванием. При инфицировании полости, сообщающейся с внешней средой, развивается микрофлора, которая – если она не мешает жизнедеятельности микроорганизма – называется сапрофитной. При попадании в макроорганизм микрофлора стремится расширить жизненное пространство, а организм этого не дает. Поэтому, на границе соприкосновения всегда есть воспалительная реакция и иммунитет находится в состоянии тонуса. Кроме того, всегда в зоне воспаления имеется нарушение микроциркуляции, поскольку возникает необходимость в отграничении очага воспаления, и формируются микросгустки. Следовательно, в возникновении пиелонефрита играют роль следующие факторы: Вид и характер возбудителя инфекции Наличие изменений в почке и мочевых путях, способствующих фиксации в них возбудителя и развитию в них патологического процесса Пути проникновения инфекции в почку Общее состояние микроорганизма и его иммунобиологическая реактивность. В последние годы возросла роль госпитальных (нозокомиальных) штаммов микроорганизмов в качестве возбудителей пиелонефрита. Провоцирующими факторами при возникновении пиелонефрита являются: Снижение иммунитета Прорыв инфекции из другого очага Нарушение оттока мочи Расстройство крово- и лимфообращения При массивном прорыве микроорганизмов (без образования инфицированных эмболов) возникает сепсис. В ответ на создание септической ситуации макроорганизм дает выраженный ответ и уничтожает эту инфекцию. В противном случае микроорганизмам удается проникнуть в микросгустки с образованием инфицированных эмболов. Поскольку поверхность инфицированных эмболов представляет собой нечужеродную для макроорганизма (они покрыты собственной тканью), то нормального иммунного ответа не наблюдается и микроорганизм может достаточно долго без вреда для себя циркулировать по сосудистому руслу. Учитывая то, что 95% крови проходит через сосуды почки, то инфекция (микроорганизмы) может там задерживаться. Этому способствует то, что сосуды почки имеют одну характерную особенность: их диаметр идет от большего к меньшему. Происходящие в дальнейшем процессы можно представить следующей схемой: Нарушение тока крови в мелком сосуде Нарушение питания эндотелия Микрорганиз мы проходят через стенку сосуда Межуточная ткань Дистальный отдел канальца Проксималь ный каналец, содержащий первичную мочу Просвет канальца Первичная моча – плазма с большим содержанием низкомолекулярных белков, которые не фильтруются и являются хорошей питательной средой для микроорганизмов. Укрепившиеся микроорганизмы с Межуточная ткань током первичной мочи распространяются по канальцам и петле Генле, попадая здесь уже во вторичную мочу, которая не является для них хорошей средой обитания. Тогда микроорганизмы вновь возвращаются в Формирование очага воспаления межуточную ткань: Дальнейшее развитие воспалительной реакции макрофаги рубцевание Процесс рубцевания приводит к тому, что определенная часть нефронов поражается и выключается из процесса жизнедеятельности. Необходимо учитывать, что если воспалительная реакция развивается непосредственно в клубочке, то этот процесс называется гломерулонефритом 50-70% мочевых пузырей инфицировано 100% почечных лоханок стерильно Проникновение инфекции в лоханку Воспаление Поскольку мочеточник представляет собой насос с цистоидами, то отсос мочи из верхних мочевых путей осуществляется активно и это предотвращает проникновение инфекции в лоханку. При снижении тонуса мочеточника или уменьшении скорости тока отсасываемой мочи инфекции получает возможность подняться наверх. При этом восходящий путь проникновения инфекции в почку может быть не только восходящим по просвету (этот путь часто встречается при возникновении рефлюкса), но и из нижних мочевых путей по стенке мочеточника (при патологических процессах, сопровождающихся нарушением целостности слизистой мочеточника). Субэпителиальная ткань мочеточника представляет собой непрерывный слой, соединяющийся с межуточной тканью почки. Этот слой может служить проводником для инфекционного начала. Воспаление Пиелит Выделение слизи в лоханку Повышение внутрилоханочного давления Нарушение проходимости лоханочно-мочеточникового сегмента Открытие пиелоренальных канальцев Проникновение инфекции в межуточную ткань ПИЕЛОНЕФРИТ Бактериальный нефрит Среди факторов, предрасполагающих к развитию пиелонефрита на первом месте стоит обструктивная уропатия, когда пиелонефрит, по данным ряда авторов, возникает в 12 раз чаще, чем в случаях без нарушения уродинамики. Основными причинами возникновения обструктивного пиелонефрита являются: Препятствие в мочевых путях – врожденное (у детей) или приобретенное Сдавление мочеточника снаружи – опухоли, воспалительные инфильтраты, болезнь Ормонда Функциональные нарушения при повреждении мочеточника. Трудности в оценке особенностей инфекционного поражения мочевого тракта связаны, кроме того, с особенностями тех или иных бактерий, что часто не принимается во внимание. Большую роль играет дифференциация различных видов и штаммов бактерий, а также определение возможной их вирулентности. Клиническое течение заболеваний практически не отражает особенности вызвавшего заболевание микроорганизма. Однако, с этиологическим фактором увязана антимикробная терапия, которая не одинакова для представителей разных классов возбудителей. Клиника При т.н. первичном пиелонефрите местные признаки выражены слабо или отсутствуют, а на первое место выходят общие симптомы интоксикации. Состояние больного тяжелое, общая слабость, потрясающий озноб с последующим повышением температуры тела до 39-400 С и проливным потом, ломящая боль во всем теле, снижение аппетита, тошнота, иногда рвота, сухой язык, тахикардия. У детей могут отмечаться на фоне повышенной температуры тела рвота и жидкий стул, что приводит к резкой дегидратации детского организма и резкому ухудшению состояния. Симптоматика острого вторичного пиелонефрита во многом зависит от наличия и степени нарушения пассажа мочи. При вторичном пиелонефрите, обусловленном нарушением оттока мочи из почки, наблюдается характерная смена симптомов, когда лидируют местные симптомы: как правило, ухудшение состояния больного совпадает с резким усилением боли в поясничной области и даже приступом почечной колики (или болей по типу почечной колики) вследствие нарушения оттока мочи из почечной лоханки. На высоте колики возникает озноб, который сменяется сильным жаром и резким повышением температуры тела. Жар сменяется критическим падением температуры тела до субфебрильных цифр, проливным потом и постепенным снижением интенсивности боли в области почки вплоть до полного исчезновения, улучшением состояния больного. Однако, если препятствие к оттоку мочи не устранено, через несколько часов кажущегося улучшения состояния вновь усиливаются боли в области почки и наступает новая атака острого пиелонефрита. Необходимо помнить, что клиническое течение острого пиелонефрита варьирует в зависимости от состояния организма, возраста, пола, предшествующего состояния почек. Особенностями течения отличаются т.н. гнойные формы пиелонефрита. Апостематозный пиелонефрит характеризуется распространением воспалительных инфильтратов из глубины почечной паренхимы по межуточной (перивенозной) ткани на поверхность почки в субкапсулярное пространство по ходу звездчатых вен, что приводит к появлению гнойничков на поверхности почки. Особенно часто эта форма острого пиелонефрита возникает при обструкции верхних мочевых путей. Карбункул почки, как правило, возникает вследствие микробной эмболизации конечного артериального сосуда почки, а микробный эмбол проникает из очага воспаления с током крови. При этом нарушается кровообращение на ограниченном участке коркового слоя почки –, что приводит к его ишемии и некрозу. Поэтому, боли, возникающие при этой форме гнойного пиелонефрита, носят ишемический характер. В дальнейшем проникшие сюда микроорганизмы вызывают гнойно-воспалительный процесс. Кроме того, карбункул может развиться при слиянии множества апостем или сдавления конечного артериального сосуда воспалительным инфильтратом, развившемся при апостематозном пиелонефрите в межуточной ткани, что в значительной степени утяжеляет клинику. При гнойном расплавлении карбункул может перейти на мозговой слой почки и вскрыться либо в лоханку, либо в паранефральную клетчатку, что приводит к развитию паранефрита, возбудителем являются золотистый и белый стафилококки, Е.соli протей. Карбункул почки выглядит как выбухание округлой формы. На разрезе он состоит из некротизированнои ткани, пронизанной множеством мелких слившихся гнойничков, клиновидно уходящих в глубь паренхимы почки. Основание карбункула прилежит к фиброзной оболочке, которая всегда вовлекается в воспалительный процесс (перинефрит). Вначале она инфильтрирована, утолщена, припаяна к поверхности почки, а в дальнейшем наступает ее гнойное расплавление. При локализации карбункула в верхнем сегменте почки воспалительный инфильтрат может перейти на надпочечник, вызывая синдром его гипофункции, сопровождается реактивным нефритом. Если карбункул возникает при отсутствии нарушения уродинамики, как гематогенный ограниченный септический очаг в почке, клиническая картина сходна с проявлениями общего инфекционного заболевания: высокая температура тела (39-40°С), озноб, нарастающая общая слабость, учащение пульса и дыхания, тошнота, рвота, задержка стула. Отсутствие локальной мочеиспускания в болезненности первые дни в области формирования почек, лейкоцитурии карбункула затрудняет и расстройств своевременное распознавание. Вследствие этого нередко больных с карбункулом почки госпитализируют для лечениz в хирургические, терапевтические и инфекционные отделения и диагнозом: грипп, пневмония, острый холецистит, острый аппендицит неизвестной этиологии, брюшной, тиф, инфекционный гепатит и т.д. Диагностика основывается на следующем. Появление массивной лейкоцитурии свидетельствующие о сообщении карбункула с чашечно-лоханочной системой, в значительной мере облегчает диагностику заболевания. Определенное диагностическое значение при карбункуле почки имеет тест выявления активированных лимфоцитов в периферической крови. В крови здорового человека их количество не превышает 0.5-1.0%. При наличии гнойного очага в почке число активных лимфоцитов достигает 7-10%. Наиболее характерные признаки выявляют с помощью рентгенологических и радиоизотопных методов исследования. На обзорной рентгенограмме можно видеть выпуклость контура почки и нечеткость контуров поясничной мышцы за счет отека в паранефральной клетчатке. Экскреторная урография, произведенная при вдохе и выдохе, позволяет установить резкое ограничение подвижности или неподвижность почки на стороне поражения. Основными рентгенологическими, признаками карбункула почки являются сдавление, деформация, раздвигание или ампутация чашечек, весьма сходные с теми, которые наблюдаются при опухолях паренхимы почки. Дифференциальная___диагностика. Наибольшие дифференциально- диагностические трудности при карбункуле почки возникают у больных с ненарушенным пассажем мочи и расположением гнойного очага в коре почки (без сообщения с мочевыми путями). Карбункул почки на фоне антибактериального лечения проявляется клиническими симптомами, общими с вялотекущим сепсисом, наиболее достоверным признаком, которого является обнаружение микроорганизмов при посеве крови больного. Абсцесс почки возникает вследствие гнойного расплавления паренхимы в очаге воспалительной инфильтрации и является крайне редкой формой острого гнойного пиелонефрита. Чаще всего абсцесс является результатом слияния группы гнойничков при апостематозном пиелонефрите, реже возникает при расплавлении карбункула. Существуют три пути развития абсцесса почки: в одном случае в окружности очага нагноения в дальнейшем возникает вал из грануляционной ткани, отграничивающий болезненный очаг от здоровых тканей; в другом – процесс распространяется на окружающую околопочечную клетчатку, приводя к развитию гнойного паранефрита, а в третьем – абсцесс опорожняется в почечную лоханку. Наблюдаются и метастатические абсцессы почки, которые возникают при заносе инфекции из экстраренальных очагов воспаления (деструктивная пневмония, септический эндокардит). Солитарные абсцессы обычно возникают с одной стороны, метастатические - нередко бывают множественными или двусторонними. Общие симптомы абсцесса почки не отличаются от признаков любого тяжелого септического заболевания: высокая температура тела с ознобом, частый пульс слабого наполнения, отдышка, жажда, общая слабость, головная боль, адинамия, эйфория. Температура тела устанавливается на высоких цифрах (39-41 °С) и небольшими суточными колебаниями в пределах 1°С. Среди местных симптомов в диагностике заболевания имеют значение интенсивные боли в области почки, возникающие вследствие расстройства кровои лимфообращения в почке и сдавления отечной ткани почки в плотной малорастяжимой фиброзной оболочке. Боли особенно усиливаются при пальпации увеличенной или напряженной почки либо при поколачивании поясничной области. Бактериурия и лейкоцитурия обычно появляются в поздние сроки заболевания, когда абсцесс прорывается в чашечно-лоханочную систему. Если происходит расплавление фиброзной оболочки почки и содержимое абсцесса опорожняется в паранефральную клетчатку, то возникает гнойный паранефрит. В некоторых случаях абсцесс вскрывается в брюшную полость. При двусторонних абсцессах почек преобладают симптомы тяжелой септической интоксикации, почечно-печеночной недостаточности. На обзорной урограмме можно обнаружить искривление позвоночника в сторону поражения, отсутствие тени m.Iliopsoas major, увеличение размеров почки. На экскреторных урограммах определяется снижение функции почки вплоть до ее отсутствия, сдавление почечной лоханки или чашечек, их ампутация или ограничение или отсутствие дыхательной экскурсии почки. Папиллит (некроз почечных сососчков). Здесь основную роль в патогенезе играет ишемия мальпигиевых пирамид, микроорганизмами или которая в возникает результате вследствие сдавления эмболии их кровеносных сосудов воспалительным инфильтратом при пиелонефрите. Некроз почечных сосочков возникает, как правило, во время одного из обострений хронического пиелонефрита, сопровождаясь тотальной макрогематурией и почечной коликой в случаях, если происходит окклюзия мочевых путей отторгнувшимися некротическими тканями. Его развитию способствует сахарный диабет, длительный спазм сосудов, атеросклероз, шок, злоупотребление анальгетиками. Некротический папиллит является следствием лейкоцитарной инфильтрации сосочка у его основания с последующей ишемией. Некроз почечных сосочков необходимо дифференцировать от некротического папиллита туберкулезного происхождения путем бактериологического исследования мочи. Необходимо помнить, что параллелизм между тяжестью гнойно-воспалительных изменений в почке и общим состоянием больного существует не всегда: у ослабленных лиц, лиц пожилого и старческого возраста, а также при тяжело протекающей инфекции, когда подавлены защитные силы организма, клинические проявления менее выражены, отсутсвуют или извращены (наблюдается картина общего инфекционного заболевания или сепсиса без признаков поражения мочевых путей, картина острого живота, могут отмечаться признаки, напоминающие острый менингит и т.д.). Хронический пиелонефрит. Хронический пиелонефрит, как правило, является следствием острого пиелонефрита. Наиболее важные причины перехода острого инфекционно-воспалительного процесса в почке в хронический следующие: Своевременно не распознанные и не утраченные причины нарушений оттока мочи (МКБ). Неправильное или недостаточное лечение острого пиелонефрита не систематическая диспансеризация больных, перенесших острый пиелонефрит Образование L-форм бактерий, которые способны сохраняться в межуточной ткани почки в неактивном при снижении защитных иммунных сил организма переходить в исходное состояние и вызывать обострение заболевания. Хронические сопутствующие заболевания (сахарный диабет, болезни желудочнокишечного тракта) Иммунодифицитные состояния. Патогенез. При хроническом пиелонефрите, как и любом другом инфекционно-воспалительном заболевании, основными патогенетическими звеньями являются проникновение бактерий в пораженный орган (почка) и состояние противоинфекционной защиты микроорганизма. Хронизация процесса начинается тогда, когда достаточно высокая вирулентность микроорганизма сочетается со снижением защитных свойств макроорганизма. Это способствует появлению т.н. Lформ бактерий и, в конечном итоге - появлению хронического пиелонефрита. Большое значение имеют нарушения уродинамики, а также почечного крово- и лимфообращения. При кажущейся простоте схемы инфекционно-воспалительного процесса потребовались многоплановые исследования для понимания каждого патогенетического звена хронического пиелонефрита. Попадание инфекционного агента в орган Повреждение органа Возникновение воспаления Изученные основные пути проникновения микроорганизмов в почку: гематогенный и уриногенный, по-прежнему остаются лидирующими в плане проникновения инфекции в почку. Гематогенный путь возможен на фоне острых заболеваний бактериальной природы. Уриногенный путь реализуется при инфицировании нижних отделов мочевых путей или за счет активации сапрофитов, обычно бытующих в дистальном отделе уретры. В настоящее время уточнены также возможные варианты распространения инфекции внутри почки, что объясняет преимущественное поражение интерстиция при пиелонефрите. Важное значение придается почечному крово-и лимфообращению в развитии пиелонефрита. Важным звеном патогенеза хронического пиелонефрита могут быть процессы, вызывающие повышение внутрилоханочного давления, что осложняется лоханочно-почечными рефлюксами с флебо- и лимфостазом в паренхиме почки. Кроме того, существует еще целый ряд патологических изменений, способствующих развитию пиелонефрита (рисунок 7). ПЕДУНКУЛИТ (воспалительносклеротические изменения клетчатки почечного синуса) ПИЕЛОНЕФРИТ Расстройство венозного и лимфотического оттока через магистральные сосуды почек ФЛЕБОСТАЗ ЛИМФОСТАЗ и Фиксация и выживание патогенных микроорганизмов в паренхиме Гипоксия паренхимы Отек интерстиция Рисунок 7. Механизмы возникновения пиелонефрита. В настоящее время выяснено, что раньше всего поражается мозговой слой почки. Это связывают с менее интенсивным его кровоснабжением по сравнению с кровоснабжением коркового слоя и высокой осмолярностью, способствующей выживанию в нем бескапсульных форм бактерий, а также с большим содержанием аммония, подавляющего один из компонентов комлимента, что может задерживать фагоцитоз и снижать бактерицидное действие антител. Важное значение придают ранимости тонкостенных венозных сплетений, расположенных близко к эпителию чашечек. Поэтому, при резком повышении внутрилоханочного давления инфицированная моча поступает в интерстиций и в венозную сеть, а возникающий отек и нарушение венозного и лимфатического оттока способствует фиксации микрофлоры в мозговом слое. Расстройства уродинамики иногда носят функциональный генез. У женщин возможны изменения тонуса мочевых путей вследствие гормонального дисбаланса. Атония мочевых путей возникает при лихорадочных состояниях, под влиянием некоторых лекарственных препаратов, при нарушениях иннервации мочевыводящих путей, например, вследствие заболевания спинного мозга. Она может быть индуцирована токсинами некоторых микроорганизмов. Рефлекторные расстройства уродинамики возможны при заболеваниях других органов, особенно гениталий. Доказана большая роль пузырно-мочеточниково-лоханочных рефлюксов, которые могут иметь как врожденный характер, так и появляться вследствие воспалительного процесса или при повышении внутрипузырного давления (ДГП, другие инфравезикальные обструкции, нейрогенный мочевой пузырь). Проводя в течение нескольких лет эксперименты по изучению механизмов формирования нарушений уродинамики при патологии верхних мочевых путей, мы обнаружили, что примерно в половине экспериментов с неокклюзивной формой нарушения уродинамики верхних мочевых путей у собак и кроликов в отдаленном периоде наблюдается спонтанное развитие хронического пиелонефрита. При этом животным не вводили никаких микроорганизмов. Моделирование нарушения уродинамики у собак осуществляли криодеструкцией участка мочеточника в средней или нижней трети, а у кроликов – путем имплантации в почечную лоханку с обтурацией лоханочно-мочеточникового сегмента. Имитатор камня в течение нескольких недель мигрировал в мочевой пузырь, а затем выводился наружу. Эти нарушения, так же как и у собак, проявлялись в замедлении выведения контраста при экскреторной урографии, нарушении эвакуации радиофармпрепарата при динамической нефросцинтиграфии, а также изменении электрофизиологических показателей функции мочеточника. У 4 из 9 собак (57%) через 6-18 месяцев после моделирования нарушений уродинамики и у 7 из 12 кроликов (58%) через 4-6 месяцев после моделирования выявили признаки хронической мочевой инфекции (протеинурия, лейкоцитурия, бактериурия), а при гистологическом исследовании почек обнаружены изменения, типичные для хронического пиелонефрита, причем у 1 собаки и 2 кроликов выявлена картина вторично-сморщенной почки. Полученные результаты подчеркивают главенствующую роль стойкого нарушения оттока мочи по верхним мочевым путям для индуцирования хронического пиелонефрита по отношению к необходимости в экзогенном инфекционном агенте. По-видимому, в результате нарушения уродинамических условий слизистая почечной лоханки свои барьерные свойства по отношению к спонтанно проникающим в небольших количествах в мочу эндогенным микроорганизмам, которые в нормальных условиях не могут проникнуть в подслизистый слой лоханки, а затем – в интерстиций почки. Этому может способствовать повреждение гликокаликса эпителиальных клеток слизистой почечной лоханки и потеря антиадгезивных свойств этих клеток по отношению к микрофлоре мочи, а также расширение межклеточных промежутков между эпителиальными клетками слизистой лоханки. Дополнительным фактором может служить регистрируемый при хроническом нарушении уродинамики заброс мочи из нижних отделов мочеточника в лоханку в результате ретроградных волн сокращения или некоординированных сокращений верхних и нижних отделов мочеточника при отсутствии смыкания стенок верхних отделов мочеточника. Это создает, в свою очередь, условия для дополнительного повреждения эпителия лоханки и повышает возможность развития восходящей инфекции из нижних мочевых путей. Одним из основных звеньев патогенеза хронического пиелонефрита являются нарушения иммунитета, обуславливая его течение даже при отсутствии урологической патологии. Изучение иммунологического статуса больных хроническим пиелонефритом показывает, что патологические изменения в иммунной системе больных затрагивают ее различные звенья, приводя к развитию порочного круга. Возможной причиной появления иммунологических сдвигов при хроническом пиелонефрите могут быть как генетические факторы, обусловливающие первичные изменения в иммунном ответе, так и вторичные, приобретенные при воздействии уропатогенных возбудителей и (или) продуктов их жизнедеятельности. В случае, когда воспалительный процесс приводит к выбросу значительного числа фагоцитов, но недостаточного для полной элиминации возбудителей, развивается функциональная недостаточность этих клеток, выражающаяся в снижении их фагоцитарной активности. Неполноценность фагоцитарных реакций приводит к длительному сохранению микроорганизмов в почечной ткани, стимулируя при этом супрессорную ветвь иммунитета. Развитие инфекции мочевого тракта изменяет содержание иммуногдобулинов всех классов, особенно А и G. Важную роль в предохранении организма от возбудителей инфекции играет система макрофагов. Известно, что при хроническом пиелонефрите происходит снижение фагоцитарной активности лейкоцитов. Немаловажны при этом и популяционные изменения среди нейтрофилов, в связи с появлением под действием кроветворных факторов в периферической крови незрелых нейтрофилов с ослабленной способностью к хемотаксису и фагоцитозу. Роль изменений отдельных звеньев иммунной системы изучена недостаточно, особенно это касается коммуникационных молекул иммунной системы – интерлейкинов (цитокинов). Клиника хронического пиелонефрита Классификация форм хронического пиелонефрита: 1. Фаза активно воспалительного процесса. В эту фазу обнаруживают лейкоцитарную инфильтрацию в межуточной ткани мозгового слоя почки и атрофию канальцев. Преимущественное поражение канальцев - характерный признак этой стадии. 2. Фаза латентного воспалительного процесса. Изменения интерстиции и канальцев носят преимущественно рубцово-склеротический характер. Это приводит к гибели дистальных отделов нефронов и сдавлению собирательных канальцев. В результате возникает нарушение функции и расширение тех отделов нефронов, которые располагаются в коре почки. Участки расширенных извитых канальцев заполнены белковыми массами, по строению напоминают щитовидную железу. Одновременно в этой стадии заболевания рубцово-склеротический процесс развивается вокруг клубочков и сосудов, поэтому выявляют гиалинизацию и запустевание клубочков. Воспалительный процесс в сосудах и ткани, окружающей сосуды, приводит к облитерации одних и сужению других из них. Для диагностики могут быть важны следующие симптомы – боли и тянущие ощущения в реберно-позвоночном углу, жжение при мочеиспускании, частое обильное мочеиспускание, жажда, нередко наблюдается артериальная гипертензия. Иногда больные предъявляют жалобы на познабливание при нормальной температуре тела. Часто отмечается слабо положительный симптом поколачивания. 3. Фаза ремиссии или клинического выздоровления. Наблюдается почти полное замещение почечной ткани рубцовой бедной сосудами соединительной тканью (пиелонефротически сморщенная почка). Прогноз при хроническом пиелонефрите во многом напрямую зависит от длительности заболевания, активности воспалительного процесса, частоты повторных атак пиелонефрита, от наличия других урологических патологий. Хронический пиелонефрит является наиболее частой причиной возникновения хронической почечной недостаточности. Наличие хронического пиелонефрита в единственной почке или развитие двустороннего процесса приводило к нарушению функциональной способности почек, как правило в первые 5-8 лет заболевания, и лишь через 10-15 лет (к возрасту 37-54 года) развивалась стойкая почечная недостаточность, от латентной до интермиттирующей стадии. Терминальная же стадия, при отсутствии отягчающих обстоятельств, наступала через 15-20 лет. При сравнении с развитием почечной недостаточности на фоне хронического диффузного гломерулонефрита, было выявлено, что с момента начала заболевания до появления терминальной ХПН проходит 5-10 лет у 72,8% больных, а от первых лабораторных и клинических признаков ХПН до терминальной ее стадии срок ограничивается от 6 мес. до 3-х лет у 90,1% больных. Это свидетельствует о более благоприятном течении хронического пиелонефрита относительно терапевтических заболеваний почек. Артериальная гипертензия наблюдается при хроническом пиелонефрите в 41,4-70% случаев. Было отмечено, что обострение пиелонефрита всегда сопровождается снижением функции почек, а ликвидация воспалительного процесса и восстановление пассажа мочи приводят к снижению азотемии, повышению клубочковой фильтрации, снижению дефицита канальцевой секреции. Следовательно, ХПН при хроническом пиелонефрите характеризуется медленным прогрессированием, волнообразным течением, а также частичной обратимостью в результате адекватного антибактериального лечения и улучшения гемо- и уродинамики. Диагноз. Большое значение в диагностике хронического пиелонефрита имеют лабораторные, рентгенологические и радиоизотопные методы исследования. Диагностическое значение при хроническом пиелонефрите имеют также уменьшение осмотической концентрации мочи. Уменьшение концентрационной способности почки может нередко наблюдаться и в более ранних стадиях заболевания. Оно свидетельствует о нарушении способности дистальных отделов канальцев поддерживать осмотический градиент в направлении кровь-канальцы. Отмечается также снижение канальцевой секреции как еще более ранний симптом хронического пиелонефрита. Существенную помощь в диагностике хронического пиелонефрита оказывают рентгенологические методы исследования. Основными рентгенологическими симптомами заболевания являются следующие: изменение размеров и контуров почек, нарушения выделения почкой рентгеноконтрастного вещества, патологические показатели ренально-кортикального индекса, деформация чашечно-лоханочной системы. Для хронического пиелонефрита характерна асимметрия поражения почек и снижение их функции, которая более четко выявляется на экскреторных урограммах, произведенных в ранние сроки (через 1, 3, 5 мин) после введения рентгеноконтрастного вещества и отсроченных (через 40 мин, 1 ч, 1.5 ч). В 1-й стадии хронического пиелонефрита преобладают инфильтративные процессы, на рентгенограммах обнаруживают раздвигание чашечек, спазм их шеек и лоханки. Во 2-й стадии хронического пиелонефрита, когда развиваются рубцово-склеротические изменения, появляются симптомы снижения тонуса чашечек лоханки и верхней трети мочеточника в виде умеренного их расширения и симптома края поясничной мышцы. Появляются различные деформации чашечек: они приобретают грибовидную, булавовидную форму, смещаются, шейки их удлиняется и суживаются. Дифференциальная диагностика. Хронический пиелонефрит чаще всего приходится дифференцировать от туберкулеза почки и гломерулонефрита. В пользу туберкулеза почки свидетельствуют перенесенный туберкулез других органов, дизурия, гематурия, рубцовые сужения верхних мочевых путей, протеинурия, менее выраженное преобладание лейкоцитурии над эритроцитурией. Достоверными признаками нефротуберкулеза являются: нахождение микобактерий туберкулеза в моче, стойко кислая реакция мочи, типичная картина туберкулезного поражения мочевого пузыря при цистоскопии и характерные признаки заболевания. Клиника ИПППП В клинике воспалительных заболеваний, которые вызываются ИПППП, не различают специфических симптомов, а проявления их неспецифически. К неспецифическим симптомам относятся жжение и зуд при мочеиспускании, болевые ощущения внизу живота и учащенное и болезненное мочеиспускание. Другое их течение абсолютно бессимптомно. Диагностика При диагностике острых пиелонефритов необходимо учитывать ряд особенностей. К ним относятся и срочность установления диагноза, и тяжесть состояния пациента, и трудность определения стадии воспалительного процесса, а также выявление (или исключение) обструкции мочевых путей. Следует помнить, что патогенез болезни не всегда соответствует ее клиническим проявлениям, что может приводить к серьезным ошибкам. Алгоритм постановки диагноза пиелонефрита: Анамнез заболевания Данные объективного осмотра Пальпация Лабораторные методы исследования Данные лучевой диагностики (ультразвуковое сканирование, рентгенологические и радионуклидные методы) Среди методов диагностики на первое место следует поставить ультразвуковое сканирование. Данные ультразвукового сканирования Данные ультразвукового сканирования во многом зависят от характера и стадии воспалительного процесса, а также от степени нарушения уродинамики. Острый «первичный» (необструктивный ) пиелонефрит в начальном периоде – в фазе серозного воспаления – может показывать нормальную ультразвуковую картину. При вторичных (обструктивных) пиелонефритах выявляются в основном признаки обтурации мочевых путей: увеличение размеров почки, расширение чашечек и лоханки. Однако, по мере развития воспаления любого генеза и нарастания интерстициального отека эхогенность паренхимы почки увеличивается, лучше дифференцируются ее корковый слой и пирамиды. В этой стадии регистрируются ограничение подвижности почки при дыхании. При апостематозном пиелонефрите ультразвуковая картина может быть такой же, как и при серозном пиелонефрите. Однако : Подвижность почки резко уменьшается или полностью отсутствует Слабо дифференцируется корковый и мозговой слои Выявляются бесформенные структуры с неоднородной эхогенностью. Для карбункула почки характерно: Выбухание внешнего контура почки Неоднородность гипоэхогенных структур Отсутствие дифференциации между корковым и мозговым веществом При формировании абсцесса почки: Выявляются гипоэхогенные структуры в центре абсцесса Иногда определяются уровень жидкости и капсула абсцесса. Выход гнойного процесса за пределы фиброзной капсулы (паранефрит) сопровождается: Неоднородная эхоструктура с преобладанием эхонегативности Внешние контуры почки неровные и нечеткие Просматривается четкая связь паранефрального процесса с пораженным участком почки. При различных обструкциях (камни, стриктуры, опухоли и т.д.) верхних мочевых путей наблюдается: Расширение чашечек, Расширение лоханки, Расширение верхней части мочеточника Появление гноя приводит к появлению в расширенных полостях однородных и неоднородных эхопозитивных структур Экскреторную урографию возможно выполнить при стабильном АД и отсутствии бактериемического шока. Радионуклидные методы диагностики дают ценную информацию о функции, кровообращении почек и уродинамике. Эти сведения весьма ценны как при первичном установлении диагноза, так и на этапах лечения, динамического наблюдения и выявления поздних осложнений. При этом в экстренной диагностике острого пиелонефрита радионуклидные методы имеют свои ограничения. Наибольшую информацию дают радионуклидные методы диагностики, такие как динамическая нефросцинтиграфия, непрямая ангиография и ренография. При острых первичных (необструктивных) пиелонефритах в фазе серозного воспаления на ренограммах сосудистый и секреторный сегменты уплощены и удлинены в 2-3 раза, фаза экскреции выражена слабо или не прослеживается. Фаза гнойного воспаления сопровождается значительным снижением сосудистого сегмента, замедлением и уплощением секреторного сегмента и слабая выраженность экскреторного сегмента. При тотальном поражении гнойным процессом почки можно получить «обструктивную» кривую линию при отсутствии обтурации верхних мочевых путей. При острых вторичных (обструктивных) пиелонефритах ренограммы на всех стадиях воспаления ренограммы имеют обструктивный тип кривой: сосудистый сегмент низкий, секреторный – замедлен, экскреторный отсутствует. Лечение пиелонефрита Осуществляется, учитывая следующие аспекты: Устранение причин, вызывающих нарушение пассажа мочи или почечного кровообращения (артериального или венозного) Этиотропная антибактериальная терапия Иммунокоррегирующая терапия Симптоматическая терапия Антибактериальная терапия представляет собой особую разновидность фармакотерапии, поскольку подразумевает использование антибиотиков - уникальной, поистине выдающейся группы лекарственных средств. С одной стороны, антибиотики наряду с вакцинацией больше чем какие-либо другие достижения медицинской науки повлияли на жизнь человечества. Причем это одна из наиболее динамичных групп лекарств, так как в связи с ростом антибиотикорезистентности микрофлоры, арсенал антибактериальных препаратов постоянно расширяется и обновляется. С другой стороны, - это группа лекарственных средств, которая почти в 50 % случаев, по мнению ведущих мировых экспертов, применяется необоснованно. Нередко это связано с недостаточной информированностью клиницистов. Поэтому врачам очень важно иметь источник современной и объективной информации по антибактериальным препаратам. Принципы рациональной антибиотикотерапии Большое разнообразие родов и видов микроорганизмов, способных вызывать урогенитальные инфекции, требует правильного подхода к выбору препарата. Микробная популяция в микробном очаге гетерогенна по уровню чувствительности к антибиотикам и химиопрепаратам. Это иллюстрируют данные таблице 1. Минимальная подавляющая концентрация (МПК) пенициллина по отношению к гноеродному стафилококку колеблется в данном примере от 0,05 до 100 и более ед/мл. При воздействии неправильно подобранной дозы препарата часть микроорганизмов в очаге воспаления погибает (те, МПК которых укладывается в диапазон селективной концентрации), а меньшая часть — выживает, потому что их МПК выше селективной концентрации. Выжившие микроорганизмы начинают накапливаться. Возникает реинфекция тем же видом микроба, но уже представленным качественно отличными штаммами, устойчивыми к применяемой концентрации препарата (рис. --). Продолжение лечения тем же препаратом, в той же дозировке эффекта не даст. Для получения успешного результата следует соблюдать несколько обязательных требований: 1. Установить возбудителя, его чувствительность к антибиотику, минимальную подавляющую концентрацию препарата для возбудителя. 2. На основании величины МПК рассчитать терапевтическую концентрацию препарата, т. е. концентрацию, которая должна быть создана в микробном очаге для достижения полноценного антимикробного эффекта. 3. Не реже, чем 1 раз в неделю, в ходе лечения следует проверять в лаборатории чувствительность возбудителя к используемому препарату и при необходимости вносить коррективы в план лечения. При положительном антимикробном эффекте микробное число снижается от 100 и более бактерий на 1 мл мочи до 50 и менее, вплоть до полного очищения. Таблица 1. Гетерогенность чувствительности гноеродного стафилококка в микробном очаге к пенициллину (изучены культуры из 100 микробных клеток, изолированных из патологического очага) —-— 2 штамма - 0,05 ед/мл 7 штаммов - 0,2 ед/мл 11 штаммов — 1,0 ед/мл ПОГИБАЮТ 14 штаммов — 5,0 ед/мл 21 штамм - 10,0 ед/мл 9 штаммов - 20,0 ед/мл Селективная концентрация 15 штаммов — 25,0 ед/мл 12 штаммов — 50,0 ед/мл 3 штамма — 75,0 ед/мл 6 штаммов — > 100,0 ед/мл ВЫЖИВАЮТ Введение антибиотика 120 100 80 60 График 1 40 20 0 Гибель штаммов, чувствительных к созданной концентрации антибиотика Селекция штаммов, резистентных к созданной концентрации антибиотика Рис. 8. Динамика изменения концентрации микробных клеток под влиянием антибиотика Следует помнить, что при наличии микробной ассоциации в микробном очаге может происходить замена одного возбудителя другим, с совершенно иными характеристиками восприимчивости к препаратам. Антимикробная терапия должна зависеть от этиологического фактора, при этом она неодинакова для представителей разных классов возбудителей. До определения вида возбудителя и его чувствительности к антимикробным лекарственным средствам целесообразно применять препараты широкого спектра действия последних поколений. Естественно, что после получения результатов из лаборатории следует переходить на специфичные в отношении возбудителя препараты. Немецкие исследователи подсчитали, что лечение больного с воспалением органов мочеполовой системы этим методом обходится в 200 марок, а лечение «вслепую» — в 2000 марок. Цели антибиотикотерапии Основными целями антибиотикотерапии НИМП являются: быстрое купирование симптомов; качество жизни в период лечения не должно изменяться восстановление трудоспособности и социальной активности; предупреждение осложнений; профилактика рецидивов. Выбор антибиотиков Выбор препарата в подавляющем большинстве случаев проводится эмпирически, на основе данных о преобладающих возбудителях (преимущественно Е.сoli), их антибиотикорезистентности в определенном регионе страны и тяжести состояния пациента. При выборе антибиотиков для лечения НИМП важно соизмерять возможный риск развития нежелательных реакций и тяжесть состояния пациента. Так как НИМП склонны к самоизлечению, применение препаратов, которые могут вызывать тяжелые нежелательные реакции, нельзя считать оправданным. Например, нельзя использовать аминогликозиды у пациентов с нетяжелыми формами НИМП в силу нефротоксичности этих препаратов. В период явного ухудшения (активная фаза) латентно текущего хронического пиелонефрита лечение проводят также интенсивно. В фазу неполной ремиссии терапию можно начать с химиопрепаратов (без антибиотиков), чередуя их 1-1,5 мес. непрерывно, а затем перейти на поддерживающее курсовое лечение. В любом случае, если удастся за 1-2 мес. добиться исчезновения лабораторных симптомов, то еще в течение 2-3 мес. назначают ежемесячными курсами - 1 неделю антибактериальные препараты и 3 недели – отвары трав. Антибактериальная терапия построена на следующих принципах: Этиотропность воздействия Определение оптимальных доз антибиотика и способа его введения на основе фармакологических свойств Своевременное начало лечения и проведение курсов необходимой продолжительности Быстрая смена антибиотиков и коррекция схем лечения при получении новых данных о возбудителе Выбор рациональных комбинаций антибиотиков при проведении эмпирической терапии и переход на монотерапию при идентификации возбудителя. Основой терапевтического действия антибактериальных препаратов является подавление жизнедеятельности возбудителя инфекционной болезни в результате угнетения более или менее специфичного для микроорганизмов (прокариот) метаболического процесса. Угнетение происходит в результате связывания антибиотика с мишенью, в качестве которой может выступать либо фермент, либо структурная молекула микроорганизма. Резистентность микроорганизмов к антибиотикам может быть природной и приобретенной. Истинная природная устойчивость характеризуется отсутствием у микроорганизмов мишени действия антибиотика или недоступности мишени вследствие первично низкой проницаемости или ферментативной инактивации. При наличии у бактерий природной устойчивости антибиотики клинически неэффективны. Природная резистентность является постоянным видовым признаком микроорганизмов и легко прогнозируется. Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Возможны ситуации, когда большая часть микробной популяции проявляет приобретенную устойчивость. Появление у бактерий приобретенной резистентности не обязательно сопровождается снижением клинической эффективности антибиотика. Формирование резистентности во всех случаях обусловлено генетически: приобретением новой генетической информации или изменением уровня экспрессии собственных генов. Собственные данные Для бактериологической диагностики инфекций мочевыводящих путей (ИМП) применяют полуколичественный метод секторных посевов мочи по Gould. Критерий инфицированности мочевыводящих путей – наличие бактериурии, превышающей показатель 100000 колониеобразующих единиц в 1 мл мочи (КОЕ\мл). Однако клинически выраженная инфекция может проявляться и при меньшей степени бактериурии – 1 000-100 000 КОЕ\мл. В подавляющем большинстве случаев ИМП вызываются одним микроорганизмом. Выделение из мочи нескольких микроорганизмов, скорее всего, свидетельствует о нарушениях правил забора или транспортировки материала. Основные уропатогены, вызывающие более 90% всех ИМП – бактерии семейства Enterobacteriaceae, представители рода Enterococcus, Staphylococcus saprophyticus, Pseudomonas aeruginosa (3, 4). При этом установлено, что этиология заболевания зависит от остроты процесса и условий возникновения инфекции (амбулаторная, стационарная). Так, основным возбудителем острых ИМП (цистит, пиелонефрит) является E.coli, выявляемая у 70-95% больных. При обострении хронических циститов и неосложненных пиелонефритов этиологическая значимость E.coli снижается до 73 -75% случаев, из образцов мочи выделяются другие представители семейства Enterobacteriaceae: Proteus spp., Klebsiella spp., Enterobacter spp., а также Enterococcus spp., Staphylococcus spp. При возникновении ИМП в отделенииях общего профиля этиологическая значимость E.coli составляет порядка 40%, а в отделениях интенсивной терапии – 23-24%. Больший удельный вес приобретают Proteus spp., Klebsiella spp., Enterobacter spp., Enterococcus spp., появляютcя неферментирующие микроорганизмы, такие как Pseudomonas aeruginosa (1, 2) (рис.9). 100% 90% 80% 77% 70% 60% 60% 40% 40% E.coli Enterobacteriaceae 30% 23% 20% 10% 0% острые хронические отд-яобщего профиля отд-я интенсивные Рисунок 9. Частота высевания микрофлоры как этиологического фактора при возникновении острых ИМП, обострении хронических, а также в отделениях общего профиля и отделениях интенсивной терапии. По данным результатов исследования мочи пациентов Диагностического центра Алтайского края (ДЦАК) в лаборатории микробиологических исследований было установлено, что из 339 выделенных бактериальных культур 67.3% (228) штаммов составили энтеробактерии (табл. 2). На долю грамположительной флоры приходилось 21.8% (74) штаммов, на долю неферментирующих грамотрицательных бактерий – 10.3% (35). Таблица 2. Этиологическая структура микроорганизмов, выделенных из мочи Микроорганизмы (n = 339) Кол-во Энтеробактерии: - E.coli - Klebsiella spp. - Proteus spp. - Enterobacter spp. - прочие Грамположительные бактерии: - Enterococcus spp. - Streptococcus gr. B - прочие кокки, палочки Неферментирующие грамотрица – тельные бактерии: - Pseudomonas aeruginosa - прочие Абс. % 228 148 26 21 17 16 74 29 8 37 35 67.3 43.7 7.7 6.2 5.0 4.7 21.8 8.5 2.4 10.9 10.3 11 24 2 3.2 7.1 0.6 Грибы Candida spp. Среди выделенных микроорганизмов основным уропатогеном была E.coli – 148 (43.7%) культур, далее по частоте выделения следовали энтерококки – 29 (8.5%) культур, клебсиелла и протей – 26 (7.7%) и 21 (6.2%) соответственно. Таким образом, по данным лаборатории ДЦАК ведущим возбудителем ИМП является E.coli, наряду с которой, представители рода Klebsiella и рода Proteus имеют этиологическую значимость в группе энтеробактерий. Среди кокковой флоры ведущее место занимают энтерококки, а неферментирующие микроорганизмы представлены в большей степени Pseudomonas aeruginosa. С целью выявления резистентности энтеробактериальных уропатогенов была изучена чувствительность выделенных штаммов к антибактериальным препаратам: В-лактамные антибиотики (амоксициллин, амоксициллин/клавуланат, цефалоспорины 2-3 поколения), аминогликозиды, хинолоны 1-2 поколения, нитрофурантоин, ко-тримоксазол. Результаты исследований представлены в таблице 2, 3. Таблица 2. Резистентность основных уропатогенов к В-лактамным антибиотикам. E.coli Антибиотик Klebsiella spp. Proteus spp. Абс. % Абс. % Абс. % Амоксициллин 35 34.3 8 62.5 5 20.0 Амоксициллин/ Клавуланат=ПАНКЛАВ Цефаклор 35 5.7 8 12.5 5 0.0 57 35.1 10 70.0 9 22.2 Цефамандол 57 19.3 10 50.0 7 14.3 Устойчивость к амоксциллину выявлена у 20.0 – 62.5% выделенных штаммов E.coli., Klesiella spp. и Proteus spp., где наибольшую резистентность проявляли клебсиеллы – 62.5% культур. Эффект действия амоксициллина\клавуланата выявил 5.7% резистенных E.coli., 12.5% резистентных клебсиелл. Цефалоспорины 2 поколения (цефаклор, цефамандол) не оказывали антибактериальное действие на 35.1% изученных штаммов E.coli. и 22.2% штаммов Proteus spp..Следует отметить высокую резистентность Klesiella spp. – 70.0% нечувствительных штаммов. Уровень устойчивости изученных уропатогенов к цефалоспоринам 3 поколения (цефотаксим, цефтазидим) составлял для E.coli – 4.1% бактериальных культур, для клебсиелл и протеев - 23.1 и 19.0% соответственно. Таблица Резистентность основных уропатогенов к аминогликозидам, нитрофуранам, хинолонам 1-2 поколения, ко-тримоксазолу. E.coli Антибиотик 3. Klebsiella spp. Proteus spp. Абс. % Абс. % Абс. % Тобрамицин 146 24.7 26 34.6 21 19.0 Амикацин 146 17.1 26 34.6 21 19.0 Гентамицин 146 13.7 26 42.3 21 23.8 Нитрофурантоин 135 13.3 26 42.3 18 38.8 Налидиксовая кис-та 135 13.3 26 42.3 18 38.8 Ко-тримоксазол 35 11.4 8 25.0 4 50.0 Из представленных выше данных установлено, что от 13.7 до 42.3% изученных уропатогенов были устойчивы к действию аминогликозидов (тобрамицин, амикацин, гентамицин), где штаммы Klebsiella spp. проявляли наибольшую устойчивость (34.6 - 43.3%). 13.3% выделенных E.coli были резистентны к нитрофурантоину и налидиксовой киcлоте, при этом количество нечувствительных Klebsiella spp. и Proteus spp. было значительно выше – 42.3 и 38.8% соответственно. Количество резистентных штаммов E.coli, Proteus spp., Klebsiella spp. к ко- тримоксазолу составило 11.4 - 50.0%, наибольшее количество устойчивых микроорганизмов выявлено среди протейных культур. Следовательно, ведущим уропатогеном ИМП является E.coli. Этиологически значимые уропатогены семейства Enterobacteriaceae - E.coli, Proteus spp., Klebsiella spp. обладают резистентными свойствами в отношении различных групп антибактериальных препаратов. Уровень резистентности уропатогенов определяется как родовой принадлежностью возбудителей, где так и механизмами антибактериального действия прапаратов. Наибольшей резистентностью характеризуются выделенные штаммы Klebsiella spp.. Учитывая рекомендуем неоднозначность осуществлять представленных бактериологическую выше результатов диагностику исследования, ИМП с мы определением антибиорезистентности выделенных уропатогенов. При эмпирическом назначении антибактериальных препаратов неспецифических ИМП могут быть рекомендованы, в частности, (панклав). для лечения амоксициллин\клавуланат При исследовании чувствительности внутриклеточных инфекций к различным антибактериальным препаратам, то она совпадала со стандартами лечения ИПППП и ведущим препаратом является азитромицин (Хемомицин). Пути введения антибиотиков При НИМП предпочтительным является пероральный путь введения. Необходимо учитывать фармакокинетику антибиотика и использовать препараты, позволяющие обеспечить высокие (выше минимальной подавляющей концентрации для возбудителя) концентрации в моче. Антибиотики с длительным периодом полувыведения могут назначаться 1-2 раза в сутки, тем самым повышая комплаентность к лечению. Парентеральное введение антибиотиков используется при тяжелом течении острого пиелонефрита или при невозможности приема препарата внутрь. Необходимо отметить, что современные антибактериальные препараты (Амоксициллин/клавуланат=Панклав и азитромицин=Хемомицин, в частности) хорошо сочетаются с препаратами других групп, которые используются в лечении основного заболевания при вторичном воспалительном процессе. Длительность терапии Острый цистит. Основным критерием выбора продолжительности антибиотикотерапии является наличие или отсутствие факторов риска. При выявлении факторов риска рационально использовать 7-дневный курс терапии, при их отсутствии - 3-дневный курс. В качестве противопоказаний к проведению терапии острого цистита короткими (3 дня) курсами являются: беременность; возраст > 65 лет; ИМП у мужчин; длительность сохранения симптомов > 7 дней; рецидив инфекции; использование диафрагм и спермицидов; сахарный диабет наличие ИПППП. Проведение коротких курсов (3 дня) антибиотикотерапии у пациентов с острым циститом достаточно эффективно. Удлинение курса антибиотика не приводит к существенному повышению эффективности, но может повысить риск развития нежелательных реакций. В течение первых 2-3 дней терапии может не отмечаться купирования симптомов, в связи с этим необходимо объяснять пациентам особенности течения острого цистита. При терапии одной дозой, несмотря на эрадикацию возбудителя в течение нескольких часов, воспалительный процесс и, как следствие, клинические симптомы могут продолжаться более длительное время. Только у одной трети пациентов клинические симптомы исчезают в течение суток, а у 50% - в течение двух дней. У некоторых пациентов клиника острого цистита может продолжаться до 3-5 дней от начала лечения. При выявлении внутриклеточных возбудителей у больных с клиникой острого цистита необходимо назначение антибиотика с заявленной чувствительностью к ИПППП, с учетом стандартов лечения. Особенно это показано в тех случаях когда не удается избежать назначения эмпирического лечения урогенитальной инфекции. При выборе препарата необходимо отдавать предпочтение таким антибактериальным средствам, которые способны создавать высокие внутриклеточные и внутритканевые концентрации, удобен в использовании, имеет высокую клиническую и микробиологическую эффективность (из-за низкой резистентности микроорганизмов к препарату). Продолжительность лечения при этом также должна укладываться в стандарты лечения ИПППП. Этим требованиям при неосложненных формах отвечает азитромицин (Хемомицин) 1,0 в три приема 1 раз в неделю в общей курсовой дозировке 3,0 грамма. При осложненном (на фоне ИПППП, особенно хламидийной инфекции, возникновение цистита и его осложнение пиелонефритом) или длительном течении нами разработана и рекомендуется другая схема: азитромицин (Хемомицин) по 500 мг * 1 раз в день 3 дня. Затем по 250 мг также 1 раз в день от 10 до 14 дней в зависимости от тяжести течения заболевания. Общая курсовая дозировка равняется от 4,0 грамм до 6,0 грамм. Клиническая эффективность при таких схемах лечения составляет от 86,9% до 88,2%, микробиологическая эффективность в среднем - 84,5%. Острый пиелонефрит. Добиться эрадикации возбудителя при поражении паренхимы почек сложнее, чем при поверхностном поражении слизистой оболочки мочевого пузыря. Поэтому при остром пиелонефрите антибиотики назначаются более длительно, чем при остром цистите. При легком и среднетяжелом течении, без выраженных симптомов интоксикации, антибиотики назначаются перорально в течение 10-14 дней. При неэффективности 14-дневного курса используют более длительное назначение антибиотиков - в течение 4-6 недель. При тяжелом течении острого пиелонефрита, наличии выраженных симптомов интоксикации необходимо парентеральное введение антибиотиков до исчезновения лихорадки, затем возможен переход на пероральный прием антибиотика в течение 10-14 дней. При частых рецидивах применяют профилактические курсы лечения в течение 6-12 месяцев. Рис. 3. Тактика в отношении пациенток с частыми рецидивами ИМП При редких рецидивах НИМП и отсутствии возможности обратиться за врачебной помощью можно рекомендовать самостоятельный прием антибиотика при появлении первых симптомов инфекции. При этом для подтверждения элиминации возбудителя желательно бактериологическое исследование мочи через 1-2 недели после приема препарата. У женщин в постменопаузальном периоде антибиотики играют меньшую роль, чем у молодых. Периуретральное и интравагинальное применение гормональных кремов, содержащих эстрогены (0,5 мг/г), на ночь в течение 2 недель с последующим применением 2 раза в неделю в течение нескольких месяцев, значительно снижает частоту обострений ИМП и должно быть рекомендовано до начала профилактического применения антибактериальных препаратов. У молодых пациентов с явлениями воспаления в предстательной железе, осложнившихся признаками эректильной дисфункции в курс антибактериальной терапии включаются препараты, восстанавливающие энергетический потенциал – Энерион, или психоактиваторы – Грандаксин. У пожилых пациентов с доброкачественной гиперплазией простаты в комплекс лечебных противовоспалительных заболеваний необходимо включать препараты, влияющие на характер мочеиспускания и объем аденоматозного узла (группа α–блокаторов и блокаторов 5α -редуктазы). Для лучшего восприятия материала информация о принципах антибактериального лечения НИМП приводится в табличном варианте (приложения 1-4). Приложение 1. Типичные ошибки при проведении антибиотикотерапии у пациентов с НИМП Назначение Kомментарий Выбор препарата Цефалоспорины I поколения Недостаточно высокая возбудителей НИМП активность против Сульфаниламиды Риск развития тяжелых нежелательных реакций основных Ампициллин, Амоксициллин (без добавления клавулановой Высокий уровень резистентности уропатогенов в России кислоты!) Применение беременных фторхинолонов у Риск развития патологии костно-хрящевой ткани у плода Путь введения препарата Гентамицин в/м при остром цистите или нетяжелом остром Риск развития нежелательных побочных реакций пиелонефрите Парентеральное антибиотиков в условиях введение Современные пероральные препараты не уступают по амбулаторных эффективности парентеральным препаратам антибиотиков Kратность введения Назначение фторхинолонов чаще двух раз в сутки Длительность терапии При отсутствии факторов риска достаточно 3-дневных, а при Применение антибиотика при их наличии - 7-дневных курсов терапии. Увеличение остром цистите в течение 10-14 продолжительности терапии существенно не влияет на дней эффективность лечения, но увеличивает риск нежелательных реакций Применение антибиотика для лечения острого цистита в течение При наличии факторов риска лечение должно проводиться 1-3 дней при наличии факторов минимум 7 дней риска у пациента Приложение 2. Алгоритм ведения пациентов с ИМП -В случае выявления ИППП проводится лечение антибактериальным препаратом с заявленным действием на внутриклеточные инфекции + интравагинально Бетадин, хлоргексидин -при наличии выраженной инфравезикальной обструкции (скорость мочеиспускания<10 мл/сек) и небольшого увеличения простаты (объем простаты <50 см ³) совместно с антибиотиками назначаются αблокаторы (Сетегис) -при наличии незначительно выраженной инфравезикальной обструкции (скорость мочеиспускания>10 мл/сек) и большого увеличения простаты (объем простаты >50 см ³) совместно с антибиотиками назначаются блокаторы 5α-редуктазы (Финастерид=Финаст, Проскар или Дутастерид=Аводарт) -простатит + эректильная дисфункция или снижение либидо: Панклав (как осложнение при ИПППП – Хемомицин) +Энерион или Грандаксин Приложение 3. Режимы антибактериальной терапии НИМП Особенности пациентов Заболевание Типичные возбудители Острый неосложненный E.coli, S.saprophyticus, Нет Proteus mirabilis, Рекомендуемая терапия1 эмпирическая Перорально в течение 3 дней: амоксициллин/клавуланат= цистит у женщин Klebsiella pneumoniae, ПАНКЛАВ Внутриклеточные инфекции (хламидии, микоплазмы, Перорально в течение 7 дней: амоксициллин/клавуланат= уреаплазмы) Сохранение симптомов > 7 Панклав+ Бетадин дней ¹ Рецидив ИМП Беременность амоксициллин/клавуланат= Панклав+ Бетадин 2 Использование диафрагм Хемомицин Выявленные ИППП Возраст >65 лет женщин >50 лет мужчин у +α-блокаторы (Сетегис) +блокаторы 5α-редуктазы у (Финастерид=Финаст, Проскар или Дутастерид=Аводарт) - Антибиотики назначаются до микробиологической идентификации возбудителя, возможна коррекция антибиотикотерапии после идентификации возбудителя; 2 - фторхинолоны нельзя назначать. Ко-тримоксазол нельзя назначать в III триместре. Гентамицин можно использовать с осторожностью из-за возможного поражения VIII черепномозгового нерва у плода; 1 Приложение 4. Список основных торговых названий и дозы антибактериальных препаратов, применяемых для лечения ИМП Генерическое название Торговые названия Амоксициллин/клавуланат Панклав Азитромицин Доза терапевтическая 250 мг 3 раза в день при неосложненных формах - 1,0 в 1й, 7-1 и 14 дни, общая курсовая дозировка 3,0 грамма. При осложненном: по 500 мг * 1 раз в Хемомицин день 3 дня. Затем по 250 мг также 1 раз в день от 10 до 14 дней в зависимости от тяжести течения заболевания. Общая курсовая дозировка равняется от 4,0 грамм до профилактическая 6,0 грамм. Литература: 1. Лопаткин Н. А., Деревянко И. И., Страчунский Л. С., Рафальский В. В., Лоран О. Б., Петров С. Б., Бабкин П. А. Антибактериальная терапия острого цистита и пиелонефрита у взрослых. М., 2001. 2.Выбор антимикробных препаратов при неосложненных инфекциях мочевыводящих путей внебольничного происхождения. Пособие для врачей. Смоленск. 2002; 14 с 3. Яковлев С.В. Современные подходы к антибактериальной терапии инфекций мочевыводящих путей. Consilium medicum. 2001; 7;