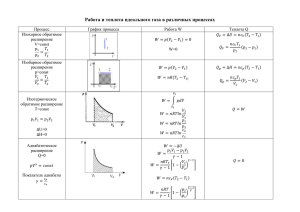
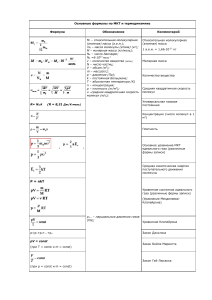
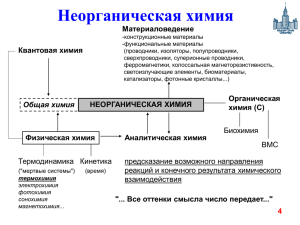
Химия пищевая химия химический состав пищевых систем (сырье, полупродукты и готовые пищевые продукты) изменения в химическом составе в ходе технологического процесса создание искусственной пищи созданы таблицы химического состава пищевого сырья и готовых продуктов концепция по подготовки специалистов по технологии продуктов питания 2 Пищевые системы - сложные системы - из сотен химических соединений: 1. нутриенты – алиментарное значение Макронутриенты (белки, жиры, углеводы) Микронутриенты (витамины, минеральные вещества, биологически активные вещества 2. пищевые добавки 3. контаминанты Нутриенты - заменимые и незаменимые 3 органическая химия неорганическая химия биотехнология физическая химия коллоидная химия наука о питании аналитическая химия П И Щ Е В А Я химия 1960 г Алексей Петрович Нечаев основатель научных школ "Липидология" и "Пищевая 4 органическая химия неорганическая химия биотехнология физическая химия коллоидная химия наука о питании аналитическая химия П И Щ Е В А Я химия 1960 г Алексей Петрович Нечаев основатель научных школ "Липидология" и "Пищевая 5 ФИЗИЧЕСКАЯ ХИМИЯ Модуль 1 Предмет и задачи физической химии Физическая химия - наука, объясняющая химические явления и устанавливающая их закономерности на основе общих принципов физики. Физическая химия рассматривается как теоретическая основа всех химических дисциплин и химических технологий. Цель физической химии установление законов протекания химических процессов: возможности их осуществления, направления, механизма, скорости и конечных результатов при различных условиях и свойствах веществ. Практическое значение физической химии прогнозирование и управление химическим процессом. Учебная литература 6.1.Основная литература Химия: учебник для среднего профессионального образования / Ю. А. Лебедев, Г. Н. Фадеев, А. М. Голубев, В. Н. Шаповал ; под общей редакцией Г. Н. Фадеева. — Москва : Издательство Юрайт, 2022. - https://urait.ru/viewer/himiya-491035#page/1 Анфиногенова, И. В. Химия : учебник и практикум для среднего профессионального образования. — Москва : Издательство Юрайт, 2022. - https://urait.ru/viewer/himiya-491735#page/1 Никольский, А. Б. Химия : учебник и практикум для среднего профессионального образования. — Москва : Издательство Юрайт, 2022. - https://urait.ru/viewer/himiya-491475#page/1 Мартынова, Т. В. Химия : учебник и практикум для среднего профессионального образования. — Москва : Издательство Юрайт, 2022. . - https://urait.ru/viewer/himiya-489733#page/1 ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Термодинамика – наука о взаимном превращении одних видов энергии в другие. «Термо» – теплота, «динамос» – движение. Различают общую, техническую и химическую термодинамику. Химическая термодинамика – раздел физической химии, в котором термодинамические методы применяются для анализа химических и физико-химических процессов – химических реакций, фазовых переходов, явлений в растворах и т.п. Макроскопический метод изучения процессов Дедуктивный метод, применяет общие закономерности к частным явлениям. «Метод черного ящика». Этот принцип заключается в том, что, не имея информации о существе, внутренней структуре процесса, для его математического описания используют лишь зависимость выходных величин от входных. Основная задача химической термодинамики. возможности проведения химического процесса. Основной объект - термодинамическая система. Определение Термодинамическая система – тело или совокупность тел, выделяемых в пространстве с помощью реально существующей или воображаемой границы. – часть материального мира, которая является предметом нашего наблюдения или исследования. Системой может быть, например, колба с реакционной смесью, человек, теплообменник на предприятии. Термодинамическая система обязательно должна содержать большое число частиц (молекул, атомов). Системы с малым числом частиц термодинамика не рассматривает. Термодинамическая система – тело или совокупность тел, выделяемых в пространстве с помощью реально существующей или воображаемой границы. – часть материального мира, которая является предметом нашего наблюдения или исследования. Системой может быть, например, колба с реакционной смесью, человек, теплообменник на предприятии. Термодинамическая система обязательно должна содержать большое число частиц (молекул, атомов). Системы с малым числом частиц термодинамика не рассматривает. Остальная часть материального мира, т.е. за пределами условно выделенной из него системы, – окружающая среда. Взаимодействие системы с окружающей средой состоит из обмена энергией и веществом. Различают открытые, закрытые и изолированные системы. Термодинамическая система – тело или совокупность тел, выделяемых в пространстве с помощью реально существующей или воображаемой границы. – часть материального мира, которая является предметом нашего наблюдения или исследования. Системой может быть, например, колба с реакционной смесью, человек, теплообменник на предприятии. Термодинамическая система обязательно должна содержать большое число частиц (молекул, атомов). Системы с малым числом частиц термодинамика не рассматривает. Остальная часть материального мира, т.е. за пределами условно выделенной из него системы, – окружающая среда. Взаимодействие системы с окружающей средой состоит из обмена энергией и веществом. Различают открытые, закрытые и изолированные системы. Параметры состояния системы – характеризуют определенное свойство системы и не зависят от способов достижения данного состояния. Измеряются опытным путем Внешние параметры: давление р, объем V температура Т (К) Начало шкалы совпадает с абсолютным нулём (0 К по шкале). Пересчёт в градусы Цельсия: Т, К = t С + 273 Внутренние параметры: концентрация с плотность Термодинамические функции – не могут быть измерены опытным путем, зависят от параметров энтальпия Н энтропия S внутренняя энергия U свободная энергия Гиббса (изобарно-изотермический потенциал) G свободная энергия Гемгольца (изохорно-изотермический потенциал) F Процесс – это любое изменение в системе, приводящее к изменению, по крайней, хотя бы одного параметра состояния. Отметим некоторые частные виды процессов: 1) изотермический (T = const); 2) изобарный (р = const); 3) изохорный (V = const); 4) адиабатический (нет теплообмена с окружающей средой); 5) изобарно-изотермический (р, T = const); 6) изохорно-изотермический (V, T = const). Если в результате процесса система возвращается в исходное состояние, такой процесс называется круговым (или циклом). Теплота и работа Работа (А) и теплота (Q) – две возможные формы передачи энергии от одной системы к другой. Теплота связана с беспорядочным (хаотическим) перемещением микрочастиц: энергия передается путем хаотических столкновений молекул соприкасающихся тел, т.е. путем теплопроводности. Работа – форма передачи энергии путем упорядоченного движения частиц. Имеют размерность энергии. Кало́рия: кал — внесистемная единица количества теплоты; энергия, необходимая для нагревания 1 грамма воды с 19.5 до 20.5 градусов Цельсия. Джо́уль : Дж; J — единица измерения работы, энергии и количества теплоты в Международной системе единиц (СИ). Джоуль равен работе, совершаемой при перемещении точки приложения силы, равной одному ньютону, на расстояние одного метра в направлении действия силы[1]. Таким образом, 1 Дж = 1 Н·м=1 кг·м²/с² ≈ 0,2388458966 кал 1 кал = 4,1868 Дж Теплота и работа Работа (А) и теплота (Q) – две возможные формы передачи энергии от одной системы к другой. Теплота связана с беспорядочным (хаотическим) перемещением микрочастиц: энергия передается путем хаотических столкновений молекул соприкасающихся тел, т.е. путем теплопроводности. Работа – форма передачи энергии путем упорядоченного движения частиц. Имеют размерность энергии. Кало́рия: кал — внесистемная единица количества теплоты; энергия, необходимая для нагревания 1 грамма воды с 19.5 до 20.5 градусов Цельсия. Джо́уль : Дж; J — единица измерения работы, энергии и количества теплоты в Международной системе единиц (СИ). Джоуль равен работе, совершаемой при перемещении точки приложения силы, равной одному ньютону, на расстояние одного метра в направлении действия силы[1]. Таким образом, 1 Дж = 1 Н·м=1 кг·м²/с² ≈ 0,2388458966 кал 1 кал = 4,1868 Дж Теплота и работа Работа (А) и теплота (Q) – две возможные формы передачи энергии от одной системы к другой. Теплота связана с беспорядочным (хаотическим) перемещением микрочастиц: энергия передается путем хаотических столкновений молекул соприкасающихся тел, т.е. путем теплопроводности. Работа – форма передачи энергии путем упорядоченного движения частиц. Имеют размерность энергии. А > 0, если работа совершена самой системой. Q > 0, если теплота передана системе. Теплота и работа в общем случае являются функцией процесса. Энергия (философская категория) , мера движения материи. Сумма кинетической и потенциальной энергий всех частиц в системе называется внутренней энергией системы (U). Внутренняя энергия - есть полная энергия системы за вычетом кинетической и потенциальной энергии системы как целого. Абсолютного значения внутренней энергии нет. Изменение ΔU при переходе системы из исходного состояния 1 в конечное 2: [U] = Дж (Нм) в U 2 (U ) ΔU = U – U . системе СИ [U] = эрг в системе СГС 1 (U ) [U] = кал ΔU > 0, если в рассматриваемом процессе внутренняя энергия системы возрастает. 2 2 1 1 Свойства функции состояния системы 1.Изменение функции состояния определяется только исходным и конечным состоянием системы и не зависит от пути перехода этой системы из исходного в конечное состояние. Любое бесконечно малое изменение функции состояния системы является полным f2 дифференциалом: f df f 2 f1 f1 2. В круговом процессе конечное состояние совпадает с начальным, поэтому любая функция состояния принимает первоначальное значение, а ее изменение равно нулю: df 0 3.Свойство аддитивности: величина термодинамической функции для всей системы складывается из величин этой функции для определенных частей системы. Fоб Fi i Первое начало термодинамики Сформулировали в середине XIX века Ю.Р. Майер (1842), Г. Гельмгольц (1847), Дж. Р. Джоуль (1842), Г. Гесс (1840). Эквивалентные формулировки. 1. Энергия не возникает из ничего и не исчезает в ничто, энергия переходит из одного вида в другой. 2. В любой изолированной системе запас энергии остаётся постоянным. (Джоуль) 3. Вечный двигатель I рода невозможен. (Нельзя построить такую машину, которая создавала бы работу из ничего.) 4. ! Теплота, подведенная к закрытой системе, идет на увеличение внутренней энергии этой системы и на совершение системой работы. Математическая формулировка Q для конечного процесса Q = U + A, для элементарного процесса Q dU A . Применение I начала к системам, в которых совершается только работа расширения 1. Изохорный процесс (v = const, dv = 0) для 1 моль в дифференциальной форме Qv dU Cv dT для n моль в интегральной форме U nC v (T2 T1 ) В изохорных условиях изменение внутренней энергии равно тепловому эффекту этого процесса. Qv = ΔU 2. Изобарный процесс (p = const, dp = 0) δA = pdv A=p(v2 - v1) для 1 моль в дифференциальной форме Q p dU pdv d (U pv) dH Q p dH C p dT H≡U + pv – энтальпия функция состояния системы, для n моль в интегральной форме [H] = Дж ∆H = nCр(Т2 – Т1) В изобарных условиях изменение энтальпии равно тепловому эффекту этого процесса. Qp = ΔH Связь между Qp и Qv Q p Qv pv dH dU pdv Если Т = const (химические реакции): H U nRT ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ ДЛЯ ПРОЦЕССОВ, ПРОТЕКАЮЩИХ В ИДЕАЛЬНОЙ ГАЗОВОЙ ФАЗЕ Тип процесса Уравнение состояния идеального газа при n = const Уравнение теплоты Уравнение внутренней энергии Уравнение работы расширения Изохорический (V = const) p const Т Q = ∆U ∆U = nCv (Т2 – Т1) A=0 Изобарический (p = const) V const T Q = ∆Н ∆Н = nCр(Т2 – Т1) А = р(V2 – V1) А = nR(Т2–Т1) Изотермический (Т = const) pV = const Q =A ∆U = 0 А = nRT lnV2/V1 А = nRT lnp1/p2 Q = const ∆U= – A pV γ const Адиабатический (Q = const) TV (γ 1) const Tp (γ 1/ ) const γ = Cp/Cv А = – nCv(Т2–Т1) Теплоемкость веществ Теплоемкость системы(или тела) – это отношение количества сообщенной системе теплоты к наблюдаемому при этом повышению температуры (при отсутствии химической реакции, переходов вещества из одного агрегатного состояния в другое). Истинная теплоемкость : Q C dT Средняя теплоемкость : C Q T2 T1 Дж/(К). Теплоемкость веществ Виды теплоемкости: 1 Истинная теплоемкость : Средняя теплоемкость : Q Q C C T2 T1 dT Связь между истинной и средней теплоемкостями : 1 T2 С CdT T2 T1 T1 2 Молярная теплоемкость : [C] = Дж/(К ·моль) 3 Изохорная теплоемкость : Q U Cv dT dT v v Удельная теплоемкость : [C] = Дж/(К ·кг) Изобарная теплоемкость : Q H Cp dT dT p p ТЕРМОХИМИЯ Термохимия – раздел химической термодинамики, изучающий взаимосвязь химических и физикохимических процессов с сопровождающими их тепловыми эффектами. Тепловой эффект – это количество теплоты, которое система выделяет или поглощает в необратимо протекающем процессе. Процессы, при протекании которых теплота выделяется, экзотермические (ΔН < 0). Процессы, протекающие с поглощением теплоты, эндотермические (ΔН > 0). 1840 г закон Гесса тепловой эффект реакции зависит только от начального и конечного состояний реагентов, а не от пути протекания процесса при выполнении следующих условий: • процесс осуществляется при v = const (Qv = ΔU) или при p = const (Qp = ΔН); • температура исходного и конечного состояния одинакова; • процесс протекает до конца. ГЕСС (Hess), Герман Иванович 1802 –1850 Прямое следствие из 1 начала термодинамики. Практическое значение закона Гесса в возможности рассчитывать тепловые эффекты процессов. 1 способ Следствие 1. Тепловой эффект реакции равен разности энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов: r H T0 ( j f H T0 j ) кон ( i f H T0 i ) исх j i 0 4NH3 (г) + 5О2 (г) = 6Н2О (ж) + 4NO (г) + r H T r H T0 [6 f H T0 (H 2 O, ж) 4 f H T0 (NO, г)] - [4 f H T0 (NH3 , г) 5 f H T0 (O 2 , г)]. Стандартной энтальпией образования соединения f H T0 j называют изменение энтальпии в реакции образования 1 моль данного соединения из простых веществ, взятых в стандартном состоянии. Стандартное состояние – это состояние чистого вещества при давлении 1,013105 Па (1 атм) и заданной температуре. Способы расчета тепловых эффектов реакций 2 способ – термохимические циклы Уравнение реакции с указанием агрегатного состояния реагентов и энтальпии реакции называется термохимическим уравнением. 6С (т) + 3Н2 (г) = С6Н6 (ж), ΔrН0 = 49,03 кДж/моль, Н1 = Н2 + Н3 + Н4 = = Н5 + Н6 3 способ , Следствие 2. Тепловой эффект реакции равен разности энтальпий сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов: r H T0 ( i с H T0 i ) исх ( j с H T0 j ) кон i j Теплота сгорания – это количество теплоты, которое выделяется при окислении 1 моль вещества до высших оксидов молекулярным кислородом. Энтальпии сгорания оксидов (Н2О (ж), СО2 (г), NO2 (г) и др.) принимаются равными нулю. В термохимических расчетах используют стандартную теплоту сгорания. Стандартной теплотой сгорания называется теплота сгорания, отнесенная к стандартному состоянию. с H T0 i В справочниках большинство термохимических данных приведено при Т = 298 К.