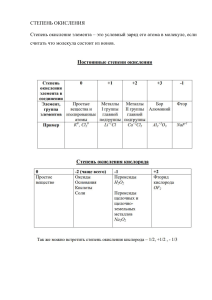
Энгельсский технологический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего образования «Саратовский государственный технический университет имени Гагарина Ю.А.» Кафедра «Технология и оборудование химических, нефтегазовых и пищевых производств» Отчет по учебной (ознакомительной) практике на тему «Технология процессов окисления органического и нефтехимического синтеза» Выполнил: студент группы б2-ТМОБ-21 . Руководитель практики от института: старший преподаватель кафедры ТОХП Денисов В.А. Энгельс - 2023г. Федеральное государственное бюджетное образовательное учреждение высшего образования «Саратовский государственный технический университет имени Гагарина Ю.А.» Кафедра Технология и оборудование химических, нефтегазовых и пищевых производств ЗАДАНИЕ НА УЧЕБНУЮ (ОЗНАКОМИТЕЛЬНУЮ) ПРАКТИКУ Студенту учебной группы б2-ТМОБ-11 института ___________________ (фамилия, имя, отчество) Практика проходит в организации ЭТИ (филиал) СГТУ им. Гагарина Ю.А. (наименование организации) расположенной по адресу 413100, г. Энгельс, пл. Свободы, 17 (фактический адрес) Согласно договору № от 20__ г. Срок практики с по 2023 г. Основание: Приказ СГТУ имени Гагарина Ю.А. № от . Индивидуальное задание Изучить технологию процессов окисления органического и нефтехимического синтеза, аппаратурное оформление процесса. Руководитель практики от кафедры Руководитель практики от организации (подпись) (подпись) / / Денисов В.А. / (Ф.И.О.) (Ф.И.О.) / 2 План-график проведения практики № п/п Наименование вопросов, подлежащих изучению в период практики или вид выполняемой работы 1. Вводное занятие Работа с литературными 2. источниками Характеристика процессов окисления. 3. Теоретические основы процесса Изучение технологии процессов окисления 4. органического и нефтехимического синтеза Аппаратурное оформление процесса, 5. анализ работы оборудования Подготовка и оформление 6. отчета Количество дней/ акад. часов 1 3 6 Письменный отчет 6 6 2 Согласовано: Руководитель практики от кафедры (дата согласования) Руководитель практики от организации Ознакомлен: Студент Канайчев А.М. Отметка руководителя о выполнении Форма отчетности (подпись) (подпись) / Денисов В.А. / (дата согласования) (подпись) « » (Ф.И.О.) / (Ф.И.О.) / 2023г. 3 Отзыв руководителя практики от организации Подпись / / Дата Отзыв руководителя практики от кафедры Подпись / Денисов В.А. / Дата 4 Содержание Введение 1. Ошибка! Закладка не определена. 2. Ошибка! Закладка не определена. 3. Ошибка! Закладка не определена. 4. Ошибка! Закладка не определена. 5. Ошибка! Закладка не определена. 6. Ошибка! Закладка не определена. 7. Ошибка! Закладка не определена. 8. Ошибка! Закладка не определена. 9. Ошибка! Закладка не определена. Заключение Список использованных источников 6 27 28 5 Введение В современном мире технологии органического и нефтехимического синтеза играют ключевую роль в обеспечении человечества необходимыми продуктами и материалами. Синтез органических соединений и получение нефтепродуктов являются важными и сложными процессами, которые требуют использования различных методов и технологий. В частности, процессы окисления занимают важное место в органическом и нефтехимическом синтезе, так как они позволяют получать различные продукты, такие как спирты, альдегиды, кетоны, кислоты и другие вещества, которые широко используются в промышленности. Технология процессов окисления представляет собой совокупность методов, процессов и подходов, направленных на осуществление реакций окисления органических и нефтехимических соединений. Эти процессы могут быть осуществлены различными способами, такими как термическое окисление, каталитическое окисление и электрохимическое окисление. Выбор метода окисления зависит от конкретных условий и требований к продукту, а также от экономических аспектов процесса. Целью данной работы является изучение и анализ современных технологий процессов окисления в органическом и нефтехимическом синтезе. Для достижения этой цели будут рассмотрены основные методы окисления, их преимущества и недостатки, а также примеры реализации этих методов на практике. Кроме того, будет проведен анализ влияния различных факторов (температура, давление, катализаторы, растворители и т.д.) на эффективность процессов окисления и качество получаемых продуктов. Полученные результаты исследования позволят лучше понять механизмы процессов окисления, что в свою очередь позволит оптимизировать существующие технологии и разработать новые методы для получения продуктов с улучшенными характеристиками и более высокой экономической эффективностью. 6 Процесс окисления органического и нефтехимического синтеза Окисление является одним из основных процессов в органической химии и нефтехимии. Оно используется для получения различных продуктов из органических соединений, таких как спирты, альдегиды, кислоты и другие. Окисление может происходить различными способами, включая термическое, каталитическое и электрохимическое. Термическое окисление - это процесс, при котором органические соединения подвергаются воздействию высокой температуры в присутствии кислорода. Этот метод обычно используется для получения продуктов с высокой степенью окисления, таких как альдегиды и кислоты. Каталитическое окисление происходит при использовании катализаторов, которые ускоряют реакцию окисления. Катализаторы могут быть как органическими, так и неорганическими. Органические катализаторы обычно используются для окисления ароматических соединений, а неорганические - для окисления парафиновых углеводородов. Электрохимическое окисление - это метод, при котором органическое соединение подвергается воздействию электрического тока. Этот метод используется для получения продуктов с низкой степенью окисления, таких как спирты и альдегиды. Каждый из этих методов имеет свои преимущества и недостатки. Термическое окисление является наиболее простым и дешевым методом, но оно может привести к образованию побочных продуктов и не всегда дает желаемые результаты. Каталитическое окисление позволяет получить более чистые продукты, но требует использования дорогих катализаторов и может быть более сложным в управлении. Электрохимическое окисление является самым дорогим методом, но позволяет получать продукты с высокой степенью чистоты и точностью контроля степени окисления. Кроме того, окисление может происходить в различных условиях, таких как температура, давление, концентрация окислителя и другие параметры. Выбор условий окисления зависит от конкретного процесса и требований к получаемому продукту. Таким образом, технология процессов окисления является важной частью органического и нефтехимического синтеза и играет ключевую роль в получении различных продуктов. Технология процессов окисления включает в себя различные методы и подходы, которые используются для осуществления реакций окисления органических соединений. Одним из таких методов является термическое окисление, которое происходит при высоких температурах в присутствии кислорода. Этот метод часто используется для получения альдегидов и кислот из органических соединений. Еще одним методом является каталитическое окисление, которое использует катализаторы для ускорения реакции окисления. Катализаторы могут быть органическими или неорганическими и могут быть использованы для окисления различных типов органических соединений. Например, органические 1. 7 катализаторы используются для окисления ароматических соединений, в то время как неорганические катализаторы используются для окисления парафиновых углеводородов. Также существует электрохимическое окисление, при котором органическое соединение окисляется под действием электрического тока. Этот метод позволяет получить продукты с низкой степенью окисления, такие как спирты и альдегиды. Однако этот метод является более дорогим и сложным в использовании по сравнению с другими методами окисления. Выбор метода окисления зависит от многих факторов, таких как тип органического соединения, требуемый продукт, доступность катализатора и экономические факторы. Каждый метод имеет свои преимущества и недостатки, и выбор наиболее подходящего метода зависит от конкретных требований к процессу окисления. Реакция окисления органического и нефтехимическом синтезе Окисление органических соединений занимает важное место в промышленном органическом и нефтехимическом синтезе. Окисляют парафиновые углеводороды, нафтены, арены, олефины, диены, спирты, альдегиды, алкины, меркаптаны, амины и др. органические соединения. В качестве окислителей используют O2, H2O2, ROOH, O3, N2O, неорганические окислители, включая Cl2, Br2, Cl2O и др. Процессы окисления по разным признакам можно классифицировать следующим образом: ● парциальное окисление; ● глубокое окисление (обычно до СО2 и Н2О); ● гомогенное газофазное окисление – обычно радикально-цепное автоокисление или инициированное окисление, процессы горения; ● гомогенное гетерофазное (жидкофазное) окисление; ● гетерогенно-каталитическое окисление. Гомогенное жидкофазное окисление делится на радикально-цепное автоокисление (или инициированное окисление) и каталитическое окисление. Приведем типичные реакции каталитического жидкофазного и гетерогенного окисления органических соединений. Типичные окислители и реакции: Окисление кислородом а) Радикально-цепное жидкофазное окисление алкилароматических соединений (катализ комплексами металлов): 2. б) “Мерокс”-процесс: в) “Вакер”-процесс (окисление олефинов): 8 г) Реакция Моисеева (синтез винилацетата): д) окислительное карбонилирование метанола: е) окислительная димеризация: Реакция Глязера-Залькинда: Реакция Моритани-Фудживары: ж) окислительное хлорирование: Окисление пероксидом водорода и гидропероксидами: а) Реакция Прилежаева: б) Эпоксидирование олефинов: в) Окисление аренов и фенолов: Pc* – замещенные фталоцианины г) “Халкон”-процесс: 9 Окисление О2 в гетерогенном катализе: а) окисление спиртов: б) окисление ароматических соединений: в) окисление алканов (окислительное дегидрирование): г) окисление олефинов: д) окислительный аммонолиз парафинов и олефинов: е) реакция Моисеева в паровой фазе: ж) синтез аллилацетата: з) окислительная димеризация метана: и) окислительное хлорирование этилена: Появились и новые окислители, например, закись азота N2O. Бензол окисляется этим окислителем на цеолитах ZSM-5, содержащих железо, при 350 – 400оС. Селективность ~100%, конверсия 8 – 13%. В 2002 году установлено (Г.И.Панов), что N2O в жидкой фазе без катализатора при давлении 10 атм и температурах 140 – 250оС окисляет олефины до кетонов с селективностью > 98%. 10 Процессы, механизмы и кинетические модели «Вакер»-процесс. Реакция окисления олефинов до карбонильных соединений была открыта практически одновременно в Германии (группа доктора Юргена Смидта в фирме «Consortium für Electrochemie» и И.И.Моисеевым, М.Н.Варгафтиком и Я.К.Сыркиным в СССР (МИТХТ им. М.В.Ломоносова) в 1957 – 1959 гг. Реакция протекает в воде или водноорганических растворах комплексов Pd(II) и Cu(II) при атмосферном давлении и температурах 70 – 95оС, например, синтез ацетальдегида: 3. Реакция вызвала интерес у промышленных фирм, и уже в 1962 году фирма “Wacker Chemie” построила производство альдегида по этой реакции. В промышленных условиях используют давление 10 – 13 атм и температуру 110 – 120оС. Процесс складывается из трех макростадий: Таким образом, PdCl2 катализирует окисление этилена окислителем CuCl2 а CuCl2 катализирует окисление Pd0 кислородом. Система PdCl2-CuCl2 является полифункциональным катализатором брутто-процесса. Интересно, что молекула воды также катализирует брутто-реакцию и является непременным участником процесса в этой каталитической системе. Поскольку скорость окисления Cu(I) кислородом достаточно велика, стационарность процесса обеспечивается равенством скоростей реакций. В условиях промышленного процесса скорость реакции обеспечивает отсутствие Pd0 в форме металлической фазы, и скорость реакции в определенных пределах не зависит от [CuCl2]. Вместо CuCl2 можно использовать другие промежуточные окислители, например, п-бензохинон, концентрация которого при определенном избытке также не влияет на скорость образования ацетальдегида. Эту систему и использовали для построения кинетической модели и изучения механизма реакции. Очевидно, таким образом, что главные события, приводящие к очень интересному превращению этилена с участием H2O, происходят в реакции. Кинетическое уравнение для реакции в присутствии п-бензохинона (Q) было получено в закрытой системе без газовой фазы (И.И.Моисеев и др.) и по поглощению этилена в двухфазном реакторе полного смешения волюмометрическим методом (П.Генри). В области концентраций PdCl2 до 0.02 М при постоянной ионной силе (I = 1 – 3) в системе NaCl – LiClO4 – HCl – HClO4 = Const Pd(II) находится преимущественно в форме PdCl42– , и закомплексованность Pd(II) этиленом не существенна. Скорость реакции или реакции описывается уравнением 11 Из уравнения следует, что процесс протекает с лимитирующей стадией и что в стадиях до лимитирующей выделяются ион Н+ и два иона Cl– при взаимодействии PdCl42– и C2H4. Для выяснения вопроса о том, из какой частицы выделяется Н+, провели опыты с меченым этиленом (C2D4) в H2O. Оказалось, что ацетальдегид содержит 4 атома D (CD3CDO) и, таким образом, Н+ может выделяться только из молекулы H2O. Схема механизма, соответствующая уравнению и подтвержденная независимым исследованием равновесий в этой системе, включает стадии Механизм лимитирующей стадии и механизм стадии до сих пор являются предметом дискуссий. Для расчетов промышленного реактора в случае системы PdCl2-CuCl2 в условиях постоянной концентрации HCl по длине трубчатого реактора (труба в трубе) используют несколько измененное уравнение, найденное экспериментально на основе уравнения. Скорость накопления ацетальдегида (САА) или исчезновения этилена вдоль трубы длиной l описывают уравнением . где d – внутренний диаметр трубы, м; Vсм – объем смеси этилена и раствора, поступающего в трубу, Vсм 0.5 м3/сек; [С2Н4]l – концентрация этилена вдоль трубы в молях на м3, рассчитываемая по найденной зависимости [С2Н4]l = f (T, P) , где , см – плотность смеси в кг/м3; , P0 – общее давление смеси, P – понижение давления по длине трубы; l – длина трубы. Термическое окисление органического и нефтехимического синтеза Термическое окисление органического и нефтехимического синтеза является процессом, при котором органические соединения подвергаются окислению при высоких температурах. Этот процесс может происходить как 4. 12 естественным образом, например, при сжигании топлива, так и при проведении промышленных химических реакций. Окисление органических соединений происходит путем реакции с молекулярным кислородом. В процессе окисления происходит разрыв химических связей и образуются новые связи. В результате этого процесса образуются окисленные продукты, которые могут быть более стабильными или менее стабильными, чем исходные соединения. Нефтехимический синтез, как следует из названия, основан на использовании нефти и ее продуктов при синтезе различных органических соединений. Термическое окисление в нефтехимическом синтезе может использоваться для получения различных продуктов, таких как пластик, каучук, синтетические волокна и другие полимеры. Процесс окисления может происходить в присутствии катализаторов, которые ускоряют химическую реакцию и повышают выход целевых продуктов. Кроме того, могут быть использованы различные методы управления процессом окисления, такие как изменение давления, температуры, времени реакции и состава смеси реагентов. Окисление органических соединений играет важную роль в различных отраслях промышленности. В процессе сжигания топлива окисляются углеводороды, освобождая энергию, которая затем используется для привода двигателей и генерации электричества. Окисление также используется при производстве различных химических соединений, таких как алкоголи, кислоты, эфиры и многие другие. Термическое окисление органического и нефтехимического синтеза имеет как положительные, так и отрицательные аспекты. С одной стороны, это позволяет получать различные полезные продукты и энергию. С другой стороны, процесс окисления может приводить к образованию вредных соединений, таких как оксиды азота и серы, озон и тяжелые металлы. Эти вещества являются серьезными загрязнителями атмосферы и влияют на здоровье людей и окружающую среду. Для уменьшения негативного воздействия термического окисления на окружающую среду и здоровье людей, применяются различные методы очистки и улавливания выбросов. Также в настоящее время активно исследуются и разрабатываются новые способы синтеза органических соединений с использованием менее вредных процессов. Каталитическое окисление органического и нефтехимического синтеза Каталитическое окисление органического и нефтехимического синтеза это процесс, при котором органические молекулы или нефтехимические соединения претерпевают окисление при наличии катализатора. Катализаторы могут быть различными металлами, оксидами или другими соединениями, 5. 13 которые активируют реагенты и позволяют им протекать более эффективно и селективно. Процесс каталитического окисления органического синтеза особенно важен в химической промышленности, поскольку позволяет получать большое количество продуктов с высокой степенью очистки. Органические реакции, такие как окисление алканов, алкенов или ароматических соединений, могут протекать достаточно медленно без катализаторов. Однако, каталитическое окисление позволяет значительно ускорить реакцию и повысить ее степень селективности, т.е. образования целевого продукта. Нефтехимический синтез включает в себя превращение нефтепродуктов (например, нефти, газа или тяжелых фракций) в различные химические соединения, такие как пластик, резина, синтетические масла и т.д. При этом процессе каталитическое окисление играет важную роль в преобразовании углеводородов, содержащихся в нефтехимических сырьях. Примеры каталитического окисления в органическом синтезе: ● Каталитическое окисление алканов. Например, метан может быть окислен до метанола с помощью катализатора на основе меди. ● Каталитическое окисление алкенов. Например, этилен может быть превращен в этанол с использованием катализатора на основе платины. ● Каталитическое окисление ароматических соединений. Например, толуол может быть окислен до бензальдегида с помощью катализатора на основе марганца. Примеры каталитического окисления в нефтехимическом синтезе: ● Преобразование нефти в пластик. Катализаторы на основе никеля или платины могут использоваться для преобразования нефти в полимеры, такие как полиэтилен или полипропилен. ● Производство синтетических масел. Катализаторы на основе кобальта или бора могут помочь преобразовать нефтяные фракции в синтетические масла с определенными свойствами, такими как вязкость или температурная стабильность. ● Производство синтетической резины. Катализаторы на основе циркония или ванадия могут использоваться для преобразования нефтяных фракций в резину, которая может быть использована для производства шин, прокладок и других резин Электрохимическое окисление органического и нефтехимического синтеза Электрохимическое окисление в органическом и нефтехимическом синтезе - это процесс, в котором органические и нефтепродукты подвергаются окислению при воздействии электрического тока. Этот метод получения продуктов имеет ряд преимуществ, таких как высокая степень чистоты продукта, экономичность и возможность использования более экологически чистых реагентов. В органическом синтезе электрохимическое окисление можно использовать для получения различных органических соединений. Например, 6. 14 электрохимическое окисление может быть использовано для функционализации алкенов и алкинов, предоставляя более сложные и полезные органические соединения. Один из примеров такого процесса - анодное ацетиленование, при котором ацетилен превращается в ацетонитрил при помощи электрического тока и цианида аммония. Также, электрохимическое окисление может быть использовано для полимеризации органических соединений. Это позволяет получать полиэлектролиты, которые могут использоваться в различных областях, включая медицину, электронику и электротехнику. В нефтехимическом синтезе электрохимическое окисление может использоваться для получения различных нефтепродуктов. Одним из примеров является процесс электрической дегидрогенации, при котором алканы превращаются в алкены. Этот процесс позволяет получать более ценные нефти и нефтепродукты, такие как бензол и толуол. Электрохимическое окисление также может быть использовано для удаления загрязнений из нефтехимических процессов. Например, электролиз воды может быть использован для удаления серы и сульфидов из сырой нефти, что позволяет улучшить качество и чистоту продукта. В целом, электрохимическое окисление органического и нефтехимического синтеза представляет собой важный метод получения органических соединений и нефтепродуктов. Он имеет множество преимуществ, высокую степень чистоты продуктов, экономичность и возможность использования экологически чистых реагентов. Этот метод широко используется в различных отраслях промышленности и имеет большой потенциал для дальнейшего развития и оптимизации. Использование различных методов окисления органического и нефтехимического синтеза Использование различных методов окисления органического и нефтехимического синтеза является важной частью химической промышленности и исследований в области химии. Окисление - это процесс, при котором вещество теряет электроны или получает кислород. В органическом синтезе окисление может приводить к образованию новых функциональных групп, изменению структуры молекулы или созданию новых соединений. Процессы окисления имеют множество применений, включая производство лекарств, пластмасс, напитков, косметики и многое другое. Один из наиболее распространенных методов окисления в органическом синтезе - использование окислителей. Окислители - это вещества, которые приводят к окислению другого вещества. Некоторые из наиболее часто используемых окислителей включают кислород (O2), хлор (Cl2), бром (Br2), пероксиды, калий перманганат и калий дихромат. Пероксиды, такие как перекись водорода (H2O2) или пероксид карбамид (CH6N2O3), широко используются в химической промышленности для окисления органических соединений. Они могут быть использованы для окисления алканов, алкенов, алкинов, алкоголей, карбонильных соединений, 7. 15 аминов и многих других органических соединений. Окисление их пероксидами может привести к образованию перекисей, кислот, кетонов или альдегидов, в зависимости от спецификации реакции. Другой метод окисления органических соединений - использование кислорода (O2). Этот метод широко применяется в нефтеперерабатывающей промышленности для производства различных видов топлива и химических веществ. Окисление органических соединений кислородом обычно происходит в присутствии катализаторов, таких как платина, палладий или ясень. Кислород может окислить алкены, алканы, ароматические соединения и другие органические вещества, образуя соответствующие оксиды. Окисление органических соединений может быть также выполнено с использованием хлора (Cl2) или брома (Br2). Эти галогены могут быть использованы для окисления органических соединений и образования галогеносодержащих продуктов. Например, хлор может окислить алкены, алканы и ароматические соединения, образуя хлорированные аналоги. Бром, с другой стороны, может быть использован для окисления ароматических соединений, образуя бромированные аналоги. Другими методами окисления органических соединений являются окисление с использованием пероксидов и хроматов. Выбор условий окисления органического и нефтехимического синтеза Выбор условий окисления в органическом и нефтехимическом синтезе является важным этапом в процессе получения различных продуктов. Условия окисления включают в себя температуру, давление, концентрацию окислителя и другие параметры. Температура является одним из ключевых параметров окисления, так как она влияет на скорость и степень окисления. При повышении температуры увеличивается скорость реакции окисления, что может привести к получению более окисленных продуктов. Однако, слишком высокая температура может вызвать побочные реакции и загрязнение продукта. Давление также влияет на процесс окисления, особенно в случае термического окисления. Повышение давления может увеличить степень окисления, но также может вызвать нежелательные побочные реакции. Концентрация окислителя также играет важную роль в процессе окисления. Слишком низкая концентрация может привести к неполному окислению, а слишком высокая концентрация может вызвать образование побочных продуктов. Кроме того, выбор условий окисления зависит от используемого метода окисления. Например, в термическом окислении важны температура и давление, а в каталитическом окислении - тип катализатора и его концентрация. Таким образом, выбор условий окисления в органическом и нефтехимическом синтезе должен быть тщательно продуман и оптимизирован для каждого процесса, чтобы получить желаемый продукт с максимальной эффективностью и качеством. 8. 16 17 Типовые схемы процессов окисления органического и нефтехимического синтеза На рис. 9.1, показан тип непрерывно действующего реактор окислениятарельчатая колонна. В ней жидкость, перетекает сверху вниз с одной тарелки на другую, а воздух движется противотоком - снизу вверх. Во всех реакторах периодического и непрерывного действия режим окисления регулируют, изменяя скорость подачи газа- окислителя и исходного органического реагента. Температуру изменяют обычно в нескольких точках по высоте реактора; реакционную массу периодически анализируют. При жидкофазном окислении необходимо исключить образование· взрывоопасных смесей в местах, где имеется сплошная активная фаза (т. е. в верхней части барботажных колонн и в пространстве над каждой тарелкой в реакторе типа рис. 9.1. Это достигается высокой степенью конверсии кислорода в совакупности с выбором давления в зависимости от летучести исходного органического вещества. Иногда в пространство над жидкостью предусмотрена подача азота. Тем не менее пожаро-взрывоопасность рассматриваемых производств (за исключением окисления твердого парафина) достаточно велики, и эти производства должны быть снабжены самыми современными средствами предупреждения, локализации и тушения пожаров. 9. Рис 9.1 - Реакционные узлы для жидкофазного окисления молекулярным кислородом 18 Технология получения фенола и ацетона кумольным методом. Производство фенола и ацетона кумольным методом включает стадии получения изопропилбензола (глава 4), синтез гидро­пероксида изопропилбензола и его кислотного разложения в фенол и ацетон. Технологическая схема двух последних стадий изображена на рис. 9.2. Окисление проводится в тарельчатой реакционной колонне 1, снабженной холодильниками: при их помощи под­держивают температуру жидкости от 120 °С на верхней тарелке до 105 °С в кубе. Воздух, предварительно очищенный от загрязнений и механических примесей и подогретый, подают в нижнюю часть колонны под давлением ~ 0,4 МПа. Свежий и оборотный изопропилбензол (ИПБ), к которому добавлен гидро­пероксид (ГП), инициирующий начальную стадию окисления, из сборника 5 подают в теплообменник 4, а оттуда на верхнюю тарелку реактора. Воздух движется противотоком к жидкости, барботируя через нее на тарелках колонны. При этом он увлекает с собой пары изопропилбензола и летучих побочных про­дуктов (муравьиная кислота, формальдегид), которые конден­сируются в холодильнике 2. Оставшийся воздух выводят в атмосферу, а конденсат отмывают от муравьиной кислоты водным раствором щелочи в промывателе-сепараторе 3. Углеводород­ный слой сливают в сборник 5, а водный слой рециркулируют нa промывку, сбрасывая в конечном сете в канализацию. Рис 9.2 - Технологическая схема кумольного метода получения фенола и ацетона 19 Схема процесса изображена на рис. 9.3. Свежий парафин и продукт со стадии разделения (так называемые неомыляемые-I) " отношении 1 : 2, а также катализатор смешивают в аппарате 1. Шихту подают на окисление в колонну 2, работающую периодически. Она выполнена из алюминия или легированной стали, имеет рубашку для подогрева или охлаждения, выносной холодильник для отвода тепла и распределительное устройство для ввода воздуха. Газ с верха колонны промывают водой в колонне 3 для поглощения низших кислот, очищают от примесей дожиганием в печи 4 и выбрасывают в атмосферу. Рис 9.3 - Технологическая схема окисления твердого парафина 20 Упрощенная схема процесса изображена на рис. 9.4. Окисление ведут в каскаде барботажных колонн 1 с последователь­ным перетоком жидкости и подачей воздуха в каждую колонну. Тепло реакции снимается за счет испарения избыточного циклогексана, который конденсируется в общем для всех колонн холодильнике 2, отделяется от газа в сепараторе 3 и поступает в линию оборотного циклогексана. Оксидат из последней ко­лонны промывают водой (для выделения низших кислот) в смесителе 4 и отделяют от водного слоя в сепараторе 5. Затем из оксидата в колонне 6 отгоняют основную массу циклогексана, оставляя в кубе такое ого количество, чтобы концентрация гидпорпероксида не превысила безопасного уровня (3-4 % ). Кубовую жидкость обрабатывают, затем при нагревании в каскаде аппаратов 7 с мешалками (на рисунке изображен один) вод-ным раствором щелочи. При этом происходит омыление сложных эфиров и лактонов, а также разложение гидропероксида. Органический слой отделяют от водного в сепараторе 8 и отгоняют от него циклогексан в колонне 9. Циклогексан из колонн 6 и 9, и из сепаратора 3 возвращают на окисление. Кубовая жидкость колонны 9 содержит циклогексанол, циклогексанон и нейтральные побочные продукты. Из них в колонне 10 отгоняют циклогексанон, а в колонне 11 циклогексанонне. Если целевым продуктом является только циклогексанон, необходимо дополнить схему установкой дегидрирования циклогексанола. Рис 9.4 - Технологическая схема окисления циклогексана в смесь анола и анона 21 Окисление бензина проводят термически или с катализатором при 170-200 °С и 5 МПа. Поскольку целевые продукты стабильны к дальнейшему окислению, реактором служит простая барботажная колонна, причем выделяющееся тепло отводят за счет испарения бензина и нейтральных продуктов окисления (рис. 9.5). Реакционная смесь попадает в колонну 2, где отгоняются непревращенный бензин и нейтральные вещества, возвращаемые в реактор. Кубовую жидкость из этой колонны направляют на выделение кислот. Успех описываемого процесса был обусловлен не только упрощением стадии разделения продуктов, но и эффективной систе­мой утилизации энергии. Остаточный воздух вместе с парами органических веществ с верха реактора поступает в парогенератор 3, где генерируется пар соответствующего давления. Тепло газа используют затем в теплообменнике 4 для нагревания воды, а давление газа в детандере 6 преобразуют в холод, при помощи которого в холодильнике 5 из газа конденсируют остатки унесенного им бензина. Объединенный конденсат возвращают в колонну окисления. Рис 9.5 - Схема окисления легкой фрак­ции прямогонного бензина 22 С учетом всех этих соображений был разработан процесс жидкофазного каталитического окисления парафина со следующими показателями: степень конверсии парафина не более : 30-35 % (что соответствует кислотному числу ~ 70 мг КОН на гоксидата); в начале процесса, когда карбоновые кислоты только начинают накапливаться, поддерживают температуру l25 -130 °С, а затем ее снижают ДО 105-110 °С; окисление пpoводят при атмосферном давлении, вводя воздух в реакцион- 11ую 6арботажную колонну через распределительные устройства с большим числом довольно мелких отверстий ( 1-2 мм). Применение более чем двукратного избытка воздуха способствует интенсивной турбулизации реакционной массы. При этих условиях и с указанными ранее количествами марганцевого катализатора окисление парафина ведут в течение 15-20 ч. Схема процесса изображена на рис. 9.6 Свежий парафин и продукт со стадии разделения (так называемые неомыляемые-1) в отношении 1 : 2, а также катализатор смешивают в аппарате 1. Шихту подают на окисление в колонну 2, работающую периодически. Она выполнена из алюминия или легированной стали, имеет рубашку для подогрева или охлаждения, выносной холодильник для отвода тепла и распределительное устройство для ввода воздуха. Газ с верха колонны промывают водой в колонне 3 для поглощения низших кислот, очищают от примесей дожиганием в печи 4 и выбрасывают в атмосферу. Рис 9.6 - Технологическая схема окисления твердого парафина 23 Упрощенная схема процесса изображена на рис. 9.7. Окисление ведут в каскаде барботажных колонн 1 с последовательным перетоком жидкости и подачей воздуха в каждую колонну. Тепло реакции снимается за счет испарения избыточного циклогексана, который конденсируется в общем для всех колонн холодильнике 2, отделяется от газа в сепараторе 3 и поступает в линию оборотного циклогексана. Оксидат из последней колонны промывают водой (для выделения низших кислот) в смесителе 4 и отделяют от водного слоя в сепараторе 5. Затем из оксидата в колонне 6 отгоняют основную массу циклогексана, оставляя в кубе такое ого количество, чтобы концентрация гидропероксида не превысила безопасного уровня (3-4 %) . Кубовую жидкость обрабатывают затем при нагревании в каскаде аппаратов 7 с мешалками (на рисунке изображен один) водным раствором щелочи. При этом происходит омыление сложных эфиров и лактонов, а также разложение гидропероксида. Органический слой отделяют от водного в сепараторе 8 и отгоняют от него циклогексан в колонне 9. Циклогексан из колонны, и 9 и из сепаратора 3 возвращают на окисление. Рис 9.7 - Технологическая схема окисления циклогексана в смесь анола и анона 24 Технологическая схема термического окисления циклододексина в присутствии борной кислоты изображена на рис. 9.8. Борная кислота и циклододекан поступают в смеситель 1, где готовят суспензию этих веществ. Она стекает в колонну 2, в которой при 150-200 °С ведут окисление воздухом, обедненчым кислородом за счет циркуляции части отходящего газа после хо­лодильника 3. Оксидат поступает на отгонку непревращенного углеводорода в колонну 4, в кубе которой остаются эфиры бор­ной кислоты, кетон и побочные продукты окисления. Их перекачивают в гидролизер 5, где при подаче воды и перемешива­нии происходит гидролиз эфиров борной кислоты. В сепараторе б отделяют органический слой от водного и направляют на ректификацию с выделением спирта, кетона и тяжелого остатка. Водный слой подвергают переработке с целью регенерации Н3ВО3 (на схеме не изображено): упаривают, кристаллизуют и отфильтровывают НзВОз, возвращая ее в аппарат 1. Недостатком этого процесса является наличие дополнитель­ных установок по рециркуляции борной кислоты; она находится в твердом состоянии, и это затрудняет транспортирование по­токов и непрерывное осуществление процесса. Однако этот про­цесс реализован за рубежом и для окисления циклогексана. Рис 9.8 - Технологическая схема окисления циклододекана в присутствии борной кислоты. 25 Технологическая схема производства диметилтерефталата изображена на рис. 9.9. Окисление смеси n-ксилола и метил-n­полуилата (в отношении 1 : 2) проводится в барботажной колонне 1 с охлаждающими змеевиками при 140-180 °С и 0,6-1 МПа. Воздух, предварительно очищенный от примесей и сжатый до рабочего давления, подают в нижнюю часть колонны 1 через распределительную трубу. Барботируя через реакционную массу, он захватывает пары ксилола, которые конденсируются и холодильнике 2, и конденсат возвращается на окисление. Остатки ксилола из отходящего воздуха улавливают активным углем (на схеме не показано). В периодическом процессе окисление заканчивают при остаточной концентрации пксилола в реакционной массе 1 % и степени конверсии метил-n-толуилата ~ 50 % . Оксидат содержит 20-25 % n-толуиловой кислоты, 30 % ее метилового эфира, 11-15 % терефталевой кислоты, 20-25 % ее моноэфира, а также небольшие количества диметилтерефталата и смолистых примесей. Из-за наличия в 11сходном п-ксилоле примесей его изомеров и этилбензола в оксидате появляются фталевая, изофталевая и бензойная кис­,110 1 ы и их эфиры. Рис 9.9 - Технологическая схема производства диметилтерефталата 26 На рис. 9.10 изображена схема одностадийного получения терефталевой кислоты окислением п-ксилола. В реактор 1 подают п-ксилол, воздух, рециркулирующую уксусную кислоту и катализатор (потери двух последних компонентов восполняют, подавая свежий раствор катализатора в уксусной кислоте, что на схеме не изображено). Реакционное тепло отводят за счет испарения уксусной кислоты и воды, пары которых конденсируются в холодильнике 2. Конденсат отделяют от воздуха в сепараторе 3 и возвращают в реактор. Реакционная масса представляет собой суспензию терефталевой кислоты в растворителе. Эту суспензию фильтруют в центрифуге (или на фильтре) 4, на которой терефталевую кислоту промывают свежей уксусной кислотой и направляют на очистку. От фильтрата отгоняют воду в ректификационной колонне 5; из клуба уксусная кислота с растворенным в ней катализатором возвращается в реактор 1. В кислоте при многократной циркуляции накапливаются смолистые примеси, поэтому часть кислоты отводят в колонну 6 для регенерации. Уксусная кислота отгоняется от тяжелого остатка и возвращается в цикл. Остаток сжигают или регенерируют из него кобальт. Рис 9.10 - Технологическая схема одностадийного синтеза терефталевой кислоты 27 Заключение Таким образом, технология процессов окисления органического и нефтехимического синтеза имеет огромный потенциал для развития и применения в различных отраслях промышленности. Она обеспечивает эффективное использование сырьевых материалов, а также снижает вредные выбросы и негативное воздействие на окружающую среду. Благодаря современным технологиям и постоянным исследованиям, процессы окисления становятся более эффективными, экологически безопасными и экономически выгодными. Это делает их важным компонентом в развитии современной индустрии и способствует улучшению качества жизни людей. 28 Список использованных источников 1. Реакции окисления в промышленном органическом и нефтехимическом синтезе.doc [Электронный ресурс]: Режим доступа: https://studfile.net/preview/2455490/#2 (дата обращения: неограниченно). 2. Химия и технология основного органического и нефтехимического синтеза Лебедев Н.Н [Электронный ресурс]: Режим доступа: https://djvu.online/file/ORvRriTq9tmaO (дата обращения: неограниченно). 29