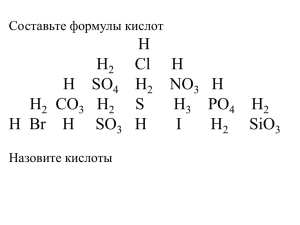
КИСЛОТЫ 1. ИЗ ПЕРЕЧИСЛЕННЫХ ФОРМУЛ ВЫПИШИТЕ И НАЗОВИТЕ ФОРМУЛЫ КИСЛОТ NaOH, H2SO4, P2O5, HNO2, HNO3, K2CO3, Ca3(PO4)2, H2SO3, H2O, HCl ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ (СТР. 155 № 3) 1 группа 2 группа 3 группа Изменение окраски индикаторов при действии растворов кислот Взаимодействие кислот с металлами Взаимодействие кислот с оксидами металлов 4 группа 5 группа 6 группа Взаимодействие кислот с растворимыми основаниями (щелочами) Взаимодействие кислот с нерастворимыми основаниями Взаимодействие кислот с солями 1. ИЗМЕНЕНИЕ ОКРАСКИ ИНДИКАТОРОВ ПРИ ДЕЙСТВИИ РАСТВОРОВ КИСЛОТ Название индикатора Окраска индикатора в кислотной среде Лакмус Красная Метиловый оранжевый Фенолфталеин Красно-розовая Бесцветная 2. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ H2SO4 + Zn = ZnSO4 + H2 H2SO4 + Cu = Кислота + металл = соль + Н2 3. ВЗАИМОДЕЙСТВИЕ С ОКСИДАМИ МЕТАЛЛОВ t H2SO4 + CuO = CuSO4 + H2O Кислота + оксид = соль + вода металла 4. ВЗАИМОДЕЙСТВИЕ С РАСТВОРИМЫМИ ОСНОВАНИЯМИ (ЩЕЛОЧАМИ) (РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ) H2SO4 + 2NaOH = Na2SO4 + 2H2O Кислота + щелочь = соль + вода 5. ВЗАИМОДЕЙСТВИЕ С НЕРАСТВОРИМЫМИ ОСНОВАНИЯМИ H2SO4 + Сu(OH)2 = CuSO4 + 2H2O Кислота + нерастворимое = соль + вода основание 6. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ H2SO4 + BaCl2 = BaSO4 + 2HCl H2SO4 + Na2CO3 = Na2SO4 + CO2 +H2O Кислота + соль = новая + новая кислота соль ТЕСТ 1. Выберите металл, который вступает во взаимодействие с соляной кислотой: а) золото; б) медь; в) магний; г)ртуть 2. Лакмус в растворе серной кислоты приобретает окраску: а) синию; б) красную; в) малиновую; г) желтую 3. В реакцию с раствором серной кислоты вступает оксид: а) SO3; б) СO; в) P2O5; г) MgO 4. При взаимодействии кислоты с солью образуется: а) новая кислота + новая соль; б) соль + вода; в) соль + водород; г) соль 5. При взаимодействии соляной кислоты с цинком образуется: а)ZnCl2 + H2; б) ZnCl2 + H2O; в) ZnCl2 ТЕСТ (ОТВЕТЫ) Критерии оценивания: «5» - 0 ошибок «4» - 1 ошибка «3» - 2 ошибки 1 –в 2–б 3–г 4–а 5–а ДОМАШНЕЕ ЗАДАНИЕ 1. 2. п.39, №4 (п) Сообщение «Применение кислот в быту» НАПИШИТЕ УРАВНЕНИЯ РЕАКЦИЙ: ПРОДОЛЖИТЕ ПРЕДЛОЖЕНИЕ: - На уроке я работал… - Своей работой на уроке я… - Урок для меня показался… - За урок я… - Мое настроение… - Материал урока мне был… 2. ИЗ ВЫБРАННЫХ ФОРМУЛ КИСЛОТ ВЫПИШИТЕ ФОРМУЛЫ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ И НАПИШИТЕ УРАВНЕНИЯ ИХ ДИССОЦИАЦИИ H2SO4, HNO2, HNO3, H2SO3, HCl 3. В КАЖДОМ РЯДУ ВЫБЕРИТЕ ЛИШНЮЮ ФОРМУЛУ (ОБЪЯСНИТЕ СВОЙ ВЫБОР) 1. H3PO4, HCl, H2SO4 2. H2CO3, H2S, HNO3 3. H2SiO3, H2SO3, HNO2 4. ДАЙТЕ ХАРАКТЕРИСТИКУ СЕРНОЙ КИСЛОТЕ, ИСПОЛЬЗУЯ РАЗЛИЧНЫЕ ПРИЗНАКИ КЛАССИФИКАЦИИ КИСЛОТ