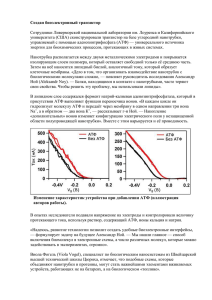
1 комплекс. НАДН-КоQ-оксидоредуктаза Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 42 белковых молекулы, из них не менее 6 железосерных белков. Функция 1-й Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). 2-й Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 2 комплекс. ФАД-зависимые дегидрогеназы Данный комплекс как таковой не существует, его выделение условно. К нему относятся ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (βокисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса атомов водорода). Функция 1-й Восстановление ФАД в окислительно-восстановительных реакциях. 2-й Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q (убихинон). 3 комплекс. КоQ-цитохром c-оксидоредуктаза По другому данный комплекс называется цитохром с редуктаза. В его составе имеются молекулы цитохрома b и цитохрома c1, железо-серные белки. Комплекс представляет собой 2 мономера, в каждом из которых насчитывается 11 полипептидных цепей. Функция 1-й Принимает электроны от коэнзима Q и передает их на цитохром с. 2-й Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Имеются разногласия по поводу количества переносимых ионов H+ при участии 3-го и 4-го комплексов. По одним данным, третий комплекс переносит 2 иона H+ и четвертый комплекс переносит 4 иона H+. По другим авторам, наоборот, третий комплекс переносит 4 иона H+ и четвертый комплекс переносит 2 иона H+. 4 комплекс. Цитохром с-кислород-оксидоредуктаза В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, состоит из 13 субъединиц. В комплексе имеются ионы меди, соединенные с белками комплекса через HS-группы цистеина, и формирующие центры, подобные тем, что имеются в железо-серных белках. Функция 1-й Принимает электроны от цитохрома с и передает их на кислород с образованием воды. 2-й Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 5 комплекс Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы: одна группа формирует субъединицу FО (произносится со звуком "о", а не "ноль" т.к олигомицинчувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ. По дыхательной цепи от окисляемого субстрата до кислорода передается 2 протона и два электрона. Коферменты дыхательной цепи принимая протоны и электроны превращаются в восстановленную форму, а отдавая их снова превращается в окисленную форму. Движущей силой, обеспечивающей перенос протонов и электронов от субстрата к кислороду, является разность редокс-потенциалов. В дыхательной цепи происходит нарастание редокс-потенциала (от –0,32 в до +0,81 в О2) Для синтеза одной макроэргической связи АТФ требуется перепад редокс-потенциалов между участками дыхательной цепи примерно в 0,22 в на пару перенесенных электронов. Длина дыхательной цепи (количество ферментов) может быть различна и зависит от природы окисляемого субстрата. Для клетки важно, чтобы молекула кислорода, присоединив 4 электрона, полностью восстановилась до двух молекул воды. При неполном восстановлении кислорода в случае присоединения двух электронов образуется перекись водорода, а в случае присоединения одного электрона – супероксидный радикал . Перекись водорода и супероксидный радикал токсичны для клетки, т.к. повреждают клеточные мембраны, взаимодействую с остатками ненасыщенных жирных кислот мембранных липидов. Аэробные клетки защищают себя от действия перекиси и супероксида с помощью двух ферментов: супероксиддисмутазы и каталазы. Пути использования энергии переноса электронов. При переносе пары электронов происходит изменение свободной энергии и эта энергия используется по двум путям: 1-й Энергия переноса электронов используется на синтез АТФ. 1-й Энергия переноса электронов используется для выработки тепла. При переносе пары электронов по дыхательной цепи происходит изменение свободной энергии, равная 52,6 ккал. Этой энергии достаточно для синтеза 3 молекул АТФ. Синтез трех молекул АТФ в стандартных условиях требует затраты ккал. В трех пунктах переноса электронов происходит наибольшее изменение свободной энергии и эти пункты называются пунктами сопряжения тканевого дыхания и окислительного фосфорилирования. Механизм окислительного фосфорилирования На основании строения и функций компонентов дыхательной цепи предложен механизм окислительного фосфорилирования: 1. Ферменты дыхательной цепи расположены в строго определенной последовательности: каждый последующий белок обладает большим сродством к электронам, чем предыдущий (он более электроположителен, т.е. обладает более положительным окислительно-восстановительным потенциалом). Это обеспечивает однонаправленное движение электронов. 2. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2. Строение дыхательной цепи и механизм окислительного фосфорилирования 3. Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную ферментативную цепь, по которой электроны движутся (50-200 шт/сек) к своему конечному акцептору – кислороду. В результате образуется вода. 4. Поступающие в дыхательную цепь электроны богаты свободной энергией. По мере их продвижения по цепи они теряют энергию. Часть энергии электронов используется I, III, IV комплексами дыхательных ферментов для перемещения ионов водорода через мембрану в межмембранное пространство. Другая часть рассеивается в виде тепла. Упрощенно сказанное можно представить в виде равенства: 5. Перенос ионов водорода через мембрану (выкачивание) происходит не случайно, а в строго определенных участках мембраны. Эти участки называются участки сопряжения (или, не совсем точно, пункты фосфорилирования). Они представлены I, III, IV комплексами дыхательных ферментов. В результате работы этих комплексов формируется градиент ионов водорода между внутренней и наружной поверхностями внутренней митохондриальной мембраны. Такой градиент обладает потенциальной энергией. Градиент (Δμ, "дельта мю") получил название электрохимический градиент или протонный градиент. Он имеет две составляющие – электрическую (ΔΨ, "дельта пси") и концентрационную (ΔрН): Δμ = ΔΨ + ΔрН Название "участки сопряжения" возникло из-за того, что появление протонного градиента в результате окислительных процессов обеспечивает в дальнейшем фосфорилирование АДФ до АТФ (см п.п.6). Именно благодаря этим трем ферментным комплексам энергия реакций окисления может передаваться на фосфорилирование, т.е. существует сопряжение (связывание) двух процессов. 6. Как завершение всех предыдущих событий и необходимый их результат происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу (Н+-транспортирующая АТФ-аза, КФ 3.6.3.14.). Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла: Моносахариды всасываются эпителиальными клетками тощей и подвздошной кишок. Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться путём диффузии (рибоза, ксилоза, арабиноза), облегчённой диффузии с помощью белков переносчиков (фруктоза, галактоза, глюкоза), и путем вторично-активного транспорта (галактоза, глюкоза). Вторично-активный транспорт галактозы и глюкозы из просвета кишечника в энтероцит осуществляется симпортом с Na+. Через белок-переносчик Na+ двигается по градиенту своей концентрации и переносит с собой углеводы против их градиента концентраций. Градиент концентрации Na+ создаётся Nа+/К+-АТФазой. При низкой концентрации глюкозы в просвете кишечника она транспортируется в энтероцит только активным транспортом, при высокой концентрации - активным транспортом и облегчённой диффузией. Скорость всасывания: галактоза > глюкоза > фруктоза > другие моносахариды. Моносахариды выходят из энтероцитов в направлении кровеносного капилляра с помощью облегченной диффузии через белки-переносчики. На первом, окислительном, этапе глюкозо-6-фосфат в трех реакциях превращается в рибулозо-5фосфат, реакции сопровождаются восстановлением двух молекул НАДФ до НАДФН. На этом этапе происходит регуляция процесса: инсулин повышает активность глюкозо-6-фосфат-дегидрогеназы и фосфоглюконат-дегидрогеназы. Второй этап – этап структурных перестроек, благодаря которым пентозы способны возвращаться в фонд гексоз. В этих реакциях молекулы рибулозо-5-фосфата изомеризуются до рибозо-5-фосфата и ксилулозо-5-фосфата. Далее под влиянием ферментов транскетолазы и трансальдолазы происходят структурные перестройки с образованием других моносахаридов. При реализации всех реакций второго этапа пентозы превращаются во фруктозо-6-фосфат и глицеральдегид-3-фосфат, т.е. возвращаются в реакции гликолиза. Поэтому иногда пентозофосфатный путь называют шунтом, т.е. рассматривают как обходной путь окисления глюкозы. Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может либо "проваливаться" во 2-й этап гликолиза, либо через диоксиацетонфосфат восстанавливаться до глицерол-3-фосфата и далее направляться в синтез фосфатидной кислоты и далее триацилглицеролов, либо при необходимости из него могут образоваться и гексозы.