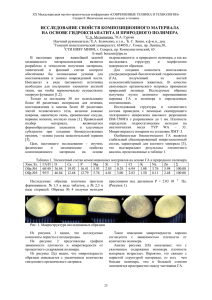
Выполнила: студентка гр. ТХВ-1 Дробот Ангелина -Структура полимеров определяется совокупностью свойств макромолекул и способом их упаковки в полимерном теле. -- Переработка полимеров может происходить путем перевода их в высокоэластическое или вязкотекучее состояние. Суть данного процесса в придании определенных свойств при формовании полимерного материала. -- Одним из способов получения вязкотекучего состояние полимера является растворение. Это следствие высокой молекулярной массы полимера и образование молекулярных клубков. Набухание – процесс поглощения полимером низкомолекулярных веществ (жидкостей). Существует параметр, которых может охарактеризовать это процесс – степень набухания Q ( 𝑄 = 𝑚−𝑚0 𝑚0 = 𝑣−𝑣0 ). 𝑣0 Особенностью растворения полимеров является набухание, предшествующее растворению. Рис. 1. Кинетика набухания: 1 – неограниченное набухание или с невысокой молекулярной массой; 2 – с высокой молекулярной массой или разветленные: 3 – ограниченное набухание с высокой молекулярной массой и сильным межмолекулярным взаимодействием. Условное обозначение набухшего клубка (а), идеального (б) и глобулы (в). Ограниченное набухание Неограниченное набухание ограниченное это набухание – процесс взаимодействия полимеров с низкомолекулярными жидкостями, ограниченный только стадией их поглощения полимером Ограниченное набухание заканчивается первой стадией, самопроизвольного растворения полимера не происходит, так как цепи не могут быть полностью отдалены друг от друга образуется две сосуществующие фазы. Более распространенным для полимеров является ограниченное набухание набухание, самопроизвольно переходящее в растворение. аналогично неограниченному смешиванию жидкостей Первая стадия: Вторая стадия: проникновение молекул растворителя дальнейшее в фазу полимера, сопровождающееся сольватацией макромолекул. В ходе этой стадии набухания выделяется энергия в форме теплоты В ходе этой стадии набухания выделяется энергия в форме теплоты: (∆𝐻𝐻 < 0), а ∆𝑆𝐻 ≈ 0 (или даже ∆𝑆𝐻 < 0 ). Но при этом |∆𝐻𝐻 | > |𝑇∆𝑆𝐻 | и |∆𝐺𝐻 | < 0. ∆𝐺𝐻 ≈ 𝑇∆𝑆𝐻 < 0 односторонняя диффузия молекул растворителя в объем полимера поглощение растворителя полимером с увеличением его объёма при этом ∆𝐻𝐻 ≈ 0 , а ∆𝑆𝐻 > 0 . ∆𝐺𝐻 ≈ 𝑇∆𝑆𝐻 < 0. медленная диффузия макромолекул в объем растворителя. Способность полимеров растворяться или набухать обусловлена многими факторами: - химической природой полимера и растворителя - молекулярной массой полимера - гибкостью цепи полимера - плотностью упаковки макромолекул - фазовым состоянием полимера - неоднородностью химического состава цепи; - температурой; - надмолекулярная структура полимера/ Фазовые диаграммы состояние растворов полимеров состав – температура: а: ΔHсм > 0, ΔSсм > 0; б: ΔHсм > 0, ΔSсм < 0; в: ΔHсм < 0, ΔSсм < 0; 1 - бинодаль; 2 - спинодаль; I - двухфазная область; II - однофазная (гомогенная) область; III метастабильная область Предельная растворимость может быть достигнута путем изменения температуры и состава раствора полимера. При изменении их возможно помутнение раствора. Температура, при которой возможно визуально заметить начало помутнение раствора, называется температурой осаждения Т0. Расчет параметров растворимости Для расчета параметра растворимости полимеров существуют два более распространённых способа: • Расчет параметров растворимости по Гильдебранду-Смоллу • Расчет параметров растворимости по Аскадскому С точки зрения термодинамики, существуют «хорошие» и «плохие» растворители. «Хорошие» растворители образуют достаточно мощные сольвативные оболочки вокруг макромолекул, в свою очередь «плохие» наоборот. «Хорошие» растворители увеличивают размеры молекулярных клубков, что способствуют быстрому растворению. в соответствии со вторым законом термодинамики: − ∆𝐺см = ∆𝐻см − 𝑇∆𝑆см При растворении ВМС должны разорваться старые связи и образоваться новые, таким образом, ΔHсм является алгебраической суммой выделившегося и поглощенного при растворении тепла: 𝛥𝐻см = 𝛥𝐻п−п + 𝛥𝐻р−р − 𝛥𝐻п−р где ΔHп-п и ΔHр-р - изменение энтальпии при разрыве молекулярных связей соответственно в полимере и в растворителе; ΔHп-р - изменение энтальпии при взаимодействии полимера с растворителем. Энтальпия смешения определяется по уравнению : 𝛥𝐻см = 𝑉см 𝛥Е1 𝑉𝑝 1 2 𝛥𝐸2 − 𝑉п 1 2 2 𝑣р ∗ 𝑣п где ΔЕ1 и ΔE2 - энергии испарения растворителя и разрыва межмолекулярных связей соответственно; Vсм - общий объем смеси; Vp и Vп - мольные объемные доли растворителя и полимера соответственно; vр и vп - объемные доли растворителя и полимера в растворе. Отношение Ei/Vi плотностью энергии когезии и представляет собой меру количества энергии, необходимой для преодоления все межмолекулярных сил в 1 см3 вещества. Корень квадратный из плотности энергии когезии называется параметром растворимости δ: δ = (ΔE/V)1/2 и, следовательно ΔHсм = Vсм (δр- δп)2 vр* vп , где δр и δп - параметры растворимости растворителя и полимера. Математический анализ показывает, что самый подходящий растворитель для данного полимера является тот, параметр растворимости которого максимально близок к параметру самого полимера. Растворение может и не произойти, если разница между параметрами растворителя и полимера будет больше 2,0 в (кал/см3)0,5.В таком случаи свободная энергия будет иметь положительный знак. Величина связана с мольной скрытой теплотой и мольным объемом соотношением 𝛿р = [(𝐿𝑒 − 1 𝑅𝑇)/𝑉см ]2 где Le - скрытая теплота парообразования. Величину δп Смолл предложил вычислять, исходя из так называемых мольных констант взаимодействия (табл. 1.), рассматривая параметр растворимости как аддитивную аддитивную: 𝛿п = 𝛾∗𝜌 п М0 где ∑γ - сумма мольных констант взаимодействия атомных группировок, входящих в элементарное звено; M0 молекулярная масса мономерного звена. Многие волокнообразующие полимеры хороша растворяются в смесях растворителей (ПЭТ в тетрахлорэтане и феноле). Параметры растворимости такого смесевого растворителя рассчитываются на основе принципа аддитивности: 𝛿СМ = Х1 𝑉1 𝛿1 + 𝑋2 𝑉2 𝛿2 𝑋1 𝑉1 + 𝑋2 𝑉2 где Х1 и Х2 - мольные доли компонентов; V1 и V2 мольные объемы компонентов; δ1 и δ2 параметры растворимости компонентов. Таблица 1. Мольные константы взаимодействия различных атомных группировок Коэффициент молекулярной упаковки может быть оценен из соотношения 𝑉𝑖 = 𝛥𝑉𝑖 /К где ΔVi - ван-дер-ваальсовы объемы атомов i-го вида; К - коэффициент упаковки. Для энергии когезии можно аналогично записать, что К∆Е0 = 𝛥Е∗ Здесь ΔЕ* представляет собой энергию когезии жидкости, уменьшенную во столько раз, во сколько ван-дер-ваальсов объем молекулы меньше мольного объема. Значение ΔЕ* величина аддитивная. Поэтому 𝑛 ∆𝐸𝑖∗ 𝛥𝐸 ∗ = 𝑖=1 где ∆𝐸𝑖∗ -- вклад каждого атома и типа межмолекулярного взаимодействия в ΔE*. Тогда 𝛿2 = где NA - число Авогадро. 𝑛 ∗ 𝑖=1 ∆𝐸𝑖 𝑁𝐴 ∆𝑉𝑖 Этот подход к оценке растворимости полимеров заключается в следующем. Структура полимеров определяется на молекулярном уровне конформациями, конфигурацией и способами взаимной упаковки макромолекул. Действующий объем атома каждого вида зависит от его окружения, т.е. от природы валентно-связанных с ним атомов и от коэффициентов упаковки молекул вещества, в которые входит данный атом. Значения ∆𝐸𝑖∗ приведены в табл. 2. Значения ΔVi для некоторых атомов в зависимости от их окружения приведены в Приложении (Мольные объемы различных атомных группировок по Аскадскому). Инкремент объема ΔVi рассматриваемого атома вычисляется как объем сферы этого атома за вычетом объема шаровых сегментов, отсекаемых на этой сфере соседними валентно-связанными атомами, т.е. 4 ∆𝑉𝑖 = 𝜋𝑅 3 − 3 1 𝜋ℎ𝑖2 (3𝑅 − ℎ𝑖 ) 3 где R - ван-дер-ваальсов радиус рассматриваемого атома; Ri - высота сегмента, которая вычисляется по формуле ℎ𝑖 = 𝑅 − (𝑅 2 + 𝑑𝑖2 + 𝑅𝑖2 )/(2𝑑𝑖 ) где di - длина связей между двумя атомами; Ri - ван-дерваальсовы радиусы соседних с рассматриваемыми валентно-связанных атомов. Таблица 2. Значение ΔЕ* для различных видов атомов и типов межмолекулярных взаимодействия