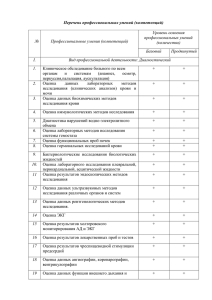
Вариант 14 КРО – 2 (выберите несколько правильных ответов) 1. К основным направлениям государственной регламентации производства и контроля качества лекарственных препаратов относятся: 1. условий изготовления препаратов высокого качества; 2. состав лекарственных препаратов; 3. разработки теоретических основ существующих методов изготовления лекарственных форм; 4. условия, обеспечивающие технику безопасности, охрану труда,соблюдение экологических норм производства; 5. лицензирование фармацевтической деятельности; КРО – 1 (выберите 1 правильный ответ) 2. Государственная система контроля качества, эффективности, безопасности ЛС включает в себя: 1. Федеральный орган контроля качества лекарств. 2. Территориальный орган контроля качества лекарств. 3.Научно-исследовательские институты, лаборатории для разработки, исследований и осуществления государственного контроля качества, эффективности, безопасности ЛС. 4. Экспертные советы по обращению ЛС при Правительстве РФ. 5. Учреждения санитарно-эпидемиологического контроля. 3. Наличие листка-вкладыша на русском языке проверяется: 1. При контроле по показателю «Описание» 2. При контроле по показателю «Упаковка» 3. При контроле по показателю «Маркировка» 4. Журналы результатов контроля качества лекарственных средств по окончании календарного года должны храниться в течение 1. полугода 2. года 3. 2 лет 4. Квартала 5.С целью предупреждения поступления в аптеку некачественных лекарственных средств проводится 1. химический контроль 2. органолептический контроль 3. физический контроль 4. приемочный контроль 6.Лицензии на осуществление деятельности по обороту наркотических и психотропных средств предоставляется на срок 1. 2. 3. 4. 1 год бессрочно 5 лет 10 лет 7.Правила хранения ЛС утверждаются 1. Министерством здравоохранения РФ 2. Федеральной службой по надзору в сфере здравоохранения или ее территориальным органом (Росздравнадзором) 3.Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека или ее территориальным органом (Роспотребнадзором) 4.Органом исполнительной власти в сфере здравоохранения субъекта РФ 8. Уничтожение ЛС не производится 1.владельцами ЛС, имеющими лицензию на фармацевтическую деятельность 2.организациями, имеющими соответствующую лицензию 3.на специально оборудованных площадках, полигонах 4.в специально оборудованных помещениях 9.К основным функциям органа по сертификации лекарственных средств относятся: 1. разработка методических документов по организации работы; 2. формирование и обновление фонда нормативных документов, используемых при сертификации лекарственных средств; 3. прием и рассмотрение заявок на сертификацию лекарственных средств, а также апелляций, подготовка решений по ним; 4. оформление и выдача сертификатов соответствия, ведение Реестра сертифицированных лекарственных средств; 5. отмена или приостановление действия выданных сертификатов соответствия; 6. организация повышения квалификации и аттестации персонала; 7. взаимодействие с контрольными лабораториями и органами по сертификации лекарственных средств. 8. все верно. 10. При розничной торговле лекарственными средствами информация о подтверждении соответствия реализуемых лекарственных средств представляется в виде ознакомления потребителя по его требованию с одним из следующих документов: 1. сертификат соответствия; 2. копия сертификата соответствия, заверенная держателем подлинника сертификата соответствия, нотариусом или органом по сертификации, выдавшим сертификат; 3. товарно-сопроводительные документы, оформленные предприятием-производителем лекарственных средств или поставщиком (продавцом), и содержащие по каждому наименованию лекарственного средства сведения о подтверждении его соответствия установленным требованиям (номер сертификата соответствия, срок его действия, орган, выдавший сертификат). 4. все верно. 11. Дополните текст необходимой формулировкой: «Сертификат — форма … соответствия объектов требованиям технических регламентов» 1.заявления 2.установления 3.подтверждения 4.обеспечения 5.испытания 6.регулирования 12. Опросный контроль проводят после изготовления 1.не менее 10 лекарственных форм 2.не более 5 лекарственных форм 3.не более 3 лекарственных форм 4.ежедневно в конце рабочего дня 13. Согласно действующим приказам МЗ РФ качество ЛС аптечного изготовления оценивают следующим условным термином 1. 2. 3. 4. отлично хорошо удовлетворяет забраковано КРО – 2 (выберите несколько правильных ответов) 14. Какими документами сопровождаются иммунобиологические поступающие в аптечные организации и учреждения здравоохранения? препараты, 1. Копия лицензии на фармацевтическую деятельность. 2. Копия лицензии на право производства и реализации МИБП. 3. Копия сертификата производства на реализуемый препарат. 4. Паспорт отделения биологического и технологического контроля организацииизготовителя. 5. Копия регистрационного удостоверения. 6. Копия гигиенического сертификата. 7. Копия сертификата соответствия на реализуемую серию препарата. 8. Копия санитарно-эпидемиологического заключения. КРО – 1 (выберите 1 правильный ответ) 15. При органолептическом внутриаптечном контроле проверяют 1. массу отдельных доз 2. количество доз 3. однородность смешивания порошков 4. общую массу порошка 16.Растворимостью лекарственных веществ в государственной фармакопее выражают в условных терминах, которые указывают 1. 2. 3. 4. объем растворителя (мл), необходимый для растворения 1 г вещества массу растворителя (г), необходимую для растворения 1 г вещества массу вещества (г), способную раствориться в 100 мл растворителя массу вещества (г), способную раствориться в 1 мл растворителя 17.При изготовлении 10 МЛ 2% раствора пилокарпина допускается отклонение 10%. При анализе достаточно установить, что было взято пилокарпина 1. 2. 3. 4. не менее 0,18 г и не более 0,22 г не менее 9 мл и не более 11 мл не менее 1,8 г и не более 2,2 г не менее 9,8 г и не более 10,2 г 18.При приемочном контроле в аптечной организации установили, что в одном наименовании лекарственного препарата отсутствуют инструкции по применению. ЛП будет «ЗАБРАКОВАН ПРИ ПРИЕМОЧНОМ КОНТРОЛЕ» по следующему показателю 1. 2. 3. 4. упаковка маркировка описание количество доз в упаковке 19.Свод общих фармакопейных статей и фармакопейных статей - это 1. 2. 3. 4. фармакопейная статья клинико-фармакологическая статья формулярная статья Государственная фармакопея 20.Для подтверждения результатов внелабораторных экспрессных методов используется верификация, которая включает в себя 1. 2. 3. 4. повторное или трёхкратное проведение каждого измерения использование химических методов анализа измерения с помощью аналогичных методов в лаборатории проведение высокоточных арбитражных методов исследования КРО – 2 (выберите несколько правильных ответов) 21. Контроль по показателю «ОПИСАНИЕ» включает проверку 1. целостности упаковки и ее соответствие физико-химическим свойствам лекарственного вещества 2. соответствия маркировки первичной, вторичной упаковки лекарственного средства требованиям нормативных правовых актов, наличие листовки-вкладыша на русском языке в упаковке 3. растворимости лекарственного вещества 4. цвета, запаха лекарственного средства 5. внешнего вида, агрегатного состояния 22. Контроль по показателю «МАРКИРОВКА» включает проверку 1. соответствия маркировки первичной, вторичной упаковки лекарственного средства требованиям нормативных правовых актов 2. внешнего вида, агрегатного состояния, цвета, запаха лекарственного средства 3. наличие листовки-вкладыша на русском языке в упаковке 4. целостности упаковки и ее соответствие физико-химическим свойствам лекарственного вещества 5. растворимости лекарственного вещества КРО – 1 (выберите 1 правильный ответ) 23.При проведении испытания «КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ» таблеток по ГФ XIV для анализа берут 1. 2. 3. 4. навеску растертых таблеток (не менее 20 шт.) точную навеску одной таблетки навеску одной упаковки растертых таблеток навеску не менее 0,2 г СКО( пример тестов со свободно конструированным ответом) 24. ОФС ,ФС и ФСП. Определения. 25. Цели, принципы стандартизации.