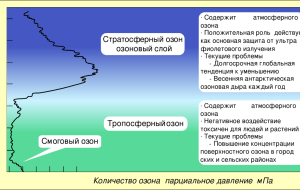
УТВЕРЖДАЮ Зам. директор ЮТИ ТПУ по УР ___________В.Л. Бибик «15» марта 2016 г. БАЗОВАЯ РАБОЧАЯ ПРОГРАММА ДИСЦИПЛИНЫ ФИЗИЧЕСКАЯ ХИМИЯ ТЕХНОСФЕРЫ НАПРАВЛЕНИЕ ООП 20.03.01 ТЕХНОСФЕРНАЯ БЕЗОПАСНОСТЬ ПРОФИЛЬ ПОДГОТОВКИ Защита в чрезвычайных ситуациях КВАЛИФИКАЦИЯ (СТЕПЕНЬ) бакалавр БАЗОВЫЙ УЧЕБНЫЙ ПЛАН ПРИЕМА 2016 г. КУРС 2 СЕМЕСТР 3 КОЛИЧЕСТВО КРЕДИТОВ 5 Виды учебной деятельности Временной ресурс Лекции Практические занятия Лабораторные занятия Аудиторные занятия Самостоятельная работа ИТОГО 32 часа 24 часа 24 часа 80 часов 100 часов 180 часов ВИД ПРОМЕЖУТОЧНОЙ АТТЕСТАЦИИ: экзамен в3 сем. ОБЕСПЕЧИВАЮЩАЯ ПОДРАЗДЕЛЕНИЕ: Кафедра «Безопасности жизнедеятельности, экологии и физического воспитания» Заведующий кафедрой ______________ Солодский С.А. Руководитель ООП ______________ Солодский С.А. Преподаватель ______________ Торосян В.Ф. 2016 1. Цели освоения дисциплины В результате освоения данной дисциплины бакалавр приобретает знания, умения и навыки, обеспечивающие достижение целей Ц1 и Ц5 ООП Цели дисциплины: - подготовка выпускников к проектно-конструкторской деятельности в области создания и внедрения средств обеспечения безопасности и защиты человека от техногенных и антропогенных воздействий; - подготовка выпускников к самообучению и непрерывному профессиональному самосовершенствованию. 2. Место дисциплины в структуре ООП Дисциплина относится к междисциплинарному профессиональному модулю. Она непосредственно связана с дисциплинами этого модуля («Медицина катастроф», «Аналитическая химия и физико-химические методы анализа», «Теория горения и взрыва», «Безопасность в техносфере», «Системный анализ и моделирование процессов в техносфере», «Опасные природные процессы», Кореквизитами для дисциплины «Физическая химия техносферы» являются дисциплины профессионального модуля: «Безопасность жизнедеятельности», «Аналитическая химия и физико-химические методы анализа». В результате освоения данной дисциплины бакалавр приобретает знания, умения и навыки, обеспечивающие достижение целей Ц1 и Ц5 ООП Цели дисциплины: - подготовка выпускников к проектно-конструкторской деятельности в области создания и внедрения средств обеспечения безопасности и защиты человека от техногенных и антропогенных воздействий; - подготовка выпускников к самообучению и непрерывному профессиональному самосовершенствованию. В результате освоения дисциплины студент должен/будет: Знать - основные понятия, законы и модели химических систем, коллоидной и физической химии, реакционную способность веществ; - свойства основных видов химических веществ и классов; - основные техносферные опасности, их свойства и характеристики, характер воздействия вредных и опасных факторов на человека и природную среду, методы защиты от них Уметь - применять химические законы для расчетов химических процессов; определять термодинамические и равновесные характеристики химических реакций, физические характеристики неорганических и органических веществ; - определять свойства химических веществ; - идентифицировать основные опасности среды обитания человека, оценивать риск их реализации, выбирать методы защиты от опасностей и способы обеспечения комфортных условий жизнедеятельности; пользоваться основными средствами контроля качества среды обитания Владеть (методами, приёмами) - методами экспериментального исследования в химии; -методами определения свойств неорганических и органических веществ; - методами обеспечения безопасности среды обитания. 3. Результаты освоения дисциплины В соответствии с требованиями ООП освоение дисциплины направлено на формирование у студентов следующих компетенций (результатов обучения), в т.ч.в соответствии с ФГОС: Таблица 1 Составляющие результатов обучения по дисциплине Результаты Составляющие результатов обучения обучения Код Владение Код (компетенции опытом из ФГОС) Р1 В.1.7, - методами У.1.7, (ОК6,7,11,12) экспериментального (ПК14) исследования в химии; -методами В.1.8, определения свойств неорганических и органических веществ; У.1.8, Р6 (ОК6,7,11,12) (ПК14) В.6.3. методами обеспечения безопасности среды обитания У.6.3. Р11 В.11.1 Навыками У.11.1 (ОК-8,19, самостоятельной ПК-10, ОПКработы по 4) выполнению исследовательской Умения Код Знания -применять химии- З.1.7, - основные ческие законы для понятия, расчетов химиизаконы и ческих процессов; модели определять химических термодинамические систем, и равновесные коллоидной и характеристики физической химических химии, реакций, реакционную физические способность характеристики веществ; неорганических и - свойства органических основных видов веществ; З.1.8, химических -определять веществ и свойства классов; химических веществ; идентифицировать З.6.3. основные основные техносферные опасности среды опасности, их обитания человека, свойства и оценивать риск их характеристи реализации, характер выбирать методы воздействия защиты от вредных и опасностей и опасных способы обесфакторов на печения комчеловека и фортных условий природную жизнедеятельности среду, методы пользоваться защиты от них основными средствами контроля качества среды обитания Эффективно работать индивидуально и в качестве члена группы по работы разработке проектов, самостоятельно решеть технические задачи в рамках учебноисследовательской работы 4. Структура и содержание дисциплины 4.1 Аннотированное содержание разделов дисциплины 1. Лекции нацелены на получение информации и алгоритма действий в образовательном процессе с использованием демонстрационных опытов и демонстрационных пособий, 2. Практические занятия направлены на формирование познавательной самостоятельности студентов и приобретение навыков решения задач различных уровней сложности: репродуктивных, реконструктивно-вариативных, а также выполнение проблемных заданий. Финалом практического занятия является текущий контроль в виде фронтального 15 минутного тестирования для оценки степени усвоения материала, 3. Консультации проходят еженедельно под руководством преподавателя для неуспевающих студентов и имеющих задолженность, направлены на развитие навыков самостоятельной деятельности с использованием литературных источников, справочной литературы 4. Лабораторный практикум нацелен на приобретение навыков и умений в обращении с химическими веществами, исследование свойств химических систем и определение их характеристик согласно календарному плану, все операции исследования свойств химических систем, их динамику развития во времени, влияние внешних условий производятся под непосредственным контролем преподавателя и с соблюдением правил техники безопасности; оформленный отчет и выполненное контрольное задание является критерием выполнения работы и приобретенных навыков, 5. Самостоятельная внеаудиторная работа, направлена на приобретение навыков самостоятельного решения реконструктивно-вариативных и проблемных заданий с использованием обязательной и дополнительной литературы. 4.2. Содержание разделов дисциплины. Виды учебной деятельности: Раздел1. «Введение. Техносфера и ее составляющие» Основные термины, понятия и определения. Техносфера и ее состав. Учение В.И. Вернадского о биосфере. Ноосфера. Распространенность химических веществ в окружающей среде. Кларки химии-ческих элемен-тов в биосфере, атмосфере, гидросфере, литосфере и космосе. Биофильность и технофильность химического элемента. Радиоактивные элементы. Тупиковый характер потоков технофильных элементов в биосфере. Определение термина «загрязнитель» (ксенобиотик) для окружающей среды. Понятие о поведении загрязнителей как о сложных процессах взаимодействия его с компонентами среды. Лабораторная работа № 1 Оценка уровня загрязнения атмосферного воздуха объектами техносферы 2.Раздел «Физика и химия атмосферы и ее загрязнителей» Структура атмосферы. Тепловой баланс системы «поверхность Земли – атмосфера». Характер изменения температуры в атмосфере. Вертикальное распределение температур в атмосфере. Факторы, влияющие на тепловой режим тропосферы и стратосферы. Инсоляция, отражение, поглощение, собственное излучение земной поверхности и атмосферы. Тепловой баланс и циркуляция атмосферы. Критические элементы баланса, определяющие среднюю температуру поверхности Земли. Ионосфера Земли. Геомагнитные «ловушки» космических частиц. Современный химический состав атмосферы. Химический состав сухого незагрязненного воздуха. Гомосфера и гетеросфера. Основные компоненты атмосферы. Общие сведения о состоянии воздушной среды. Основные антропогенные загрязнители атмосферы: СО, СО2, SО2, NO, NO2, пары воды, твердые частицы веществ, тепловая энергия. [2;3;13] Окислительные компоненты атмосферы: Озоноразрушающие вещества в стратосфере. Реакции разру-шения озона про-дуктами фотолиза хлорофторуглеродов (фреонов) и свободными ради-калами, поступаю-щими из выхлопов ракетных двига-телей. Общие сведения о фотохимии загрязнителей. Фотохимические реакции в тропосфере и стратосфере. Ультрафиолетовое излучение Солнца с λ 370 нм, как фотохимический фактор в тро-посфере Земли. Химические превращения соеди-нений S и N в атмосфере. Образование нитрофенола, пероксиацетилнитратов (ПАН) и пероксибензоилнитратов (ПБН). Сухое и влажное осаждение кислот. Кислотные дожди. «Зимний смог» Лондонского типа. Атмосферные про-цессы, приводящие к образованию кислотных дождей. Фотохимический или «летний» смог Лос-анжелесского типа. Их влияние на живые организмы. Химические реак-ции органических соединений. Алканы, фото-химическое окис-ление метана и его гомологов, кине-тические данные о реакциях алканов с радикалами ОН. Алкены, реакции с озоном, радикалом ОН. Окисление ароматических сое-динений, кислородсодержащих производных угле-водородов. Вторичное загряз-нение атмосферы монооксидом угле-рода. Фотоокисление и поликонденсация пентахлорфенола (ПХФ). Образование чрез-вычайно токсичных полихлорированных диоксинов на примере полихлордибензо(n)диоксина (ПХДД). Биогенные углеводороды (терпены). Фотохимические реакции терпенов, выделяемых хвой-ными и листвен-ными деревьями (α-пинен, изопрен). Реакции изопрена и монопреновых углеводородов с О3. Возможность образования ПАН. Фотохимия кислородсодержащих углеводородов: альдегидов, кетонов, спиртов, карбоновых кислот. Фотохимические процессы аминов, серосодержащих и галогенсодержащих углеводородов. Фреоны. Реакция образования аэрозолей. Образование и рост аэрозольных частиц в атмосфере. Реакции атмосферных кис-лот. Физические механизмы проса-чивания аэрозолей в стратосферу. Стратосферный аэрозольный «пояс» Земли. Воздействие за-грязняющих ве-ществ на объекты техносферы. Воздействие оксидов серы, оксидов азота, озона, кислот, аэрозолей и других загрязняющих веществ на строительные и конструкционные материалы, памят-ники культуры. Воздействие загрязняющих веществ на атмосферу: влияние на видимость в атмосфере. Теория видимости в атмосфере. Влияние загрязнителей на выпадение осадков. Химические процессы, протекающие при образовании осадков в облаках. Влияние загрязняющих веществ на метеорологические условия в гло-бальном масштабе. Роль многоатомных газов (Н2О, СО2, NH3) в атмо-сферном поглоще-нии. Повышение концентрации мно-гоатомных газов, «парниковый» эффект. Обоснование формирования «парникового» эффекта в атмосфере Землииегопоследствия.[1; 6; 8; 11] Лабораторная работа № 2 Оценка уровня загрязнения атмосферного воздуха объек-тами техносферы 3.Раздел « Физико-химические свойства гидро-сферы. Трансформация загрязнителей в ней» Физические характеристики Мирового океана. Характеристика водных ресурсов Земли. Поверхностные и подземные воды. Химический состав природных вод. Радиоактивность природных вод. Роль океанов в регулировании климата и концентрации СО2 в атмосфере. Растворение избытка СО2 в литорали Мирового океана. Влияние глобального потепления на растворимость СО2. Аккумулирование тепла поверхностным слоем морей и океанов. Циркуляционный перенос тепла из низкоширотных в высокоширотные районы. Теплые течения, повышение температуры в прибрежных районах теплых течений. Горизонтальные и вертикальные перемещения водных масс. Апвеллинг. Круговорот природных вод. Содержание химических элементов в Мировом океане. Пресная и соленая вода. Буферность природных вод. Главные ионы, растворенные газы, газовая фаза, твердые частицы, биогенные вещества, микроэлементы в воде. Кислотность вод в объектах гидросферы. Растворимость за-грязнителей Миро-вого океана. Процессы окисле-ния и восстанов-ления в природных водоемах. Синглетный кисло-род, озон, гидроксил радикал, пероксид водорода в природных водах. Механизмы образо-вания радикалов: растворение актив-ных газов из атмосферы, катали-тическое иниции-рование, радиолиз, кавитационные эффекты. Окисление мине-ральных солей. Образование окси-дов тяжелых метал-лов. Нефтяные загрязнения при-родных вод. Реакции окисления алканов, алкенов, кислородсодержащих углеводородов. Окисление арома-тических углеводо-родов. Образование токсичных соеди-нений. Влияние микро-организмов на процессы окислен-ия-восстановления. Аэробные и анаэробные микро-организмы и их деятельность: сульфатредуцирующие микро-организмы, метано-бактерии, железо-бактерии, нитро-фицирующие бактерии. Гидролиз солей и органических сое-динений в природ-ных водоемах. Гидролиз пестицидов. Каталитический гидролиз в при-сутствии кислот и щелочей. Фотолиз в водной среде. Влияние погодных условий. Реакции фотолиза сульфи-дов, кислородсо-держащих и галогенсодержащих углеводородов. Фотосенсибилизирующиеся реакции окисления ароматических углево-дородов. Комплексообразование в гидросфере. Лигандный состав природных вод. Комплексообразование тяжелых металлов. Гидроксокомплексы. Коллоидно-дисперсные формы комплексных соединений. Бионакопление тяжелых металлов, пестицидов, радио-нуклидов в орга-низмах, обитающих в водной среде. Возможность био-логической ток-сификации загряз-нителей в водных организмах. Образование вы-сокотоксичных органических сое-динений. Биометилирование ртути. Последствия хлорирования за-грязненных при-родных вод при водоподготовке. Взаимодействие хлора с оста-точными углево-дородами. Образование чрез-вычайно токсичных тригалометанов, хлороформа и четыреххлористого углерода. Поверхностно-ак-тивные вещества в водоемах, вспе-нивание природных вод. Классификация ПАВ. Биоразлагаемые ПАВ. Устойчивость алкилбензолсульфонатов (АБС) в окружающей среде. Тенденция замены АБС в моющих средствах биоразлагаемыми ПАВ. Влияние кислотных дождей на объекты гидросферы. Буферная емкость естественных водоемов. Влияние на буферную емкость подстилающих геологических пород. Диаграммы динамики рН водоемов с ложами, образованными вулканическими (базальты, грани-ты) и осадочными (известняк, глина, гипс) горными породами. Соединения фосфора и азота как лимитирующий пищевой фактор водных экосистем. Сброс соединений фосфора и азота со сточными водами. Антропогенное эвтрофирование водоемов. Лабораторная работа № 3 Измерение поверхностного натяжения и определение адсорбции растворенного ПАВ в водных объектах Определить поверхностное натяжение растворов ПАВ методом отсчета капель Вычисление адсорбции ПАВ в поверхностном слое, построение графиков поверхностного натяжения ПАВ и изотермы адсорбции ПАВ Лабораторная работа № 4 Получение коллоидных систем. Освоить методики получения золей. Написать формулы мицелл полученных золей. Знакомство с методом пептизации, диспергирования и конденсации. Составление уравнений получения различных типов мицелл в природных водах Лабораторная работа № 5 Коллоквиум №1 4.Раздел «Физико-химические процессы в литосфере. Загрязнения почв» Характеристики почв: гранулометрический состав, объем пор, гигроскопичность, рН, ионообменная емкость. Песчаные и глинистые почвы. Классификация почв по гранулометрическому составу, диаметру пор, содержанию песка и глины. Вода в почвах. Гравитационная и гигроскопическая влага. Составляющие компоненты почв. Кварц, алюмосиликаты, минеральные вещества, гидроксиды, гумус, газовая фаза почв. Химический состав гумуса: гуминовые кислоты, фульвокислоты, комплексообразующие гумины. Сорбционные центры частиц почвы. Реакции тяжелых металлов. Преобра-зование оксидов металлов в растворимые формы гидроксидов, карбонатов, гидрокарбонатов и др. Адсорбция ионов металлов на ионообменных центрах почвенных частиц. Образование малоподвижных комплексных соединений (фульваты, гуматы) с органическими веществами почвы. Хелатообразующие комплексы почв. Принципы образо-вания хелатных соединений. Образование внутрикомплексных хелатов металлов. Минеральные удобрения и соли, основные окислительно-восстановительные реакции в почве. Окисление суль-фидов металлов в сульфаты в газовой фазе почв. Аэробные условия. Ферментативные реакции сульфофикации, образо-вание серной кислоты. Ферментативные реакции нитри-фикации и нитрофикации. Образование азотной кислоты. Подкисление почв. Анаэробные усло-вия. Восстановление серы из сульфатов анаэробными сульфатредуцирующими бактериями. Подщелачивание почв. Пестициды, галогенсодержащие углеводороды, нефть в почве. Фотолиз ароматических углеводо-родов. Окисление с участием почвенного пероксида водорода. Аэроб-ный и анаэробный биолиз пестицидов. Метаболические реакции биолиза ароматических углеводородов. Аммонификация органических сое-динений. Раствори-мость конечных продуктов. Ско-рость метаболии-ческих реакций. Связь скорости реакций с температурой, правило Вант-Гоффа. Уравнение Аррениуса. Радионуклиды: цезий, йод, стронций, рубидий, радий и уран в почвах. Естест-венные источники радиации. Лабораторная работа № 6 Определение полевой влажности почвы Лабораторная работа № 7 Определение гигроскопической влажности почвы Лабораторная работа № 8 Определение плотности почвы. Определение плотности твѐрдой фазы почвы Лабораторная работа № 9 Определение суммы поглощенных оснований Лабораторная работа № 10 Определение актуальной кислотности Лабораторная работа № 11 Коллоквиум №2 5. Раздел «Миграция загрязнителей атмосферы, гидросферы и литосферы. Биотический перенос загрязнителей» Лабораторная работа № 12 . Расчет загрязнения почв при внесении удобрений Определить массу и объем осадка, образовавшегося после очистки сточных вод, который допустимо ис-пользовать в качестве удобрения для сельскохозяйственного объекта Расчет массы и объема удобрения для внесения на определенную почву и расчет ее площади. В результате освоения дисциплины (модуля «Химия 1.6») студентом должны быть достигнуты следующие результаты: Таблица 2 Планируемые результаты освоения модуля № п.п Результат Знать: основные понятия и законы химии, реакционную РД1 способность веществ; свойства основных классов химических веществ; определять свойства химических веществ. Применять химические законы для расчетов химических РД2 процессов, определять термодинамические и равновесные характеристики химических реакций. Уметь предсказывать протекание возможных химических реакций и их кинетики. Определять изменения концентраций растворов при РД3 протекании химических реакций; уметь выделять и очищать вещества. Применять методы экспериментального исследования в химии РД4 для определения свойств веществ и их состава. Номер раздела при изучении которого достигается результат Раздел 1. Раздел 4. Раздел 2. Раздел 3 Раздел 4,5. Раздел 2,3,4,5 6. Организация и учебно-методическое обеспечение самостоятельной работы студентов (CРC) 6.1 Текущая и опережающая СРС, направленная на углубление и закрепление знаний, а также развитие практических умений заключается в: - работе бакалавров с лекционным материалом, поиск и анализ литературы и электронных источников информации по заданной проблеме; - выполнении индивидуальных домашних заданий; - изучении тем, вынесенных на самостоятельную проработку: - подготовке к коллоквиумам и семинарским занятиям; - изучении инструкций к приборам и подготовка к выполнению эксперимента; - выполнении тестов текущего контроля знаний; - подготовке к экзамену. Творческая проблемно-ориентированная самостоятельная работа (ТСР), ориентирована на развитие интеллектуальных умений, комплекса универсальных (общекультурных) и профессиональных компетенций, повышение творческого потенциала студентов и заключается в: - поиске, анализе и презентации информации; - исследовательской работе и участии в научных студенческих конференциях, семинарах и олимпиадах; - анализе научных публикаций по заранее определенной преподавателем теме; - анализе фактических материалов по заданной теме, проведении расчетов, составлении схем и моделей. 6.3 Контроль самостоятельной работы Оценка результатов самостоятельной работы организуется как единство двух форм: самоконтроль и контроль со стороны преподавателя. 7. Средства (ФОС) текущей и итоговой оценки качества освоения дисциплины Оценка успеваемости бакалавров осуществляется по результатам следующих контролирующих мероприятий Контролирующие мероприятия Результаты обучения по дисциплине Выполнение лабораторных работ Защита результатов эксперимента и решение заданий для самостоятельной работы. Работа на практических занятиях Выполнение тестовых заданий Выполнение ИДЗ Защита ИДЗ Внеаудиторная работа по тематике Презентация, реферат исследования Экзамен Итоговая оценка Для оценки качества освоения дисциплины при проведении контролирующих мероприятий предусмотрены следующие средства (фонд оценочных средств): - задания входного контроля: Классификация и номенклатура Указать основной оксид: 1) NO 2) CaO 3) CO 4) N2O5 Какие гидроксиды проявляют амфотерные свойства? 1) KOH 2) Fe(OH)2 3) Zn(OH)2 4) NaOH Mg(OH)2 Bi(OH)3 Al(OH)3 Ca(OH)2 3. Какое вещество является ангидридом сернистой кислоты? H2SO3 2) H2S 3) SO2 4) SO3 4. Какие соли встречаются среди неорганических веществ? 1) Средние 2) Кислые 3) Основные 4) Двойные Все перечисленные 6) Все, кроме двойных 5. Выбрать правильное название для соединения NaHCO3: 1) Гидроксокарбонат натрия 2) Гидрокарбонат натрия Карбонат натрия 4) Карбонат-гидрид натрия 6. Каков состав бордосской жидкости? 1) Смесь растворов NaOH и KOH 2) Раствор CuSO45H2O 3) Раствор Ca(OH)2 4) Смесь растворов CuSO4 и Ca(OH)2 Окислительно-восстановительные реакции Указать формулу вещества, которое проявляет в окислительно-восстановительных реакциях только окислительные свойства. 1) КNO3 2) KNO2 3) NH3 4) NH2OH Чем является пероксид водорода в реакции: KMnO4 + H2O2 + H2SO4 MnSO4 + K2SO4 + O2 + H2O? 1)Окислителем 2) Восстановителем 3) Окислителем и восстановителем 4) Средой Какой коэффициент должен стоять перед окислителем в реакции: K2Cr2O7 + HCl KCl + CrCl3 + Cl2 + H2O? Какой коэффициент должен стоять перед азотной кислотой в уравнении реакции: Zn + HNO3 Zn (NO3)2 + N2O + H2O? Указать тип окислительно-восстановительной реакции, приведенной в четвертом вопросе: 1) Внутримолекулярная 2) Окислитель в качестве среды 3) Диспропорционирования 4) Восстановитель в качестве среды - задания для тестирования 1. Содержание озона в атмосфере над некоторой географической точкой составило 350 е.Д*. Была ли превышена средняя для этого района концентрация озона, равная 35 мкг/м3? а) единицы измерений несопоставимы; б) да, в 1,3 раза; в) нет, она была в 1,2 раза меньше; г) нет, эти значения равны; д) да, концентрация была на 10% больше. *Слой озона высотой 10-5 метра принимается равным одной единице Добсо-на (е.Д) 2. а) б) в) г) д) Какие изменения связаны с увеличением солнечной активности? значительно увеличивается поток солнечной энергии; заметно увеличивается температура в приземном слое атмосферы; в спектре Солнца значительно возрастает доля видимого излучения; в спектре Солнца значительно возрастает доля инфракрасного излучения; в спектре Солнца значительно возрастает доля жесткого излучения. 3. Основную роль в в тропосфере играют: а) кислород воздуха; б) озон; в) свободные радикалы; г) оксиды азота; д) жесткое излучение. инициировании процессов окисления примесей 4. Концентрация озона в атмосфере по мере удаления от Земли: а) экспоненциально уменьшается с увеличением расстояния от поверхности Земли; б) экспоненциально увеличивается с увеличением расстояния от поверхно сти Земли; в) достигает максимального значения в термосфере; г) достигает максимального значения в стратосфере; д) достигает максимального значения в мезосфере. 5. а) б) в) г) д) е) Явление локальной температурной инверсии в тропосфере обусловлено: изменением солнечной активности; изменением температурного градиента в тропосфере; изменением альбедо поверхности Земли; ростом выбросов углекислого газа; резким изменением атмосферного давления; изменением влажности воздуха. 6 Необходимым условием для возникновения смога как в Лондоне, так и в Лос-Анжелесе является: а) солнечное излучение; б) высокое атмосферное давление; в) высокая концентрация диоксида серы в тропосфере; г) высокая плотность транспортного потока; д) температурная инверсия. 7. Какое из утверждений, характеризующих влияние загрязнения атмосферного воздуха на климат, неверно? а)увеличение концентрации диоксида углерода может привести к повышению средней глобальной температуры на Земле; б) увеличение концентрации соединений серы в стратосфере может привести к уменьшению средней глобальной температуры на Земле; в) увеличение концентрации фреонов в тропосфере может привести к повышению средней глобальной температуры на Земле; г) увеличение концентрации пыли в атмосфере может привести к повышению средней глобальной температуры на Земле; д) увеличение концентрации метана в тропосфере может привести к повышению средней глобальной температуры на Земле. 8. Как меняются давление, температура и концентрация озона в стратосферес увеличением расстояния от поверхности Земли? а) давление и температура уменьшаются, концентрация озона проходит черезмаксимум; б) давление уменьшается, температура растет, концентрация озона проходитчерез максимум; в) давление уменьшается - температура и концентрация озона увеличиваются; г) температура растет, концентрация озона и давление уменьшаются; д) давление, температура и концентрация озона увеличиваются. 9. Как меняются давление, температура и концентрация озона в мезосфере с уменьшением расстояния до поверхности Земли? а) давление, температура и концентрация озона увеличиваются; б) давление уменьшается, температура растет, концентрация озона проходит через максимум; в) давление и температура увеличиваются, концентрация озона проходит через максимум; г) давление и температура уменьшаются, концентрация озона увеличивается; д) давление и концентрация озона уменьшаются, температура растет. 10. Сколько молекул формальдегида присутствует в каждом кубическом сантиметре воздуха при нормальных условиях, если его концентрация достигает значения предельно допустимой разовой концентрации ПДКМ а) 7,0 • 1011; б) 6,0 • 1011; в) 3,5 • 1013; г) 3,5 • 1019; д) 3,0 • 1013. 11. Сколько частиц пыли присутствует в каждом кубическом метре воздуха при концентрации, равной ПДК для рабочей зоны 4 г/см3, диаметр частиц -0,5 мкм, все частицы сферической составляющей 6 мг/м3 (принять: плотность пыли ской формы)?; а) 23 • 109 б)6,0109 в) г) д) 6,0101 2,31 01 7,0 • 107. 12. Какое соединение, присутствующее большую долю ее теплового излучения? а) NO2: б) СО2: в) Н2О: г) CClхF4-х; д) СН4. в атмосфере Земли, улавливает 13. В результате антропогенной деятельности состав атмосферы 20 лет: а) претерпел значительные изменения на уровне макрокомпонентов; б) не изменился; в) изменился на уровне микрокомпонентов; г) изменился в отдельных регионах; д) правильными являются несколько из перечисленных выше ответов. за наи последние 14. Основной причиной возникновения парникового эффекта является: а) изменение направления движения и интенсивности океанических течений; б) изменение орбиты вращения Земли вокруг Солнца; в) увеличение в атмосфере концентрации соединений, поглощающих фракрасной области; г) тепловое загрязнение; д) правильными являются несколько из перечисленных выше ответов в ин 15. Какой газ в стратосфере поглощает 99% излучения Солнца в опасной для биосферы УФ-области? а) О2; б) О3; в) CClхF4-х; г) СО2; д) Н2О. 16. Сегодня ученые полагают, что глобальное уменьшение содержания озона в стратосфере может быть вызвано: а) увеличением интенсивности УФ-излучения; б) галогенсодержащими углеводородами антропогенного происхождения; в) резким увеличением концентрации СО2 в тропосфере; г) «зимней воронкой» над Южным полюсом; д) активизацией вулканической деятельности 17. а) б) в) г) д) Массовая вырубка лесов приводит: к опустыниванию; к изменению альбедо Земли; к нарушению кислородного цикла; к увеличению концентрации диоксида углерода в тропосфере; правильными являются все перечисленные выше ответы. 18. а) б) в) г) д) Масштабы и скорость проявления глобального изменения климата: не поддаются регулированию мировым сообществом; могут быть ограничены при быстрых действиях всего мирового сообщества; могут быть достоверно предсказаны при помощи компьютерной модели; уже вышли из-под контроля; не изменились за последние 1000 лет. 19. Злокачественная меланома и другие раковые заболевания кожи могут быть обусловлены чрезмерным воздействием: а) фреонов, содержащихся в тропосфере; б) озона, содержащегося в стратосфере; в) озона, содержащегося в мезосфере; г) УФ-излучения Солнца; д) ИК-излучения Земли. 20. За два столетия, прошедших со времени промышленной революции, концентрация диоксида углерода: а) увеличилась примерно в два раза; б) уменьшилась примерно в два раза; в) осталась неизменной; г) увеличилась на 25%; д) уменьшилась на 25%. -вопросы к экзамену 1. Какие изменения связаны с увеличением солнечной активности? 2. Основную роль в инициировании процессов окисления примесей в тропосфере играют:…… 3. Концентрация озона в атмосфере по мере удаления от Земли:…… 4. Чем обусловлено явление локальной температурной инверсии в тропосфере? 5. Необходимым условием для возникновения смога как в Лондоне, так и в Лос-Анжелесе является:…….. 6. Как меняются давление, температура и концентрация озона в стратосфере с увеличением расстояния от поверхности Земли? 7. Как меняются давление, температура и концентрация озона в мезосфере с уменьшением расстояния до поверхности Земли? 8. Какое соединение, присутствующее в атмосфере Земли, улавливает наибольшую долю ее теплового излучения? 9. В результате антропогенной деятельности состав атмосферы за последние 20 лет:….. 10. Что является основной причиной возникновения парникового эффекта? 11. За два столетия, прошедших со времени промышленной революции, концентрация диоксида углерода:…… 12. Какой вид антропогенной деятельности более всего ответствен за глобальное повышение концентрации диоксида углерода в атмосфере? 13. Газ, являющийся основной причиной образования кислотных осадков, это:……. 14. Из общей массы гидросферы доля пресных вод составляет:…..(%) 15. Какие группы анионов и катионов относятся к главным ионам, доля которых в любых природных поверхностных во дах превышает 95% от общей массы катионов или анионов. 8. Рейтинг качества освоения дисциплины Оценка качества освоения дисциплины в ходе текущей и промежуточной аттестации обучающихся осуществляется в соответствии с «Руководящими материалами по текущему контролю успеваемости, промежуточной и итоговой аттестации студентов Томского политехнического университета», утвержденными приказом №88/ОД от 27.12.2013 7. Учебно-методическое и информационное обеспечение дисциплины Основная литература 1. Гидрохимические показатели состояния окружающей среды: Учебное пособие для вузов / Под ред. Т.В. Гусевой. - М.: ИД Форум - ИНФРА-М, 2007. - 190 с. 2. Садовникова Л.К. Биосфера: загрязнение, деградация, охрана. Краткий толковый словарь: Учебное пособие для вузов / Л.К. Садовникова; Н.И. Суханова, С.Я. Трофимова. - М. : Высшая школа, 2007. - 125 с. 3. Степановский А.С. Прикладная экология: охрана окружающей среды: Учебник / А.С. Степановский. - М.: ЮНИТИ-ДАНА, 2003. - 751 с. 4. Сборник методик по определению концентраций загрязняющих веществ в промышленных выбросах [Электронный ресурс]. – Л.: Гидрометеоиздат, 2007. 5. Петров В.В. Экологический мониторинг окружающей среды [Электронный ресурс] : учеб.пособие / В.В.Петров,Т.Н.Назарова. - Таганрог: Южный Федеральный университет, 2007. 6. Павлов А.Н.Экология: рациональное природопользование и безопасность жизнедеятельности: Учебное пособие для вузов / А.Н. Павлов. - М. : Высшая школа, 2005. 343 с. 7. Голицын А.Н. Промышленная экология и мониторинг загрязнения природной среды: Учебник для СПО / А.Н. Голицын. - 2-е изд., испр. - М.: ОНИКС, 2009. - 332 с. 8. Торосян В.Ф. Химия окружающей среды. Почва – поверхностная оболочка Земли, структурно-функциональное звено биосферы. Лабораторный практикум. часть 1.: методические указания для студентов всех форм обучения направления 280700 "Техносферная безопасность"/ Сост. В.Ф. Торосян. - Юрга: Издательство Юргинского технологического института (филиала) Томского политехнического университета. 2012-62 с. 9.Ложниченко О.В. Экологическая химия6 учеб.пособие для студ. высш. учеб. заведений / О.В. Ложниченко, И.В. Волкова, В.Ф. Зайцев.- М.: Издательский центр "Академия", 2008. 272 с. Дополнительная литература 1.Астафьева Л.С. Экологическая химия: учебник для студентов сред. проф. учеб. заведений/ Л.С. Астафьева - М.: Издательский центр "Академия", 2006. -224 с. Электронные коллекции НТБ ТПУ:http//ezproxy.ha.tpu.ru: 2090//fulltext2/m/2012/m467.pdf) Internet-ресурсы: Биоиндикация природных водоемов (телекоммуникационный проект) / ГУ ЯО "Центр телекоммуникаций и информационных систем в образовании", 2002. Адрес в Интернет http://www-windows1251.edu.yar.ru/russian/misc/eco_page/bioind/index.html Гусева Т.В., Молчанова Я.П., Заика Е.А. и др. Гидрохимические показатели состояния окружающей среды: справочные материалы. – М.: СоЭС, Метод. центр “Эколайн”, 2000. Адрес в Интернет http://http://www.tolcom.ru/kiril/library/book1/content999/www.cci.glasnet .ru/mc/refbooks/hydrochem Ташкер И.Д. К проблеме установления безопасных уровней токсических веществ во внешней среде // Адрес в Интернет http://www.medved.kiev.ua/arhiv_mg/st_2000/00_2_9.htm Химия окружающей среды / Под ред. В. В. Зеленцова. – http://www.college.ru/chemistry/course/design/index.htm Экологическая оценка. Пособие для преподавателей (UNEP Environmental Impact Assessment Training Resource Manual) / Программа ООН по окружающей среде (UNEP) . Пер. РОО "Эколайн" и Центра подготовки и реализации инвестиционных проектов (ЦПРП) Адрес в Интернет http://cci.glasnet.ru/mc/books/eiamanual/index.html 10. Материально-техническое обеспечение дисциплины При изучении основных разделов дисциплины, выполнении лабораторных работ бакалавры используют технические средства, химические реактивы, лабораторное оборудование и приборы. №п/п Наименование Корпус, кол. установок-1 1 Иономер «Итан» 2корпус, ауд.14 2 Фотометр фотоэлектрический КФК-2 2корпус, ауд.14 3 Электронные аналитические весы 2корпус, ауд.14 4 Термоблок 2корпус, ауд.14 5 Центрифуга 2корпус, ауд.14 6 Муфельная печь 2корпус, ауд.14 7 Инверсионный вольтамперометрический анализатор ТА-4 2корпус, ауд.14 Программа составлена на основе Стандарта ООП ТПУ в соответствии с требованиями ФГОС − по направлению 20.03.01 «ТЕХНОСФЕРНАЯ БЕЗОПАСНОСТЬ», профиль подготовки: «Защита в чрезвычайных ситуациях» Программа одобрена на заседании кафедры БЖД Э и ФВ ЮТИ ТПУ (протокол № 5/16 от «10 » 03. 2016г.) Автор Торосян В.Ф. Рецензент к.т.н., доцент Гришагин В.М.