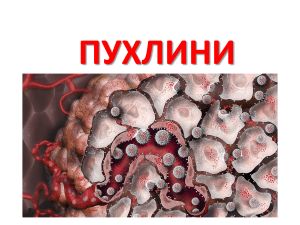
Сучасні уявлення про компенсаторно-пристосувальні процеси та регенерацію
реклама

КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ТАРАСА ШЕВЧЕНКА НАВЧАЛЬНО-НАУКОВИЙ ЦЕНТР «ІНСТИТУТ БІОЛОГІЇ ТА МЕДИЦИНИ» Реферат на тему: Сучасні уявлення про компенсаторно-пристосувальні процеси та регенерацію Підготувала студентка 4-го курсу групи лабораторна діагностика Рожкова Діана Анатоліївна Київ 2020 Зміст Вступ………………………………………………………………………….…3 Компенсаторно-пристосувальні процеси…………………………………….4 Гіпертрофія……………………………………………………………….5 Гіперплазія………………………………………………………………..8 Атрофія…………………………………..……………………………….10 Склероз…………………………………………………………………...15 Організація……………………………………………………………….17 Інкапсуляція……………………………………………………………...17 Метаплазія………………………………………………………………..18 Перебудова тканин і органів……………………………………………21 Регенерація: загальні відомості.……………………………………………22 Регенерація окремих органів…………………………………………..26 Висновки………………………………………………………………………38 Список використаних джерел………………………………………………39 2 Вступ Основною умовою існування організму є його здатність забезпечувати гомеостаз, тобто постійність внутрішнього середовища. Незважаючи на безперервні зміни довкілля, організм утримує в певних межах не тільки біологічні константи крові, лімфи і тканинної рідини, а й фізіологічні функції (кровообіг, терморегуляцію, дихання, обмін речовин), допускаючи коливання цих показників у вузькому діапазоні. Різноманітні комбінації регулювальних, координувальних і коректувальних гомеостатичних реакцій, які здійснюються з участю нервових, ендокринних і обмінних факторів, створюють оптимальні умови для існування організму за дії не тільки помірних, але й надпорогових подразників. Такі реакції називаються пристосувальними або адаптаційними. Вони спрямовані на виживання та відновлення клітин і тканин у незвичних умовах існування. Проте, надто сильний подразник може привести клітину до загибелі ще до настання адаптації або ж за умови її зриву. У таких випадках корекція порушеного гомеостазу здійснюється шляхом компенсації, тобто заміщення функцій. Незважаючи на деяку різницю між пристосуванням і компенсацією, їх часто об’єднують терміном “компенсаторно-пристосувальні реакції”. 3 Пристосування (адаптація) – сукупність біологічних процесів, що забезпечують здатність біологічного виду до існування при зміні умов середовища. Процеси пристосування, в тій чи іншій мірі, тривають в організмі постійно, протягом усього життя - від народження до смерті. Компенсація (лат. cоmpensatio - відшкодування) – окремий вид пристосування, який розвивається в організмі за умов наявності патологічного процесу (хвороби, травми, ін.), спрямований на відшкодування порушеної функції органа або тканини. Процеси пристосування клітин до змін позаклітинного середовища, що можна виявити мікроскопічно, називають «акомодація клітин». Морфологічні прояви акомодації клітин: 1. Проліферація та гіперплазія (збільшення кількості) клітин. Розмноження та вчасне диференціювання спеціалізованих клітин забезпечує посилення функціональної активності органа. 2. Збільшення кількості апоптотично змінених клітин відбувається при підвищенні рівня апоптогенних сигналів із позаклітинного мікрооточення. 3. Гіпертрофія клітин – збільшення розмірів клітин. 4. Ендореплікація та поліплоїдія. У ядрі клітини збільшується кількість хромосом кратне гаплоїдному (одинарному) набору непарних хромосом. 5. Амітоз із формуванням дво- чи багатоядерних клітин – при цьому клітини зберігають властиву їм функціональну активність, яка майже повністю припиняється при мітозі. 6. Атрофія клітин – зменшення розмірів цитоплазми і ядра клітин при обмеженні функції клітин або при зниженні їх трофічного забезпечення. 7. Метаплазія клітин – стійке заміщення диференційованих клітин одного типу диференційованими клітинами іншого типу при збереженні основної видової належності тканини. Метаплазія тканини - перехід одного виду тканини в інший в межах одного зародкового листка. Компенсаторно-пристосувальні процеси (механізми, реакції) – це механізми, що компенсують дію зовнішніх чинників на організм і дають йому можливість пристосовуватися до існування в навколишньому середовищі. Ці процеси проявляються морфологічною перебудовою організму з відповідними змінами функцій. При пошкодженні різних структур організму компенсаторнопристосувальні процеси направлені на їх відновлення. Такі процеси називають відновлювальними. До компенсаторно-пристосувальних процесів відносять атрофію, гіпертрофію та гіперплазію, регенерацію, склероз, організацію, інкапсуляцію, метаплазію та перебудову органів і тканин. 4 Гіпертрофія - збільшення розмірів органа або його частини завдяки збільшенню розмірів клітин. Гіперплазія - збільшення розмірів органа або його частини в результаті збільшення кількості клітин. Атрофія - прижиттєве зменшення об'єму органу або його частини за рахунок зменшення розмірів (кількості) клітин. Організація - заміщення сполучною тканиною нежиттєздатних тканин і чужорідних тіл. Склероз – заміщення нормальної тканини органів сполучною тканиною. Інкапсуляція - розміщення в оболонці, ізоляція, закриття чого-небудь стороннього (чужорідних тіл, паразитів і т. д.) з метою виключення впливу на оточуючі тканини організму. Регенерація – відновлення структурних елементів тканини замість загиблих. Пристосувальні реакції здійснюються на принципах автоматизації і ауторегуляції. Компенсаторні реакції носять стадійний характер. В умовах патології розрізняють наступні фази (стадії) компенсаторно-пристосувальних процесів (компенсації): 1) фаза становлення (син.: аварійна) – характеризується включенням структурних резервів організму з відповідними змінами їх функції у відповідь на дію патогенного чинника; 2) фаза стабілізації (син.: компенсації, закріплення) – характеризується перебудовою структури органу з відповідними змінами його функціонування для забезпечення місцевого й загального гомеостазу в умовах дії патогенного чинника; 3) фаза декомпенсації (син.: виснаження компенсації) – виникає при недостатності компенсаторно-пристосувальних змін, внаслідок чого розвиваються різноманітні порушення роботи органів і тканин. ГІПЕРТРОФІЯ Гіпертрофія – це збільшення об’єму органу чи тканини за рахунок збільшення розміру кожної клітини. Гіпертрофія може відбуватись як за рахунок збільшення об’єму структурних елементів (клітин, сполучнотканинних волокон) органу чи тканини (власне гіпертрофія), так і за рахунок збільшення кількості їх структурних елементів (гіперплазії). Так, гіпертрофія селезінки, лімфатичних вузлів, сполучної тканини, кісткового мозку відбувається за 5 рахунок гіперплазії їх клітин. В той же час гіпертрофія міокарду, скелетних м’язів, нейронів головного мозку відбувається за рахунок гіпертрофії клітин. До гіпертрофії не відносять природжене збільшення органів і тканин (вади розвитку), збільшення об’єму органів і тканин у зв’язку з ростом організму та в результаті їх набряку, запальні розростання, збільшення порожнинних органів при переповненні їх вмістом чи ексудатом. Гіпертрофія може бути фізіологічною й патологічною. Також виділяють справжню та несправжню гіпертрофію. Справжня гіпертрофія відбувається за рахунок пропорційного збільшення об’єму всіх структурних елементів органу, в першу чергу паренхіматозних. Несправжня гіпертрофія (син.: псевдогіпертрофія) – це збільшення органу за рахунок розростання в ньому жирової та (або) сполучної тканини. У трубчастих і порожнинних органах (шлунок, кишечник, сечовий міхур тощо) гіпертрофія може бути концентричною (супроводжується звуженням порожнини органу) та ексцентричною (супроводжується розширенням порожнини органу). Несправжня гіпертрофія – при атрофії паренхіматозних клітин органів і тканин Патологічна гіпертрофія – це збільшення об’єму органу чи тканини під впливом незвичайних або надмірних за своєю силою чинників. За етіопатогенезом патологічну гіпертрофію поділяють на робочу (компенсаторну), вікарну (замісну), гормональну (корелятивну, нейрогуморальну), вакатну, гіпертрофічні розростання. Найчастіший вид гіпертрофії - це робоча гіпертрофія, яка зустрічається як в умовах фізіології, так і при деяких патологічних станах. Причиною її є посилене навантаження, до органу або тканини. Прикладом робочої гіпертрофії в фізіологічних умовах може служити гіпертрофія скелетної мускулатури і серця у спортсменів, у осіб важкої фізичної праці. В умовах патології робоча гіпертрофія розвивається в тих випадках, коли в результаті хворобливого процесу органу або частини органу доводиться посилено працювати. Іншими словами, робоча гіпертрофія - це гіпертрофія посилено функціонуючого органу. 6 Робоча гіпертрофія спостерігається в тканинах, що складаються з стабільних клітин, в яких адаптація до підвищеного навантаження не може бути реалізована шляхом збільшення кількості клітин. Такий вид гіпертрофії часто зустрічається в порожнистих органах, що мають стінку з гладкої мускулатури: стінка шлунка, кишечника, сечового міхура. Вона є морфологічним виразом хронічної непрохідності. Причини цієї непрохідності різні, наприклад, рубцевий стеноз воротаря в результаті загоєння виразки шлунка або цибулини 12-палої кишки, екзофітно зростаючі (тобто ростуть у просвіт) пухлини кишечника, аденоматозна гіперплазія передміхурової залози, яка сечівник, перешкоджає виведенню сечі з сечового міхура. Компенсація функції цих органів відбувається за рахунок збільшення обсягу гладкої мускулатури стінки вище місця перешкоди. Результат робочої гіпертрофії на прикладі серця. В принципі, робоча гіпертрофія процес оборотний за умови, що причину вчасно усунено. Наприклад, якщо хворому вчасно зроблена реконструктивна операція при вродженому або придбаному пороці серця, то зміни серця можуть мати зворотний розвиток і відбувається повернення до норми. Але на практиці така можливість рідкісна. Часто результатом є декомпенсація гіпертрофованого серця в зв'язку з тим, що процес гіпертрофії обмежений можливістю кровопостачання органу. Згодом, у міру наростання маси органу, виникає відносна недостатність кровопостачання, тобто виникає хронічна ішемія. Порушуються обмінні процеси в гіпертрофованому серці, виникають дистрофічні зміни, а потім незворотні зміни - загибель клітин з розростанням на їхньому місці сполучної тканини, тобто розвивається декомпенсація. Значення. Розвиток в органі гіпертрофії, безсумнівно, має позитивне значення, оскільки дозволяє зберегти функцію органу, незважаючи на захворювання. Цей період в клініці називається стадією компенсації. Надалі, коли в органі виникають дистрофічні зміни, відбувається ослаблення функції і, в кінцевому рахунку, коли адаптаційні механізми вичерпані, настає декомпенсація органу. А стосовно до серця - розвивається серцева недостатність, яка і є причиною смерті хворого. Вікарна (різновид робочої гіпертрофії) – при випадінні функції частини органу (в печінці, легенях) або одного з парних органів (нирка, легені). Гормональна. Прикладом фізіологічної гормональної гіпертрофії може служити гіпертрофія матки при вагітності. В умовах патології гормональна гіпертрофія виникає в результаті порушень функції ендокринних залоз. Прикладом такої гіпертрофії може служити акромегалія (від грец. Akros 7 крайній, виступаючий, megalos - великий), обумовлена гіперфункцією передньої долі гіпофіза з надмірною продукцією соматотропного гормону, що виникає зазвичай на грунті еозинофільної аденоми. При акромегалії відбувається збільшення органів і виступаючих частин скелета. При видаленні пухлини процес звернемо. Вакатна – при розростаннях тканин у простір, що звільнився внаслідок різних патологічних процесів (розростання жирової тканини в капсулі нирки при її атрофії тощо). Гіпертрофічні розростання – при дії на органи й тканини фізичних і хімічних подразників (гіпертрофія шкіри, особливо її рогового шару, внаслідок тертя збруї тощо), хронічному запаленні, застої та стазі лімфи. При несправжній гіпертрофії в органах і тканинах знаходять розростання жирової та (або) сполучної тканини. ГІПЕРПЛАЗІЯ Гіперплазія - збільшення розмірів органа або тканини в результаті збільшення числа клітин. Гіперплазія спостерігається при стимуляції мітотичної активності клітин, що призводить до збільшення їх числа. Розрізняють реактивну, або захисну гіперплазію, нейрогуморальную, або гормональну гіперплазію і замісну компенсаторну при втраті крові. Реактивна, або захисна гіперплазія виникає в імунокомпетентних органах - в тимусі, селезінці, лімфатичних вузлах, червоному кістковому мозку, мигдаликах, лімфатичному апараті кишечника і ін. Причини цієї гіперплазії різні. Гіперплазія еритроцитарного паростка кісткового мозку може бути пов'язана з підвищеним руйнуванням еритроцитів (гемолітичні процеси) або тривалої гіпоксією (проживання у високогірних районах), миелоидного - з підвищеною потребою організму в нейтрофілах, наприклад, при запаленні. Гіперплазія лімфатичних вузлів це, як правило, відповідь на антигенну стимуляцію. Гіперплазія селезінки спостерігається при септичних станах. При гіперплазії селезінка збільшується в розмірах, набуває в'ялої консистенції і, якщо провести по поверхні розрізу ножем, дає зішкріб пульпи. Лімфатичні вузли збільшуються в розмірах, стають соковитими, рожевочервоного кольору. Мікроскопічно відзначається розростання 8 імунокомпетентних клітин. Кістковий мозок діафізу стегна при септичних станах стає червоним за рахунок гіперплазії клітин мієлоїдного ряду. Гормональна гіперплазія виникає в органах-мішенях під дією гормонів. Вона може спостерігатися і в нормі. Наприклад, гіперплазія молочної залози при вагітності і лактації. Прикладами гормональної гіперплазії в умовах патології можуть служити: Гіперплазія ендометрію, яка виникає в результаті підвищеної стимуляції ендометрію естрогенами, особливо при ановуляторних менструальних циклах, коли відсутнє вироблення прогестерону при склерокистозе яєчників у молодих жінок і у жінок в клімактеричному періоді. У слизовій оболонці розвивається гіперплазія залоз, іноді з кістозним розширенням просвіту - так звана залозисто-кістозна гіперплазія ендометрію. При цьому виникають метроррагии - нерегулярні, часті надмірні маткові кровотечі. Фіброзно-кістозна мастопатія також виникає в результаті порушення гормональної функції яєчників, проявляється гіперплазією і перебудовою ацинусів і вивідних проток молочної залози. Ці ділянки залози набувають вигляду щільних білих вузлів і в клініці їх необхідно диференціювати з істинними пухлинами. Гіперплазія органів-мішеней часто супроводжується збільшенням їх функції. Так, при гіперплазії наднирників внаслідок надмірної секреції АКТГ спостерігається збільшена секреція кортизолу (синдром Кушинга). Гіперплазія щитовидної залози (токсичний зоб, хвороба Грейвса) виникає при збільшенні кількості ТТГ або при дії аутоантитіл, які здатні зв'язуватися з рецепторами до ТТГ на мембранах клітин щитовидної залози. Еутиреоїдний зоб виникає при нестачі йоду у воді, ґрунті, може бути ендемічним. Гіперплазія передміхурової залози, часто виникає в літньому віці, супроводжується гіперплазією і залозистої тканини, і строми. Причина не відома, проте припускають, що вона відбувається в результаті зниження рівня андрогенів. Збільшення передміхурової залози супроводжується застоєм сечі, утворенням каменів, нерідко розвитком висхідної інфекції. При атрофії яєчок в грудній залозі чоловіків розвивається гіперплазія залізистих часточок, що призводить до збільшення розмірів усієї залози - відзначається гінекомастія (від грец. Gyne - жінка, mastos - груди). Патолого-анатомічні зміни. Органи при гіпертрофії збільшені в розмірах, але зберігають свою форму. Колір органів більш виразний. Краї печінки й 9 селезінки заокруглені. При гіпертрофії за рахунок гіперплазії в частині випадків, крім того, капсула може бути напруженою, а паренхіма випинатись над поверхнею розрізу. При гіпертрофії трубчастих і порожнинних органів (шлунок, кишечник, сечовий міхур тощо) товщина їх стінки збільшується за рахунок гіпертрофії та (або) гіперплазії їх м’язового шару. В сечовому міхурі при цьому з боку слизової оболонки видно м’язові трабекули (трабекулярна гіпертрофія). Залозисті органи (печінка, щитоподібна залоза, молочні залози та ін.) при виразній гіпертрофії набувають вузлуватого вигляду. Тканини при гіпертрофії займають об’єм значно більший за звичайний. В одних випадках (гіпертрофія м’язів) вони зберігають свою форму, а в інших (гіпертрофічне розростання сполучної й жирової тканин тощо) – їх форма змінюється. Мікроскопічні зміни. При власне гіпертрофії розміри клітин, в першу чергу паренхіматозних, і їх ядер збільшується, що призводить до збільшення розмірів інших структурних одиниць (часточок печінки, ацинусів залоз тощо). Строма в більшості випадків гіпертрофується лише при досить інтенсивному процесі, переважно за рахунок гіперплазії фібробластів і сполучнотканинних волокон. АТРОФІЯ Атрофія – прижиттєве зменшення об'єму тканини або органу за рахунок зменшення розмірів кожної клітини, а в подальшому - числа клітин, які складають тканину, що супроводжується зниженням або припиненням їх функції. Звертаємо увагу, що атрофія, яка характеризується зменшенням розміру нормально сформованого органу, відрізняється від агенезії, аплазії і гіпоплазії, які є патологією розвитку органу. Агенезія - повна відсутність органу і його закладки в зв'язку з порушенням ходу онтогенезу. Аплазія - недорозвинення органу, який має вигляд раннього зачатка. Гіпоплазія - не повний розвиток органу (орган частково зменшений в розмірі). Атрофія може бути фізіологічною та патологічною, вогнищевою та дифузною, рівномірною й нерівномірною. Фізіологічна атрофія спостерігається протягом усього життя людини. Так, після народження атрофуються і 10 облітеруючий пупкові артерії, артеріальна (боталова) протока. У літніх людей атрофуються тимус і статеві залози. Сенільна (стареча) атрофія: зменшення кількості клітин - одне з морфологічних проявів процесу старіння. Цей процес має найбільше значення в тканинах, утворених постійними клітинами, наприклад, в мозку і серці. Атрофія при старінні часто обтяжується атрофією в результаті впливу супутніх факторів, наприклад, ішемії. Патологічна атрофія виникає в результаті дії на організм різних патогенних чинників. Загальна патологічна атрофія виникає при виснаженні (кахексії) будь-якого походження. Патологічна атрофія може мати місцевий і загальний характер. Місцева атрофія. Розрізняють такі види місцевої патологічної атрофії залежно від причини і механізму розвитку: Атрофія від бездіяльності (дисфункциональная атрофія): розвивається в результаті зниження функції органу. Вона спостерігається, наприклад, в іммобілізованих скелетних м'язах і кістках (при лікуванні переломів). При тривалому постільному режимі, гіподинамії скелетні м'язи атрофуються досить швидко внаслідок бездіяльності. В першу чергу спостерігається швидке зменшення розмірів клітин, які також швидко відновлюють обсяг при поновленні активності. При більш тривалій іммобілізації м'язові волокна зменшуються і в розмірах, і в якій кількості. Так як скелетні м'язи може регенерувати в обмеженому обсязі, відновлення розмірів м'язів після втрати м'язових волокон відбувається в основному шляхом компенсаторної гіпертрофії залишилися в живих волокон, на що потрібен тривалий період відновлення. Атрофія кістки полягає в тому, що резорбція кістки відбувається швидше, ніж її формування; це проявляється зменшенням розмірів трабекул (зменшення маси), що призводить до остеопорозу від бездіяльності. Крім того, прикладами дисфункціональної атрофії можуть служити атрофія зорового нерва після видалення ока; країв зубної комірки, позбавленої зуба. Атрофія, викликана недостатністю кровопостачання, розвивається внаслідок звуження артерій, що живлять даний орган. Зменшення кровотоку (ішемія) в тканинах в результаті захворювань артерій призводить до гіпоксії, внаслідок чого виникає зменшення об'єму клітин, їх кількості - діяльність паренхіматозних органів знижується, розмір клітин зменшується. Гіпоксія стимулює проліферацію фібробластів, розвивається склероз. Такий процес спостерігається в міокарді, коли на фоні прогресуючого атеросклерозу вінцевих 11 артерій розвивається атрофія міокарду з розростанням на місці атрофованих м’язових волокон волокнистої сполучної тканини (дифузний кардіосклероз); при прогресуючому склерозі вінцевих артерій серця; атрофія й зморщування нирок при склерозі їх судин – артеріосклеротично зморщена нирка); хвороби судин мозку, наприклад, проявляються мозковою атрофією, яка включає в себе і загибель нейронів. Атрофія від тиску: тривале здавлювання тканини викликає атрофію. Велике, інкапсульоване доброякісне новоутворення в спинномозковому каналі може викликати атрофію спинного мозку. Ймовірно, цей вид атрофії виникає через здавлення дрібних кровоносних судин, що призводить до ішемії, а не від прямого впливу тиску на клітини. При тиску аневризми в тілах хребців і в грудині можуть з'являтися узури. Атрофія від тиску виникає в нирках при скруті відтоку сечі. Сеча розтягує просвіт балії, здавлює тканину нирки, яка перетворюється в мішок з тонкими стінками, що позначають як гідронефроз. При утрудненні відтоку спинномозкової рідини відбуваються розширення шлуночків і атрофія тканини мозку - гідроцефалія. Атрофія при денервації (нейротичні атрофія): стан скелетної мускулатури залежить від функціонування иннервирующего нерва, що необхідно для збереження нормальної функції і структури. Пошкодження відповідного мотонейрона в будь-якій точці між тілом клітини в спинному мозку і моторної кінцевий платівкою веде до швидкої атрофії м'язових волокон, які іннервуються цим нервом (при поліомієліті, при запаленні нервів). При тимчасової денервації за допомогою фізіотерапії та електричної стимуляції м'язів можна запобігти загибелі м'язових волокон і гарантувати відновлення нормальної функції при поновленні функціонування нерва. Атрофія в результаті нестачі трофічних гормонів: ендометрій, молочна залоза і велика кількість ендокринних залоз залежать від трофічних гормонів, необхідних для нормального клітинного росту і зменшення кількості цих гормонів веде до атрофії. При зменшенні секреції естрогену в яєчниках (пухлини, запальні процеси) спостерігається атрофія ендометрію, вагінального епітелію і молочної залози. Хвороби гіпофіза, що супроводжуються зменшеною секрецією гіпофізарних трофічних гормонів, призводять до атрофії щитовидної залози, надниркових і статевих залоз. Лікування кортикостероїдами наднирників у високих дозах, яке іноді використовується для імуносупресії, викликає атрофію надниркових залоз через придушення секреції гіпофізарного кортикотропіну (АКТГ). Такі пацієнти швидко втрачають здатність до секреції кортизолу і стають залежними від екзогенних стероїдів. Скасування стероїдної 12 терапії у таких пацієнтів повинна бути досить поступової, щоб встигла відбутися регенерація атрофованих наднирників. Атрофія під впливом фізичних і хімічних факторів. Під дією променевої енергії атрофія особливо виражена в кістковому мозку, статевих органах. Йод і тиоурацил пригнічують функцію щитовидної залози, що веде до її атрофії. Зовнішній вигляд органа при місцевій атрофії різний. У більшості випадків розміри органа зменшуються, поверхня його гладка (гладка атрофія). При гладкою атрофії зменшується складчастість слизової оболонки шлунковокишкового тракту. Рідше органи, наприклад, нирки, печінку, приймають зернистий або горбистий вид (зерниста атрофія). При гідронефрозі, гідроцефалії, помилковій гіпертрофії (збільшення органу в обсязі за рахунок стромального компонента) органи збільшені в розмірах, але не за рахунок збільшення обсягу паренхіми, а внаслідок скупчення рідини або розростання жирової клітковини. У порожніх органах розрізняють концентричну і ексцентричну атрофію. Бура атрофія характеризується зменшенням розмірів клітин, яке відбувається за рахунок зменшення кількості цитоплазми і числа цитоплазматичних органел і зазвичай пов'язано зі зниженням інтенсивності метаболізму. Органели, які піддаються дистрофічних змін, виявляються в лізосомних вакуолях, де вони піддаються ферментативному руйнування (аутофагія). Залишкові мембрани органел часто накопичуються в цитоплазмі як коричневий пігмент - липофусцин (пігмент зношування). Зменшення кількості клітин виникає через порушення балансу між рівнями проліферації клітин і їх загибелі протягом тривалого періоду. Змішана атрофія – внаслідок дії декількох факторів (наприклад, атрофія печінкових балок і гепатоцитів при хронічній венозній гіперемії та при амілоїдозі виникає як внаслідок тиску крові, що знаходиться у внутрішньочасточкових капілярах, так і в результаті зниження процесів метаболізму внаслідок гіпоксії та порушення надходження поживних речовин). Загальна атрофія, або виснаження (кахексія) має наступні причини: атрофія через нестачу поживних речовин: важке білкове та калорійне голодування призводить до спользование тканин організму, в першу чергу скелетної мускулатури, як джерело енергії і білків після того, як інші джерела (глікоген і жири в жирових депо) виснажуються. Така атрофія виникає також при хворобах травного тракту внаслідок зниження його здатності перетравлювати їжу. 13 ракова кахексія (при будь-якої локалізації злоякісної пухлини); ендокринна (гіпофізарна) кахексія (хвороба Симмондса при ураженні гіпофіза, при підвищенні функції щитовидної залози тиреотоксическом зобі); церебральна кахексія (ураження гіпоталамуса); виснаження при хронічних інфекційних захворюваннях (туберкульоз, бруцельоз, хронічна дизентерія). Зовнішній вигляд хворих при виснаженні характерний. При загальній атрофії в першу чергу зникає жир з жирових депо, потім атрофуються скелетні м'язи, потім - внутрішні органи, в останню чергу - серце і мозок. Відзначається різке схуднення, підшкірна клітковина відсутня, там, де вона збереглася, має оранжеве забарвлення (накопичення пігменту ліпохроми). М'язи атрофічний, шкіра суха, в'яла. Внутрішні органи зменшені в розмірах. У печінці і міокарді відзначаються явища бурої атрофії (накопичення в клітинах ліпофусцину). Значення атрофії для організму визначається ступенем зменшення органа і зниження його функції. Якщо атрофія і склероз не досягнули великій мірі, то після усунення причини, що викликала атрофію, можливе відновлення структури і функції. Далеко зайшли атрофічні зміни незворотні. Патолого-анатомічні зміни. Органи й тканини зменшуються в об’ємі за рахунок зменшення об’єму паренхіми. При дифузній рівномірній атрофії форма їх не змінюється, поверхня органів гладка (гладка атрофія). При вогнищевій атрофії чи дифузній нерівномірній атрофії (особливо в поєднанні з рубцевим стягуванням) поверхня органів стає зернистою (зерниста атрофія) чи бугристою. Це може призводити до їх деформації. При зниженні кровонаповнення колір органів і тканин стає більш блідим. Капсула органів у частині випадків потовщується. Консистенція внаслідок зміни співвідношення строми й паренхіми (а в частині випадків – й одночасного розростання волокнистої сполучної тканини) ущільнена. Краї печінки й селезінки загострюються й ущільнюються, стаючи схожими на шкіру (шкіроподібні краї). Стінки трубчастих і порожнинних органів (серце, кишечник, матка тощо) тоншають. Якщо при цьому звужується їх просвіт, говорять про концентричну атрофію, а якщо просвіт, навпаки, розширюється – про ексцентричну атрофію. Якщо атрофія супроводжується відкладанням в органи й тканини ліпофусцину (що особливо характерне для періоду старіння), вони набувають буро-коричневого кольору (бура або стареча бура атрофія). При атрофії серця його вінцеві судини стають звивистими. При атрофії скелетних м’язів вони в частині випадків збільшуються в об’ємі за рахунок 14 розростання міжм’язових (псевдогіпертрофія мязів). прошарків сполучної й жирової тканин Мікроскопічні зміни. Паренхіматозні клітини органів спочатку зменшуються в розмірах внаслідок зменшення об’єму цитоплазми (внаслідок втрати води й білків), яка більш інтенсивно зафарбовується барвниками. Ядра клітин спочатку не змінюються, але внаслідок зменшення розміру клітин здаються зближеними й більш численними. Потім ядра зменшуються й стають більш інтенсивно зафарбованими (гіперхроматоз ядра). З часом зменшується й кількість паренхіматозних клітин. Іноді, як прояв компенсаторної регенерації, виявляється амітотичний поділ клітин з появою двоядерних клітин. Посмуговані м’язи атрофуються нерівномірно: одні пучки м’язів товсті, інші – тонкі або зовсім зникають (залишаються тільки ядра, кількість яких здається збільшеною). Сполучнотканинна строма зберігається, а в частині випадків (особливо при дисциркуляторній атрофії та при атрофії скелетних м’язів) навіть гіпертрофується (склероз), заміщуючи атрофовану паренхіму. Лише при сильно вираженій атрофії в частині випадків відбувається атрофія строми й судин. При цьому реєструється руйнування й базофілія колагенових та еластичних волокон. Також можливе розростання на місці атрофованої паренхіми органів жирової тканини. Ліпофусцин при атрофії найчастіше відкладається в цитоплазмі м’язових клітинах міокарду (біля полюсів ядер), гепатоцитів (переважно в центральній частині часточок), волокнах скелетних м’язів, в клітинах центральної та вегетативної нервової систем. СКЛЕРОЗ Склероз – це розростання щільної волокнистої сполучної тканини в органах (печінці, нирках тощо) тканинах (шкірі, клапанах серця тощо) чи стінках судин. Склероз може бути вогнищевим і дифузним, рівномірним і нерівномірним. Вогнищевий склероз серцевого м’язу називається кардіосклерозом, а дифузний – міофіброзом. Склероз легень називають пневмосклерозом, заростання волокнистою сполучною тканиною плевральної порожнини – фібротораксом, розростання цієї ж тканини в стінці вени (головним чином в медії) – флебофіброзом. Склероз виникає: 1) як закінчення проліферативного (частіше хронічного) запалення; 2) внаслідок руйнування чи дисрофічних змін сполучної тканини; 15 3) при атрофії паренхіматозних клітин органів і тканин (замісний склероз); 4) при порушеннях кровообігу. В усіх випадках причиною склерозу є в першу чергу гіпоксія тканин, оскільки вона ініціює активацію розмноження фібробластів і фіброцитів та (або) активацію продукування цими клітинами колагенових волокон, що призводить до розростання в зоні гіпоксії щільної волокнистої сполучної тканини. Склероз печінки (цироз) виникає при венозній гіперемії, хронічних гепатозах і гепатитах (особливо тих, що супроводжуються некрозом гепатоцитів). Склероз легень – при хронічній венозній гіперемії, ателектазі, хронічних пневмоніях, дії іонізуючого опромінення, токсичних і деяких лікарських речовин. Кардіосклероз і міофіброз – при хронічній ішемії в зв’язку з коронарною недостатністю, метаболічних кардіопатіях (електролітних, адреналінових, тіреотоксичних тощо), продуктивних міокардитах. Патолого-анатомічні зміни. При слабо вираженому склерозі помітного ущільнення органів і тканин не відбувається. Такий стан часто називають фіброзом, але чіткої границі між термінами „склероз” і „фіброз” немає. При помірно вираженому дифузному склерозі консистенція органів і тканин ущільнюється, але форма їх зберігається або змінюється не сильно. При сильно вираженому дифузному склерозі тканини помітно ущільнюються й потовщуються й стають більш блідими. Органи також помітно ущільнюються, стають більш блідими та досить рівномірно збільшуються (псевдогіпертрофія). На розрізі знаходять щільні вогнища й тяжі фіброзної сполучної тканини білуватого чи блідо-сірого кольору. При нерівномірному дифузному склерозі органи й тканини помітно деформуються. В них знаходять щільні вогнища й вузли, які на розрізі мають білуватий чи блідо-сірий колір. Такий стан органів називають цирозом. Вогнищеві фіброзні зрощення органів і тканин між собою чи зі стінками серозних і синовіальних порожнин тіла, або ж зростання самих цих стінок між собою (наприклад, зрощення костальної та легеневої плевр, вогнищеве зрощення стінки тонкої кишки з очеревиною, вогнищеве зростання печінки та 16 стінки тонкої кишки тощо) називають синехіями (син.: комісури, спайки, шварти). Мікроскопічні зміни. В паренхімі органів і тканин виявляють вогнищеве чи дифузне розростання щільної волокнистої сполучної тканини. Часто таке розростання супроводжується атрофією паренхіми. ОРГАНІЗАЦІЯ Організація - це процес заміщення будь-яких нежиттєздатних тканин або вогнищ патологічних процесів (вогнищ некрозу, інфаркту, гематом, тромботичних мас, інфекційних гранульом тощо) сполучною тканиною. Заміщення ділянки омертвіння, ексудату, тромботичних мас сполучною тканиною відбувається в тому випадку, якщо маси піддаються розсмоктуванню чи резорбції і одночасно, за умови відсутності повної репаративної регенерації, в них вростає молода сполучна тканина, яка перетворюється після цього в рубцеву. Патолого-анатомічні зміни. Спочатку патологічні вогнища ущільнюються, а з часом на їх місці утворюються щільні осередки волокнистої сполучної тканини білуватого чи блідо-сірого кольору. Значення процесу організації не однозначне. З біологічної точки зору, будучи пристосувальним процесом, організація має позитивне значення, оскільки обмежує вплив мертвих тканин і чужорідних тіл на організм. З точки зору клінічної практики, організація може мати негативне значення. Наприклад, при організації ексудату в плевральній порожнині утворюються спайки між вісцеральною і парієтальною плеврою, що порушує присмоктуючу функцію грудної клітки і таким чином сприяє розвитку легенево-серцевої недостатності. Негативне значення має і організація ексудату в альвеолах легені - карніфікація, призводить до зменшення дихальної функції легень. При наявності спайок в черевній порожнині може розвинутися кишкова непрохідність. Організація ексудату в мозкових оболонках може порушувати відтік ліквору і призвести до розвитку гідроцефалії. ІНКАПСУЛЯЦІЯ Інкапсуляція (осумкування) – це утворення сполучнотканинної капсули навколо омертвілих мас, тваринних паразитів, чужорідних тіл (шовний матеріал), які не розсмоктуються, внаслідок реактивного розростання сполучної тканини. За своєю суттю інкапсуляція є захисною реакцією організму, 17 спрямованою на ізоляцію чужорідного тіла чи вогнища патологічного процесу від організму тварини. Патолого-анатомічні зміни. На розтині знаходять чужорідне тіл або вогнище патологічного процесу (вогнище некрозу, інфаркту, гематому, інфекційну гранульому тощо), оточені щільною капсулою білуватого чи блідосірого кольору. Якщо розсмоктування патологічного вогнища починається раніше й відбувається швидше за розростання навколо нього щільної волокнистої сполучної тканини, утворюється осумкована заповнена рідиною порожнина (осумкована кіста). Процес утворення такої кісти називають інцистуванням. МЕТАПЛАЗІЯ Метаплазія – це перехід одного виду тканини в інший, споріднений вид, в межах одного зародкового листка, що супроводжується відповідною перебудовою структури й функції тканин. Метаплазія виникає через неправильне диференціювання стовбурових клітин. «Нова» метапластична тканина структурно нормальна, тому що є чітка клітинна організація. Метаплазія носить пристосувальний характер і зазвичай спостерігається при наявності будь-якого хронічного фізичного або хімічного подразнення. До метаплазії не відносять гетеротопію та гетероплазію, при яких тканини з’являється в нехарактерних для них місцях внаслідок природжених вад розвитку. Метаплазія виникає при: 1) процесах регенерації, що вимагають диференціації клітин одного виду в клітини іншого виду для кількісного поповнення популяції зруйнованих клітин; 2) порушенні процесів регенерації, коли порушується диференціація клітин, які утворились з стовбурових; 3) дії на клітини й тканини різних патогенних чинників, здатних викликати метаплазію (наприклад, утворення багатошарового зроговілого епітелію на місці призматичного епітелію слизових оболонок при гіповітамінозі А). Пряма метаплазія – це безпосереднє перетворення клітин одного виду в клітини іншого виду (наприклад, фібробласти можуть змінювати свою внутрішньо-клітинну організацію й перетворюватись на гладкі м’язові клітини, ходндробласти – на остеобласти тощо). Непряма метаплазія – це перетворення клітин одного виду в клітини іншого виду в процесі їх поділу. 18 Зміну зовнішньої форми клітин, що не супроводжується їх ультраструктурною перебудовою та зміною функції, називають несправжньою метаплазією (неаприклад, сплощення кубічного епітелію при переповненні залоз секретом, сплощення призматичного епітелію до кубічного чи плоского при закритті дефекту, що виникає внаслідок руйнування частини епітеліальних клітин тощо). Якщо новоутворені клітини за ступенем свого розвитку (диференціації) стоять вище від попередніх, говорять про прогресивну метаплазію (наприклад, утворення багатошарового зроговілого епітелію на місці призматичного епітелію слизових оболонок – епідермальна метаплазія). Якщо ж новоутворені клітини за ступенем свого розвитку стоять нижче від попередніх, говорять про говорять про регресивну метаплазію (наприклад, утворення з клітин невроглії епендими бокових шлуночків головного мозку). Перехід клітин в зворотному напрямку (повернення їх до клітин первинного виду) називають прозоплазією. Метаплазія найчастіше спостерігається в епітелії. Прикладом може служити луската (сквамозна) метаплазія (найбільш частий тип епітеліальної метаплазії), при якій одношаровий призматичний або кубічний епітелій замінюється багатошаровим плоским зроговілому епітелієм. Сквамозна метаплазія найчастіше спостерігається в епітелії шийки матки і слизової оболонки бронхів, рідше вона зустрічається в ендометрії і сечовому міхурі. У бронхах ця метаплазія розвивається при хронічному, рідше - гострому (коровий бронхіт) запаленні. Залозиста метаплазія спостерігається в стравоході, при цьому нормальний багатошаровий епітелій замінюється на залозистий епітелій (шлункового або кишкового типу), який секретує слиз. Причиною зазвичай є рефлюкс кислого шлункового соку в стравохід. Метаплазія може також відбуватися в шлунку і кишечнику, наприклад, заміна шлункової слизової оболонки кишкової слизовою оболонкою (кишкова метаплазія) або навпаки (шлункова метаплазія). Також залозиста метаплазія може спостерігатися в гермінативному епітелії яєчника у вигляді формування серозних і слизових кіст. Рідше метаплазия відбувається в сполучній тканині. Найкращий приклад осифікація в рубцях і інших фібробластичних проліфераціях. Метаплазія сполучної тканини, як і епітеліальна метаплазія, може служити доказом 19 можливості диференціювання стовбурових клітин сполучної тканини в різних напрямках. Метаплазія реверсивна (оборотна). Позитивне значення метаплазії і мотиви віднесення її до групи компенсаторно-пристосувальних процесів обумовлені її захисною суттю: коли в умовах, що змінилися життєдіяльності органу або тканини стає неможливим функціонування і виживання притаманного йому виду клітин, то оптимальною є, на противагу їх повної відсутності, заміна не характерні, але більш пристосованими до патологічних умов клітинами. У більшості випадків метаплазія не має великого клінічного значення, проте, в деяких органах вона може викликати значні функціональні порушення. Наприклад, втрата війок і накопичення слизу в бронхах може сприяти проникненню інфекції і розвитку запалення легеневої паренхіми. Метапластична тканина структурно нормальна і сама метаплазія не є небезпекою в плані розвитку пухлини. Однак, при виникненні диспластичних змін, які досить часто розвиваються в ділянках метаплазії внаслідок супроводжуючих її порушень диференціювання і детермінації, ризик утворення пухлини різко зростає. Наприклад, сквамозна карцинома може розвиватися в метапластичному зроговілому епітелії бронхів; аденокарцинома може виникнути в стравоході з метапластичного залозистого епітелію. Патолого-анатомічні зміни. Метаплазія частіше реєструється в епітелії й сполучній тканині, рідше – в інших тканинах і органах. При метаплазії призматичного епітелію слизових оболонок у багатошаровий зроговілий реєструються ознаки лейкоплакії (див. рогову дистрофію). В ході регенераторного процесу на місці пошкодження шляхом метаплазії утворюється характерна для даної ділянки тіла тканина (наприклад, метаплазія сполучної тканини, що утворилася на місці дефекту, в гладку м’язову, хрящову чи кісткову тканину тощо). Мікроскопічні зміни. В багатьох випадках метаплазія виявляється лише під мікроскопом. Досить часто вона виникає в епітелії шлунка, де може відбуватися кишкова, пілорична та війчаста метаплазії. Кишкова метаплазія епітелію шлункових ямочок (ентеролізація слизової оболонки шлунка) виникає при порушенні процесів оновлення клітинної популяції шлункових ямочок (особливо при порушенні регенерації внаслідок атрофічного гастриту чи раку шлунка). Може бути повною й неповною. Реєструється переважно на поверхні слизової оболонки. При повній кишковій метаплазії епітеліальні 20 клітини шлунка стають повністю подібними до епітеліоцитів кишечнику, між ними з’являються келихоподібні клітини. При неповній кишковій метаплазії в шлункових ямочках відсутні клітини Панета. Між стовпчастими ШИКпозитивними клітинами розташовані келихоподібні клітини. Пілорична метаплазія епітелію шлункових ямочок являє собою трансформацію фундальних залоз в пілоричні. При повній пілоричній метаплазії, яка виникає при атрофічному гастриті, головні, додаткові й парієнтальні клітини зникають, а на їх місці знаходять кубічні клітини, характерні для пілоричних залоз (утворюються песевдопілоричні залози). При неповній пілоричній метаплазії, яка виникає в краях виразок або на місці загоєних виразок шлунка, утворюються подібні до пілоричних залози, в яких відсутні гастринпродукуючі клітини й гранули пепсиногену. Війчаста метаплазія епітелію шлункових ямочок характеризується появою в епітелії шлунку війчастих епітеліоцитів, які зазвичай вкривають слизову оболонку дихальних шляхів і маточних труб. Виникає при кістозному перетворенні шлункових залоз внаслідок їх дисплазії та аденокарциноми. В кишечнику можлива можлива метаплазія його епітелію в епітелій шлункових ямочок. В епітелії слизової оболонки жовчного міхура зустрічається кишкова, фундальна та пілорична метаплазія, частіше неповна. В стінці аорти при атеросклерозі в частині випадків відбувається метаплазія сполучної тканини в хрящову й кісткову тканину. ПЕРЕБУДОВА ТКАНИН І ОРГАНІВ Перебудовою органів і тканин називають зміну форми, розмірів і співвідношення їх структурних елементів. Вона є морфологічним проявом пристосування (адаптації) до зміни функціонування тканин і органів як при фізіологічних змінах інтенсивності їх функцій (фізіологічна перебудова органів і тканин), так і при дії на них різних патогенних чинників (патологічна перебудова органів і тканин). Перебудову органів і тканин у зв’язку з підвищенням на них функціонального навантаження називають акомодацією. Якщо така перебудова виявляється лише при мікроскопічному дослідженні, говорять про гістологічну акомодацію. Перебудова органів і тканин відбувається при будь-яких патологічних процесах, які призводять до зміни інтенсивності функцій органів і тканин. Патолого-анатомічні зміни. Морфологічно перебудова органів і тканин проявляється різноманітними процесами: гіпертрофією, атрофією, 21 організацією, гіперемією, колатеральним кровообігом тощо. Всі ці зміни в будь-яких комбінаціях призводять до більш чи менш значних змін загальної організації органів і тканин (співвідношення й топографії їх різних структурних елементів). РЕГЕНЕРАЦІЯ Регенерація (regeneratio - відродження) – це процес відновлення зруйнованих або втрачених тканин, органів або окремих частин тіла у живих істот. Регенерація - це відновлення як структури, так і функції. Чим нижчий ступінь організації організму, тим краще розвинуті у нього процеси регенерації. Зокрема, якщо морську губку розтерти в ступці до консистенції кашки, вона може відродитись як одна цілісна істота. Так само, якщо дощового черв’яка перерізати навпіл, із цих фрагментів утворяться два повноцінні черв’яки. Ящірка, яка перебуває на більш високому ступеню філогенетичного розвитку, при небезпеці здатна позбуватися свого хвоста, який у неї через деякий час знову відростає. У ссавців (в т.ч. і у людини) відродженню підлягають лише частини тканин. В основі будь-якої регенерації лежать 3 групи процесів: 1. відновлення гомеостазу; 2. компенсація пошкоджень; 3. пристосування організму до нових умов існування. Вказаний комплекс процесів отримав назву компенсаторнопристосувальні процеси. Ці процеси послідовно відбуваються у 3-х фазах: перша фаза – формування пристосувально-компенсаторних реакцій; друга фаза – повний розвиток пристосувально-компенсаторних реакцій; третя фаза – вичерпання процесу (закінчення процесу). У механізмах розвитку пристосувально-компенсаторних процесів першої фази визначну роль відіграють реакції з боку нервової системи, які обумовлюють реактивність організму і його здатність до регенерації. На етапі повного розвитку компенсаторно-пристосувальних реакцій (друга фаза) відбувається глибинна перебудова тканин. Наприклад, при переломах кісток, внаслідок зміни напрямку тиску на кістку, змінюється розташування кісткових балок. Ще одним прикладом є формування колатерального кровообігу, який розвивається при утрудненні кровотоку по магістральному руслу. Окрім того, можливим є також розвиток процесів метаплазії. Зокрема, 22 при переломах можливий перехід сполучної тканини у кісткову чи хрящову. В інших випадках (хронічні запальні процеси, тривалий вплив токсичних речовин та інш.) одні види епітелію можуть перетворюватися в інші. Наприклад, миготливий епітелій слизової одобонки бронхів у курців часто метаплазує в багатошаровий плаский епітелій. На етапі вичерпання пристосувально-компенсаторного процесу (третя фаза) можливе як відновлення організму (одужання), так і погіршення його стану (затягування хвороби та перехід її в хронічну форму). Вкрай несприятливим є остаточне вичерпання пристосувально-компенсаторних можливостей організму, яке закінчується його смертю. Необхідно зазначити, що розвиток компенсації та нормалізація функції не завжди автоматично означають одужання. Одужання настає у тих випадках, коли фаза закінчення компенсаторно-пристосувального процесу співпадає із закінченням хвороби. У тих же випадках, коли закінчення компенсаторнопристосувального процесу є лише епізодом хвороби, компенсація врешті-решт обов’язково закінчиться декомпенсацією (наприклад: декомпенсація при гіпертрофії міокарду, яка є тимчасовим компенсаторним пристосуванням при вадах серця). Регенерація може відбуватися на різних рівнях. В залежності від цього виділяють: 1) молекулярну регенерацію (різні форми поновлення молекул); 2) внутрішньоорганоїдну регенерацію (відновлення будови окремих структур органел клітини); 3) органоїдну регенерацію (відновлення будови окремих органел клітини); 4) клітинну регенерацію (відновлення будови окремих клітин); 5) тканинну регенерацію (відновлення будови окремих тканин); 6) регенерацію органів (відновлення будови окремих органів). Існує два механізми (дві форми) регенерації – внутрішньоклітинний і клітинний. Внутрішньоклітинна регенерація відбувається на молекулярному й субклітинному рівнях. Регенерація на молекулярному рівні характеризується підвищеним синтезом певних молекул. На субклітинному рівні регенерація відбувається шляхом гіпертрофії та гіперплазії ультраструктур клітини (апарату Гольджі, мітохондрій, рибосом, ядра тощо). У випадку збільшення розмірів (гіпертрофії) ультраструктур клітини говорять про внутрішньоорганоїдну регенерацію, а у випадку збільшення кількості (гіперплазії) ультраструктур клітини – про органоїдну регенерацію. Клітинна регенерація відбувається на рівні клітин, тканин і органів шляхом мітотичного й амітотичного поділу клітин. Вона протікає в дві фази (стадії): проліферації та диференціювання. В фазу проліферації відбувається 23 розмноження молодих, недиференційованих клітин, які називають стовбуровими (син.: камбіальні (від лат. cambium – обмін, зміна), клітинипопередники). В фазу диференціювання відбувається зміни структур клітин, спрямовані на забезпечення їх функціональної спеціалізації. Таблиця 1. Форми регенерації в органах і тканинах ссавців Клітинна регенерація Кістки Епідерміс Слизові оболонки Пухка сполучна тканина Ендотелій Кровотворна тканина Лімфоїдна тканина Мезотелій Клітинна й внутрішньоклітинна (змішана) регенерація Внутрішньоклітинна регенерація Переважно Печінка Міокард Нирки Скелетні Підшлункова залоза м’язи Ендокринні залози Легені Гладка м’язова тканина Вегетативна нервова система Виключно Гангліозні клітини ЦНС ОСНОВНІ ВИДИ РЕГЕНЕРАЦІЇ поділяються на: 1. фізіологічну; 2. репаративну; 3. патологічну; Фізіологічна регенерація. Цей вид регенерації триває протягом усього життя організму. Зокрема, постійно оновлюються стінки судин, клітини органів, клітини крові та інш. Процеси фізіологічної регенерації відбуваються практично безперервно: постійно злущуються зовнішні шари епітелію шкіри, за кілька тижнів оновлюється склад крові і т.інш. Швидкість фізіологічної регенерації в різних тканинах є різною: дуже швидко процеси регенерації перебігають в тих органах, де відбувається інтенсивний поділ клітин (наприклад, у кістковому мозку), тоді як у печінці, де поділ клітин не такий швидкий, процеси регенерації проходять значно повільніше. Регенерація може здійснюватись кількома шляхами. В основному вона відбувається за рахунок поділу клітин (мітозу). В тих тканинах, клітини яких втратили здатність до поділу (м’язові клітини, клітини міокарду, гангліозні клітини головного та спинного мозку) регенерація відбувається за рахунок біохімічного оновлення структурних компонентів клітин – мітохондрій, 24 ендоплазматичного ретикулуму, комплекса Гольджі, мікрофібрил та інш. Таким чином, необхідно зазначити, що регенерація ультраструктур клітин є найбільш універсальною формою фізіологічної регенерації. Репаративна регенерація (репарація). Репарація - це відродження ділянок органів або тканин після їх ушкодження будь-яким патологічним процесом. Механізми репаративної і фізіологічної регенерації єдині, репаративна регенерація - це посилена фізіологічна регенерація. До основних видів репарації належать: 1. Цілковита (повна), або реституція. Цей вид репарації передбачає заміщення втрачених ділянок тканиною того ж виду і тієї ж структури, що і загибла. Наприклад, при пораненнях та ушкодженнях епітелія шкіри, слизових оболонок, кісток навіть відносно крупні дефекти можуть бути повністю заміщені тканиною, ідентичною до втраченої. В таких випадках визначити місце травми після загоєння часто буває практично неможливо. Неповна, або субституція. В цьому випадку загоювання дефекту відбувається за допомогою утворення рубця. В загальному такий процес отримав назву рубцювання. Субституція супроводжується інтенсивним новоутворенням нової тканини, яка є аналогічною до тієї, яка загинула. В цьому випадку патологоанатоми вважають, що доцільно говорити про регенераційну гіпертрофію. В залежності від виду тканин та функції органів регенераційна гіпертрофія може здійснюватись 2-ма шляхами: а)шляхом посиленого розмноження клітин. Таким шляхом регенерують клітини печінки, селезінки, підшлункової залози, нирок та деяких інших внутрішніх органів; б)шляхом нарощування маси специфічних ультраструктур у тих клітинах, які збережені. Останні відповідно гіпертрофуються. За подібним типом репаративна регенерація відбувається в міокарді, нервовій системі, тобто там, де фізіологічна регенерація відбувається шляхом оновлення не клітин, а їх специфічних ультраструктур. Наприклад, при утворенні рубця в серцевому м’язі при інфаркті міокарду в тих волокнах, які залишились неушкодженими, різко зростає кількість міофібрил та мітохондрій, що й обумовлює подальшу регенерацію та гіпертрофію. 2. 3. Надмірна репаративна регенерація (репаративна гіперрегенерація) – це надмірне новоутворення характерної для даного органу тканини чи сполучної тканини на місці втраченої (наприклад: утворення кісткової мозолі при переломах кісток; надмірне розростання грануляційної тканини в ранах). 25 Репаративна регенерація не є місцевою реакцією в ушкодженій ділянці. Вона являє собою генералізовану реакцію, яка охоплює системи органів з переважною локалізацією регенераційного процесу в одному із них. Зокрема, у зв’язку із підсиленим розпадом білків, який спостерігається на місці травми, в інших органах вже на початку хвороби підвищується інтенсивність (швидкість) їх фізіологічної регенерації. В цілому подібна перебудова організму сприяє прискоренню одужання. Патологічна регенерація - це збочення регенераторного процесу, порушення зміни фаз проліферації і диференціювання. Патологічна регенерація проявляється в надмірному або недостатньому утворенні регенеруючої тканини (гіпер - або гіпорегенерація). Прикладами її можуть служити утворення келоїдних рубців, надлишкова регенерація периферичних нервів (травматичні невроми), надмірне утворення кісткової мозолі при зростанні перелому, в'яле загоєння ран (хронічні трофічні виразки гомілки в результаті венозного застою) і ін. Патологічна регенерація виникає у несприятливих для пацієнта обставинах. До них можуть належати: а)похилий вік пацієнта; б)порушений рівень обмінних процесів (прискорений або уповільнений); в)порушений стан харчування пацієнта (недостатній або надмірний); г)наявність загальних або місцевих розладів кровообігу; д)наявність розладів інервації в ураженій ділянці; е)наявність запалення в ураженій ділянці, і т.інш. В усіх подібних випадках регенерація відбувається атипово, тобто не так, як би вона перебігала в тих же тканинах при звичайних умовах. Подібну атипову, ненормальну, регенерацію називають патологічною. В результаті порушення процесу регенерації (тобто патологічної регенерації) можуть: а)утворюватись виразки, які тривало не загоюються; б)тривалий час не зростатись поламані кістки; в)надмірно розростатись тканини, які оточують уражене місце; г)виникати метаплазії епітелія в місці ураження. Регенерація окремих тканин РЕГЕНЕРАЦІЯ СПОЛУЧНОЇ ТКАНИНИ Процес загоєння дефекту тканини шляхом формування рубця ділиться на декілька стадій. Підготовка. На початковому етапі регенерації відбувається видалення 26 некротичного детриту, тобто уламків всіх загиблих клітин, запального ексудату, включаючи фібрин і кров. Цей детрит розріджується лізосомних ферментів нейтрофілів, які мігрують в цю область. Розріджений матеріал видаляється по лімфатичної системи; будь-які залишки у вигляді частинок видаляються макрофагами шляхом фагоцитозу. Розростання грануляційної тканини знаменує кінець першого етапу регенерації - фази проліферації клітин. Грануляційна тканина - високо васкуляризована сполучна тканина, яка складається із сформованих капілярів і проліферуючих камбіальних клітин сполучної тканини (малі і великі круглі, епітеліоїдних клітини). Ці клітини мігрують по ходу капілярів в пошкоджену область. Ситуація, що формується грануляційна тканина заповнює пошкоджену ділянку по мірі того, як некротичний детрит видаляється. Проліферація капілярів, фібробластів та інших клітин в процесі загоєння регулюється різними факторами росту та інгібуючими факторами. Макроскопічно грануляційна тканина м'яка і строката (здається рожевою і «гранулярною") через наявність численних капілярів. Мікроскопічно виявляється безліч тонкостінних (утворених ендотелієм) капілярів, оточених недиференційованими клітинами сполучної тканини. Проліферуючі камбіальні клітини сполучної тканини є метаболічно високо активними, з великими ядрами і видимими ядерця; іноді видно фігури мітозу. При електронній мікроскопії виявляється розширений шорсткий ендоплазматичнийретикулум в цитоплазмі фібробластів - індикатор активного синтезу білка. Через якийсь час - тривалість залежить від ступеня пошкодження - вся область загоєння замінюється розростається грануляційною тканиною. В подальшому фібробласти сприяють формуванню в ній ретикулярних та колагенових волокон. Кількість судин в грануляційній тканині поступово зменшується, тканина втрачає свою зернистість і набуває щільного і гладкого вигляду. Кількість колагенових волокон збільшується, вони групуються в пучки, між якими проходять судини. В міру формування сполучної тканини уражене місце перетворюється в рубець. У випадку тривалого запалення або інших причин, які сприють підвищенню активності фібробластів, спостерігається надмірне утворення колагенових волокон з їх наступною значною гіаліновою дистрофією, що призводить до формування келоїдного рубця – товстого пухлиноподібного утвору синьо-червоного кольору, яке піднімається над поверхнею шкіри. 27 РЕГЕНЕРАЦІЯ КРОВОНОСНИХ СУДИН Регенерація кровоносних судин перебігає неоднозначно залежно від калібру. Регенерація судин мікроциркуляторного русла - капілярів, венул, артеріол - може відбуватися шляхом брунькування або аутогенно. При регенерації судин шляхом брунькування в їх стінці з'являються бічні випинання за рахунок посиленого ділення ендотеліальних клітин (ангіобласти, ендотеліобласти). Утворюється ендотеліальний виріст, який перетворюється в тяж без просвіту. Потім під тиском крові з "материнської" судини утворюється капіляр. Інші елементи судинної стінки утворюються за рахунок диференціювання камбіальних клітин навколишньої сполучної тканини. В подальшому в тяж вростають нерви, які є відгалуженнями від вазомоторних нервів ураженої судини. Аутогенне (спонтанне) новоутворення судин полягає в тому, що в сполучній тканині з'являються ділянки недиференційованих клітин. У цих ділянках виникають щілини, в які відкриваються попередні капіляри і виливається кров. Молоді клітини сполучної тканини, диференціюючи, утворюють ендотеліальну вистилку і інші елементи стінки судини. Такий шлях новоутворення капілярів спостерігається в період ембріогенезу і в пухлинах. Великі судини не мають достатніх пластичних властивостей. Тому при пошкодженні їх стінки відновлюються лише структури внутрішньої оболонки, її ендотеліальна вистилання. Елементи середньої і зовнішньої оболонок відновлюються за рахунок рубцювання. РЕГЕНЕРАЦІЯ ЕПІТЕЛІЮ Регенерація епітелію здійснюється, як правило, повністю, оскільки він володіє високою регенераторной здатністю. Особливо добре регенерує покривний епітелій (багатошаровий плоский зроговілий і незроговілий, перехідний, одношаровий призматичний і багаторядний миготливий). Наприклад, відновлення багатошарового плоского ороговевающего епітелію здійснюється за рахунок розмноження клітин мальпігієвого шару. Утворені епітеліальні клітини спочатку покривають дефект одним шаром. Надалі пласт епітелію стає багатошаровим, клітини його диференціюються і він набуває всіх ознак епідермісу, що включає в себе паростковий, зернистий, блискучий і роговий шари. При порушенні регенерації епітелію шкіри утворюються незагойні виразки, нерідко з розростанням в їхніх краях атипового епітелію, що може служити основою для розвитку раку шкіри. 28 Регенерація спеціалізованого епітелію органів (печінки, підшлункової залози, нирок, залоз внутрішньої секреції) здійснюється по типу регенераційної гіпертрофії: в ділянках пошкодження тканина заміщується рубцем, а по периферії його відбувається гіперплазія і гіпертрофія клітин паренхіми. У печінки ділянку некрозу завжди піддається рубцюванню, однак в іншій частині органу відбувається інтенсивне новоутворення клітин, а також гіперплазія внутрішньоклітинних структур, що супроводжується їх гіпертрофією. Регенераторні можливості печінки дуже високі. В нирках при некрозі епітелію канальців відбувається розмноження збережених нефроцитів і відновлення канальців за умови збереження базальної мембрани. При її руйнуванні (тубулорексис) епітелій не відновлюється і каналец заміщується сполучною тканиною. Чи не відновлюється каналець і в тому випадку, якщо одночасно гине і судинний клубочок. У підшлунковій залозі регенераторні процеси добре виражені як в екзокринних відділах, так і в панкреaтіческіх острівцях. У залозах внутрішньої секреції відновні процеси представлені неповною регенерацією. ЗАГОЮВАННЯ РАН Розуміння механізмів, які втягнуті в загоєння ран шкіри, забезпечує розуміння процесів загоєння взагалі. Шкіра складається з епідермісу, який представлений багатошаровим плоским зроговілому епітелієм (базальний гермінативний шар - це лабільні (камбіальні) клітини) і дерми, яка складається з фібробластів, колагену, кровоносних судин і придатків шкіри (волосяні фолікули, потові залози, сальні залози). Клітини сполучної тканини дерми і придатків шкіри відносяться до відносно стабільних клітин. Типи пошкоджень шкіри. Пошкодження шкіри класифікуються на основі важкості і характеру пошкодження. Садно: найлегша форма ушкодження шкіри, характеризується видаленням поверхневої частини епідермісу. Основний базальний гермінативний шар лабільних клітин непошкоджений, епітелій відновлюється повністю, без формування рубця. Розріз і розрив: при різаної і розірваної рани шкіра ушкоджується на повну товщину (і епідерміс, і дерма), але з мінімальною втратою гермінативних клітин. Якщо краї шкірної рани ретельно зіставляються, як, наприклад, при хірургічному розрізі, відновлення відбувається дуже швидко. Простий розріз є ідеальний варіант рани шкіри щодо процесу загоєння, так як в ній не міститься чужорідний матеріал і вона не інфікована і тому заживає швидко і без ускладнень. 29 Рани з дефектами епідермісу: важкі ушкодження (наприклад, глибокі розрізи, розриви, опіки) характеризуються видаленням великих ділянок епідермісу, включаючи базальні гермінативні клітини, з різного ступеня некрозом підлеглої дерми. На відміну від садна, відсутність лабільних епідермальних клітин на дні рани визначає необхідність епідермальній регенерації з живих базальних гермінативних клітин країв рани. Поширений некроз, який виникає в таких ранах супроводжується запаленням. Загоєння первинним натягом: Чисті різані (наприклад, операційні) і рвані рани, в яких краї рани знаходяться на близькій відстані один від одного, гояться первинним натягом. Маленький проміжок в епідермісі і дермі заповнюється згорнулася кров'ю, яка формує струп і немов би закриває шкіру протягом 24 годин, запобігаючи потрапляння інфекційних агентів в рану. Епідерміс відновлюється швидко шляхом ділення базальних клітин в краях рани. Ці клітини вростають під струп і відновлюють неперервність епідермісу в межах 48 годин. У міру дозрівання епідермальних клітин поверхневі кератінізірованние шари починають відшаровуватися, струп відділяється в основному в кінці першого тижня. У підлеглій дермі рана заповнюється згорнутої кров'ю і заживає шляхом формування рубця. Невелика кількість згустків і тканинного детриту розріджується ферментами нейтрофілів і видаляється макрофагами шляхом фагоцитозу. Нейтрофіли з'являються в рані в межах 24 годин, швидко закінчують процес розрідження і, звичайно, замінюються макрофагами до 3 дня. Зростання фібробластів і нових судин (грануляційна тканина) в "підготовленої" дермальной порожнини починається до 48 годин, а колаген може виявлятися там в через 72 години після пошкодження. До 5 дня дермальний дефект заповнюється грануляційною тканиною і невеликою кількістю пухкої волокнистої сполучної тканини. Кількість колагену збільшується протягом приблизно 4-6 тижнів. Молодий рубець, який стає видимим після відділення струпа, спочатку виглядає рожевим через високу васкуляризацію дермальної грануляційної тканини. Протягом наступних кількох тижнів рубець стає білим в результаті зменшення числа кровоносних судин і збільшення кількості колагену в созревающем рубці. В кінцевому рахунку, рубець набуває нормального кольору шкіри в результаті дозрівання епідермісу. Під час операції краю хірургічного розрізу штучно з'єднуються швами або скобами. При знятті швів в кінці першого тижня (при більш пізньому знятті збільшується ризик інфікування рани) межа міцності молодого рубця становить 30 приблизно тільки 10% від міцності нормальної шкіри. Міцність рубця збільшується приблизно до 30-50% від міцності нормальної шкіри до 4 тижнів і до 80% - після кількох місяців. Загоєння вторинним натягом: Рани, які не в стані загоїтися первинним натягом, гояться вторинним натягом. Причини неможливості загоєння первинним натягом - загоєння первинним натягом неможливе за наступних обставин: o в рваних ранах, коли неможливо досягти зіставлення країв рани; o коли в рані присутній чужорідний матеріал; o коли стався великий некроз тканин; o коли рана інфікована. Якщо інфекція розвивається після зіставлення країв рани, то в результаті гострого запалення з нагноєнням відбувається розрив рани і гній проривається назовні. Перебіг вторинного натягу. Процеси, що зумовлюють загоєння вторинним натягом, аналогічні процесам, що відбуваються при загоєнні первинним натягом, але тривають вони довше через обширного пошкодження тканин. Інфекційний агент видаляється за допомогою гострого запалення. Рідкий ексудат і некротична тканина видаляються шляхом ферментного розрідження, видалення по лімфатичних шляхах і фагоцитозу. Хірургічне видалення мертвої тканини і чужорідного матеріалу з рани значно прискорюють процес очищення рани. Грануляційна тканина потім зростає з боку здорової тканини на дні рани і переміщує некротизовану тканину до поверхні шкіри. Епідерміс відновлюється з базальних клітин в краях рани. У великих ранах реепітелізація може тривати протягом декількох тижнів. У цих ситуаціях хірургічна трансплантація шкіри може прискорити загоєння. Після завершення епітелізації поверхні рани відбувається колагенізація грануляційної тканини. Кінцевий розмір зрілого рубця менший від розміру первинної рани через скорочення рубця. Придатки шкіри (волосяні фолікули і залози) відновлюються при наявності достатньої кількості залишилившихся в живих клітин. При великих ранах шкіри з повним руйнуванням шкірних придатків утворений шкірний рубець 31 зазвичай позбавлений цих структур. РЕГЕНЕРАЦІЯ ХРЯЩОВОЇ ТКАНИНИ Хрящова тканина є одним із різновидів сполучної тканини. Вона сформована із хрящових клітин та великої кількості міжклітинної речовини. Клітинні елементи хрящової тканини представлені хондроцитами (зрілі клітини) та хондробластами (молоді клітини, які в процесі розвитку трансформуються у зрілі). Регенерація хрящової тканини відбувається погано: на нову повноцінну тканину можуть замінитись тільки невеликі дефекти. Така регенерація хряща відбувається за рахунок перетворень юних елементів хрящових структур, які називаються хондробластами, у зрілий хрящ. У випадках значних уражень пошкоджена хрящова тканина заміщається на рубцеву, що часто призводить до утруднення рухів в суглобі і порушення його функції. РЕГЕНЕРАЦІЯ КІСТКОВОЇ ТКАНИНИ В кістковій тканині є три види клітин – остеоцити, остеобласти та остеокласти. Остеоцити – це основні клітини, з яких сформована зріла кістка. Вони містяться в особливих кісткових порожнинах, які, з’єднуючись між собою та довколосудинним простором, сприяють обміну речовин між остеоцитами та тканинною рідиною. Остеобласти – це юні клітини, з яких в подальшому формується кісткова тканина. Саме тому в зрілій кістці вони зустрічаються тільки на тих ділянках, де кістка зруйнована або ж, навпаки, відбувається процес її формуванні. В процесі утворення кістки остеобласти вкривають щільним шаром усю поверхню, на який відбувається її формування. На відміну від остеобластів, остеобласти беруть активну участь у руйнуванні кістки та звапнілого хряща. Регенерація кісткової тканини при переломі кісток може відбуватися двома шляхами у вигляді: o первинного кісткового зрощення; o вторинного кісткового зрощення. Первинне кісткове зрощення відбувається при неускладненому кістковому переломі, коли кісткові уламки добре зіставлені і нерухомі, відсутня інфекція. Зрощення починається з I-го етапу - активації і проліферації остеобластів в зоні пошкодження, перш за все в періості і ендості - формування остеобластической грануляційної тканини (м'яка мозоль). Вона побудована, як звичайна грануляційної тканини, тобто складається з великої кількості 32 новоутворених судин і клітин, які в міру диференціювання і дозрівання перетворюються в кісткові - остеоцитів, які виробляють міжклітинний речовина, в результаті чого формується остеоїдна тканину (II етап регенерації). На III етапі регенерації відбувається відкладення солей кальцію в остеоїдну тканину і формування твердої кісткової мозолі, яка за своєю будовою відрізняється від кісткової тканини лише безладним розташуванням кісткових балок. Після того як кістка починає виконувати свою функцію і з'являється статичне навантаження, утворена тканина за допомогою остеокластів і остеобластів піддається перебудові, з'являється кістковий мозок, відновлюється васкуляризація ііннервація (IV етап). При порушенні місцевих умов регенерації кістки - розлади кровообігу, поширені осколкові діафізарні переломи, рухливість уламків, відбувається вторинне кісткове зрощення. Для цього виду зрощення характерне утворення між кістковими уламками спочатку хрящової тканини, на основі якої будується кісткова тканина. Тому при вторинному зрощенні говорять про попередню кістково-хрящової мозолі, яка з часом перетворюється в зрілу кістку. Вторинне кісткове зрощення, в порівнянні з первинним, зустрічається значно частіше і повне відновлення займає набагато більше часу. Кісткова тканина має велику регенераційну здатність. При переломах порушується цілісність як окістя, так і кістки. Регенерація починається в місці пошкодження із розростання окістя як за рахунок перемішення клітин із неушкоджених ділянок, так і за рахунок їх розмноження. Необхідно зазначити, що остеобласти вкривають кістку як зверху, так і вистеляють кістковомозковий канал. Внаслідок посиленого розмноження остеобластів утворюється однорідна пружна маса (остеоїдна тканина), яка з’єднує кінці переламаної кістки. Її характерною особливістю є те, що вона не містить солей кальцію. Через 1,5-2 тижні остеоїдна (кісткова) тканина разом із судинами повністю заповнює місце перелому – таким чином відбувається формування первинної кісткової мозолі. С часом остеобласти частково атрофуються, частково трансформуються у кісткові клітини, в остеоїдну тканину відкладаються солі кальцію, і тоді кісткова мозоля набуде остеоїдної будови. Одночасно відбувається розсмоктування тієї надлишкової кісткової тканини, що оточувала місце перелому для кращої фіксації уламків. Відповідно до розташування тих кровоносних судин, що проросли в остеоїдну тканину, утворюються гаверсові канали, а по ходу судин регенерують нервові волокна. Таким чином формується остаточна кісткова мозоля. Значно рідше регенерація кістки відбувається шляхом метаплазії із сполучної тканини. У цьому випадку волокниста сполучна тканина 33 трансформується в остеоїдну тканину з подальшою петрифікацією і перетворенням в повноцінну кісткову тканину. При несприятливих умовах можливі відхилення від нормального перебігу регенерації кістки. У випадку потрапляння в рану інфекції (при відкритих переломах) кісткові уламки та осколки перестають відігравати роль формувальників кісткової тканини. Навпаки, вони перетворюються у джерело підтримання інфекції і гальмують процес нормального загоєння. Часом первинна кісткова мозоля трансформується не у зрілу кісткову тканину, а у хрящову, або у волокнисту сполучну тканину. В цих випадках кінці переламаної кістки не зростаються і залишаються рухливими, а в місці перелому формується несправжній суглоб. РЕГЕНЕРАЦІЯ ПОПЕРЕЧНО-ПОСМУГОВАНИХ М’ЯЗІВ Регенерація поперечносмугастих м’язів відбувається кількома шляхами. У випадку збереження сарколеми (оболонка м’язового волокна) регенерація саркоплазми та її органоїдів відбувається тільки в межах сарколеми. Довкола тих м’язових ядер, що збереглися, скупчується саркоплазма і формуються клітини, які отримали назву міобластів. В подальшому міобласти видовжуються, кількість ядер в них збільшується, поступово в саркоплазмі утворюються (диференціюються) мікрофібрили і формується повноцінне поперечносмугасте м’язове волокно, яке здатне витримувати повноцінне функціональне фізичне навантаження. У випадку порушення цілісності сарколеми розрив заповнюється грануляційною тканиною, яка потім перетворюється на рубець (мозоль), стійкість якого до навантажень є значно меншою, ніж у неушкодженої м’язової тканини. РЕГЕНЕРАЦІЯ ГЛАДКИХ М’ЯЗІВ Гладка м’язова тканина розташована в стінках судин і переважної більшості порожнистих внутрішніх органів. Морфологічна особливість гладкого м’язу полягає в тому, що він, маючи виражену клітинну будову, одночасно містить і скоротливий аппарат, який представлений гладкими міофібрилами. Функціональною особливістю гладких м’язів є те, що їх структурною одиницею є не окрема клітина, а комплекс клітин, який синхронно реагує на імпульс, що сприймається будь-яким елементом цього комплекса. Гладкі м'язи, клітини яких спроможні до мітозу і амітозу, при невеликих дефектах можуть регенерувати достатньо повно. При великих пошкодженнях гладких м'язів відбувається рубцювання (неповна регенерація). Крім того, новоутворення гладких м'язових волокон може відбуватися шляхом 34 перетворення (метаплазії) клітин сполучної тканини. Саме таким шляхом утворюються м’язи в стінках судин після їх поранень. РЕГЕНЕРАЦІЯ МІОКАРДУ Міокард утворений із поперечносмугастих м’язових клітин (серцевих міоцитів). Серед них розрізняють типові скоротливі клітини та атипові серцеві клітини, які формують провідну систему серця. Вони оточені тонковолокнистою сполучною тканиною, яка подібна на ендомізій скелетних м’язів. Міокард регенерує погано. На місці пошкодження утворюється сполучнотканинний рубець, який часто витоншується і трансформується в аневризму. Небезпека аневризми полягає у тому, що її тонка стінка не витримує м’зових скорочень та тиску крові, що призводить до її розриву і тяжких внутрішніх кровотеч, які зазвичай закінчуються смертю пацієнта. РЕГЕНЕРАЦІЯ КРОВІ Кровотворення – це безперервний процес продукування клітин крові. Його складовими є еритропоез (утворення еритроцитів), лейкопоез (утворення лейкоцитів) та тромбоцитопоез (утворення тромбоцитів). В нормі у дорослому організмі кровотворення (гемопоез) відбувається в кістковому мозкові. У дорослих розрізняють червоний та жовтий кістковий мозок, з яких кровотворним органом є червоний кістковий мозок. Він розташований в губчастій речовині пласких кісток (лопатки, кістки тазу, ребра та інш.), хребців та в епіфізах трубчастих кісток. Жовтий кістковий мозок є продуктом жирового переродження речовини червоного кісткового мозку. У випадках значних крововтрат, а також при деяких захворюваннях системи крові (наприклад, при лейкозах) відбувається розширення кровотворної території: в жовтому кістковому мозкові утворюються вогнища кровотворення, які здатні продукувати клітини крові. Регенерація крові спочатку відбувається за рахунок надходження в кровоносні судини тканинної рідини та рідини, яка всмоктується в кишечнику. Потім активується кровотворення в червоному кістковому мозку (інтрамедулярне кровотворення), який у дорослих тварин локалізується в хребцях, грудній кістці, ребрах та дрібних кістках. При цьому відбувається гіпертрофія червоного кісткового мозку за рахунок гіперплазії його клітин, які заміщують жовтий (жировий) кістковий мозок (мієлоїдне перетворення жовтого кісткового мозку), в першу чергу в трубчастих кістках кінцівок. При інтенсивній регенерації стовбурові клітини кровотворної тканини виселяються 35 з червоного кісткового мозку та з’являються в багатьох органах і тканинах (селезінка, печінка, лімфовузли, слизові оболонки, жирова клітковина та ін.), де утворюють острівці кровотворної тканини (екстрамедулярне кровотворення). Регенерація крові може бути пригнічена (при дії іонізуючого опромінення, апластичній анемії, алейкії, агранулоцитозі тощо) або спотворена (при злоякісній анемії, поліцитемії, лейкозах тощо). В останньому випадку в крові з’являються незрілі або неповноцінні клітини (патологічна регенерація). Таким чином, регенерація крові відбувається швидко і повноцінно за рахунок як підсилення діяльності червоного кісткового мозку, так і розширення зони кровотворної тканини, в наслідок чого до зазначених кровотворних утворень додаються довгі трубчасті кістки. РЕГЕНЕРАЦІЯ НЕРВОВОЇ ТКАНИНИ Регенерація нервової тканини залежить від місця ураження і відбувається по-різному в різних відділах нервової системи. У головному мозку новоутворення нейроцитів не відбувається. У разі їх пошкодження і загибелі відновлення функції можливе лише за рахунок внутрішньоклітинної регенерації (збільшення маси ультраструктур) збережених нейронів. Для клітин нейроглії, особливо мікроглії, характерна клітинна форма регенерації, завдяки чому дефекти тканини головного мозку заміщаються гліальними (гліозними) рубцями. Регенерація периферійного нерва відбувається за рахунок центрального відростку, який зберіг зв'язок з клітиною і відходить від центральної нервової системи. Периферичний відрізок гине. Клітини шванівської оболонки загиблого периферичного відрізка нерва розташовуються уздовж нього і утворюють футляр, в який вростають регенеруючі осьові циліндри з проксимального відрізка. Регенерація нервових волокон завершується їх мієлінізацією і відновленням нервових закінчень. Якщо регенерація нерва в силу тих чи інших причин порушується (значне розходження частин нерва, розвиток запального процесу), то в місці його розриву формується рубець, в якому безладно розташовуються регенеруючі осьові циліндри проксимального відрізка нерва. Такі розростання називаються ампутаційними невромами. РЕГЕНЕРАЦІЯ ІНШИХ ОРГАНІВ Регенерація лімфовузлів відбувається по типу повної репаративної тільки в тих випадках, коли зберігається зв’язок їх вхідних і вихідних лімфатичних 36 судин з оточуючою сполучною тканиною, а пошкодження відносно незначне. В інших випадках дефект, як правило, заміщується рубцевою тканиною. Регенерація селезінки, як правило, неповна – дефект заміщується рубцевою тканиною. Регенерація печінки відбувається дуже швидко й навіть після видалення 4/5 органу (в такому випадку вона триває 1,5–2 міс.). Для печінки характерна повна репаративна регенерація, яка відбувається шляхом розмноження гепатоцитів, фіброцитів і фібробластів сполучнотканинної строми органу та вростання в новоутворені тканини судин і жовчних протоків. При порушенні процесів регенерації в органі утворюється рубець. Регенерація підшлункової залози відбувається шляхом проліферації й гіпертрофії всіх типів клітин острівців Лангерганса та регенерації епітелію екзокринної частини залози. При порушенні процесів регенерації на місці зруйнованих тканин розростається волокниста сполучна тканина з утворенням вогнищ склерозу. Регенерація нирок при руйнування (некрозі) епітелію канальців при збереженій базальній мембрані й ниркових тільцях відбувається шляхом мітотичного й амітотичного поділу епітеліоцитів, що лишились неушкодженими. При цьому можуть утворюватись багатоядерні епітеліальні клітини. При руйнування базальної мембрани, ниркових тілець та при значних пошкодженнях на місці дефекту утворюється рубцева тканина. Регенерація легень, як правило, відбувається шляхом утворення рубцевої тканини. Регенерація жирової тканини відбувається за рахунок розмноження сполучнотканинних клітин, які, накопичуючи в своїй цитоплазмі жири, перетворюються на ліпоцити. 37 Висновки Компенсаторно-пристосувальні процеси – це механізми, що компенсують дію зовнішніх чинників на організм і дають йому можливість пристосовуватися до існування в навколишньому середовищі. Ці процеси проявляються морфологічною перебудовою організму з відповідними змінами функцій. При пошкодженні різних структур організму компенсаторно-пристосувальні процеси направлені на їх відновлення. До них відносять атрофію, гіпертрофію та гіперплазію, склероз, організацію, інкапсуляцію, метаплазію та перебудову органів і тканин та регенерацію. Усі вони у нормі є фізіологічними процесами, але при дії незвичайних, патогенних або надмірних за своєю силою чинників можуть ставати патологічними. Регенерація – це процес відновлення як структури, так і функції зруйнованих або втрачених тканин, органів або окремих частин тіла у живих істот. Вона буває внутрішньоклітинна – регенерація на молекулярному (характеризується підвищеним синтезом певних молекул) й субклітинному (відбувається шляхом гіпертрофії та гіперплазії ультраструктур клітини) рівнях - і клітинна (регенерація відбувається на рівні клітин, тканин і органів шляхом мітотичного й амітотичного поділу клітин). У випадку збільшення розмірів (гіпертрофії) ультраструктур клітини говорять про внутрішньоорганоїдну регенерацію, а у випадку збільшення кількості (гіперплазії) ультраструктур клітини – про органоїдну регенерацію. Морфогенез регенераторного процесу складається з двох фаз проліферації і диференціювання. У фазу проліферації розмножуються молоді, недиференційовані (камбіальні, стовбурові або клітини-попередники) клітини. Поділ клітин триває до тих пір, поки не буде заповнений дефект тканини. У фазу диференціювання молоді клітини дозрівають, відбувається їх структурнофункціональна спеціалізація. Описані процеси складні і вкрай необхідні нам для життя. Завдяки ним організм може підтримувати сталість внутрішнього середовища і адаптуватися до змін навколишнього середовища, зважаючи на дію різноманітних чинників. 38 Список використаних джерел 1. https://studfile.net/preview/6445915/page:11/ 2.https://pathology.med.sumdu.edu.ua/files/%D0%9B%D0%B5%D0%BA% D1%86%D1%96%D1%97_%D0%BD%D0%BE%D0%B2%D1%96/%D0%A0% D0%9E%D0%A1/%D0%A1%D0%BA%D0%BE%D1%80%D0%BE%D1%87% D0%B5%D0%BD%D1%96/Kompensatornye_processy_sokr.pdf 3. https://works.doklad.ru/view/v7JDQlRLBW0.html 4. http://repository.ldufk.edu.ua/bitstream/34606048/7558/1/lek_2.pdf 5. Компенсаторно – пристосувальні процеси. Регенерація. Старченко Іван Іванович. 6. Регенерація. Курс “Основи медичних знань” канд.мед.наук, доц. Рябуха О.І 39