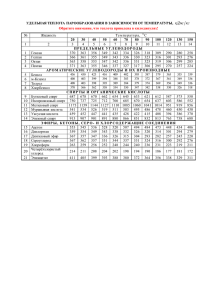
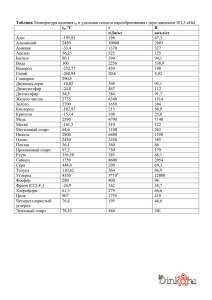
1 МИНИСТЕРСТВО ОБРОЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Благовещенский государственный педагогический университет» Естественно-географический факультет Кафедра химии КУРСОВАЯ РАБОТА на тему: Органические растворители по дисциплине: Нерганическая химия Исполнитель: студент группы 2Х Руководитель: к.х.н., доцент _____________ ________________ дата подпись _____________ ________________ дата подпись Благовещеск 2017. Д.С.Басманова В.В.Жидков 2 ОГЛАВЛЕНИЕ Введение……………………………………………………………………. 1 Общие сведенья о растворителях……………………………………... 1.1 Взаимодействие между растворенным веществом и растворителем.. 1.2 Свойства растворителей……………………………………………….. 1.3 Растворители и их классификация……………………………………. 1.4 Растворители в органическом синтезе………………………………... 1.5 Этиловый спирт……………………………………………. 1.6 История открытия этилового спирта………………………………. 1.7Химические свойства этилового спирта 1.8 Физические свойства этилового спирта 1.9 Этиловый спирт в органическом синтезе…………………………….. 1.10 Получение этилового спирта 1.11 Применение этилового спирта 2 Подготовка растворителей к органическому синтезу……….………… 2.1 Получение абсолютно чистого этилового спирта путем перегонки... 2.2 Способы идентификации растворителей……………………………... 2.3 Способы хранения этилового спирта ЗАКЛЮЧЕНИЕ СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ 3 5 5 5 6 8 8 9 9 11 12 12 14 16 17 18 19 20 21 3 ВВЕДЕНИЕ Подавляющее большинство реакций в органической химии осуществляется в жидкой фазе, преимущественно в растворах. В случаях, когда растворитель не вводится в реакционную среду, то говорят, что процесс протекает в присутствии растворителя, роль которого выполняют один из исходных элементов. Таким образом взаимодействие основных участников химических реакций всегда возникает в присутствии третьего. Первым веществом, признанным в качестве растворителя, была вода. Долгое время химики органики искали растворитель, который бы растворял все вещества. Благодаря таким поискам ученные открыли большое разнообразие новых реакций, растворителей, а также известное химическое правило – подобное растворяется в подобном. Растворитель выступает в роли активного участника химического процесса, оказывает большое влияние на скорость, селективность и на направления реакции. Влияние растворителя на скорость химической реакции впервые отметили Берто и Пеан де Сан-Жиль в 1862 г. в ходе работ по изучению этерификации уксусной кислоты этанолом: «…ход этерификации нарушается, а ее скорость снижается при добавлении нейтральных растворителей, не участвующих в реакции» После детального изучения реакции триалкиламинов с галогеналканами Меншуткин в 1890г. пришел к выводу, что реакцию нельзя отделить от среды, в которой она проводится. Также он связал влияния растворителей в первую очередь с их химическими, а не физическими свойствами. Таким образом уже целое столетие проблема влияния растворителя (эффект среды) на течение химической реакции является основным содержанием исследований в органической химии. Накоплены к настоящему времени конкретный экспериментальный материал и его научная трактовка позволяют рас- 4 сматривать растворитель как средство управления химическим процессом. Выбор растворителя для конкретной реакции имеет строгое научное обоснования[1]. Целью данной работы явилось ознакомление с природой и способами подготовки органических растворителей в органическом синтезе. Для достижения данной работы необходимо решить следующие задачи. • Изучить литературные источники по теме исследования; • Отработать приемы сбора прибора для перегонки жидких веществ при пониженном и атмосферном давлении. • Освоить методы идентификации жидких веществ методами рефрак- тометрии и определением температуры кипения. 5 1.Общие сведенья о растворителях 1.1Взаимодействие между растворенным веществом и растворителем В органическом смысле раствор это – однофазная система переменного состава, образованная не мене чем двумя не зависимыми компонентами (растворитель и растворенное вещество). Обычно растворителем называют основной компонент, а растворенным веществом – минорные компоненты. Растворитель нельзя рассматривать, как макроскопическую непрерывную фаз, которая характеризуется фризскими свойствами, напротив растворитель следует считать дискретной фазой, состоящей из множества индивидуальных, взаимодействующих друг с другом молекул. Такое взаимодействие может применятся в широких приделах. Для одной группы растворителей характерна очень глубокая внутренняя структура, а для других незначительные межмолекулярные взаимодействия. Взаимодействия между молекулами в растворителях и в растворах, сильно сильны, чтобы оценить только с помощью законов кинетической теории газов, и в тоже время они слабы, чтобы применить теорию физики твердого тела. Таким образом в силу сложности взаимодействий структура жидкостей по сравнению со структурой газов и твердых тел изучена в наименьшей степени, потому что экспериментальное и теоретическое изучение структуры жидкостей представляет собой одну из труднейших проблем физической химии [2]. 1.2 Свойства растворителей Рассмотрим свойства растворителей, которые положены в основу классификации, свойства, благодаря которым растворитель становится активным участником химического процесса. 6 Из физических характеристик одной из важнейшей является диэлектрическая проницаемость ε (величина, показывающая, во сколько раз уменьшается сила электростатического взаимодействия частиц, находящихся в некоторой среде, по сравнению с вакуумом). По величине ε различают растворители с высокой (>50), средней (12-15) и низкой (<12) диэлектрической проницаемостью. Таким образом при увеличении ε растворитель становится более полярным. По полярности различают следующие группы: высокополярные растворители (вода, пропиленкарбонат, гидразин, формамид, серная кислота) среднеполярные растворители (спирты, ацетон, нитрометан, нитро- бензол, ацетонитрил, диметилсульфоксид) не полярные растворители (углеводороды, хлороформ, дихлорэтан, хлорбензол) Следующие свойство является дипольный момент μ (измеряется в дебаях, D), являющейся векторной суммой диполей связей в молекулах. Диэлектрическая проницаемость из физических характеристик является доминирующей. Из других характеристик учитываю вязкость, плотность, электропроводимость. Температура кипения и плавления, определяют температурный режим процесса и легкость удаления растворителя от продуктов реакции [2]. 1.3 Растворители и их классификация В силу различий физических и химических свойствах между множеством органических и неорганических растворителей задача классификации растворителей очень сложна. Эти классификации отчасти перекрывают друг друга, поскольку в их основе лежат очень широкие определения. 1. ением. Классификация растворителей в соответствии с их химическим стро- 7 В соответствии с типом химических связей растворители можно разбить на три группы; а) молекулярные жидкости (молекулярные расплавы; только ковалентные связи); б) ионные жидкости (расплавы солей; только ионные связи); в) атомные жидкости (низкоплавкие металлы, например, жидкая ртуть или жидкий натрий, металлические связи). Классификация растворителей в соответствии с их химическим строением позволяет сделать вывод, совпадающее с правилом «подобное, растворяется в подобном». Обычно соединения легко растворяются в растворителе, имеющем такие же или родственные функциональные группы. 2. Классификация растворителей в соответствии с их физическими свойствами. Для описания свойств растворителей можно использовать следующие физические константы: температура кипения и плавления, давления паров, поверхностное натяжение, дипольный момент и т.п. Физические свойства распространенных органических растворителей суммированы и приведены в таблице 1.(см. приложение). 3. Классификация растворителей в соответствии с их кислотно-основ- ными свойствами. Здесь особую роль отводят теории кислот и оснований Бренстеда-Лоури, а также Льюиса. 4. Классификация растворителей на основе специфических взаимодей- ствий между растворителями и растворенным веществом. Растворители делят на протонные и апротонные. К протонным относят растворители, которые проявляют протон-донорную или протон-акцепторную функцию по отношению к растворенному веществу. В зависимости от этого протонные растворители, в свою очередь, делят на протогенные (способные поставлять протоны), протофильные (способные принимать протоны) и амфипротонные (способные как поставлять, так и принимать протоны) [1]. 8 1.4 Растворители в органическом синтезе. Роль растворителя на течение химической реакции надо связывать с характером процессов сольватации всех участников взаимодействия. В процессе сольватации может происходить перераспределение электронной плотности, это должно приводить к ослаблению химической связи.Таким образом, полярные растворители, облегчающие разделение зарядов, благоприятствуют реакциям, включающим гетеролитическое расщепление. Неполярные растворители, наоборот, благоприятствуют радикальным реакциям. Растворители могут влиять на: 1. Кислотно основное равновесие. 2. Скорость реакций и состояние химического равновесия. 3. Выход[2]. 1.5 Этиловый спирт Этиловый спирт (этанол, метилкарбинол, винный спирт) – одноатомный спирт, второй представитель гомологического ряда одноатомных спиртов, при стандартных условиях летучая, горючая, бесцветная прозрачная жидкость бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом. Относится к сильнодействующим наркотикам, вызывающим сначала возбуждение, а затем паралич нервной системы. Имеет формулу CH3CH2OH (упрощённо: С2Н5ОН) Этиловый спирт прожигает кожу и слизистые оболочки, при приеме во внутрь тормозит центры головного мозга, также он вызывает опьянение и алкоголизм. Вредно воздействует на зародыш ребенка. Наименование этанола винный спирт произошло от лат. spiritus vini (дух вина). В русский язык слово «спирт» пришло через английский его вариант англ. Spirit [3]. 9 1.6 История открытия этилового спирта Этиловый спирт, вернее хмельной растительный напиток его содержащий, был известен с глубокой древности. Считается, что не менее чем за 8000 лет до новой эры люди были знакомы с действием перебродивших фруктов, а позже – с помощью брожения получали хмельные напитки, содержащие этанол, из фруктов и мёда. Археологические находки показали, что в Западной Азии виноделие существовало ещё в 5400 – 5000 годах до н. э., а на территории современного Китая, провинция Хэнань, найдены свидетельства производства «вина», вернее ферментированных смесей из риса, мёда, винограда и, возможно, других фруктов, в эпоху раннего неолита: от 6500 до 7000 гг. до н. э. Впервые спирт из вина получили в 6 – 7 веках арабские химики, а первую бутылку крепкого алкоголя (прообраза современной водки) изготовил персидский алхимик Ар-Рази в 860 году. В Европе этиловый спирт был получен из продуктов брожения в 11 – 12 веке, в Италии. В Россию спирт впервые попал в 1386 году, когда генуэзское посольство привезло его с собой под названием «аква вита» и презентовала царскому двору. В 1660 году английский химик и богослов Роберт Бойль впервые получил обезвоженный этиловый спирт, а также открыл его некоторые физические и химические свойства, в частности обнаружив способность этанола выступать в качестве высокотемпературного горючего для горелок. Абсолютированный спирт был получен в 1796 году русским химиком Т. Е. Ловицем [3] 1.7 Химические свойства этилового спирта Этиловый спирт горюч, легко воспламеняющийся, при большом количестве воздуха горит (светлым голубоватым пламенем), образуя продукты окисления – диоксид углерода и воду: 10 C2H5OH+3O2 → 2CO2+3H2O Такая реакция протекает более энергичней в атмосфере чистого кислорода. При определенных условиях возможно и контролируемое окисление до уксусной кислоты, щавелевой кислоты, ацетальдегида и д.р. продуктов, например: 3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O Также этиловый спирт обладает слабо выраженными кислотными свойствами, он подобно кислотам, взаимодействует со щелочными металлами, магнием и алюминием. При таком взаимодействии образуются водород и солеподобные этилаты, которые являются представителями алкоголятов: 2C2H5OH + 2К → 2С2Н5ОК + Н2. C2H5OH + NaH → C2H5ONa + H2 Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров: С2Н5OH + RCOOH ⇄ RCOOС2Н5 + H2O С2Н5OH + HNO2 ⇄ С2Н5ONO + H2O Реакция с HCI без катализаторов идет медленно, значит быстрее в присутсвии хлорида цинка и других кислот Люиса. С галогеноводородами вступает в обратимые реакции нуклеофильного замещения: C2H5OH + HX ⇄ C2H5X + H2O Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты. Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например: С2Н5OH + СH2 = CHCN → С2Н5OCH2СH2CN, реагирует с альдегидами с образованием полуацеталей и ацеталей: RCHO + С2Н5OH → RCH(OH)OС2Н5 RCH(OH)OС2Н5 + С2Н5OH → RCH(OС2Н5)2 + H2O С концентрированной серной кислотой при умереном нагревании ( не выше 120°C ) образуется диэтиловый эфир: 11 2С2Н5OH ⇄ С2Н5-O-С2Н5 + H2O А при более сильном нагревании, при пропускании паров над нагретым ло 300/500°C оксидом алюминия, образуется этилен: CH3CH2OH ⇄ CH2=CH2 + H2O [3] 1.8 Физические свойства этилового спирта Внешний вид: в обычных условиях представляет собой бесцветную летучую жидкость с характерным запахом и жгучим вкусом. Этиловый спирт легче воды. Является хорошим растворителем других органических веществ. Следует избегать популярной ошибки: часто смешивают свойства 95,57 % спирта и абсолютизированного. Их свойства почти одинаковы, но величины начинают различаться, начиная с 3 – 4 -й значащей цифры. В таблице 1 приведены химические свойства этанола. Таблица 1 – Физические свойства этанола Молекулярная масса Температура плавления Температура кипе- ния Критическая точка 46,069 а. е. м. −114,15 C 78,39 C 241 C (при давлении 6,3 МПа) смешивается с бензолом, водой, глицерином, диэтиловым Растворимость эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом Показатель преломления 1,3611 (температурный коэффициент показателя преломления 4,0·10−4, справедлив в интервале температур 10 – 30 C) 12 Стандартная энтальпия образования ΔH Стандартная энтро- пия образования S Стандартная мольная теплоёмкость Cp Энтальпия плавления ΔHпл Энтальпия ΔHкип кипения −234,8 кДж/моль (г) (при 298 К) 281,38 Дж/моль·K (г) (при 298 К) 1,197 Дж/моль·K (г) (при 298 К) 4,81 кДж/моль 839,3 кДж/моль Смесь 95,57 % этанола + 4,43 % воды является азеотропной, т. е. не разделяется при перегонке [3] 1.9 Этиловый спирт в органическом синтезе Этиловый спирт, будучи очень реакционноспособным с соединениями, играет очень большую роль в органическом синтезе. Спирт является хорошим растворителем алкалоидов, гли-козидов, эфирных масел, смол и других веществ, которые в воде растворяются в незначительных количествах. В статье на тему: СИНТЕЗ И СТОРОЕНИЕ КООРДИНАЦИОННЫХ СОЕДИНЕЙ КОБОЛЬТА(II) C N,N-ДИМЕТИЛ-N`,N`- ДИМЕТИЛТИОКАРБАМОИЛСУЛЬФЕНАМИДОМ. Хитрич и д.р использовали этанол в качестве отчистки белого осадка [4] 1.10 Получение этилового спирта Получают этиловый спирт несколькими способами: 1. Брожение, которое делится на: 13 A. Промышленное производство спирта из биологического сырья. B. Гидролизное производство 2. Гидратация этилена 3. Очистка этанола 4. Абсолютный спирт Получение этилового спирта путем брожения известна с давних времен – это брожение органических продуктов, содержащих углеводы под действием ферментов дрожжей и бактерий. Таким получением, раствор содержит 15% этанола, потому что в концентрированных растворах дрожжи нежизнеспособны. Промышленное производство спирта из биологического сырья всключает следующие стадии: Подготовка и измельчение крахмалистого сырья – зерна (прежде всего – ржи, пшеницы), картофеля, кукурузы, яблок и т. п. Ферментация. На этой стадии происходит ферментативное расщеп- ление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путём – глюкамилаза, амилосубтилин. Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в браге спирта. Брагоректификация. Осуществляется на разгонных колоннах. Поступающий из брагоректификационной установки (БРУ), спирт не является безводным, в нем содержится до 95.6% этанола. Спиртовой завод производит около 30 000 – 100 000 литров спирта в сутки. В гидролизном производстве этиловы спирт получают из сырья, который содержит целилозу (древесина, солом), которую предворительно гидролизуют. Спиртовое броежение происходит при оброзовании смеси пентоза и гексоза. В промышленности используют гидротацию этилена, наряду с первым сособом. Гидратацию можно вести по двум схемам: 14 прямая гидратация при температуре 300 C, давлении 7 МПа, в каче- стве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест: CH2=CH2 + H2O → C2H5OH. гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80 – 90° С и давлении 3,5 МПа): CH2=CH2 + H2SO4 → CH3-CH2-OSO2OH (этилсерная кислота). CH3-CH2-OSO2OH + H2O → C2H5OH + H2SO4. Эта реакция осложняется образованием диэтилового эфира. Получение этанола путем гидратации этилена или брожения, представляет собой водную спиртовую смесь, содержащую примеси. Для его применения не обходи отчистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.); эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15°C. Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток). Абсолютный спирт – этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 C, в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15°C. Получают перегонкой водного спирта, содержащего бензол, и другими способами, например, спирт обрабатывают веществами, реагирующими с водой или поглощающими воду, такими, как негашёная известь CaO или прокалённый медный купорос CuSO4 [3]. 1.11 Применение этанола. Применяется этанол в химической промышленности, он служит сырьем для получения химических реакций (уксусная кислота, этилен и т.д.). Он является компонентом антифризов и стеклоомывателей. В бытовой химии этанол 15 присутствует в чистящих и моющих средствах особенно для уход за сантехникой. Применения этанола в качестве моторного топлива было использовано в 1880г. Генрихом Фордом (он является первосоздателем автомобиля). Этанол может использоваться как топливо, в т. ч. для ракетных двигателей (так, 75% - й водный этанол использовался в качестве топлива в первой в мире серийной баллистической ракете – немецкой «Фау-2» и ранних советских ракетах конструкции Королёва - от Р-1 до Р-5), двигателей внутреннего сгорания, бытовых, походных и лабораторных нагревательных приборов (т. н. «спиртовок»), грелок для туристов и военнослужащих (каталитическое автоокисление на платиновом катализаторе). Ограниченно (в силу своей гигроскопичности) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов – Этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ. Большое применение этанола это в медицине: по своему действию этиловый спирт можно отнести к антисептикам; как обеззараживающее и подсушивающее средство, наружно; подсушивающие и дубящие свойства 96%-го этилового спирта ис- пользуются для обработки операционного поля или в некоторых методиках обработки рук хирурга; растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.; консервант настоек и экстрактов (минимальная концентрация 18 %); пеногаситель при подаче кислорода, искусственной вентиляции лёг- в согревающих компрессах; для физического охлаждения при лихорадке (для растирания) ; компонент общей анестезии в ситуации дефицита медикаментозных ких; средств; как пеногаситель при отёке лёгких в виде ингаляции 33 % раствора; 16 этанол является противоядием при отравлении некоторыми токсич- ными спиртами, такими, как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола – формальдегида и муравьиной кислоты, для этиленгликоля – щавелевой кислоты) [3]. Вывод по первой главе Таким образом по литературным данным органические растворители классифицированы в соответствии со своей природой, с вязи с чем широко используются как в области получения органических веществ, так и в области и элементоорганического синтеза. Кроме того, важную роль органические растворители играют в быту. 2. Подготовка растворителей к органическому синтезу. Перед применением растворитель не обходимо отчистить Чистота которых в значительной степени определяет успех синтеза. Чаще всего приходится освобождать растворитель от остатка воды. Так как вода мешает осуществлению многих химических реакций, обезвоживание растворителей представляет собой одну из основных лабораторных операций. Обезвоживающие агенты могут связывать воду физически или химически Любой органический растворитель с диэлектрической проницаемостью менее 15 можно практически полностью освободить от воды, спиртов, пероксидов, фильтруя его через высокоактиный силикогель и оксид алюминия, помещенные например, в хроматографическую колонку диаметром 2-5 см и длиной 40-150 см. Однако промышленные образцы 17 растворителей могут содержать и другие примеси, поэтому в каждом конкретном случае в зависимости от возможных примесей разрабатывают индивидуальный способ очистки, хотя для соединений одного класса имеются и общие методы. Предложено следующее определение чистоты растворителя: «Вещество считается достаточно чистым, если оно не содержит примесей определенной природы и в определенном количестве, что они могли бы воспрепятствовать предполагаемому применению этого вещества» [1]. 2.1 Получение абсолютно чистого этилового спирта путем перегонки Перегонка широко применяется для отчистки и выделения органических соединений. Она подвергаются не только жидкие, но и твёрдые вещества. Перегонку можно проводить простую и фракционную. При простой перегонке дистиллят собирают в один приемник. При фракционной – дистиллят разделяют на фракции, которые отличаются по температуре кипения. Перегонку можно разделить на три основных вида: • При атмосферном давлении • При уменьшенном давлении т.е в вакуме • С водяным паром Наш прибор состоял из круглодонной колбы с боковым отводом (колба Вюрдца), термометра, холодильника, алонжа и приемника. Термометр вставляют в колбу так, чтобы шарик находился на 0.5 см нижи отверстия отводной трубки и полностью омывался отходящими порами. К боковой трубки колбы присоединяются холодильник, служит для концентрации паров жидкости и отвода его в приемник, также его называют не сходящим. Часто применяют холодильник Либиха. Алонж используется если перегоняемое вещество не индифферентно к влаге воздуха [5]. 18 В соответствии с задачей исследования, мы брали салициловую кислоту, которую приобрели в аптеки, и осуществили простую перегонку при атмосферном давлении Салициловой кислоте соответствует следующая формула: С7Н6О3 = С6Н4(ОН) – СО2Н. Она является представительницей группы ароматических оксикислот. В соседних положениях бензольного кольца у нее находятся группа ОН, как у фенола, и группа СООН – как у бензойной кислоты. Данное соединение широко распространено в природе. Она применяется наружно в качестве местнораздражающего, противовоспалительного, кератопластического, кератолитического, подсушивающего и антисептического средства [6]. Колбу мы заполнили салициловой кислотой на 3/5 ее объёма, перед началом перегонки в колбу поместили несколько «кипятильников». Они служат для равномерного кипячения. Раствор закипел при температуре 64 °С, олучили этиловы спирт 2.2 Способы идентификации растворителей Температура кипения этанола установлена 78,15 °С по литературным данным, наша температура составила 64 °С. Изменение температуры произошло изза того, что мы делали перегонку при атмосферном давлении. При понижении давления понижается температура кипения вещества, так как они взаимно связанны. Давление мы рассчитали таким образом: 78,15 – 760 Х – 64 Х= 78,15∗64 760 Х=6.581 Полученный этиловый спирт мы исследовали методом рефрактометрии на рефрактометре Аббе. Установлен показатель преломления этанола n20Д= 1.36 по 19 литературным данным.(приложение), наш показатель составил 1.3622, что и соответствует данным. Таким образом нами установлено, что показатель преломления в данном случае является главным способом идентификации. А температура кипения не является главным способом т.к она отличается от литературных данных, то можно сделать вывод: этиловый спирт лучше идентифицировать показателем преломления, чем температурой кипения. 2.3 Способы хранения этилового спирта Спирт должен храниться в стальных резервуарах различной вместимости и формы с обязательным условием возможности измерения в них наличия спирта по объему и устанавливаемых как на открытых площадках, так и в закрытых помещениях, удовлетворяющих требованиям, предъявляемым к помещениям. Небольшое количество спирта можно хранить в стальных бочках по ГОСТ 1395084, 6247-79, бутылях по ГОСТ 1482-80 или металлических флягах исполнения ФЛ по ГОСТ 5037-78, тщательно закупоренных пробками, опломбированных или опечатанных [6]. ВЫВОД ПО ГЛАВЕ 2 Нами изучено способы получения и хранение органических растворителей на примере этилового спирта. Отработали навыки: сборки прибора для перегонки жидких веществ при пониженном и атмосферном давлении, идентифицировали жидкие вещества методами рефрактометрии и определением температуры кипения. Изучение материал и навыки работы с лабораторным оборудованием, позволяет в дальнейшем использовать их в полученных исследованиях. 20 ЗАКЛЮЧЕНИЕ В соответствии с поставленной целью и задачами нами проведен литературный обзор о природе, свойствах органических растворителях, отработали навыки сборки прибора для перегонки жидких веществ при пониженном и атмосферном давлении, освоили методы идентификации жидких веществ методами рефрактометрии и определением температуры кипения, установлено, что этиловый спирт является чистым с показателем преломления 1.3622 и температурой кипения 64 °С. 21 СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ 1. Райхардт, К. Растворители и эффекты среды в органической химии: Пер. с англ. – М.: Мир, 1991. – 763 с. 2. Москва, С.С. Растворители в органической химии / С.С Москва // Соросовский оброзовательный журнал. – 1999. – №4. – С.44-50. 3. Этилен [Электронный ресурс]. – Режим доступа https://ru.wikipedia.org/wiki/%D0%AD%D1%82%D0%B0%D0%BD%D0%BE%D 0%BB – 14.04.2017 4. Русанов, А.И. Общая химия / А.И. Руснов // Журнал общей химии. – 2011. С? 5. Лабораторные работы по органическому синтезу: учеб. пособие для хим. и биол. спец. пед. ин-тов / О.А. Птицина [ и др.]. – М. : Просвещение, 1979. – 256 с.,ил. 6. Салициловая кислота [Электронный ресурс]. – Режим доступа http://www.tiensmed.ru/news/salicilacid-p8u.html 7. Хранение спирта [Электронный ресурс]. – Режим доступа http://www.consultant.ru/document/cons_doc_LAW_28378/9282c1c1e4a6b657b1b2 6242ae9aea7dd9b8daec/