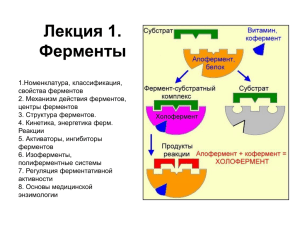
ФЕРМЕНТЫ ИЛЛЮСТРИРОВАННАЯ БИОХИМИЯ (формулы, схемы, термины и алгоритм познавания предмета) Учебное пособие для конспектирования лекций и самостоятельной подготовки к занятиям по биохимии Тверь, 2018 г. История энзимологии — Реомюр и Л. Спалланцани (XVIII в.— изучение ферментов пищеварительных соков). — К. С. Кирхгофф (Россия, 1814 г. — экстракты из солода, проросшего ячменя, способны осахаривать крахмал с превращением его в мальтозу). — Л. Пастер (Франция, конец XIX в. — спиртовое брожение — результат обмена веществ в живых микроорганизмах). — Д. Самнер и Д. Нортон (США, начало ХХ в. — впервые выделены ферменты в кристаллическом виде. Доказано, что ферменты – это белки). — Л. Мехаэлис, М. Ментен (начало ХХ в. — теория ферментативной кинетики: при катализе образуется промежуточный фермент-субстратный комплекс). Химическая природа ферментов (докажите, что это белки) — — — — — — — — — молекулярная масса, денатурация, кристаллизация, электрофорез, диализ, высаливание, коллоидные свойства, специфичность действия, продукты гидролиза, — искусственные ферменты (осуществлен синтез фермента рибонуклеазы). Ферменты - простые и сложные белки — используя схему, опишите химическую природу и структурную организацию составных частей энзимов и объясните их функции ФЕРМЕНТ СЛОЖНЫЙ БЕЛОК (ХОЛОФЕРМЕНТ) АПОФЕРМЕНТ ПРОСТОЙ БЕЛОК КОФАКТОР МЕТАЛЛ КОФЕРМЕНТ НЕВИТАМИНЫЙ ВИТАМИНЫЙ Классификация коферментов Коферменты витаминной природы (после изучения коферментов впишите в таблицу витамин и дайте краткую характеристику биологической функции кофермента): Название коферментов Витамин, входящий в кофермент Биологическая функция Тиаминовые Пантотеновые Никотинамидные Флавиновые Фолиевые Пиридоксиновые Кобамидные Биотиновые Липоевые Хиноновые Карнитиновые КОФЕРМЕНТЫ ВИТАМИННОЙ ПРИРОДЫ 1. Тиаминовые коферменты (основа–витамин В1, тиамин; кофермент ТДФтиаминдифосфат): Химическая структура ТДФ: Выделите отдельные фрагменты этой структуры и покажите пиримидиновые и тиазоловые кольца, пирофосфат, витамин и кофермент. Функции ТДФ (в составе энзимов участвует в окислительном декарбоксилировании α-кетокислот, в трансальдолазных и транскетолазных реакциях пентозофосфатного пути). 2 2. Никотинамидные коферменты (основа–витамин В5, РР, ниацин, никотинамид и АМФ; кофермент НАД(Ф)-никотинамидадениндинуклеотид(фосфат)): Химическая структура НАД(Ф): ++ Выделите фрагменты в этой структуре и покажите витамин В5, АМФ. Докажите, что НАД(Ф) - это динуклеотиды. Назовите функции НАД(Ф) (в составе энзимов участвует в окислительноОН восстановительных реакциях). — структуры Покажите, к какой части Р=О НАД(Ф) присоединяются е- и Н+ Различия в функциях НАД иОН НАДФ (реакции катаболизма и анаболизма). 3. Пантотеновые коферменты (основа–витамин В3-пантотеновая кислота и АДФ; кофермент – КоА-SН-коэнзим-А): — Химическая структура Коэнзима А: H-S- 3 Выделите фрагменты в этой структуре и покажите: АДФ, пантотеновую кислоту, -аланил, α,γ-дигидрокси, β,β -диметилбутирил, тиоэтаноламин. Назовите функции НS-КоА (в составе энзимов участвует в образовании ацил-КоА). Покажите активную часть в структуре кофермента. 4. Флавиновые коферменты (витамин В2, рибофлавин) Химическая структура ФАД и ФМН: Дайте полное название ФМН и ФАД Выделите в написанной структуре ФМН, ФАД. Покажите его фрагменты: витамин, изоаллоксазиновое кольцо, рибитол, АМФ). Функции ФМН и ФАД (в составе энзимов участвует в окислительновосстановительных реакциях). Покажите, куда присоединяются е- и Н+. 5. Пиридоксиновые коферменты (витамин В6, пиридоксин): Химическая структура коферментов: Покажите: витамин, кофермент. Объясните названия написанных коферментов (пиридоксальфосфат, пиридоксаминфосфат) Перечислите функции этих коферментов (в составе энзимов участвуют в реакциях трансаминирования и декарбоксилирования аминокислот). 4 6. Фолиевые коферменты (витамин В9, фолиевая кислота): Химическая структура: Н Н Н Н Дайте название написанной структуры (ТГФК). Покажите фрагменты, входящие в эту структуру: птеридин, nаминобензойная кислота и глутамат. перечислите функции этого кофермента (в составе энзимов участвует в переносе одноуглеродных фрагментов – формильной –СНО, метильной – СН3, метиленовой –СН2-, метенильной –СН=, оксиметильной –СН2ОН, формиминовой –СН=NН). 7. Кобамидные коферменты (витамин В12, кобаламин): Химическая структура: 5 Покажите основные составляющие фрагменты молекулы: пирролльные кольца, корриновое ядро, центральный атом кобальта, нуклеотидный лиганд. Кобамидные коферменты: метилкобаламин (СН3—В12), дезоксиаденозилкобаламин (дезоксиаденозил—В12). В чем их химическое различие? Функции кобамидных коферментов - в составе энзимов участвуют в: - реакциях трансметилирования (совместно с ТГФК): СН3—В12 этаноламин холин - реакциях изомерации: Дезоксиаде-окисление ВЖК (нечет. ат. С) метилмалонил-КоА нозил-В сукцинил-КоА 12 ЦТК Факторы Касла (внешний – В12, внутренний – гастромукопротеид). 8. Биотиновые коферменты (витамин Н, биотин): Химическая структура: Покажите фрагменты, входящие в эту структуру: тиофен, мочевину, валериановую кислоту. Функции биотиновых коферментов (в составе энзимов участвуют в реакциях карбоксилирования при биосинтезе глюкозы и ВЖК). Объясните образование активной формы СО2 (карбоксибиотина). 9. Липоевые коферменты (витамин N): Химическая структура: + 2Н+ + 2е- НS S ЛК ЛК НS S Функции липоевых коферментов (в составе энзимов участвуют в окислительном декарбоксилировании α-кетокислот: пирувата до ацетил-КоА и α-кетоглутарата до сукцинил-КоА). 6 10. Хиноновые коферменты (убихинон, коэнзим-Q): Химическая структура: СН3 R = — (СН2 – СН = С – СН2)n – Н (изопрен, n= 6-10) Покажите фрагменты, входящие в эту структуру (хинон и изопреновую — цепь). Что обозначают Ко-Q6 и Ко-Q10? Функции хиноновых коферментов - обязательный компонент дыхательной цепи: коллектор электронов и протонов в дыхательной цепи перенос 2е- на цитохромы передача 2Н+ в митохондриальный матрикс 11. Карнитиновые коферменты (витамин Вт, карнитин): Химическая структура: Покажите основные компоненты, входящие в эту структуру (холин и ацетат). Функции карнитиновых коферментов (в составе энзимов участвуют в переносе ВЖК через мембрану митохондрий). КОФЕРМЕНТЫ НЕВИТАМИННОЙ ПРИРОДЫ 1. Нуклеотидные коферменты НОСН2 Н О Н Н ОН Н НО О Н CH3 | H3C – N+ - CH2 – CH2 – O – ЦДФ | CH3 УДФ Цитидиндифосфатхолин ОН (ЦДФ-холин) Уридиндифосфатглюкоза (УДФ-глюкоза) 7 2. Металлопорфириновые коферменты цитохромов 3. Пептидные коферменты: глутатион (Глу-Цис-Гли, см. раздел «Обмен белков») 4. Дифосфаты моносахаридов 6 СН2ОРО3Н2 Н СООН |2 НС — О — РО3Н2 |3 Н2С — О — РО3Н2 Н ОН О Н НО 2,3-дифосфоглицерат Н 1 О Н РО3Н2 ОН Глюкозо-1,6-дифосфат Опишите химическую структуру каждого кофермента. Охарактеризуйте биологическую роль каждого кофермента - перенос глюкозы в синтезе гликогена (УДФ-глюкоза), - перенос холина в синтезе фосфатидилхолина (ЦДФ-холин), - перенос электронов по дыхательной цепи (металлопорфириновые коферменты), - является донором водорода в окислительно-восстановительных реакциях (глутатион), - 2,3-дифосфоглицерат — кофермент фосфоглицеромутазы, обеспечивает превращение 3-фосфоглицерат 2-фосфоглицерат, - глюкозо-1,6-дифосфат — кофермент, обеспечивает превращения глюкозо-1-фосфат глюкозо-6-фосфат. КОФАКТОРЫ ФЕРМЕНТОВ - ИОНЫ МЕТАЛЛОВ: Na+, K+, Mg2+, Mn2+, Ca2+, Zn2+, Cu2+, Fe2+, Mo6+ и другие Функции ионов металлов в ферментах: - стабилизируют третичную и четвертичную структуры энзимов, - входят в состав активного центра фермента и способствуют присоединению субстрата к активному центру, - образуют с субстратом комплекс, на который действует энзим, - выполняют коферментные функции: Na+, K+, Mg2+, Ca2+ - входят в состав АТФ-аз, которые транспортируют соответствующие ионы, Zn2+ - входит в состав угольной ангидразы (карбоангидразы), катализирующей биосинтез и распад угольной кислоты, 8 Ионы металлов с переменной валентностью (Fe2+, Cu2+) - входят в состав цитохромоксидаз и катализируют перенос электронов на кислород. - Кофермент выступает в роли акцептора или донора химических группировок атомов, электронов. - Апофермент обеспечивает специфичность действия энзима. ОРГАНИЗАЦИЯ СТРУКТУРЫ ФЕРМЕНТА Аллостерический центр Активный центр Первичная, вторичная, третичная, четвертичная структуры апофермента (линейная последовательность аминокислот, преимущественно α-спираль, олигомерную структуру) глобула, объединение субъединиц в Активный центр фермента (уникальная комбинация функциональных групп аминокислотных остатков полипептидной цепи, обеспечивающая прикрепление субстрата и акт катализа): - акцепторный участок, - каталитический участок. функциональные группы активного центра фермента (уникальная комбинация 12-16 радикалов аминокислот из различных участков полипептидной цепи): Сер О R—CН2— ОН Глу — С О— Цис R—CН2— SН Н Лиз — N — Н Н + Гис R—CН2— С = СН NН N: СН Гидрофобные группы Фен, Лей, Вал и др. 9 Аллостерические ферменты - ферменты, имеющие аллостерический центр, расположенный не в активном центре. Аллостерический центр (комбинация радикалов нескольких аминокислот) - роль аллостерических центров в регуляции активности фермента - положительные и отрицательные модификаторы аллостерических центров (промежуточные метаболиты обмена веществ и лекарственные препараты). Изоферменты – группа ферментов, катализирующих одну химическую реакцию, но обладающих различными свойствами: - аминокислотным составом, - сродством к субстрату, - электрофоретической подвижностью, - каталитической активностью, - локализаций в тканях. Пример изоферментов - лактатдегидрогеназы (ЛДГ): - реакции катализируемые изоферментами ЛДГ ЛДГ4, ЛДГ5 Пируват + НАДН2 Распределение изоферментов ЛДГ разных тканей при электрофорезе Миокард Скелетные мышцы Лактат + НАД+ ЛДГ1, ЛДГ2 Набор субъединиц 10 Обозначение набора субъединиц Название изофермента, принятое в медицине Н4 ЛДГ1 М1Н3 ЛДГ2 М2Н2 ЛДГ3 М3Н1 ЛДГ4 М4 ЛДГ5 - биологическое значение распределения изоферментов ЛДГ по органам и тканям: - ЛДГ1 преимущественно в миокарде (аэробных условия функционирования), - ЛДГ5 преимущественно в скелетных мышцах (функционирующих не редко в анаэробных условиях); - диагностическое значение определения изоэнзимного спектра сыворотки крови при различных заболеваниях: - инфаркт миокарда – некроз кардиомиоцитов – вымывание ЛДГ в плазму – повышение активности преимущественно ЛДГ1 в плазме крови; - гепатит - ………….? Полиферментные системы (совокупность ферментов, объединенных единым метаболическим процессом). Метаболизм – совокупность всех протекающих в клетках химических реакций. В клетках продукт одной реакции служит субстратом для другого энзима, и таким образом формируются метаболические пути (“конвейеры”). Структура метаболических путей: они бывают линейные (гликолиз) и циклические (ЦТК). Реакции, катализируемые энзимами, согласованы между собой по времени, скорости, разделены по месту действия. Компартментализация ферментов: - в цитоплазме – ферменты гликолиза; - в лизосомах – гидролитические ферменты; - в ядре – ферменты синтеза ДНК и РНК; - в матриксе митохондрий – ферменты ЦТК; - в мембране митохондрий – ферменты переноса электронов и протонов. Органоспецифичность ферментов: - аргиназа – синтез мочевины в печени; - кислая фосфатаза – гидролиз фосфорных эфиров в простате; - креатинкиназа МВ – биоэнергетика миокарда; - GOT – трансаминирование в миокарде; - GPT - трансаминирование в печени. Формы организации полиферментных систем: - функциональные (объединены по функции, свободно диффундируют в цитоплазме клетки - энзимы гликолиза), - структурно-функциональные (объединены по функции и закреплены на структуре - энзимы дыхательной цепи митохондрий), - смешанные (часть ферментов метаболического пути свободна в матриксе митохондрий, а другая часть закреплена на мембране - энзимы ЦТК). Теория катализа (термодинамика катализа) - все процессы самопроизвольно протекают в сторону уменьшения свободной энергии (второй закон термодинамики), 11 - в любой реакционной смеси все молекулы значительно различаются по содержанию потенциальной и кинетической энергии: число молекул энергия молекул - скорость химической реакции зависит от энергии исходных веществ и величины энергетического барьера (молекулярные силы отталкивания), - чтобы повысить скорость химической реакции, необходимо увеличить энергию реагирующих веществ (сообщить энергию активации) либо уменьшить величину энергетического барьера, - энергия активации (энергия, которая необходима, чтобы все молекулы 1 моля вещества могли бы преодолеть энергетический барьер и вступить в химическую реакцию), графическое изображение энергии реагирующих веществ, энергии активации и энергетического барьера: G Средняя энергия исходных вещества (S) энергия активации в присутствии катализатора энергетический барьер без катализатора энергия активации без катализатора энергетический барьер в присутствии катализатора энергия продуктов реакции (Р) динамика химической реакции (t) 12 способы повышения скорости химической реакции: - температура (повышение температуры на 10 0С увеличивает скорость реакции в 2-3 раза), - катализаторы: неорганические и органические (ферменты). Сходства и отличия в действии ферментов и неорганических катализаторов Сходства: - катализируют энергетически возможные реакции, - не изменяют направление реакций, - не смещают равновесие реакций, - ферменты и неорганические катализаторы не расходуются в ходе химической реакции. Отличия: - энзимы обладают значительно большей каталитической активностью, - энзимы действуют в «мягких» условиях (рН, температура, давление), - энзимы обладают специфичностью действия, - энзимы являются катализаторами с регулируемой активностью. Гипотезы механизма действия ферментов Адсорбционная (Бейлис, Варбург) Гипотеза промежуточных соединений (Михаэлис, Ментен): - сближение и ориентация субстрата и активного центра энзима, - образование E-S комплекса, эффект напряжения (индуцированное напряжение и дестабилизация, при которых энергетический барьер химической реакции становится ниже), - акт катализа (кислотно-щелочной или ковалентный): - кислотно-основной катализ (фермент и субстрат реагируют, как кислота и щелочь), - ковалентный катализ (при взаимодействии фермента и субстрата образуются ковалентные связи, которые не устойчивы и быстро распадаются с образованием новых продуктов реакции), - выход конечных продуктов реакции из активного центра фермента. 13 Кинетика ферментативных реакций Кинетика химических реакций зависит от: количества субстрата, количества фермента, температуры, рН среды, активности фермента, и многих других причин. Влияние количества субстрата (Кm - константа Михаэлиса): - Кm - это концентрация субстрата, при которой скорость химической реакции составляет 1⁄2 от максимально возможной.Km для каждого энзима величина постоянная, она отражает сродство энзима и субстрата; - Кm гексокиназы=0,1 мМ ⁄л, - Кm глюкокиназы=10 мМ ⁄л. - Биологических смысл различного сродства (Кm) гексокиназы и глюкокиназы к глюкозе и распределения этих ферментов по тканям (сохранение гомеостаза глюкозы). Влияние количества фермента: скорость реакции количество фермента - Зависимость прямо пропорциональная, т.е. чем больше фермента в клетке, тем выше скорость ферментативной реакции. - Количество энзима в клетке зависит от ее потребности в ферменте (гипотеза Жакоба и Моно. - В покое в клетке функционирует лишь небольшая часть энзимов. - В ситуации стресса в кинетике химической реакции участвует максимальное количество энзимов, что обеспечивает адаптацию клетки к экстремальным условиям. 14 Влияние температуры, - При увеличении температуры до 400С скорость ферментативной реакции возрастает 0 (повышение температуры на 10 С увеличивает скорость реакции в 1,5-2 раза), - возрастание скорости ферментативной реакции при повышении температуры используется организмом как защитный механизм, - понижение температуры (гипотермия организма и его отдельных тканей) используется в медицине для замедления ферментативных реакций при консервации органов и выполнении хирургических операций на «сухом» органе. - Выше 400С скорость некоторых ферментативных реакций замедляется, т.к. начинается денатурация фермента. - Каждый фермент проявляет максимальную активность при оптимальном для него значении рН среды. - Оптимум рН среды для большинства ферментов лежит в нейтральной среде. Имеются исключения: - пепсин – оптимум рН=1,5-2, - щелочная фосфатаза – оптимум рН=9-10. - Изменение рН в организме при патологиях нарушает функцию энзимов (изменяется степень ионизации функциональных групп активного и аллостерического центров и их архитектоника). Влияние рН среды, Принципы регуляции метаболических путей Изменением количества фермента (на уровне транскрипции и трансляции и протеолиза белка фермента); Доступностью молекул субстрата и кофермента (т.е. проницаемостью мембран, а также активностью транслоказ); Изменением каталитической активности фермента (наиболее эффективный и быстрый способ регуляции метаболизма). Активность фермента Может увеличиваться или понижаться. 15 Активность фермента в клетке изменяется под действием на него активаторов и ингибиторов. Понятие об активаторах и ингибиторах ферментов: - активатор увеличивает скорость ферментативной реакции, - ингибитор уменьшает скорость ферментативной реакции. Использование ингибиторов и активаторов в медицине (лекарственные препараты в большинстве случаев являются активаторами или ингибиторами ферментов). Активирование ферментов Способы активирования ферментов: - Витаминами и коферментами, - субстратами, - ионами металлов, - активацией профермента (профермент активный фермент: частичный протеолиз пепсиногена с образованием активного пепсина), - активацией по принципу ковалентной модификации (фосфорилирование/дефосфорилирование ферментов: фосфорилаза активируется, а гликогенсинтетаза ингибируется в первом случае и наоборот при дефосфорилировании), - ассоциацией и диссоциацией протомеров: например, протеинкиназа неактивная – тетрамер (2R-регуляторные и 2G-каталитические субъединицы) + 4 ц-АМФ диссоциация олигомера с освобождением 2G субъединиц, обладающих каталитической активностью. - положительными модификаторами аллостерических ферментов. Ингибирование ферментов Виды ингибирования (необратимое и обратимое) Необратимое ингибирование (активность фермента не восстанавливается); например при действии диизопропилфторфосфата (ДФФ) на ацетилхолинэстеразу: H CH CH33 C H CH3 CH3 ФЕРМЕНТ O C CH3 O ФЕРМЕНТ F CH2O H P O CH2O O CH3 C P O O CH3 CH3 H C HF CH3 H ДФФ 16 НЕАКТИВНЫЙ ФЕРМЕНТ ацетилхолин является медиатором при синаптической передаче нервного импульса, холинэстераза катализирует распад ацетилхолина, прерывая передачу нервного импульса, при необратимом ингибировании холинэстеразы передача нервного импульса не прерывается, что вызывает тетанию и паралич дыхания, на принципах необратимого ингибирования основано действие многих боевых отравляющих веществ, Обратимое ингибирование (после отделения ингибитора от фермента его активность восстанавливается) Виды обратимого ингибирования: конкурентное ингибирование: - Конкурентный ингибитор сходен по структуре с субстратом. - Субстрат и ингибитор конкурируют за активный центр фермента образуются комплексы ЕS и EI. Последний препятствует взаимодействию энзима с истинным субстратом. - Конкурентными ингибиторами могут быть метаболиты (например, ЩУК, малат), антиметаболиты, антикоферменты, антивитамины и лекарственные препараты (например, прозерин, физостигмин, присоединяясь к активному центру ацетилхолинэстеразы, препятствуют гидролизу ацетилхолина и усиливают проведение нервного импульса при лечении мышечной дистрофии.) действие малоновой кислоты на сукцинатдегидрогеназу неконкурентное ингибирование: - Субстрат и ингибитор не конкурируют за активный центр фермента. - Ингибитор обратимо изменяет структуру энзима. В связи с этим, последний не может эффективно катализировать реакцию превращения субстрата. - Неконкурентными ингибиторами могут быть промежуточные метаболиты, которые ингибируют энзим по принципу отрицательной обратной связи, а также ионы тяжелых металлов в небольших количествах. S S H S H - S Hg2+ Е S Hg2+ I Е + S + I ———————— ESI 17 субстратное ингибирование: - Избыток субстрата ингибирует энзим, т.к к активному центру фермента присоединяются одновременно 2 молекулы субстрата. - Ингибирование снимается простым уменьшением концентрации субстрата. E 2S S Е S Е + S + S ———————— ESS Аллостерическая регуляция активности ферментов (ферменты "дирижеры", регуляторные, ключевые ферменты ) - возможна в группе ферментов с аллостерическими центрами, - аллостерическими эффекторами в организме являются метаболиты, гормоны, металлы, коферменты, благодаря аллостерической регуляции активности энзимов, аллостерические ферменты являются «дирижерами» метаболических процессов, как правило, катализируют самые медленные реакции и располагаются в начале и конце метаболического пути, пример аллостерической регуляции (энзимы гликолиза): - - Схема гликолиза: — Е2 Е1 Е3 Е10 Е11 г г-6-ф ф-6-ф ф-1,6-диф …… феп пируват лактат аллостерическими ферментами этого пути являются Е3 и Е10 (фосфофруктокиназа и пируваткиназа), Е3 и Е10 , увеличивая или уменьшая свою активность, контролируют скорость гликолиза, положительными модификаторами Е3 и Е10 являются АМФ и АДФ, отрицательными модификаторами Е3 и Е10 являются АТФ, цитрат и ВЖК. 18 биологический смысл аллостерической регуляции (клетка тонко реагирует на изменения окружающей среды и в режиме саморегуляции изменяет метаболизм в нужном направлении), ингибирование по принципу отрицательной обратной связи (ретроингибирование) – разновидность аллостерической регуляции: - осуществляется продуктами реакции (лактат); они ингибируют энзим (Е11) , катализирующий их образование. Специфичность действия ферментов: — В основе специфичности лежит структурное и химическое соответствие субстрата и активного центра фермента. Гипотезы: гипотеза Фишера ("ключ-замок"), гипотеза Кошланда (вынужденного соответствия). Виды специфичности ферментов: субстратная и каталитическая. субстратная специфичность (в порядке убывания степени специфичности): - стереохимическая – фермент специфичен к стереоизомерам (Lаминокислоты, d-сахара), - абсолютная субстратная специфичность – фермент катализирует превращение только одного субстрата (уреаза катализирует превращение только мочевины, аргиназа – распад аргинина), - абсолютная групповая специфичность – фермент специфичен к функциональным группам субстрата (алкогольдегидрогеназа – катализирует окисление различных спиртов), - относительная групповая специфичность - фермент специфичен к химическим связям определенной группы субстратов (пепсин, трипсин - катализируют пептидные связи белков), - относительная субстратная специфичность- фермент мало специфичен (монооксидазы в присутствии цитохрома Р450 окисляет тысячи различных веществ, лекарств, ядов). – Каталитическая специфичность, например глюкозо-6-Ф является субстратом 4 энзимов: глюкозо-6-фосфатазы, фосфогексоизомеразы, фосфоглюкомутазы и глюкозо-6-фосфатдегидрогеназы. Номенклатура ферментов (название ферментов): тривиальная (произвольная, исторически сложившаяся: пепсин, трипсин, химотрипсин), номенклатура, предложенная Дюкло (название субстрата с заменой его окончания на «аза»: сахароза- сахараза, лактоза-лактаза), предложения Международного конгресса по энзимологии (1961 г.): - рабочее название фермента (название субстрата + тип реакции + окончание «аза»: лактатдегидрогеназа = ЛДГ1-5?) – удобное для повседневного использования. 19 - систематическое название фермента (названия субстратов + тип реакций + окончание «аза»: L-лактат:НАД-оксидоредуктаза = ЛДГ5) – используется для однозначной идентификации энзима. Классификация ферментов - I. II. несколько тысяч ферментов разделены на 6 классов, название класса фермента определяется типом химической реакции, катализируемой ферментом: Оксидоредуктазы: - катализируют окислительно-восстановительные реакции: с участием кислорода, а также перенос электронов и атомов водорода с одного субстрата на другой, - в природе обнаружено около 500 ферментов этого класса, - их разделяют на 17 подклассов (оксидазы, оксигеназы и др.), - каждый подкласс делят на подподклассы (оксидазы делят на анаэробные и аэробные дегидрогеназы), - каждому ферменту присваивают номер, 1.- класс фермента 1.- подкласс - код (шифр) фермента: ЛДГ1 = КФ 1.1.1.27. (окисляемая ОНгруппа ) 1.- подподкласс МДГ = КФ 1.1.1.38. (кофермент НАД) 27.- порядковый Трансферазы: номер фермента - катализируют перенос групп атомов, - делят на 8 подклассов: - аминотрансферазы (переносят аминогруппу), - метилтрансферазы (переносят метильную группу), - фосфотрансферазы (переносят остаток фосфорной кислоты) и др. III. Гидролазы: катализируют расщепление внитримолекулярных связей с участием воды, - в природе обнаружено около 460 ферментов этого класса, - делят на 11 подклассов: - пептидазы (гидролизуют пептидные связи в белках), - эстеразы (гидролизуют сложноэфирные связи), - гликозидазы (гидролизуют гликозидные связи в полисахарах) и др., - IV. - V. Лиазы: катализируют разрыв связей (С─О, С─С, С─N и др.) без участия воды, в природе обнаружено около 230 ферментов этого класса, делят на 4 подкласса: - декарбоксилазы (катализируют отрыв СО2-группы, например, от аминокислот с образованием биологически активных аминов.) Изомеразы: 20 - VI. катализируют реакции изомеризации, в природе обнаружено около 80 ферментов этого класса, делят на 5 подклассов, примеры изомераз: - триозофосфатизомераза (дигидроксиацетонфосфат↔ глицеральдегид-3-ф.), - фосфогексоизомераза (глюкозо-6-ф ↔ фруктозо-6-ф), - фосфоглюкомутаза (глюкозо-1-ф глюкозо-6-ф). Лигазы (синтетазы): - катализируют реакции биосинтеза молекул с участием макроэргов, - в природе обнаружено около 80 ферментов этого класса, - делят на 5 подклассов, - примеры лигаз: - аминоацил-тРНК-синтетаза (активирует аминокислоты при биосинтезе белков), - ацил-КоА-синтетаза (активирует ВЖК при биосинтезе триглицеридов). Методы определения активности ферментов Активность фермента определяется в стандартных (оптимальных) условиях по: - убыли концентрации исходных субстратов или - приросту продуктов реакции, при определении активности энзимов до сих пор используется оптический тест Варбурга - НАД(Ф) ─ НАД(Ф)Н2: ЛДГ Пируват НАДН - Лактат НАД 2 контроль за изменением в инкубационной среде концентрации НАДН2 (при 340 нм с увеличением НАДН+ возрастает оптическая плотность инкубационной среды) используется для расчета активности фермента; Единицы активности ферментов - 1 Е (U) = 1 мкмоль/мин (т.е. 1 единица активности энзима – это то его количество, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях), Е (единица активности фермента) - русское обозначение, U (единица активности фермента) - английское обозначение; - 1 катал = 1 моль/сек (выражение активности фермента по Международной системе единиц СИ), 1 катал = 6∙107 МЕ; - удельная активность фермента = мкмоль/(мин мг белка). 21 - число оборотов фермента (молярная активность) это количество молекул субстрата, превращенного в продукт за одну секунду одной молекулой фермента. Медицинская энзимология энзимопатология: - универсальная концепция энзимопатологии гласит, что абсолютно все заболевания являются результатом нарушения функции ферментов, - энзимопатии подразделяют на первичные (наследуемые) и вторичные (приобретеные), - наследуемые энзимопатии являются следствием мутаций генов: - фенилкетонурия – результат мутации гена, кодирующего энзим фенилаланингидроксилазу, - приобретенные энзимопатии являются следствием изменения конформации энзима под влиянием факторов окружающей среды, энзимодиагностика: - энзимы широко используются для: - дифференциальной диагностики заболеваний, - оценки интенсивности и величины патологического процесса, - для установления прогноза заболевания и др. - наиболее часто анализируются с диагностической целью ферменты сыворотки крови, которые подразделяют на: - секреторные (энзимы свертывающей и антисвертывающей системы крови), - экскреторные (энзимы поджелудочной железы – диастаза, липаза), - клеточные, которые подразделяют на: - неспецифические, - органоспецифические, которые называют маркерные, или индикаторные, ферменты (аргиназа), - изоэнзимы, которые неравномерно распределены по органам и тканям (ЛДГ1 преимущественно в миокарде, а ЛДГ5 – в печени и скелетных мышцах), что тоже используется в диагностике, - концентрация клеточных и экскреторных энзимов в сыворотке крови на несколько порядков ниже, чем в соответствующих органах и тканях, - при патологиях (воспалении, некрозе) энзимы в большом количестве вымываются в кровь, что является свидетельством повреждения соответствующего органа. энзимотерапия: - использование ферментов в качестве лекарственных препаратов: - пепсин, трепсин, химотрипсин применяют для лечения болезней желудочно-кишечного тракта, - коллагеназу, эластазу, гиалуронидазу применяют для обработки ран с интенсивным воспалением с целью предотвращения образования келоидных рубцов, - стрептокиназу, урокиназу, фибринолизин применяют для растворения сгустков крови (тромбов), сформировавшихся в кровеносных сосудах. 22