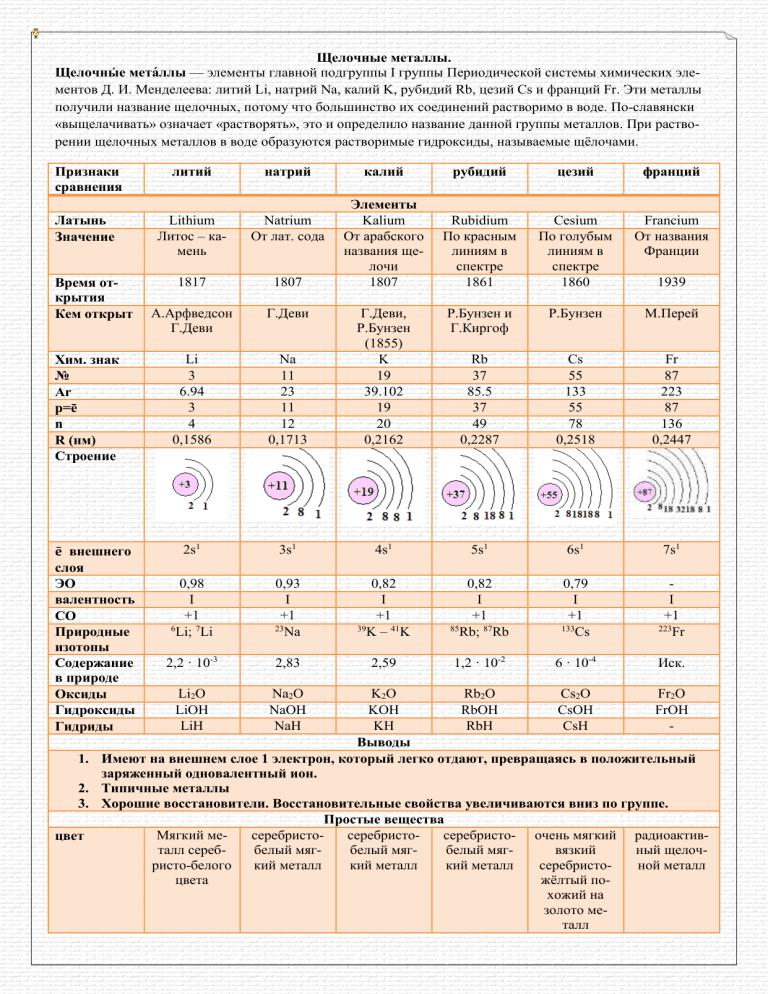
Щелочные металлы. Щелочны́е мета́ллы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами. Признаки сравнения литий натрий Латынь Значение Lithium Литос – камень Natrium От лат. сода 1817 1807 А.Арфведсон Г.Деви Г.Деви Li 3 6.94 3 4 0,1586 Время открытия Кем открыт Хим. знак № Ar p=ē n R (нм) Строение ē внешнего слоя ЭО валентность СО Природные изотопы Содержание в природе Оксиды Гидроксиды Гидриды калий рубидий цезий франций Элементы Kalium От арабского названия щелочи 1807 Rubidium По красным линиям в спектре 1861 Cesium По голубым линиям в спектре 1860 Francium От названия Франции Р.Бунзен и Г.Киргоф Р.Бунзен М.Перей Na 11 23 11 12 0,1713 Г.Деви, Р.Бунзен (1855) K 19 39.102 19 20 0,2162 Rb 37 85.5 37 49 0,2287 Cs 55 133 55 78 0,2518 Fr 87 223 87 136 0,2447 2s1 3s1 4s1 5s1 6s1 7s1 0,98 I +1 6 Li; 7Li 0,93 I +1 23 Na 0,82 I +1 39 K – 41K 0,82 I +1 85 Rb; 87Rb 0,79 I +1 133 Cs I +1 223 Fr 2,2 · 10-3 2,83 2,59 1,2 · 10-2 6 · 10-4 Иск. Li2O LiOH LiH Na2O NaOH NaH 1939 K2O Rb2O Cs2O Fr2O KOH RbOH CsOH FrOH KH RbH CsH Выводы 1. Имеют на внешнем слое 1 электрон, который легко отдают, превращаясь в положительный заряженный одновалентный ион. 2. Типичные металлы 3. Хорошие восстановители. Восстановительные свойства увеличиваются вниз по группе. Простые вещества Мягкий месеребристосеребристосеребристо- очень мягкий радиоактивцвет талл сереббелый мягбелый мягбелый мягвязкий ный щелочристо-белого кий металл кий металл кий металл серебристоной металл цвета жёлтый похожий на золото металл ρ г/см3 Tпл Ткип 1. 2. 3. 4. 0,53 0,97 0,86 1,53 1,87 181 98 64 39 28 1347 883 774 688 678 Низкие температуры кипения, плавления и плотность Элементы – типичные металлы, легко режутся ножом, очень мягкие. Литий, натрий и калий легче воды Имеют металлическую кристаллическую решетку (кубическая объёмноцентрированая) ЛИТИЙ НАТРИЙ РУБИДИЙ КАЛИЙ ЦЕЗИЙ Химические свойства 1. Взаимодействуют с водой 2Э+ 2H2O = 2ЭOH + H2 2Li + 2H2O = 2LiOH + H2 2. Взаимодействуют с кислородом 4Li + O2 = 2Li2O – оксид лития 2Na + O2 = Na2O2 – пероксид натрия K + O2 = KO2 – надпероксид калия 3. Взаимодействуют с водородом 2Э + H2 = 2ЭH 2Li + H2 = 2LiH 4. Взаимодействуют с другими неметаллами 6Li + N2 = 2Li3N 2K + S = K2S 5. Взаимодействуют с кислотами 2Э + 2HCl = 2ЭCl + H2 2Na + 2HCl = 2NaCl + H2 6. Взаимодействуют с оксидами металлов и солями 2Na + BeO = Na2O + Be Качественная реакция на щелочные металлы – окрашивание пламени их катионами Li Na K Rb Cs Кармино-красный Желтый Фиолетовый розоворозовофиолетовый фиолетовый Основные соединения Оксиды – Э2О. Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами: 1) Э2О + Н2О = 2ЭОН 2) Э2О + SO3 = Э2SO4 3) Э2О + H2SO4 = Э2SO4 + H2O Гидроксиды щелочных металлов (ЭОН) — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований: 1) Диссоциируют в водных растворах: ЭОН ⇄Э+ + ОН¯ 2) Действуют на индикаторы 3) Взаимодействуют с кислотами: ЭОН + HCl = H2O + ЭCl 4) Взаимодействуют с кислотными оксидами: 2ЭОН + SO3 = Э2SO4+Н2О 5) Взаимодействуют с амфотерными оксидами: 2ЭОН + Al2O3 = 2ЭAlO2+Н2О 6) Взаимодействуют с амфотерными гидроксидами: ЭОН + Al(ОН)3 + 2Н2О = Э[Al(OH)4 (H 2O)2] 7) Взаимодействуют с солями, если образуется осадок: 2ЭОН + CuSO4 = Э2SO4 + Cu(OH)2↓ Получение 1) Электролиз расплавов солей или гидроксидов 2) Металлический калий получают пропусканием через хлорид или гидроксид калия паров натрия (при Т=800оС): KOH + Na = K + NaOH 3) Рубидий и цезий восстановление из хлоридов металлическим кальцием: Ca + 2RbCl = Rb + CaCl2 4) Цезий высокой чистоты для фотоэлементов получают (в вакууме и при 1000оС) в результате реакции: 2Cs2CrO4 + 5Zr = 4Cs + 5ZrO + Cr2O3 Применение Литий 1) изотоп 𝟔𝟑𝐋𝐢 используется как исходный продукт для получения трития 2) изотоп 𝟕𝟑𝐋𝐢 - теплоноситель в атомных реакторах 3) литий и некоторые его соединения служат топливом для ракет 4) гидроксид лития – компонент электролита для щелочных аккумуляторов 5) Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски, и для изготовления оптики с широкой спектральной полосой пропускания 6) Соли лития обладают психотропным действием и используются в медицине при профилактике и лечении ряда психических заболеваний. Наиболее распространен в этом качестве карбонат лития. применяется в психиатрии для стабилизации настроения людей, страдающих биполярным расстройством и частыми перепадами настроения. Он эффективен в предотвращении мании депрессии и уменьшает риск суицида. Медики не раз наблюдали, что некоторые соединения лития (в соответствующих дозах, разумеется) оказывают положительное влияние на больных, страдающих маниакальной депрессией. Объясняют этот эффект двояко. С одной стороны, установлено, что литий способен регулировать активность некоторых ферментов, участвующих в переносе из межклеточной жидкости в клетки мозга ионов натрия и калия. С другой стороны, замечено, что ионы лития непосредственно воздействуют на ионный баланс клетки. А от баланса натрия и калия зависит в значительной мере состояние больного: избыток натрия в клетках характерен для депрессивных пациентов, недостаток – для страдающих маниями. Выравнивая натрий калиевый баланс, соли лития оказывают положительное влияние и на тех, и на других. 7) Стеарат лития («литиевое мыло») используется в качестве высокотемпературной смазки Натрий 1) Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель, в том числе в металлургии. 2) Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. 3) Его также применяют в выпускных клапанах грузовиков как теплоотвод. 4) В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя 5) Натрий также используется в газоразрядных лампах высокого и низкого давления 6) Гидроксид натрия использую в мыловарении 7) Хлорид натрия – поваренная соль в пищевой промышленности 8) Нитрат натрия – удобрение 9) Гидрокарбонат натрия – питьевая или чайная сода в пищевой промышленности 10) Карбонат натрия – в стекольной, мыловарении, текстильной, бумажной, нефтяной промышленности 11) Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение). 12) Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне. Калий 1. Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C. 2. Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений. 3. Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока. 4. Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы. 5. Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов. 6. Карбонат калия (поташ) — используется как удобрение, при варке стекла. 7. Хлорид калия (сильвин, «калийная соль») — используется как удобрение. 8. Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха. 9. Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике. 10. Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина. 11. Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода. 12. Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика. 13. Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике. 14. Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода). 15. Фтороборат калия — важный флюс для пайки сталей и цветных металлов. 16. Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали. 17. Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Рубидий 1. Хотя в ряде областей применения рубидий уступает цезию, этот редкий щелочной металл играет важную роль в современных технологиях. Можно отметить следующие основные области применения рубидия: катализ, электронная промышленность, специальная оптика, атомная промышленность, медицина. 2. Рубидий используется не только в чистом виде, но и в виде ряда сплавов и химических соединений. Рубидий имеет хорошую сырьевую базу, более благоприятную, чем для цезия. Область применения рубидия в связи с ростом его доступности расширяется. 3. Изотоп рубидий-86 широко используется в гамма-дефектоскопии, измерительной технике, а также при стерилизации лекарств и пищевых продуктов. Рубидий и его сплавы с цезием — это весьма перспективный теплоноситель и рабочая среда для высокотемпературных турбоагрегатов (в этой связи рубидий и цезий в последние годы приобрели важное значение, и чрезвычайная дороговизна металлов уходит на второй план по отношению к возможностям резко увеличить КПД турбоагрегатов, а значит и снизить расходы топлива и загрязнение окружающей среды). Применяемые наиболее широко в качестве теплоносителей системы на основе рубидия — это тройные сплавы:натрийкалий-рубидий, и натрий-рубидий-цезий. 4. В катализе рубидий используется как в органическом, так и неорганическом синтезе. Каталитическая активность рубидия используется в основном для переработки нефти на ряд важных продуктов. Ацетат рубидия, например, используется для синтеза метанола и целого ряда высших спиртов из водяного газа, что актуально в связи с подземной газификацией угля и в производстве искусственного жидкого топлива для автомобилей и реактивного топлива. Ряд сплавов рубидия с теллуром обладают более высокой чувствительностью в ультрафиолетовой области спектра, чем соединения цезия, и в связи с этим он способен в этом случае составить конкуренцию цезию как материал для фотопреобразователей. В составе специальных смазочных композиций (сплавов), рубидий применяется как высокоэффективная смазка в вакууме (ракетная и космическая техника). 5. Гидроксид рубидия применяется для приготовления электролита для низкотемпературных химических источников тока, а также в качестве добавки к раствору гидроксида калия для улучшения его работоспособности при низких температурах и повышения электропроводности электролита. В гидридных топливных элементах находит применение металлический рубидий. 6. Хлорид рубидия в сплаве с хлоридом меди находит применение для измерения высоких температур (до 400 °C). 7. Пары рубидия используются как рабочее тело в лазерах, в частности, в рубидиевых атомных часах. 8. Хлорид рубидия применяется в топливных элементах в качестве электролита, то же можно сказать и о гидроксиде рубидия, который очень эффективен как электролит в топливных элементах, использующих прямое окисление угля Цезий Цезий нашёл применение только в начале XX века, когда были обнаружены его минералы и разработана технология получения в чистом виде. В настоящее время цезий и его соединения используются в электронике, радио-, электро-, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике. В основном применяется стабильный природный цезий-133, и ограниченно — его радиоактивный изотоп цезий-137, выделяемый из суммы осколков деления урана, плутония, тория в реакторах атомных электростанций Франций Соль франция FrCl использовалась для обнаружения раковых опухолей, но по причине чрезвычайно высокой стоимости эту соль в масштабных разработках использовать невыгодно







