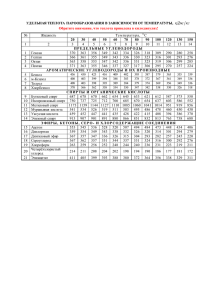
Контроль качества лекарственных средств, производных спиртов и альдегидов. Спирты Спирты-это производные углеводов, молекулы которых содержат гидроксильные группы Спиртами алхимики называли летучие вещества (от лат. spiritus - дух), выделяющиеся при получении вина. Лекарсвенное средства Фармакологическая группа Физико-химические свойства Спирт этиловый Этанол 95% Spiritus aethylicus C2H5OH C2H6O Mr 46,1 Органический растворитель для получения настоек, экстрактов, а также в виде 50-70% раствора для наружного применения в качестве дезинфицирующего средства и раздражающего средства в виде обтираний и компрессов Прозрачная летучая (Ткип 78,3 °С) бесцветная подвижная жидкость, легко воспламеняется, имеет характерный запах, жгучий вкус; горит синим пламенем, смешивается в любых соотношениях с водой, эфиром, хлороформом, ацетоном и глицерином. Более высокая температура кипения по сравнению с изомером - диэтиловым эфиром - обусловлена водородными связями. Смесь спирта с воздухом (319%) взрывоопасна Химические свойства спиртов определяются их функциональной группой - гидроксильной группой ОН. Спирты являются слабыми ОН-кислотами, поэтому щелочные металлы вытесняют из спиртов водород: Образующиеся алкоголяты легко гидролизуются: R-ONa + H2O → ROH + NaOH Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации: При взаимодействии спиртов с карбоновыми кислотами (в присутствии следов сильных минеральных кислот) образуются сложные эфиры. Первичные и вторичные спирты легко окисляются, причем при окислении первичных спиртов образуются альдегиды, которые окисляются в карбоновые кислоты: Вторичные спирты окисляются до кетонов: Получение Синтетический этиловый спирт получают гидратацией этилена в присутствии фосфорной (или серной) кислоты: При получении спирта брожением пищевого сырья, содержащего крахмал зерновых культур, картофеля, к нему добавляют солод - измельченные проросшие зерна ячменя. Содержащийся в солоде фермент амилаза катализирует превращение крахмала в мальтозу: Под влиянием фермента мальтазы дрожжей дисахарид мальтоза превращается в глюкозу: Глюкоза под влиянием зимазы дрожжей дает конечные продукты брожения - спирт и углекислый газ: Концентрация спирта выражается в массовых или объемных долях в процентах (1 объемный % = 1°). В фармацевтической практике концентрацию спирта выражают обычно в объемных процентах (градусах). Имеются следующие продажные сорта спирта: 1) спирт-сырец 93-95% крепости; этот спирт недостаточно очищен от сивушных масел и альдегидов; 2) ректифицированный спирт 95-96%, очищенный и почти без примесей; 3) абсолютный спирт 100%, безводный; 4) денатурированный спирт-сырец, к которому добавлены пиридиновые основания, метиловый спирт или сивушные масла. Применяется денатурированный спирт только для хозяйственных целей, например для работы спиртовки. ГФ описывает следующие препараты спирта: безводный, т.е. абсолютный, спирт, и спирт этиловый 95, 90, 70 и 40%. ЕФ содержит 2 статьи: «Этанол (96%)» и «Этанол безводный». Контроль качества Определение подлинности. Подлинность этилового спирта устанавливают йодоформной пробой - при нагревании препарата с йодом в щелочной среде ощущается запах йодоформа: C2H5OH + 4I2 + 6KOH → CHI3↓ +5KI + HCOOK + 5H2O. Более специфичная реакция на спирт - реакция образования сложных эфиров: при взаимодействии спирта с ледяной уксусной кислотой в присутствии концентрированной серной кислоты образуется уксусно-этиловый эфир, обладающий своеобразным запахом: Спирт можно окислить дихроматом калия в присутствии серной кислоты до уксусного альдегида со специфическим запахом свежих яблок: Количественное содержание спирта этилового определяют с помощью ареометра или спиртометра, В жидких ЛФ-по плотности отгонов или по температуре кипения водно-спиртовых смесей Химический метод количественного содержания спирта: Основанный на окислении спирта до ацетальдегида с помощью 0,1М раствора дихромата калия (избыток K2Cr2O7 устанавливают йодометрическим методом(индикатор крахмал) 3C2H5OH+ K2Cr2O7+8HNO3=3C2H3OH +2Cr(NO3)3+2KNO3+7H2O K2Cr2O7+6KJ+14HNO3=2Cr(NO3)3+3J2+ 8KNO3+7H2O 3J2+6Na2S2O3=6NaJ+3Na2S4O6 Спирт этиловый хранят в хорошо укупоренной таре в прохладном месте, учитывая летучесть спирта и способность глицерола поглощать пары воды, содержащиеся в воздухе. Спирт этиловый при приеме внутрь вызывает наркотический эффект. Спирт этиловый применяют наружно для обтираний, компрессов и т.д. Альдегиды и их производные Альдегидами называют органические соединения, в которых карбонильная группа связана с водородом и с алифатическим или ароматическим углеводородным радикалом Лекарственное средство Фармакологическая группа Физико-химические свойства Альдегиды Формальдегид, мeтaнaль cн2o Mr 30,0 Раствор формальдегида в воде (формалин) Solutio Formaldehydi Антисептическое средство. Применяют в виде 0,5-1% раствора как дезинфицирующее средство. Используют для консервации анатомических и биологических препаратов, в бальзамирующих составах. Хранение: в хорошо закрытых склянках при температуре не ниже +9 °C, так как при более низкой температуре происходит полимеризация с образованием пapaфopмa (CH2O)n, который выпадает в осадок. Πapaфopм уже не обладает теми свойствами, которые присущи раствору формальдегида как медицинскому препарату Формалин - водный раствор формальдегида, содержащий около 40% формальдегида. Прозрачная, бесцветная, обладающая запахом формальдегида жидкость, мутнеющая при стоянии вследствие образования белого осадка пapaфopмaльдeгидa. Смешивается во всех отношениях с водой и спиртом. Формалин для предотвращения окисления стабилизируют добавлением метанола (не более 1%). Плотность формалина 1,11091,0764 г/см3 и показатель преломления - 1,3766- 1,3776 колеблются в указанных пределах в зависимости от содержания добавленного для стабилизации метилового спирта. Формалин имеет pH от 2,8 до 4,0 Альдегиды растворяются в органических растворителях, например в спиртах и эфирах. Низшие альдегиды имеют резкий запах, у альдегидов с 3-6 углеродными атомами весьма неприятный запах, в то время как высшие альдегиды обладают цветочными запахами и применяются в парфюмерии. Альдегиды легко окисляются. Например, альдегиды восстанавливают медь(II) до меди(I). Для проведения реакции к раствору альдегида добавляют реактив Фелинга и нагревают. Сначала образуется желтый осадок гидроксида меди(I) - CuOH, а затем - красный оксида меди(I) (Cu2O): 2KNa[Cu(C4H4O6)2] + RCOH + 3NaOH + 2KOH → → 2CuOH↓ + RCOONa + 4KNaC4H4O6 + 2H2O 2CuOH → Cu2O + H2O. К окислительно-восстановительным относится также реакция взаимодействия альдегидов с реактивом Несслера в щелочной среде; при этом выпадает темный осадок восстановленной ртути: K2[HgI4] + RCOH + 3KOH → 4KI + RCOOK + Hg↓ + 2H2O. Альдегиды также легко присоединяют аммиак. Продукты присоединения обычно малоустойчивы и легко подвергаются дегидратации и полимеризации. Образующиеся в результате полимеризации циклические соединения при нагревании с разбавленными кислотами легко разлагаются, вновь освобождая альдегид: Формальдегид и уксусный альдегид склонны к полимеризации. Формальдегид полимеризуется, образуя циклические тримеры, тетрамеры или линейные полимеры. Реакция полимеризации протекает в результате нуклеофильной атаки кислорода одной молекулы карбонильного атома углерода другой: Раствор формальдегида (формалин). Промышленное производство метаналя основано на парофазном окислении метанола с железомолибденовым катализатором или окислением метана: Механизмы действия и биотрансформация. Для альдегидов характерны наркотические и дезинфицирующие свойства. По сравнению со спиртами альдегидная группа усиливает токсичность вещества. Контроль качества Определение подлинности Если 1 мл исследуемого раствора (10 мл отфильтрованного раствора формалина с 50 мл воды, не содержащей CO2) разбавить 10 мл воды и к 0,05 мл полученной смеси добавить 1 мл 15 г/л раствора натриевой соли хромотроповой кислоты, 2 мл воды и 8 мл концентрированной серной кислоты, то в течение 5 мин появляется сине-фиолетовое или красно-фиолетовое окрашивание: Для определения подлинности формальдегида могут быть использованы реакции с азотсодержащими нуклеофильными соединениями, например с первичными аминами. Образующиеся N-замещенные амины (основания Шиффа) малорастворимы, некоторые из них окрашены, другие дают окрашенные соединения с ионами тяжелых металлов. Например, при добавлении к 0,1 мл исследуемого раствора формалина 10 мл воды и 2 мл 10 г/л свежеприготовленного раствора фенилгидразина гидрохлорида образуется фенилгидразон: При смешивании 0,5 мл исследуемого раствора с 2 мл воды и 2 мл раствора серебра нитрата в слабощелочном растворе аммиака при нагревании на водяной бане образуется серый осадок серебряного зеркала: AgNO3 + 3NH3 → [Ag(NH3)2]OH + NH4NO3; реактив Толленса НCOH + 2[Ag(NH3)2]OH → НCOOH + 2Ag↓ + 4NH3 + H2O. Испытания на чистоту Испытуемый раствор должен быть бесцветным. При оценке его кислотности (примесь муравьиной кислоты) применяют индикаторный метод: к 10 мл и 1 мл раствора фенолфталеина добавляют не более 0,4 мл 0,1 моль/л раствора натрия гидроксида, чтобы раствор приобрел красную окраску. Содержание метанола (9,0-15,0%об.) определяют методом газовой хроматографии, используя в качестве внутреннего стандарта этанол. Содержание сульфатной золы, определяемой для навески в 1,0 г, не должно превышать 0,1%. Количественное определение В мерную колбу объемом 100 мл, содержащую 2,5 мл воды и 1 мл раствора натрия гидроксида, добавляют 1,000 г исследуемого раствора, встряхивают и доводят водой до метки. К 10,0 мл раствора добавляют 30,0 мл 0,05 моль/л йода, перемешивают и приливают 10 мл разбавленного раствора натрия гидроксида. Через 15 мин добавляют 25 мл разбавленной серной кислоты и 2 мл раствора крахмала. Титруют 0,1 мл натрия тиосульфата. Метенамин Метенамин получают конденсацией метаналя и аммиака из водных растворов. Промежуточный продукт реакции - гексагидро-1,3,5-триазин превращается в уротропин: Контроль качества Определение подлинности При нагревании смеси препарата с разведенной серной кислотой выделяется аммиак: (CH2)6N4 + 6H2O → 6HCOH + 4NH3 ↑ Метенамин можно обнаружить, используя реакции подлинности для формальдегида. Испытания на чистоту В препарате не допускается присутствие примесей органических соединений, параформа, солей аммония. В определенных пределах допустимы примеси хлоридов, сульфатов, тяжелых металлов. Количественное определение Для определения содержания метенамина используют метод нейтрализации. Для этого навеску препарата нагревают с избытком 0,1 моль/л раствора серной кислоты. Избыток кислоты оттитровывают раствором щелочи с концентрацией 0,1 моль/л (индикатор - метиловый красный). На способности гексаметилентетрамина давать с йодом тетра-йодиды основан йодометрический метод определения содержания вещества. Контрольные вопросы и задания • Какую функциональную группу содержат спирты? • Опишите способы получения этанола. • Что такое йодоформная проба? • Перечислите основные реакции подлинности этанола, приведите уравнения реакций. • Назовите источники примесей в этаноле. Напишите уравнения химических реакций, лежащих в основе испытания этанола на чистоту. • Какие методы количественного анализа этанола используют в фармацевтическом анализе?