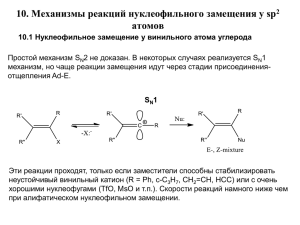
Типы химических реакций в органической химии. Что такое механизм химической реакции? C4H8 + 6O2 = 4CO2 + 4H2O. В отличие от неорганических реакций, которые классифицируют по типу взаимодействия, изменению степени окисления, тепловому эффекту, обратимости и т. п., в органических реакциях в первую очередь учитывают механизм разрыва существующих химических связей и процессы, предшествующие образованию новых связей. • Механизм реакции – это детальное описание хода реакции по стадиям, которое показывает, в каком порядке и как разрываются химические связи в реагирующих молекулах и образуются новые связи и молекулы. Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации). ОСНОВНЫЕ ПОНЯТИЯ: ЭЛЕКТРОФИЛ, НУКЛЕОФИЛ, КАРБОКАТИОН • В органической химии реагенты традиционно делят на три типа: нуклеофильные, электрофильные и радикальные Электрофил E (любящий электроны) – это частица, которая атакует атом углерода органического соединения, отнимая у него электронную пару (является акцептором электронов). Часто электрофилы несут положительный заряд. Электрофилы атакуют молекулы с высокой электронной плотностью или отрицательно заряженные реагенты Примеры частиц – электрофилов:H3O+, H+, HCl, HNO3, NO2+, AlCl3 и др • Нуклеофил N (любящий ядро) – это частица, которая атакует атом углерода, предоставляя ему электронную пару (является донором электронов). Это частицы, обладающие избытком электронной плотности, чаще всего отрицательно заряженные или имеющие неподеленную электронную пару Нуклеофилы атакуют молекулы с низкой электронной плотностью или положительно заряженные реагенты («Любят положительный заряд»). Такие частицы, как правило, обладают основными свойствами. К ним относятся: OH-, Cl-, S2-, NH3, H2O, ROH, CH3O- и др • Реагент – участвующее в реакции вещество с более простой структурой. Субстрат – исходное вещество с более сложной структурой. Уходящая группа – это замещаемый ион, который был связан с углеродом. Продукт реакции – новое углеродсодержащее вещество (записывается в правой части уравнения реакции). Примеры ионных реакций разных типов. • Нуклеофильное замещение: • Электрофильное замещение: Нуклеофильное присоединение (сначала присоединяется CN–, потом Н+): Электрофильное присоединение (сначала присоединяется Н+, потом Х–): Элиминирование при действии нуклеофилов (оснований): Элиминирование при действии электрофилов (кислот): Реакции, протекающие по ионному механизму, часто сопровождаются образованием карбокатионов. • Карбокатионом называют заряженную частицу, имеющую свободную р-орбиталь на атоме углерода • СН3-СН2+, CH3-CH+-CH3 CH3-C+-CH3 CH3 По типу разрыва химической связи органические реакции можно разделить на две группы. 1. Радикальные реакции, в которых происходит гомолитический разрыв общей электронной пары, образующей связь. При этом возникают свободные радикалы — частицы, обладающие неспаренным электроном: R1º | º R2 R1 º + R2º 2. Ионные реакции, в которых происходит гетеролитический разрыв связи. При этом оба электрона остаются у одной из образующихся частиц. Эта частица (нуклеофил), обладающая парой неподеленных электронов на внешнем уровне, заряжается отрицательно и в последующих процессах может стать донором электронов для вновь образующейся связи. Вторая частица (электрофил) несет на себе положительный заряд и имеет на внешнем уровне незаполненную свободную орбиталь. В последующих процессах ее можно предоставить электронодонору для образования общей связи, т. е. электрофил является акцептором электронов. A |: B A+ + : B- электрофил нуклеофил Классификация химических реакций по механизмам • В каждой органической реакции можно различить объект воздействия и реагент, т. е. вещество, действующее на объект и вызывающее изменение химических связей в нем. • • Реагенты можно разделить на радикальные, электрофильные и нуклеофильные. Это деление связано с тем, что реагент может реагировать с различными частями молекулы объекта. • Электрофильным называется реагент,который взаимодействует с электронодонорной частью молекулы объекта, предоставляя ей свою вакантную орбиталь. Это положительно заряженные ионы (Н+, Н3O+ и др.) или молекулы, на части которых в результате поляри- зации образовался положительный заряд , например: • • Нуклеофильным называется реагент, который взаимодействует с электронодефицитной частью молекулы объекта, предоставляя ей свою неподеленную пару электронов. Нуклеофилы — это анионы и молекулы, несущие неподеленную электронную пару (НО-, RCOO-, Сl-, Вr- и т. п.). С учетом описанных особенностей объекта и реагента, а также структурных изменений, происходящих в той или иной реакции, все органические реакции делят на: • Реакции замещения: R—СН2—X + АВ —> R— СН2—А + ХВ. При этом они могут быть радикальными (SR), электрофильными (SE) или нуклеофильными (SN). • Реакции присоединения, характерной особенностью которых является разрыв кратной связи: RCH=CH2 + АВ —> RCH—СН2. | | A B Они тоже могут быть разделены на электрофильные (AdE), нуклеофильные (AdN) и даже радикальные (AdR). • Реакции отщепления (элиминирования): Кроме того: • Перегруппировки атомов (или групп атомов) внутри молекулы: • Окисления и восстановления: первичный спирт альдегид альдегид первичный спирт кислота • Этерификации (и обратной ей реакции гидролиза): Полимеризации и поликонденсации: хлорвинил поливинилхлорид 1.Радикальное замещение (SR). Это, прежде всего, реакции замещения атома водорода у атома С (sp3). В таких соединениях σсвязи С—С неполярны, а σ-связи С—Н тоже поляризованы очень слабо. Поэтому они разрываются по гомолитическому механизму с образованием свободных радикалов. Однако для такого процесса необходимо затратить значительное количество энергии. Это достигается различными способами: нагреванием до температуры ≥ 250° С; облучением (hv); добавками инициаторов, т. е. веществ, способствующих образованию свободных радикалов. • В предельном углеводороде (например, метане) можно последовательно добиться полного замещения всех атомов водорода на атомы хлора: Механизм радикального замещения на примере реакции хлорирования метана (SR) • Цепные реакции – химические превращения, в которых появление промежуточной активной частицы вызывает большое число превращений малоактивных исходных веществ. • При бромировании и низкотемпературном галогенировании алканов более сложного строения легче всего замещение водорода идет у третичного атома углерода, затем у вторичного и труднее всего у первичного атома углерода. Реакция сульфохлорирования Схема реакции: RH + Cl2 + SO2 RSO2Cl + HCl Механизм реакции: 1. Cl• •Cl 2Cl• 2. RH + Cl• R• + HCl R• + SO2 RSO2• RSO2• + Cl2 RSO2Cl + Cl• и т.д. 3. 2Cl• Cl2 и т.д. Реакция Коновалова Д.П. Нитрование по Коновалову проводят действием разбавленной азотной кислоты при температуре 140оС. Схема реакции: RH + HNO3 RNO2 + H2O Механизм реакции Коновалова HNO3 N2O4 1. N2O4 2NO2• 2. RH + NO2• R• + HNO2 R• + HNO3 RNO2 + •OH RH + •OH R• + H2O и т.д. 3. Обрыв цепи. У гомологов бензола при взаимодействии с галогенами при нагревании или освещении происходит не электрофильное замещение водорода в бензольном кольце, а радикальное замещение атомов водорода в радикале в α-положении: 2.Электрофильнос замещение (SE). • Этот тип реакций характерен для ароматических соединений. • Известно, что ароматическая система с делокализованным π-облаком весьма стабильна. Поэтому она может быть нарушена только частицей с ярко выраженным положительным зарядом (электрофилом). Oбратите внимание, в каких условиях протекают реакции замещения у бензола: • Используемые в качестве катализаторов реакции молекулы FeBr3, H2S04, А1С13 и т. п. способствуют образованию электрофилов, т. е. положительно заряженных частиц типа R+ —Cl • А1С13-, N+O2 (ион нитрония), Вr +—Вr - • FeBr3 и т. п. Затем электрофил взаимодействует с π-орбиталями бензольного кольца и нарушает ароматическую систему. Стремление молекулы к восстановлению ароматической системы, как более стабильной, приводит к последующему отщеплению протона от того атома углерода, к которому присоединилась электрофильная частица. • Электрофильное замещение – механизм реакции взаимодействия ароматических углеводородов с молекулами, содержащими электрофильные частицы. • Примеры электрофильных частиц: Cl+, NO2+, CH3+. • I стадия образование π–комплекса. • Электрофильная частица Х+ притягивается к π-электронному облаку бензольного кольца и образует с ним π-комплекс. • II стадия (лимитирующая): образование σ-комплекса. • Два из шести p-электронов кольца образуют σ-связь между Х+ и одним из атомов углерода. При этом ароматичность системы нарушается, т.к. в кольце остается только четыре πэлектрона, распределенные между пятью атомами углерода (образуется σ-комплекс). • III стадия: образование продукта реакции. • Для восстановления ароматичности σ-комплекс выбрасывает протон, а два электрона связи С-Н переходят в π-электронную систему. 3.Нуклеофильное замещение (SN). • Поскольку нуклеофил — это анион или молекула, содержащая атом с неподеленной парой электронов, то и реагировать такая частица будет с электронодефицитной частью молекулы - объекта. Для появления такой части молекулы в объекте необходимо, чтобы связь R—X была достаточно сильно поляризована. Этому условию удовлетворяют: спирты R—>ОН, галогенопроизводные R—>Г, первичные амины R—>NH2 и др Реакции нуклеофильного замещения SN В зависимости от строения галогеналкана, природы нуклеофила и растворителя реакции SN протекают по двум основным направлениям: SN1 и SN2. • По механизму SN2 реагируют первичные и несколько труднее вторичные галогеналканы. Реакция протекает в одну стадию через образование переходного состояния. • По механизму SN1 происходит нуклеофильное замещение в третичных и, в определенных условиях, во вторичных галогеналканах (в несколько стадий) Механизм SN2 (бимолекулярное нуклеофильное замещение) Механизм SN1 (мономолекулярное нуклеофильное замещение) На первой стадии происходит диссоциация молекулы галогеналкана при участии молекул протонного полярного растворители. В результате образуются карбкатион и галогенил-ион. Поскольку процесс ионизации протекает медленно, то 1 стадия определеят скорость всей реакции. На второй стадии образовавшийся карбкатион быстро реагируете нуклеофилом. • Реакция Вюрца: 2СН3С1 + 2Na—>2NaCl + СН3—СН3. Эта реакция идет в две стадии: а) СН3—CI + 2Na——>NaCl + СН3 - +Na+ (частица СН3- (карбанион) является нуклеофилом); б) СН3С1 + CH3- ——>СН3—СН3 + Сl-. Суммируя реакции а и б, получим исходное уравнение реакции. • Гидролиз галогенопроизводных (получение спиртов): • R—Сl + Н2О + (КОН)—>R—ОН + КС1 + Н2О; Н2С—С1 СН2ОН | + 2Н2О + (2КОН) ——> | + 2КС1 + Н2О; Н2С—С1 СН2ОН Н2C—Cl | Н2С—С1 + 3Н2О + (3КОН) ——> | Н2С-С1 CH2OH | СН2ОН + 3KC1 + 3НаО. | СН2ОН • В этих реакциях гидролиз проводят в щелочной среде, так как щелочь нужна для связывания образующейся в реакции гидролиза НС1 и смещения равновесия в сторону образования спирта. Реагентомнуклеофилом является гидроксил (ОН-). • По такому же механизму идут реакции получения кетонов: карбоновых кислот: фенолов: • По такому же механизму (SN) осуществляется и взаимодействие галогенопроизводных с аммиаком: нуклеофильным реагентом является молекула аммиака, атом азота которой несет неподеленную пару электронов. Реакции нуклеофильного замещения характерны для алкил- и арилгалогенидов: 4. Реакции присоединения (Ad). • Как известно, такие реакции характерны для органических соединений, содержащих кратные (т. е. двойные или тройные) связи, и заключаются в том, что части молекулы-реагента присоединяются по краям разорванной связи в молекуле - объекте. • В тех случаях, когда разрывается связь или —С ≡ С—, протекает реакция электрофильного присоединения (AdE). К реакциям указанного типа относятся хорошо известные реакции присоединения Г2, НГ и Н2О к алкенам и алкинам. по правилу Марковникова Способность алкенов вступать в реакцию с электрофильными реагентами обусловлена повышенной электронной плотностью в области двойной связи (облако π-электронов над и под плоскостью молекулы). • I стадия: образование π–комплекса. • Электрофильная частица (чаще всего это бывает протон Н+) взаимодействует с π–электронами двойной связи и образует π–комплекс. • II стадия (лимитирующая): образование карбокатиона. • π–комплекс превращается в карбокатион путем образования ковалентной σ-связи между электрофильной частицей и одним из атомов углерода. • III стадия: образование продукта реакции. • Карбокатион реагирует с анионом Х─, образуя вторую σ-связь за счет электронной пары аниона Ион водорода в реакциях электрофильного присоединения присоединяется к тому из атомов углерода при двойной связи, на котором больше отрицательный заряд. • Реакция гидратации– присоединение воды. Эта реакция возможна только в присутствии сильных минеральных кислот (серной или фосфорной). Чтобы объяснить роль кислоты, необходимо рассмотреть механизм этой реакции. • Молекула воды – плохой источник электрофильных частиц (H+), т.к. степень её диссоциации очень низкая. Фактически роль электрофилов в реакции гидратации играют протоны, полученные не от молекул воды, а от молекул минеральной кислоты. Именно они и начинают реакцию. По правилу Марковникова Против правила Марковникова • Необходимо обратить внимание на другой тип двойной связи, присутствующий во многих органических молекулах. Это связь , в которой электронодефицитный атом углерода в sр2-гибридизации связан кратной связью с более электроотрицательным атомом кислорода. Поэтому по месту разрыва такой связи (в альдегидах и кетонах) идут реакции нуклеофильного присоединения AdN : • Спиртов (получение полуацеталей) Гидросульфита натрия Реактива Гриньяра • при взаимодействии с метаналем — первичные спирты: при взаимодействии с другими альдегидами — вторичные спирты: • при взаимодействии с кетонами — третичные спирты: 5.Реакции отщепления (элиминирования) • Это реакции, приводящие к образованию кратных связей. При отщеплении галогеноводородов и воды наблюдается определенная селективность реакции, описываемая правилом Зайцева, согласно которому атом водорода отщепляется от того атома углерода, при котором находится меньше атомов водорода. Так, например, в реакции: • Реакции элиминирования сопровождаются отщеплением галогеноводорода от галогеналкана и приводят к образованию алкенов. • Реакции элиминирования (Е) и нуклеофильного замещения (SN2) конкурируют друг с другом, но в определенных условиях каждая из них может стать доминирующей. Отщепление галогеноводорода от галогеналкана становится основным процессом в присутствии нуклеофильных реагентов, обладающих высокой основностью. К ним относятся спиртовые растворы гидроксидов щелочных металлов или алкоголяты щелочных металлов Механизм Е2 (бимолекулярное элиминирование). • В реакции отщепления по механизму Е2 наиболее легко вступают первичные галогеналканы. В отличие от механизма SN2 в механизме Е2 частица с неподеленной парой электронов или несущая отрицательный заряд действует не как нуклеофил, а как основание, атакуя атом водорода при β-углеродном атоме. Механизм E1 (мономолекулярное элиминирование). • Наиболее легко происходит элиминирование поданному механизму у третичных галогеналканов. Реакция не требует основания как реагента, но для ее протекания необходим ионизирующий растворитель. Процесс является двустадийным. Элиминирование при действии нуклеофилов (оснований): Элиминирование при действии электрофилов (кислот): 7. Элиминирование