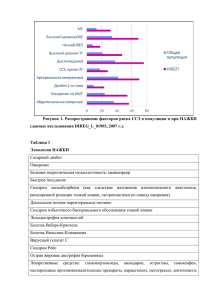
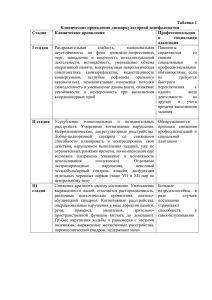
АНЕМИИ У ДЕТЕЙ 1. Анемии – определение. Анемии – это клинико-гематологический симптомокомплекс, который характеризуется снижением эритроцитов и гемоглобина в единице объема крови. Критерии анемии: эритроциты ≤ 3,5 Т/л, Нв ≤ 110 г/л (у детей до 6 лет), Нв ≤ 120 г/л (у детей старше 6 лет). 2. Анемии – классификация. Разнообразные виды анемий можно объединить в группы по ведущему механизму возникновения (указывается в клиническом диагнозе): 1. Анемии вследствие нарушенного кровообращения: а) связанные с недостаточностью гемопоэтических факторов (дефицитные), б) связанные с угнетением пролиферации клеток костного мозга (апластические). 1. Анемии, вызванные кровоточивостью (постгеморрагические). 2. Анемии, связанные с повышенным разрушением эритроцитов (гемолитические). 4. Анемии со сложным патогенезом. Анемии оценивают по тяжести, регенераторной способности костного мозга, цветовому показателю. 1. По тяжести: 2. Легкая – эритроциты 3,5–3,0 Т/л, Нв 110-90 г/л. 3. Среднетятяжелая – эритроциты 3,0–2,5 Т/л, Нв 90-70 г/л. 4. Тяжелая – эритроциты менее 2,5 Т/л, Нв менее 70 г/л. 1. В зависимости от функционального состояния эритропоэза (регенераторной способности костного мозга): 5. регенераторная – ретикулоциты 0,5% - 5%. 6. гиперрегенераторная – ретикулоциты более 5%. 7. гипорегенераторная – ретикулоциты менее 0,5%. III. По цветовому показателю (ЦП): 1. нормохромные – ЦП 0,85–1,0. 2. гиперхромные – ЦП более 1,0. 3. гипохромные – ЦП ниже 0,8. 3. Дефицитные анемии – определение. Дефицитные анемии (ДА) – это анемии, которые развиваются в результате недостаточности гемопоэтических факторов. 4. Классификация ДА. Мегалобластные анемии: o фолиеводефицитные (недостаток фолиевой кислоты в питании или мальабсорбция); o витамин B12-дефицитные (мальабсорбция или нарушение транспорта); o оротовая ацидурия. Микроцитарные анемии: o железодефицитные; o o медьдефицитные; отравления свинцом. 5. Железодефицитная анемия - определение. Железодефицитная анемия (ЖДА) – это клинико-гематологический симптомокомлекс, проявляющийся гипоксическим и сидеропеническим синдромами, вследствие нарушения синтеза гемоглобина в эритроцитах из-за дефицит железа. По данным ВОЗ дефицит железа регистрируется у 50-70% детей раннего возраста и у10% детей старшего возраста. 6. Железодефицитная анемия -этиопатогенез Среди причин развития ЖДА у детей можно выделить: a) алиментарные факторы; б) недостаточный исходный уровень железа (у недоношенных, у новорожденных при малых материнских запасах железа, многоплодной беременности); в) повышенная потребность в железе (без кровопотерь): усиленный рост в раннем возрасте и в период полового созревания; г) нарушение всасывания железа (синдром нарушенного всасывания); д) нарушение транспорта железа (при инфекциях и воспалительных процессах). Железо в организме находится в следующем виде: 1) Основной фонд (60-70%): эритроциты и костный мозг. 2) Запасной фонд (30-40%) – депо: мышцы, печень, селезенка (железо в виде ферритина). 3) Транспортный фонд – сывороточное железо 4) Тканевой фонд – железосодержащие ферменты. Фазы патогенеза 1) Прелатентный дефицит железа: истощение запасного фонда, снижение уровня ферритина, отсутствие симптомов ЖДА; 2) Латентный дефицит железа: снижение сывороточного железа, появление симптомов сидеропении; 3) Явная ЖДА: истощение всех фондов, снижение эритроцитов и Нв, появление анемических сипмтомов. Механизмы патогенеза ЖДА 1) из-за снижения Нв развиваются гипоксические изменения в тканях, особенно центральной нервной системы. 2) уменьшается активность железосодержащих ферментов, которые участвуют в тканевом дыхании. 7. Железодефицитная анемия - клиническая картина Основные клинические синдромы: – анемический (обусловлен снижением эритроцитов и Нв): бледность кожи и слизистых; – астеновегетативный: слабость, вялость, головокружение, сонливость; одышка, обмороки, шум в ушах; – сердечно-сосудистый: тахикардия, приглушенность тонов, м.б. функциональный систолический шум; – гепатолиенальный: увеличение печени, селезенки; – иммунодефицитный: (часто и длительно болеющие дети); – сидеропенический(обусловлен снижением железа): ü извращение вкуса и запаха; ü эпителиальные симптомы (дистрофические изменения кожи и придатков); ü койлонихии, ангулярный стоматит («заеды»), хейлит, глоссит (сглажность сосочков языка); ü выпадение волос (алопеция); ü мышечная гипотония, нарушения работы сфинктеров (запоры, недержание мочи, кала); ü дисменорея; ü субфебриллитет (нарушение работы центра терморегуляции). 8. Железодефицитная анемия - данные дополнительных методов исследования В анализе крови: - анемия гипохромная, нормо (гипер) – регенераторная, анизо-, пойкилоцитоз. - снижение сывороточного железа, - коэффициента насыщения плазмы трансферрином, - повышение общей железосвязывающей способности сыворотки. 9. Железодефицитная анемия - дифференциальная диагностика ОСНОВНЫЕ ЛАБОРАТОРНЫЕ ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ ГИПОХРОМНЫХ АНЕМИЙ Показатели Железодефицитная анемия Морфология Анизоцитоз, пойкилоцитоз, Наследственная Большая талассемия сидероахрестическая анемия Анизоцитоз, пойкилоцитоз, Микроцитоз эритроцитов микроцитоз микроцитоз мишеневидные клетки Количество ретикулоцитов Нормальное Нормальное Увеличено Содержание сывороточного железа Снижено Повышено Повышено Общая железосвязываю-щая способность сыворотки Увеличена Снижена Снижена Коэффициент насыщения трансферрина железом Снижен Увеличен Увеличен Уровень Hb F Нормальный Нормальный Увеличен Уровень протопорфирина эритроцитов Нормальный Увеличен Нормальный Кольцевидные сидеробласты Отсутствуют Количество резко увеличено Имеются 10. Железодефицитная анемия - принципы лечения Диета Основа диетотерапии – рациональное питание. o рациональное лечебное питание (для новорожденных – грудное естественное вскармливание, а при отсутствии молока у матери – адаптированные молочные смеси, обогащенные железом). Своевременное введение прикорма, мяса, особенно телятины, , гречневой и овсяной круп, фруктовых и овощных пюре; уменьшение приѐма фитатов, фосфатов, танина, кальция, которые ухудшают всасывание железа. Медикаментозное лечение 1. Основа лечения ЖДА – препараты железа. 2. Гемотрансфузии – по жизненным показаниям (эритроцитарная масса, отмытые эритроциты), при снижении Нв < 60 г/л Принципы ферротерапии: 1. Невозможно восполнить дефицит железа без назначения его препаратов. 2. Использование преимущественно железа внутрь. 3. Продолжение приема железа после нормализации Нв и эритроцитов (для восполнения депо железа). 1. Назначение гемотрансфузий по жизненным показаниям. При анемии легкой и средней тяжести: 1. Препараты железа назначают внутрь: - ионные (2-х валентное железо): актиферрин, тотема и др.; - неионные (3-х валентное железо): феррум лек, мальтофер, глобирон и др. 1. Препараты железа дают между приемами пищи, запивая соками. 1. Расчет железа для перорального применения: 5-3 мг/кг в сутки элементарного железа (у детей до 3-х лет). При тяжелой ЖДА, синдроме мальабсорбции, непереносимости ферротерапии: 1. Препараты железа назначают парентерально: феррум лек, фербитол, эктофер и др. 2. Расчет элементарного железа для парентерального применения (курсовая доза): М х (780,35 х Нв), где М – масса в кг, Нв – в г/л. Критерии эффективности ферротерапии: 1. Появление ретикулоцитарного криза (повышение ретикулоцитов к 7-10 дню приема железа). 2. Прирост Нв на 10 г/л/нед до полной нормализации. Длительность ферротерапии: 1. До нормализации Нв полная терапевтическая доза; 2. затем в половинной дозе до 6 мес, (чтобы восполнить депо железа); 3. затем профилактическая доза у отдельных групп (например, у недоношенных в течение 1 года). 11. Железодефицитная анемия - профилактика. 1. Антенатальная: - Сбалансированное питание беременных женщин. Всем женщинам во второй половине беременности назначают препараты железа или поливитамины, обогащенные железом. При повторной беременности – прием препаратов железа на протяжении второго и третьего триместров. 1. Постнатальная: - Естественное вскармливание и своевременное введение прикормов, обогащенных железом. - Детям из группы риска (с избыточной прибавкой массы тела, рожденным от многоплодной беременности; от матерей, переносивших анемию беременных) – с 3 мес. жизни рекомендуется назначать препараты железа под контролем показателей крови. - Недоношенным с массой тела при рождении менее 1800 г и сроком беременности менее 32 недели рекомендуется назначение препаратов железа ( 2-4 мг/кг) с 3-ей недели и до конца 1 года жизни - Достаточное пребывание на свежем воздухе. - Предупреждение и своевременное лечение рахита, гельминтозов, очагов хронических инфекций. 12.Мегалобластные анемии - определение. Мегалобластные (макроцитарные) анемии - группа приобретенных и наследственных анемий, общим признаком которых является наличие мегалобластов в костном мозге. К ним относят 12 12 витамин В – и фолиево-дефицитные анемии. Распространенность витамин В -дефицитной анемии составляет у детей от года до 10 лет 1:10000. 13. Мегалобластные анемии-этиопатогенез. Причины: врожденные и приобретенные. Приобретенные: а) Дефицит витамина В12 может быть при глистной инвазии, атрофическом гастрите, дисбиозе кишечника, синдроме мальабсорбции, вегетарианской диете. б) Дефицит фолиевой кислоты может возникнуть при недостаточном поступлении еѐ с пищей или повышенной потребности (тяжелые инфекционные заболевания), при вскармливании козьим молоком (не содержит фолиевой кислоты). 12 При дефиците фолиевой кислоты или витамина В нарушается синтез нуклеиновой кислоты, что приводит к прекращению митоза на ранних стадиях гемопоэза, в результате чего нарушается синтез ДНК, замедляются нормальные процессы созревания гемопоэтических клеток, что выражается в мегалобластическом типе кроветворения, и развитии панцитопении. Дефицит 12 кобаламина (при недостатке витамина В ) вызывает неврологические нарушения, обусловленные пятнистой демиелинизацией серого вещества головного и спинного мозга и периферических нервов. 14. Мегалобластные анемии-клиническая картина 1) анемические симптомы; 2) геморрагические симптомы; 3) симптомы иммунодефициты из-за снижение лейкоцитов; 4) симптомы поражения ЖКТ; 5) увеличение селезенки и печени. 6) при дефиците В рефлексов. 12 развивается неврологическая симптоматика: атаксия, парестезии, угнетение 15. Мегалобластные анемии-данные дополнительных методов обследования - клинический анализ крови: гиперхромная, гипорегенераторная анемия; в мазке крови: ядерные эритроциты, а в тяжелых случаях – мегалобласты, эритроциты с кольцами Кэбота, тельцами Жолли (остатки ядер); - 12 снижение концентрации витамина В , фолиевой кислоты и фолатов в сыворотке крови 16. Мегалобластные анемии-дифференциальная диагностика. ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ МЕГАЛОБЛАСТНЫХ, АПЛАСТИЧЕСКИХ И ГЕМОЛИТИЧЕСКИХ АНЕМИЙ Показатели Мегалобластные анемии Приобретенные апластические Гемолитическая анемии анемия МинковскогоШоффара ЦП >1,0 0,85-1,0 0,85-1,0 Средний объем эритроцита Увеличен Увеличен Нормальный Количество ретикулоцитов Снижено Снижено или отсутствует Резко увеличено Морфология эритроцитов Макроцитоз, мегалоцитоз, тельца Жолли, кольца Кебота Анизоцитоз с тенденцией к макроцитозу, умеренный пойкилоцитоз микросфероцитоз Количество тромбоцитов Снижено Снижено Нормальное Количество лейкоцитов Снижено Снижено, нейтропения Лейкоцитоз со сдвигом формулы влево в период криза Костный мозг Выраженная гиперплазия Резкое снижение клеточности На высоте эритроидного ростка. костного мозга, гипоплазия всех гемолитического криза Мегалобластный тип ростков кроветворения, выраженная кроветворения. Гигантские увеличение числа лимфоидных гиперплазия формы гранулоцитов, элементов и клеток стромы эритроидного ростка мегакариоцитов. 17. Мегалобластные анемии-принципы лечения 1. Устранение причины, вызвавшей дефицит витаминов. 2. При дефиците витамина В12 назначают цианокобаламин или оксикобаламин. Лечебная доза составляет 5 мкг/кг у детей до года, 100-200 мкг в сутки - в возрасте после года, 200–400 мкг в сутки – в подростковом возрасте. Вводят внутримышечно 1 раз в день в течение 5-10 дней. Продолжительность курса 2-4 недели, а при исходном наличии неврологических симптомов - до 6 месяцев. 3. При дефиците фолиевой кислоты назначают 1-5 мг фолиевой кислоты внутрь до нормализации анализа крови. 18. Мегалобластные анемии-профилактика 1. Сбалансированное питание (фолиевая кислота содержится в томатах, шпинате, дрожжах, мясе, печени). 2. При наследственных формах дефицита витамина В раз в 3 месяца на протяжении всей жизни. 12 рекомендуется введение витамина 1 ГЕМОРРАГИЧЕСКИЕ ЗАБОЛЕВАНИЯ У ДЕТЕЙ 1. Геморрагические диатезы: определение, эпидемиология. Геморрагические диатезы – это группа заболеваний с повышенной кровоточивостью, обусловленной нарушениями в различных звеньях гемостаза (коагуляционном, тромбоцитарном, сосудистом). По данным ВОЗ, в странах Европы частота гемофилии А составляет 1:10 000 новорожденных мальчиков, идиопатическая тромбоцитопеническая пурпура – 2-2,5:100 000, геморрагический васкулит – 2,5:10 000 детей. 2. Геморрагические диатезы: классификация. I. Геморрагические диатезы, обусловленные нарушением плазменного звена гемостаза: 1. Нарушение образования плазменного тромбопластина: Ø гемофилия А; Ø гемофилия В; Ø гемофилия С. 2. Нарушение образования тромбина: гипопроконвертинемия; недостаток фактора X; нарушение образования фибрина; недостаток фактора XIII. II. Геморрагические диатезы, обусловленные нарушением мегакариоцитарно-тромбоцитарной системы: аутоиммунная тромбоцитопеническая пурпура; тромбастения; гипо- и апластическая анемия; o дополнительно: тромбоцитопения при лучевой болезни, тромбоцитопения при лейкозах. III. Геморрагические диатезы, обусловленные нарушением сосудистой системы: геморрагический васкулит; болезнь Рандю-Ослера; цинга (хроничский гиповитаминоз С); геморрагическая лихорадка; геморрагический васкулит при инфекционном эндокардите, тифах и др. 3. Геморрагические диатезы: типы кровоточивости. Различают пять типов кровоточивости (по З.С. Баркагану): Гематомный Болезненные напряженные кровоизлияния как в мягкие ткани (гематомы), так и в суставы (гемартрозы), с выраженной патологией опорно- двигательного аппарата; типичен для гемофилии А и В. Петехиально-пятнистый (синячковый) Геморрагическая сыпь в виде экхимозов, петехий. Характерна для тромбоцитопений, тромбоцитопатий и некоторых нарушений свертываемости крови (исключительно редких) - гипо- и дисфибриногенемий, наследственного дефицита факторов Х и II, иногда VII. Смешанный синячковогематомный Характеризуется сочетанием петехиально-пятнистой кровоточивости с появлением отдельных больших гематом (забрюшинных, в стенке кишечника и т. д.) при отсутствии поражения суставов и костей (в отличие от гематомного типа) либо с единичными геморрагиями в суставы: синяки могут быть обширными и болезненными. Такой тип кровоточивости наблюдается при тяжелом дефиците факторов протромбинового комплекса и фактора XIII, болезни Виллебранда, ДВС-синдроме, передозировке антикоагулянтов и тромболитиков, при появлении в крови иммунных ингибиторов факторов VIII или IX. Васкулитно-пурпурный Характеризуется геморрагиями в виде сыпи или эритемы (на воспалительной основе), возможно присоединение нефрита и кишечных кровотечений; наблюдается при инфекционных и иммунных васкулитах, легко трансформируется в ДВС-синдром (разграничение представляет большие трудности). Ангиоматозный Наблюдается при телеангиоэктазиях, ангиомах, артериовенозных шунтах; характеризуется упорными строго локализованными и привязанными к локальной сосудистой патологии геморрагиями. 4. Геморрагический васкулит (болезнь Шейнляйн–Геноха): определение. Геморрагический васкулит – это иммунопатологическое заболевание, которое характеризуется системным васкулитом. 1. Геморрагическиий васкулит: этиопатогенез. Ведущая роль в этиопатогенезе геморрагического васкулита принадлежит иммунокомплексному поражению мелких сосудов и развитию микротромбоваскулита. За 1-3 нед. до клинических проявлений заболевания обычно удается выявить действие какого-либо антигена (вирусного, бактериального, медикаментозного, пищевого и др.). В организме на этот антиген вырабатываются антитела, которые с антигеном образуют иммунные комплексы. Они оседают на стенках мелких сосудов, в них развивается «асептическое» воспаления – васкулит. При этом повышается проницаемость сосудов, а в микроциркуляторном русле образуются микротромбы из форменных элементов крови. Для предотвращения тромбообразования в них потребляется (проникает) белокантикоагулянт антитромбин III (предшественник гепарина), при этом его уровень в крови снижается. 6. Геморрагическиий васкулит: классификация. Клинические формы кожная; Степень активности Течение I – минимальная; острое - до 1 мес.; суставная; II – умеренная; подострое – 2-3 мес.; абдоминальная; молниеносная. рецидивирующее – возврат симптомов III – максимальная. после клинического выздоровления со светлыми промежутками более 1 мес.; затяжное – 3-8 мес.; хроническое – волнообразное в течение 1 года со светлыми промежутками менее 1 мес. По тяжести кожная форма может быть легкой и средней степени тяжести, суставная – средней степени тяжести и тяжелая, абдоминальная и молниеносная – всегда тяжелые. 7. Геморрагическиий васкулит: клиническая картина. КЛИНИЧЕСКИЕ ФОРМЫ ГЕМОРРАГИЧЕСКОГО ВАСКУЛИТА КОЖНАЯ ФОРМА. Тип кровоточивости – васкулитно-пурпурный. На коже имеются петехиально-папулезные элементы, располагаются симметрично с локализацией на разгибательных поверхностях конечностей, вокруг крупных суставов, ягодицах. Пробы на резистентность капилляров (проба щипка, проба жгута и др.) отрицательные. СУСТАВНАЯ ФОРМА. Геморрагическая сыпь на коже. Артрит (аллергический синовиит). Поражаются крупные и средние суставы: боль, припухлость, повышение местной температуры (над суставом). Артрит исчезает за несколько дней бесследно. Интоксикация. АБДОМИНАЛЬНАЯ ФОРМА. Геморрагическая сыпь на коже. Артрит. Абдоминальный синдром: схваткообразные боли в животе, рвота, алая кровь в стуле. Выраженная интоксикация. МОЛНИЕНОСНАЯ ФОРМА – бурное развитие всех симптомов, элементы на коже сливные, с некрозами. Кожные поражения могут быть полиморфны за счет новых подсыпаний. У больных при всех формах могут быть явления многоморфной или узловатой эритемы, ангионевротического отека, отечность кистей, стоп, голеней, век, лица. СТЕПЕНИ АКТИВНОСТИ ГЕМОРРАГИЧЕСКОГО ВАСКУЛИТА 1. I. Температура тела нормальная или субфебрильная, на коже небольшое количество элементов сыпи, СОЭ и количество лейкоцитов обычно в норме. 2. II. Температура тела до 38°С, суставной и абдоминальный синдром, СОЭ - 20-40 мм/час, лейкоцитоз - более 10 Г/л. 3. III. Так называемая ―молниеносная форма‖: быстрое бурное развитие всех симптомов, сыпь сливная некротическая. Значительное повышение СОЭ и лейкоцитов. ОСЛОЖНЕНИЯ ГЕМОРРАГИЧЕСКОГО ВАСКУЛИТА ü Инвагинация. ü Гломерулонефрит – поражение почек, вызванное иммунными комплексами с IgA. 8. Геморрагическиий васкулит: данные дополнительных методов обследования. Количество тромбоцитов в норме (200-300 Г/л или 50-70 тромбоцитов на 1000 эритроцитов). Ретракция кровяного сгустка в норме (через 24 часа – полная). Длительность кровотечения по Дьюку в норме (до 5,5 мин). Свертываемость капиллярной крови (по Сухареву) в норме (начало-2-3 мин, конец - 5,5 мин). Свертываемость венозной крови (по Ли-Уайту) в норме (6-8 мин., максимум – до 10 мин.). Грубых изменений свертывающей системы не находят, но как правило регистрируют тенденцию к гиперкоагуляции: o Активированное частичное тромбопластиновое время (АЧТВ) укорочено - склонность к гиперкоагуляции. o Повышение уровня фактора Виллебранда в плазме. o Снижение уровня антитромбина III. В клиническом анализе крови: o лейкоцитоз, o нейтрофилез, o повышение СОЭ. Повышение содержания уровня циркулирующих иммунных комплексов (ЦИК). Геморрагическиий васкулит: дифференциальная диагностика. Дифференциальный диагноз проводится с идиопатической тромбоцитопенической пурпурой, гемофилией. 10. Геморрагическиий васкулит: принципы лечения. Постельный режим до стойкого исчезновения геморрагических элементов. Диета – гипоаллергенная МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ГЕМОРРАГИЧЕСКОГО ВАСКУЛИТА 1. 1. Антиагреганты: курантил (Dipyridamole), трентал (Pentoxifylline): от 3-4 недель до 6 месяцев. 2. 2. Антикоагулянты: гепарин ( при средне-тяжелых и тяжелых формах) от 300 ЕД/кг в сутки п/к 4 р/д или в/в капельно почасово (исходная доза 1-2 недели, длительность лечения от 2-3 недель до 4-6 недель). Снижают дозу постепенно на 50 ЕД/кг/ в сутки, не уменьшая числа инъекций, под контролем показателей свертываемости крови. Предпочтительны низкомолекулярные гепарины – фраксипарин (Nadroparin) – эффект от меньшей дозы. 3. 3. Нестероидные противовоспалительные средства (при суставном синдроме) до 12 недель. 4. 4. При тяжелых формах – преднизолон 1-2 мг/кг (длительность курса индивидуальная, чаще коротко 7-14 дней). 5. 5. Антигистаминные препараты – у детей с атопией 6. 6. Энтеросорбенты (связывание токсинов и биологически активных веществ в кишечнике): энтеросгель, энтеродез и др. 7. 7. При интоксикации – реополиглюкин, глюкозо-солевые растворы. 8. 8. При болях в животе – антиспастики, наблюдение хирурга (угроза инвагинации). Геморрагическиий васкулит: профилактика. - Предупреждение острах инфекционных заболеваний - Лечение очагов хронической инфекции 12. Идиопатическая тромбоцитопеническая пурпура: определение. Идиопатическая тромбоцитопеническая пурпура (ИТП) – это первичный геморрагический диатез, который проявляется количественной и качественной недостаточностью тромбоцитарного звена гемостаза. Идиопатическая тромбоцитопеническая пурпура: этиопатогенез. В основе этиопатогенеза идиопатической тромбоцитопенической пурпуры лежит иммунопатологический процесс: выработка антител к собственным тромбоцитам. При аутоиммунных формах идиопатической тромбоцитопенической пурпуры антитела вырабатываются к неизменным тромбоцитам, при гетероиммунных формах свойства тромбоцитов изменены (фиксированным на них инфекционным или неинфекционным антигеном). Тромбоциты с антитромбоцитарными антителами поступают в селезенку, где разрушаются фагоцитирующими мононуклеарами (макрофагами). Длительность жизни тромбоцитов при идиопатической тромбоцитопенической пурпуры 1-2 дня (в норме 10 дней). В костном мозге как реакция на снижение тромбоцитов в крови наблюдается гиперплазия мегакариоцитарного ростка. 14. Идиопатическая тромбоцитопеническая пурпура: классификация. Период геморрагический криз; клиническая ремиссия; клинико-гематологическая ремиссия. Форма влажная; сухая. Течение острое - до 6 мес; хроническое – более 6 мес.: o Ø с редкими рецидивами; o o Ø с частыми рецидивами; Ø непрерывно-рецидивирующее. 15. Идиопатическая тромбоцитопеническая пурпура: клиническая картина. Тип кровоточивости петехиально-пятнистый (микроциркуляторный). Геморрагический синдром представлен геморрагиями на коже и кровотечениями. На коже геморрагии различной величины (полиморфные), от петехий до экхимозов и различной окраски (полихромные), так как есть свежие элементы и старые, отцветающие. Геморрагии располагаются несимметрично. Геморрагии не имеют излюбленной локализации. Могут быть кровоизлияния во внутренние органы, самое опасное – в головной мозг. Характерны кровотечения из слизистых оболочек: носовые, желудочно-кишечные, мено- и метроррагии (у девочек пубертатного периода). Кровотечения спонтанные, длительные. Пробы на резистентность капилляров – положительные (так как нарушается ангиотрофическая функция тромбоцитов). «Влажная» пурпура - с кровотечениями, «сухая» – без кровотечений. Идиопатическая тромбоцитопеническая пурпура: дифференциальная диагностика. Дифференциальный диагноз проводится с тромбоцитопатиями, геморрагическим васкулитом, лейкемией. 17. Идиопатическая тромбоцитопеническая пурпура: данные дополнительных методов обследования. Тромбоциты крови – снижены. Критическое число Франка – количество тромбоцитов ниже 30 Г/л (при снижении количества тромбоцитов ниже этого числа у больного могут появляться тяжелые спонтанные кровотечения). Длительность кровотечения по Дьюку – удлинена. Ретракция кровяного сгустка нарушена. Свертываемость капиллярной и венозной крови в норме. Для подтверждения ИТП – исследование пунктата костного мозга: ü гиперплазия мегакариоцитарного ростка или нормальное содержание мегакариоцитов, ü увеличение молодых форм мегакариоцитов; Определение антитромбоцитарных антител. 18. Идиопатическая тромбоцитопеническая пурпура: принципы лечения. 1. 1. При средне-тяжелой и тяжелой идиопатической тромбоцитопенической пурпуры («влажная» пурпура) – глюкокортикостероиды (иммуносупрессия) после исследования костного мозга. 2. 2. Поливалентные иммуноглобулины в/в капельно (блокируют рецепторы клеток ретикуло-эндотелиальной системы): внутривенный иммуноглобулин «Sandoz». Чаще назначают в ургентных случаях: угрожающие жизни кровотечения, кровоизлияния в мозг и др. 3. 3. Препараты, улучшающие функции тромбоцитов: адроксон, дицинон (этамзилат); аминокапроновая кислота (ингибитор фибринолиза). 4. 4. Если в течение 6 мес. нет эффекта («влажная» пурпура) – показана спленэктомия (желательно детям старше 5 лет). 5. 5. При неэффективности спленэктомии – иммуносупрессивная терапия: винкристин, циклофосфан (Cyclophosphamide), с малыми дозами стероидов; циклоспорин в течение нескольких месяцев. Идиопатическая тромбоцитопеническая пурпура: профилактика. - Предупреждение острых инфекционных заболеваний - Лечение очагов хронической инфекции 20. Гемофилия: определение. Гемофилия – наследственное заболевание, обусловленное дефицитом или молекулярными аномалиями одного из прокоагулянтов, которые участвуют в активации внутреннего пути свертывания крови. 1. 1. Гемофилия: этиопатогенез. Гемофилия А – это заболевание наследственное, сцепленное с полом, ген гемофилии А локализован на Х-хромосоме. Тип наследования – рецессивный. Болеют в основном мужчины. От больного отца ген гемофилии А передается всем его дочерям (они являются кондукторами – проводниками признака) у этих женщин-носителей дефектного гена 50% сыновей будут больны гемофилией А. Женщины болеют очень редко (отец – гемофилик и мать – носительница гена). Гемофилия В (болезнь Кристмасса) обусловлена дефицитом плазменного компонента тромбопластина — фактора IX. Как и гемофилия А, гемофилия В наследуется по рецессивному типу, сцеплена с полом (ген локализован на Х-хромосоме). Гемофилия С развивается при дефиците фактора XI — плазменного предшественника тромбопластина (фактор Розенталя). Наследуется аутосомно, поэтому лица обоего пола болеют с одинаковой частотой. 22. Гемофилия: классификация. Ø Гемофилия А - дефицит фактора VIII (80 %). Ø Гемофилия В - дефицит фактора IX (19 %). Ø Гемофилия С - дефицит фактора XI (1 %). В зависимости от уровня дефицитного фактора выделяют: тяжелую форму заболевания (уровень фактора менее 1 %); средней тяжести (уровень фактора 1-5 %); легкую (уровень фактора более 5 %). 23. Гемофилия: клиническая картина. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ГЕМОФИЛИИ А Тип кровоточивости – гематомный. Характерны: 1) гематомы – обширные и плотные при пальпации геморрагические элементы, так как захватывают более глубокие ткани. Могут быть мышечные гематомы, забрюшинной локализации (кровоизлияния в полость сустава); 2) гемартрозы: сустав увеличен, болезненный, нарушена функция сустава; 3) кровотечения, как правило, посттравматические (не спонтанные), длительные и отсроченные по времени, так как при гемофилии нарушен внутренний (без участия тканевого тромбоплатина) механизм гемостаза, а внешний (с участием тканевого тромбопластина) не нарушен. Возможны почечные кровотечения. Выраженность кровоточивости зависит от степени дефицита фактора VIII. В норме его содержание составляет от 50 до 200 %: при снижении показателя до 20-50 % наблюдается только тенденция к повышенной кровоточивости при крупных травмах; при уровне фактора от 5 до 20 % возникают тяжелые кровотечения при травмах и оперативных вмешательствах; если же он колеблется в пределах от 1 до 5 %, возникают различные кровоизлияния, в том числе в суставы, посттравматические кровотечения, неадекватные травме, длительные, отсроченные по времени (через 3 часа, так как при гемофилии нарушен вторичный гемостаз); при полном отсутствии фактора VIII развивается тяжелая форма гемофилии, проявляющаяся спонтанными кровоизлияниями, кровотечениями, развитием гемартрозов. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ГЕМОФИЛИИ В По своим клиническим проявлениям этот вид гемофилии не отличим от гемофилии А. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ГЕМОФИЛИИ С. Различают латентную и выраженную формы проявления дефицита фактора XI. При латентной форме кровоточивость проявляется при травмах и хирургических вмешательствах. При выраженных формах болезни могут наблюдаться умеренная спонтанная кровоточивость, легкое появление синяков, носовые кровотечения и обильные кровотечения при травмах и хирургических вмешательствах, изредка — подкожные и мышечные гематомы. 24. Гемофилия: дополнительные методы исследования. Тесты для характеристики плазменно-коагуляционного звена гемостаза Время свертывания венозной крови Время рекальцификации плазмы Активироанное парциальное тромбопластиновое время (АПТВ/АЧТВ) Одноступенчатое протромбиновое время (протромбиновый индекс) Тромбиновое время Концентрация фибриногена Тест растворимости фибринового сгустка в мочевине (активность фактора XIII) Определение уровня фактора в крови! Обязательным является определение следующих показателей: Время свертывания крови по Сухареву (удлинено). Время свертывания крови по Ли-Уайту (удлинено). Уровень факторов свертывания: VIII – снижен при гемофилии А. IX – снижен при гемофилии В. XI – снижен при гемофилии С. 25. Гемофилия: дифференциальный диагноз. ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ ГЕМОРРАГИЧЕСКИХ ДИАТЕЗОВ Показатели Геморрагический васкулит ИТП Гемофилия А Тип кровоточивости Васкулитно-пурпурный Петехиальнопятнистый Гематомный Геморрагическая сыпь Папулезно-геморрагическая, Экхимозы, петехии; на разгибательных полихромные, поверхностях конечностей, полиморфные, без суставов, на ягодицах, характерной симметричная локализации, несимметрич-ные Гематомы: глубокие кровоизлияния, могут быть крупные, несимметричные Кровотечения Могут быть кишечные Из слизистых, спонтанные Посттравматические, отсроченные Гемартрозы Не характерны Не характерны Характерны Эндотелиальные симптомы Отрицательные Положитель-ные Отрицательные Вовлечение других органов Суставы, ЖКТ, почки Не характерно Суставы Явления интоксикации Характерны Не характерны Не характерны ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ ПРИ ГЕМОРРАГИЧЕСКИХ ДИАТЕЗАХ Показатели Геморрагический васкулит ИТП Гемофилия А Тромбоциты Норма Снижены Норма Длительность кровотечения по Дьюку Норма Удлинена Норма Ретракция кровяного сгустка Норма Нарушена Норма Свертываемость крови по Сухареву, Ли-Уайту Норма Норма Удлинена Уровень VIII фактора Норма Норма Снижен Антитромбин III Снижен Норма Норма 26. Гемофилия: принципы лечения. Заместительная терапия — адекватное замещение недостающего фактора свертывания в целях профилактики или купирования кровотечений. При кровотечениях главным принципом является раннее начало трансфузионной терапии. К средствам заместительной терапии относятся: Концентрат фактора VIII (вводят в дозе 20-50 ЕД/кг в зависимости от тяжести кровотечения). Концентрат фактора IX. Свежезамороженная плазма ( содержит факторы VIII и IX). Криопреципитат ( содержит VIII фактор). Концентрат протромбинового комплекса PPSB (содержит факторы 11, VII, IX, ХI). Частота введения антигемофильных факторов: 1. 1. Концентрат VIII фактора – вводится каждые 8 часов. 2. 2. 3. 3. Концентрат IX фактора – вводится 1 раз в сутки или 1 раз в 2 суток. Концентрат ХI фактора – вводится 1 раз в 3 суток. Необходимо учитывать, что 1 ЕД введенного фактора VIII/кг массы повышает содержание фактора в крови на 1,5–2 %, а 1 ЕД фактора IX – на 0,8 %. Местная терапия направлена на минимизацию повреждения и боли, обеспечение заживления. При наружных кровотечениях вследствие разрезов, эрозий и повреждений кожи и слизистых эффективным может быть мягкое давление (без давящих циркульных повязок!) с гемостатическими препаратами (гемофобин, гемостатическа губка и др.) и льдом, наложение швов. Необходимо осторожное удаление сгустков, шатающихся молочных зубов, которые нарушают заживление. В лечении гемартрозов, внутримышечных гематом большое значение принадлежит иммобилизации, приподнятое положение пораженной конечности. Пункция сустава с аспирацией излившейся крови проводится только после введения факторов свертывания. НЕОБХОДИМЫЙ УРОВЕНЬ ФАКТОРОВ VIII/IX ДЛЯ ПРЕДОТВРАЩЕНИЯ КРОВОТЕЧЕНИЙ Вид кровотечения/ кровоизлияния Желаемый уровень фактора VIII/IX Режим введения препарата Гемартроз, гематома, носовое кровотечение, гематурия 40-50 % В течение первых 2х суток: каждые 12 часов (гемофилия А), каждые 18 часов (гемофилия В), затем каждые 24 часа до остановки кровотечения и исчезновения боли. Экстракция зуба 60–80 % За 30 минут до манипуляции, затем: каждые 12 часов (гемофилия А), каждые 18 часов (гемофилия В) до полного заживления раны. Забрюшинная гематома, кровотечение из ЖКТ 60–80 % В течение первых 3х суток: каждые 8 часов (гемофилия А), каждые 18 часов (гемофилия В), затем поддерживающая терапия каждые 24 часа в течение 14 дней. Госпитализация в стационар. Кровоизлияния в спинной мозг и головной мозг. Другие кровоизлияния, угрожающие жизни. 80-100 % Каждые 8 часов (гемофилия А), каждые 18 часов (гемофилия В) до полной остановки кровотечения, затем поддерживающая терапия каждые 24 часа в течение 14 дней. Срочная госпитализация в стационар обязательно! Появление ингибиторов к факторам свертывания VIII и IX – одно из тяжелых осложнений заместительной терапии у больных гемофилией. Под действием ингибиторов экзогенный фактор VIII быстро теряет прокоагулянтную активность, стимулирует дополнительную продукцию антител – повышается титр и активность ингибитора в крови. Кровотечение приобретает неконтролируемый характер. Антитела к фактору VIII отмечаются чаще (до 35 %), чем к фактору IX (3-5 %), и появляются в детском возрасте (чаще 3-6 лет). Для лечения гемофилии, осложненной ингибиторами, применяют «шунтовые» препараты: эптаког-альфа активированный; антиингибиторный коагуляционный комлекс (факторы II,VII,IX,X); возможно использование плазмафереза, десмопрессина. 27. Гемофилия: профилактика. Планирование семьи — определение носительства мутантного гена (фенотипически — по уровню фактора VIII в крови; генотипически — выявление дефектного гена в молекулярногенетических лабораториях). Пренатальная диагностика — биопсия ворсинок хориона на 8-й неделе беременности или проба амниотической жидкости для анализа ДНК; редко — аспирация крови плода на 18-20-й неделе. Обеспечить больному условия, которые бы сводили до минимума возможные травмы. По возможности раннее введение фактора свертывания после травмы (в домашних условиях). В дальнейшем – правильный выбор профессии (без физических нагрузок). Не назначают препараты антиагрегационного механизма воздействия (НПВС и др.); Лекарственные препараты никогда не вводят в/м, п/к, только в/в или внутрь. САХАРНЫЙ ДИАБЕТ У ДЕТЕЙ 1.Сахарный диабет: определение. Сахарный диабет – синдром хронической гипергликемии, обусловленный абсолютной или относительной недостаточностью инсулина и сопровождается нарушением всех видов обмена веществ в организме, прежде всего, углеводного, жирового, белкового. 2.Сахарный диабет: классификация. Классификация сахарного диабета (ВОЗ, 1999). Классификация по типам: 1.Сахарный диабет типа 1 (деструкция b-клеток, обычно приводит к абсолютной инсулиновой недостаточности): аутоиммунный идиопатический 2.Сахарный диабет типа 2 (с преимущественной резистентностью к инсулину и относительной инсулиновой недостаточностью или преимущественно секреторным дефектом и резистентностью к инсулину или без нее). 3.Гестационный сахарный диабет. 4.Другие специфические типы: А. Генетические дефекты функции b-клеток: MODY-3 (хромосома 12 ген HNF-1а) MODY-2 (хромосома 7, ген глюкокиназы) MODY-1 (хромосома 20 ген HNF-4а) Митохондриальная мутация ДНК. Другие. В. Неонатальный диабет С. Генетические дефекты в действии инсулина: Резистентность к инсулину типа А Лепречаунизм, Синдром Робсона-Менденхолл Липоатрофичний диабет. Другие. D. Болезни экзокринной части поджелудочной железы (панкреатит, травма / панкреатэктомия, неоплазия, кистозный фиброз, гемохроматоз, фиброкалькулѐзная панкреатопатия) E. Эндокринопатии (акромегалия, синдром Кушинга, глюкагонома, феохромоцитома, тиреотоксикоз, соматостатинома, альдостерома и другие) F. Сахарный диабет, индуцированный лекарствами и химикатами (вакор, пентамидин, никотиновая кислота, глюкокортикоиды, тиреоидные гормоны, диазоксид, агонисты aадренорецепторов, тиазиды, дилантин, -a интерферон и т.д.) G. Инфекции (врожденная краснуха, цитомегаловирус) H. Необычные формы иммуногенного диабета ("Stiff-man" - синдром, аутоантитела к рецептору инсулина и т.д.) I. Другие генетические синдромы, иногда сочетающиеся с диабетом (синдром Дауна, синдром Клайнфельтера, синдром Тернера, синдром Вольфрама, Атаксия Фридрейха, хорея Гентингтона, синдром Лоренса, миотоническая дистрофия, порфирия, синдром Прадера-Вилли и т.п.) Классификация по состоянию гликемического контроля: идеальный; - оптимальный; субоптимальный; высокий риск для жизни. Классификация осложнений: 1. Острые осложнения: Диабетический кетоацидоз; кетоацидотическая кома - Гиперосмолярная кома - Гипогликемия, гипогликемическая кома; - Молочнокислая (лактоцидемическая) кома. 2. Хронические осложнения: - Ангиопатии (микро- и макроангиопатии); - Невропатия (периферическая, центральная, автономная); - Синдром Мориака, синдром Нобекура; - Поражение кожи (дермопатия, липоидный некробиоз, липодистрофия, хроническая паронихия); - Синдром диабетической кисти (хайропатия, контрактура Дюпюитрена); - Синдром диабетической стопы, сустав Шарко. Сахарный диабет типа 1: определение. Сахарный диабет типа 1 (СД типа 1)− аутоиммунное заболевание у генетически предрасположенных лиц. В результате длительного многоэтапного аутоиммунного процесса развивается лимфоцитарный инсулит, что приводит к деструкции β-клеток островков и последующего развития абсолютной инсулиновой недостаточности. Сахарный диабет типа 1: этиопатогенез. Этиологические факторы: 1.Эндогенные факторы: Генетическая предрасположенность (наличие антигенов главного комплекса гистосовместимости HLA-В8, В15, В35, DR3, DR4, DR3|DR4, DW3, DRW3, DRW4 и др., дефект определенных локусов на коротком плече 6-й хромосомы, приводящий к изменению белков мембраны β-клеток островков Лангерганса-Соболева поджелудочной железы, также дефекты генов, контролирующих иммунный ответ, что формирует склонность к аутоиммунным реакциям). 2. Экзогенные факторы: вирусы, тропные к β-клеткам (Коксаки, энтеровирусы, цитомегаловирус,ротавирусы, вирусы кори, Эпштейна-Барра, эпидемического паротита, ветряной оспы, гриппа, гепатита, инфекционного мононуклеоза) химические яды (аллоксан, стрептозотоцин, нитраты, нитрозоамины), лекарственные препараты (кортикостероиды, индометацин, циметидин) стресс физические и химические травмы врожденная гипоплазия поджелудочной железы избыточное питание, особенно с преобладанием жиров и легкоусвояемых углеводов. Патогенетические механизмы Большинство исследователей связывают развитие СД 1 типа с аутоиммунным воспалением островкового аппарата поджелудочной железы (инсулитом). Выделяют 6 стадий данного процесса: I стадия – воздействие пусковых факторов. II стадия – избирательное повреждение β-клеток поджелудочной железы. III стадия – возникновение активного аутоиммунного инсулита. IV стадия – деструкция части β-клеток и снижение секреции инсулина в ответ на введение глюкозы натощак. V стадия – клиника явного ИЗСД, когда появляются большие симптомы. Происходит деструкция более 80 % β-клеток, но еще сохраняется продукция собственного инсулина. VI стадия – полная деструкция β-клеток и абсолютная инсулиновая недостаточность. Сахарный диабет типа 1: клинические проявления. Клинические проявления: Полиурия; Полидипсия; Полифагия; Потеря массы тела; Ночное недержание мочи; Сухость слизистых оболочек рта; Зуд кожи и слизистых; Повышенная нервная возбудимость; Головная боль; Боль в животе, тошнота, рвота (особенно при диабетическом кетоацидозе); Диабетический румянец; Запах ацетона изо рта; Стоматит, в т.ч. ангулярный стоматит; Частые инфекции; Фурункулез, ячмени. У девочек− вульвиты, вульвовагиниты Проявления сахарного диабета у грудных детей: Жажда Остановка прибавок массы или потеря веса, уплощение весовых кривых Необычное беспокойство, которое проходит после питья Феномен накрахмаленных пеленок (обусловлен глюкозурией). Сухость кожи, пиодермии, упорные опрелости Дебют сахарного диабета может быть различным: постепенным либо острым, с развитием симптомов интоксикации и обезвоживания. В тяжелых случаях может отсутствовать гипергликемия натощак Сахарный диабет типа 1: критерии диагностики. 1. Клинические признаки (см. предыдущий блок) 2. Параклинические признаки: 2.1. обязательные лабораторные: Гипергликемия; Глюкозурия Кетонурия. 2.2. дополнительные лабораторные: С-пептид в сыворотке крови (снижен или отсутствует); Повышенный уровень гликированного гемоглобина; Повышенный уровень фруктозамина; Наличие аутоантититил к антигенам β-клеток, к инсулину, к глутаматдекарбоксилазе. Гипергликемия - главная лабораторная признак СД типа 1. В норме содержание глюкозы в капиллярной крови натощак составляет 3,3-5,5 ммоль / л, а в течение суток от 4 до 8-9 ммоль / л. Уровни гликемии натощак в зависимости от возраста ребенка (И.И.Дедов и соавт., 2007). у новорожденных −1,6-4,0 ммоль / л, у доношенных грудных детей 2,78-4,4 ммоль / л, у детей раннего возраста и школьников - 3,3-5,0 ммоль / л Оценка показателей гликемии: При наличии клинических симптомов заболевания и уровеня глюкозы натощак в капиллярной крови 6,1 ммоль / л и более или выборочно в течение суток - 11,1 ммоль / л или при получении дважды уровня гликемии натощак в капиллярной крови ≥6,1 ммоль / л или в венозной крови ≥7,0 ммоль / л, или выборочно ≥11,1 ммоль / л диагноз СД не вызывает сомнений и во вспомогательных исследованиях нет необходимости. В сомнительных случаях при наличии или отсутствии характерной клиники и гликемии натощак <6,1 в капиллярной крови (5,6-6,1 ммоль / л) проводится стандартный оральный глюкозотолерантный тест (ОГТТ). Сахарный диабет типа 1: критерии диагностики. Методика проведения орального глюкозотолерантного теста(ОГТТ): в течение трех дней перед проведением теста придерживаться привычного режима питания и физической нагрузки; отменяются лекарственные препараты, которые влияют на уровень гликемии; тест рекомендуется проводить после 10-14 часов голодания; в день проведения теста утром определяется уровень гликемии натощак, после чего пациент принимает глюкозу, растворенную в 250-300 мл воды. Раствор глюкозы выпивается за 2-5 мин. детям до 14 лет количество глюкозы для проведения ОГТТ дают из расчета 1,75 г сухого вещества на 1 кг фактической массы тела (не более 75 г). Повторное исследование уровня гликемии проводится через 2 часа после нагрузки глюкозой; Диагностические значение орального глюкозотолерантного теста Диагноз Определение Концентрация глюкозы, ммоль/л Центральная кровь Плазма Венозная Капилярная Венозная Натощак > 6,1 > 6,1 > 7,0 Через 2 часа > 10,0 > 11,1 > 11,1 Нарушение толерантности Натощак < 6,1 < 6,1 < 7,0 к глюкозе. Через 2 часа >6,7 <10,0 >7,8 <11,1 >7,8 <11,1 Натощак >5,6 <6,1 >5,6 <6,1 > 6,1 <7,0 Через 2 часа <6,7 <7,8 <7,8 Сахарный диабет Повышение гликемии натощак глюкозы в крови ● Показатели уровня глюкозы натощак в капиллярной крови от 5,6 до 6,1 и в венозной - от 6,1 до 7,0 ммоль / л относят к нарушению гликемии натощак, что требует проведения ОГТТ. Показатели гликемии в плазме и капиллярной крови через 2 часа после нагрузки глюкозой менее 7,8 ммоль / л (не превышает норму) подтверждают диагноз «нарушение гликемии натощак». ● Уровень глюкозы в капиллярной крови и плазме через 2 часа после нагрузки глюкозой от 7,8 до 11,1 ммоль / л− диагностируют нарушенную толерантность к глюкозе. ● Повышение уровня глюкозы в капиллярной крови до 6,1 ммоль / л и выше, в плазме крови - до 7,0 ммоль / л и выше или через 2 часа после нагрузки глюкозой - до 11,1 ммоль / л и выше и в капиллярной крови, и в плазме свидетельствует о сахарном диабете. Диагноз должен быть подтвержден повторным определения содержания глюкозы в крови (2-3 раза), особенно при отсутствии клинических симптомов СД. Сахарный диабет типа 1: критерии диагностики. Глюкозурия является важным диагностическим критерием СД. В норме глюкоза в моче отсутствует. Глюкозурия возникает, если уровень глюкозы в крови превышает 8,8-9,0 ммоль / л (почечный порог). Диагностика СД типа 1 при выявлении глюкозурии может считаться достоверной только при наличии гипергликемии. Кетонурия или ацетонурия. Наличие кетоновых тел (продукты метаболизма жиров - βгидроксимасляная, ацетоуксусная кислоты и ацетон) в моче свидетельствует о выраженной декомпенсации СД и тяжесть состояния ребенка в связи с дефицитом инсулина. Сахарный диабет типа 1: дифференциальная диагностика. Симптом гипергликемии необходимо дифференцировать с: акромегалией болезнью Иценко-Кушинга, гиперкортицизмом, обусловленным аденомой коркового слоя надпочечников, феохромацитомой гипертиреозом поражением нервной системы; Глюкозурия может наблюдаться: при употреблении детьми большого количества сладостей стрессах почечном диабете наследственном синдроме Де Тони-Дебре-Фанкони патологии почек врожденных ферментопатиях и других состояниях. органические поражения ЦНС, интоксикации (отравления солями ртути, урана, хромовыми кислотами, угарным газом, кофеином, морфином и др.), кислородная недостаточность (наркоз, асфиксия ), тяжелые заболевания (токсикоз с эксикозом, инфекционные заболевания, высокая лихорадка и т.п.), тяжелые физические травмы, панкреатиты, болезни Вильсона, циррозе печени и др. Кетонурия у детей без диабета может случаться при инфекционных заболеваниях с высокой лихорадкой, голодании, диете с высоким содержанием жира и недостаточным количеством углеводов, особенно у детей раннего возраста. Сахарный диабет типа 1: дифференциальная диагностика (продолжение). При постепенном развитии заболевания у детей дифференциальный диагноз проводится с СД типа 2 и MODY-типом. Клинические СД типа 1 СД типа 2 MODY Возраст манифестации с 6 мес и старше посля 8-10 лет в любом возрасте Начало заболевания острое, чаще постепенное, чаще постепенное реже подострое асимптоматичное быстро розвивается не характерный В 20% манифестация (очень редко) с кетозом характерно Менее чем (лабораторные) признаки Кетоацидоз Ожирение редко в 20% больных Наследственность чаще не отягощена СД 2 у родственников, СД 2 чаще гестационный, СД у матери молодого возраста в нескольких поколениях Течение заболевания Обычно лабильный, высокая Легкий, Мягкий, потребность потребность в инсулине не требует в небольших дозах введения инсулина инсулина у 30% больных Отмена инсулина Невозможно, - Легко переносится Ассоциация с др.аутоиммунными заболеваниями Характерна Не характерна Не характерна Наличие специфических Характерно аутоантител Не характерно Не характерно Секреция инсулина Резко снижена снижена І фаза с последующим снижена гиперинсулинизмом Молекулярно- Ассоциация с Не разработаны генетические комбинацией Имеют абсолютную диагностическую исследования алелей HLA ценность Сахарный диабет типа 1: лечение. Лечение СД типа 1 у детей включает следующие основные факторы: диета; инсулинотерапия; физическая нагрузка; проведение самоконтроля в домашних условиях; психологическая помощь. 1.Особенностью диеты при ИЗСД является исключение легкоусвояемых углеводов, ограничение жиров животного происхождения, количество белков в пище должно соответствовать возрастной норме. В общепринятом рационе питания здоровых детей соотношение белков, жиров и углеводов составляет 1:1:4, а в диете детей с ИЗСД – 1:0,8:3. В настоящее время придерживаются построения питания по хлебным единицам (ХЕ). 1 ХЕ соответствует 12 г углеводов и повышает уровень глюкозы в крови на 2,8 ммоль/л. Для усвоения 1 ХЕ необходимо 1,3 ЕД инсулина. 2. Заместительная инсулинотерапия при СД типа 1. . Фармакокинетическая характеристика различных видов инсулина Вид инсулина производитель Начало действия Пик действия Длительность действия Хумалог Ели Лилли 0-15 мин 1ч 3,5-4 ч НовоРапид Ново Нордиск 10-20 мин 1-3 ч 3-5 ч Эпайдра Санофи-Авентис 5-15 мин 1-2 ч 3-4 ч Хумулин регуляр Ели Лилли 0,5-1 ч 1-3 ч 6-8 ч Актрапид НМ Ново Нордиск 0,5-1 ч 1-3 ч 6-8 ч Інсуман рапид Санофи-Авентис 0,5 ч 1-4 ч 7-9 ч Хумодар Р Индар 0,5 ч 1-2 ч 5-8ч Хумулин НПХ Ели Лилли 1-2 ч 4-12 ч 17-22ч Протафан НМ Ново Нордиск 1-2 ч 4-12 ч До 24 ч Инсуман базал Санофи-Авентис 1ч 3-4 ч 11-20 ч Хумодар Б Индар 1ч 3-4 ч 11-20 ч Хумулин ультраленте Ели Лилли 3ч 3-18 ч 24-28 ч Ультратард НМ Н.Нордиск 4г 8-18 г 28 ч Санофи-Авентис 1ч Инсулины ультракороткого действия Инсулины короткого действия Инсулины средней продолжительности действия Инсулины длительного действия Инсулины длительного действия Лантус Нет 24 ч Левемир Ново Нордиск 2ч Нет До 24 ч Ели Лилли 0,5-1 ч 5-9 ч 18-24 ч 0,5-1 ч 1-3 ч 18-24 ч Смеси инсулинов (препараты двухфазного действия ) Хумулин 30/70, 50/50 (%регуляр+%НПХ) Микстард 30 НМ Ново Нордиск 0,5-1 ч 5-9 ч 18-24 ч НовоМикс 30 Ново Нордиск 10-20 мин 1-3 ч 18-24 ч (аналог инсулина) 4-12 ч Доза инсулина. дебют диабета - 0,3 - 0,6 ЕД / кг; период ремиссии - <0,5 ЕД / кг; длительное течение - 0,7 - 1,0 ЕД / кг; декомпенсация (кетоацидоз) - 1,0- 1,5 ЕД / кг; период препубертата - 0,7 - 1,0 ЕД / кг; период пубертата - 1,0 -2,0 ЕД / кг. 1. Сразу после установления диагноза СД типа 1 назначается инсулин короткого действия подкожно перед основными приемами пищи (4-6 раз в день), иногда возможна комбинация 2. быстродействующего и длительного действия инсулина два раза в день. Доза инсулина при первой инъекции зависит от возраста ребенка и степени гипергликемии: у детей первых лет жизни - 0,5 -1 ЕД/ кг. у школьников - 2 - 4 ЕД/ кг. у подростков - 4 - 6 ЕД/ кг. 1. Дальнейшая доза инсулина изменяется в зависимости от динамики уровня гликемии: если она не уменьшается, дозу инсулина повышают на 50%; гликемия нарастает - дозу повышают на 100%; гликемия снижается к гипогликемии - дозу уменьшают на 25-50%. 1. Кроме того, при необходимости дополнительно делают инъекции в 24 и 6 часов, а при гликемическом контроле с высоким риском - и в 3.00, но в меньшем количестве инсулина с учетом отсутствия еды ночью. 2. Через несколько дней переходят на комбинированное введение инсулинов (аналогов) продленного действия (перед завтраком и на ночь) и короткого действия (перед основными приемами пищи). Потребность в инсулине при гликемическом контроле с высоким риском может превышать 1,5-2 ЕД / кг массы тела в сутки. После достижения идеального (оптимального) гликемического контроля доза инсулина, как правило, снижается. 6. Суточную дозу инсулина распределяют чаще примерно поровну между быстродействующими и пролонгированными препаратами (50% на 50% или 40% на 60%). Дозу короткодействующего препарата определяют в зависимости от пищевой нагрузки 7. При коррекции инсулинотерапии учитывают чувствительность к инсулину: введение 1 ЕД инсулина короткого действия снижает гликемию: - у детей старше 15 лет - на 2-3 ммоль / л; - у детей с массой тела более 25 кг - на 3 - 7 ммоль / л; - у детей с массой тела менее 25 кг - на 5 - 10 ммоль / л. Дозированная физическая нагрузка (ФН): утренняя гимнастика, дозированная ходьба, ЛФК, занятия спортом (плавание, бадминтон, настольный теннис, легкая атлетика). ФН требует корректировки диеты и уменьшения дозы инсулина короткого действия в соответствии энергозатратам. Проводить ФН рекомендуется через 1-2 часа после еды. До, во время и после ФН следует измерять концентрацию глюкозы в крови. Противопоказано интенсивное ФН при гликемии выше 12-14 ммоль / л, это может спровоцировать развитие кетоацидоза и меньше 7ммоль / л (риск гипогликемии). Сахарный диабет типа 1: критерии компенсации Критерии эффективности лечения включают: хорошее самочувствие, высокий уровень работоспособности; отсутствие клинических проявлений декомпенсации СД; лабораторная компенсация СД отсутствие тяжелых гипогликемий; допускается наличие отдельных легких гипогликемий; нормальное физическое и половое развитие ребенка; нормальное психосоциальное состояние. Оценка степени компенсации углеводного обмена (целевые показатели (ISPAD Consensus guidelines, 2000) Уровень гликемического контроля Идеальный Оптимальный Субоптимальный Высокий риск осложнений Клиническая оценка Гипергликемия Отсутствует Нет симптомов Полиурия, полидипсия, энурез, избыток массы тела, ребенок не может регулярно посещать школу Гипогликемия Ухудшение зрения, судороги, задержка роста, поздний пубертат, инфекции кожи и гениталий, признаки сосудистых осложнений Отсутствует Периодические Эпизоды тяжелой гипогликемии (потеря легкие гипогликемии сознания, могут быть судороги) отсутствуют тяжелые 3,6-6,1 4,0-7,0* >8,0 >9,0 4,4-7,0 5,0-11,0 11,1-14,0 >14 Биохимическая оценка Гликемия натощак ммоль/л Гликемия после еды (постпрандиальная) Гликемия ночью, ммоль/л 3,6-6,0 Не <3,6 <3,6 или>9,0 <3,0 или >11,0 Нв А1с, % <7,6 7,6-9,0 >9,0 <6,05 * Если уровень гликемии <4 ммоль / л, возможна предварительная ночная гипогликемия. Сахарный диабет типа 1: осложнения инсулинотерапии. Наиболее характерными осложнениями инсулинотерапии являются: 1.Иммунологические реакции: Аллергия к препаратам инсулина Липодистрофия Инсулинорезистентность 2.Состояния, которые возникают в результате гормонального действия инсулина: Гипогликемия Синдром Сомоджи (синдром хронической передозировки инсулина) Инсулиновые отеки Инсулиновая пресбиопия Синдром Сомоджи (синдром хронической передозировки инсулина) характеризуется значительным повышением гликемии после гипогликемии, индуцированной введением инсулина. Причиной гипергликемии считают высвобождение контринсулярных гормонов в ответ на гипогликемию. Инсулиновые отеки наблюдаются у больных с недостаточной компенсацией СД после начала инсулинотерапии. Основной причиной их возникновения считают влияние инсулина на почки, уменьшение выделения натрия, вызывает задержку воды. Инсулиновая пресбиопия (нарушение рефракции) обусловлена значительным снижением уровня гликемии в начале инсулинотерапии. Сахарный диабет типа 1: хронические или поздние осложнения. В результате неудовлетворительного метаболического контроля, у ребѐнка формируются ряд хронических или поздних специфических и неспецифических диабетических осложнений: I. Хронические или поздние специфические диабетические осложнения 1. Ангиопатии (микро- и макроангиопатии); Микроангиопатии: Диабетическая нефропатия Диабетическая ретинопатия 2. Диабетическая невропатия: Диабетическая периферическая полиневропатия — с преимущественным поражением чувствительных нервов (сенсорная форма) — с преимущественным поражением двигательных нервов (моторная форма) — с комбинированным поражением нервов (сенсомоторная форма) Автономная невропатия (сердечно-сосудистая форма, поражение желудочно-кишечного тракта, мочеполовой системы, диафрагмального нерва) 3. Синдром диабетической стопы. II. Неспецифические осложнения или ассоциированные с СД типа 1 патологические состояния и заболевания: Задержка физического развития Задержка полового развития Липоидный некробиоз Жировой гепатоз или стеатогепатоз Поражения глаз: катаракта, глаукома Инфекционные заболевания Нарушения опорно-двигательного аппарата Ограниченная подвижность суставов (хайропатия) Остепения/остеопороз Инфекции плода и новрожденного. 1. Неонатальная инфекция. Неонатальный сепсис: определение, эпидемиология Неонатальный сепсис – это системное бактериальное заболевание у детей первых 28 дней жизни, которое сопровождается характерными клиническими симптомами и может быть подтверждено одной или несколькими положительными культурами крови. Общая частота сепсиса у новорожденных колеблется от 1 до 3,5 на 1000 рожденных живыми среди доношенных и 1 на 250 рожденных живыми среди преждевременно рожденных. Летальность при сепсисе по данным различных авторов, в зависимости от этиологии колеблется от 20% до 80%. Максимальная летальность отмечается при манифестном течении, синегнойном и анаэробном сепсисе. Летальность новорожденных с ранним сепсисом составляет от 20 до 40%, при позднем до 20%, и зависит от его этиологии, хотя может быть выше в случаях, когда инфекционный процесс вызван грамотрицательной микрофлорой. 2. Неонатальный сепсис. Этиология, патогенез. Этиология Ранний – клиническая манифестация инфекции в первые 72 часа жизни ребенка, преимущественно в первые 12 часов жизни. Наиболее частые возбудители – стрептококк группы В (Str. Agalactiae), кишечная палочка (E.Coli), энтерококки, листерии. Поздний – выявляется после 72 часов жизни, также может встречаться в пределах 3-х месяцев жизни (89 дней) и являться приемущественно нозокомиальным (госпитальным) заболеванием, хотя в случае инфекции вызванной стрептококками группы В, сепсис может быть внутриутробным. Наиболее частыми возбудителями позднего сепсиса является коагулазонегативный стафилококк (его частота может достигать 50%), Str. Pneumonia, Neisseria meningitides, Enterobacter spp., E.coli. Патогенез Системный воспалительный ответ организма на инфекцию: повышенный синтез цитокинов → поражение цитокинами сосудов, клеточных мембран различных тканей → развитие полиорганной недостаточности → нарушение гомеостаза с развитием ДВС–синдрома → шок. Факторы высокого риска развития сепсиса Тяжелая интранатальная асфиксия на фоне хронической внутриутробной гипоксии. Родовые травмы. Пороки развития и наследственные заболевания. Внутриутробные вирусные и паразитарные инфекции. Недоношенность < 32 недель гестационного возраста. Масса тела при рождении < 1500 г. 3. Неонатальный сепсис: классификация 1. 1. По времени появления первых клинических признаков: ранний (первые 72 часа жизни); поздний (после 72 часов жизни). 1. 2. бактерии (грамотрицательные, грамположительные и др.); вирусы; простейшие; грибы. 1. 3. Время инфицирования: антенатальный; интранатальный; постнатальный. 1. 7. Характер течения: острое; подострое; молниеносное. 1. 6. Форма заболевания: септицемическая; септикопиемическая. 1. 5. Входные ворота: пупочный, кожный, отогенный, урогенитальный и др. 1. 4. По этиологии: По условиям развития: внебольничный, госпитальный (нозокомиальный). 4. Неонатальный сепсис. Клиническая картина. Для клинической картины сепсиса характерна тяжесть общего состояния новорожденного. Она проявляется выраженными нарушениями терморегуляции (у доношенных чаще наблюдают лихорадку; у недоношенных и детей с отягощенным преморбидным фоном более вероятна прогрессирующая гипотермия). Нарушение функционального состояния ЦНС (угнетение или беспокойство, мышечная гипотония, судороги). Характерны бледный или бледно-серый оттенок кожи, нередко с геморрагиями, иногда можно наблюдать цианоз. В раннем неонатальном периоде может быть быстро нарастающая желтуха. Черты лица заострены. Типичны развитие дыхательной недостаточности, при отсутствии воспалительных изменений на рентгенограмме, нарушение функции сердца, по типу токсической кардиопатии, которая может сопровождаться развитием сердечной недостаточности. Характерно отсутствие прибавки в массе, склонность к срыгиваниям, рвоте, анорексии. Отмечается увеличение размеров селезенки и печени, вздутие живота, выраженная венозная сеть на животе. Септицемия – клинически проявляется наличием симптомокомплекса токсикоза, системной воспалительной реакцией и полиорганной недостаточностью. Септикопиемия – характеризуется развитием одного или нескольких септикопиемических очагов, которые и определяют особенность клинической картины и течения болезни. Среди метастатических очагов сепсиса у новорожденных первое место по частоте занимает гнойный менингит, пневмония, энтероколит, остеомиелит. 5. Неонатальный сепсис. Данные дополнительных методов обследования. Клинический анализ крови: лейкоцитоз, нейтрофилѐз со сдвигом влево, повышение СОЭ, анемия (токсическая, инфекционная), может быть лейкопения, нейтропения. Бактериальный посев крови на стерильность: выделяется возбудитель (бактериемия). Биохимический анализ крови: гипопротеинемия с уменьщением уровня альбуминов и увеличением α1- и α2-глобулинов, положительная реакция на С-реактивный белок. Клинический анализ мочи. 6. Неонатальный сепсис: дифференциальный диагноз Проводят с иммунодефицитами, внутриутробной инфекцией (цитомегалией, токсоплазмозом), острым лейкозом, тяжелым течением при единичном гнойном очаге инфекции. 7. Неонатальный сепсис. Принципы лечения. 1. 1. Антибактериальная терапия При раннем сепсисе новорожденных препаратом выбора считается ампициллин в сочетании с аминогликозидами (гентамицин или амикацин). При подозрении на заболевания вызванные устойчивыми штаммами стафилококка или энтерококками назначают ванкомицин либо в виде монотерапии, либо в сочетании с аминогликозидами (амикацином). При кожном сепсисе антибиотик выбора оксациллин или ампициллин, или цефалоспорины первого и второго поколения (цефазолин или цефуроксим), применяемые в комбинации с аминогликозидами (амикацином). Эффективной считается антибактериальная терапия, при проведении которой в течение 48 часов достигается стабилизация состояния или даже некоторое улучшение. Неэффективной считают терапию, при проведении которой в течение 48 часов отмечается нарастание тяжести состояния и органной недостаточности. При позднем сепсисе, если не возможно идентифицировать возбудитель, сменить ампициллин на цефотаксим+аминогликозид. 1. 2. Инфузионная терапия Позволяет восполнить дефицит ОЦК, провести коррекцию электролитных расстройств. 1. 3. Иммунотерапия: антистафилококковый иммуноглобулин в/в; нормальный иммуноглобулин человека («Биофарма», «Sandos») в/в, в/м. 1. 4. Противогрибковая терапия (флуконазол) 8. Неонатальный сепсис: профилактика Необходим контроль за течением беременности, соблюдением женщиной режима, рациональное питание для поддержания нормальной функции иммунной системы. При выявлении гнойновоспалительных заболеваний у будущей мамы требуется своевременное комплексное лечение. Обязательно строгое соблюдение санитарно-эпидемического режима в родильных домах. Малейшее изменение состояния новорожденного, появление местных очагов воспаления на коже в области пупочной ранки, дисфункция кишечника, отит требуют очень внимательного наблюдения и адекватного лечения для того, чтобы не допустить трансформации так называемых «малых гнойных инфекций» в септическое состояние. 9.Неонатальные инфекции кожи и подкожно-жировой клетчатки Неонатальные инфекции кожи: везикулопустулез Часто встречающееся заболевание новорожденных, характеризующееся воспалительными изменениями в области устьев эккриновых потовых желез. Заболевание связывают с котнаминацией ребенка стафилококками. На коже ягодиц, бедер, естественных складок головы появляются мелкие (2-3мм) поверхностно расположенные пузырьки, наполненные вначале прозрачным, а затем и мутным содержимым. Течение доброкачественное. Пузырьки лопаются через 2-3 дня с момента появления. Образовавшиеся вследствие этого маленькие эрозии покрываются сухими корочками, не оставляющими после отпадения рубцов или пигментации. Для лабораторной диагностики используют бактериологическое исследование содержимого пузырьков и крови для идентификации возбудителя и определения чувствительности к антибактериальным препаратам. В общем анализе крови в ряде случаев можно обнаружить лейкоцитоз, нейтрофилез. 10. Неонатальные инфекции кожи: пузырчатка (пемфигус) Острое контагиозное заболевание. Характерно быстрое образование вялых пузырей (фликтен). Выделяют доброкачественную и злокачественную форму пузырчатки. Возбудителями чаще являются стафилококки и стрептококки. Доброкачественная форма, характеризуется появлением на фоне эритематозных пятен пузырьков и небольшого размера пузырей (до 0,5-1см в диаметре), наполненных серозно-гнойным содержимым. Пузыри имеют незначительно инфильтрированное основание, вокруг пузыря отмечается венчик гиперемии. Локализуется в нижней половине живота, около пупка, на конечностях, естественных складках. Симптом Никольского отрицательный. После вскрытия пузырей появляются эрозии. Характерно, что на месте бывших пузырей корки не образуются. Состояние может быть не нарушено или среднетяжелое. Злокачественная форма пузырчатки характеризуется появлением на коже большого количества вялых пузырей, преимущественно больших размеров – до 2-3 см в диаметре. Симптом Никольского положительный. Состояние тяжелое, выраженный симптом интоксикации. Заболевание не редко заканчивается сепсисом. Лабораторная диагностика включает бактериологическое исследование содержимого пузырей и крови с определением чувствительности выявленных возбудителей к антибиотикам. В клиническом анализе крови лейкоцитоз с нейтрофилезом и сдвигом лейкоцитарной формулы влево до юных форм. Увеличение СОЭ, иногда анемия. 11. Неонатальные инфекции кожи: эксфолиативный дерматит Риттера Заболевание представляет собой злокачественную форму пемфигуса. Вызывается госпитальными штаммами золотистого стафилококка, продуцирующим экзотоксин – эксфолиатин. Начинается с появления покраснения, мокнутия кожи и образования трещин в области пупка, паховых складок, вокруг рта. В течение нескольких часов яркая эритема распространяется на кожу живота, туловища, конечностей. На различных участках тела появляются вялые пузыри, наблюдается слущивание эпидермиса, оставляющее обширные эрозии. Симптом Никольского положительный. Тело новорожденного имеет вид обожженного кипятком. На фоне заболевания возникают другие очаги гнойной инфекции, развивается сепсис. Для определения этиологии заболевания проводят бактериологическое исследование крови и отделяемого из пузырей с антибиотикограммой. Для гемограммы характерна анемия, лейкоцитоз, нейтрофилез, сдвиг лейкоцитарной формулы влево, увеличение СОЭ. 12. Неонатальные инфекции кожи: псевдофурункулез Заболевание представляет собой инфицирование выводного протока потовой железы. Возбудитель – золотистый стафилококк, гемолитический стрептококк, кишечная палочка, протей. Наиболее частая локализация кожа волосистой части головы, задняя поверхность шеи, кожа спины, ягодиц, конечностей. Характерно появление подкожных узлов размером 1-1,5см багровокрасного цвета. В дальнейшем в центре узлов появляется гнойное содержимое. Типична интоксикация. Лабораторная диагностика включает бактериологическое исследование крови и гноя, антибиотикограмму. В гемограмме регистрируется лейкоцитоз, нейтрофилез со сдвигом лейкоцитарной формулы влево, повышение СОЭ, возможно появление токсической зернистости нейтрофилов. 13. Неонатальные инфекции кожи и подкожножировой клетчатки: гнойный мастит новорожденных Острое воспаление грудной железы, осложнение физиологического нагрубания грудных желез. Возбудитель – стафилококк. Путь проникновения инфекции – через поврежденную кожу и выводные протоки кожных желез, либо гематогенным путем. Клинически проявляется увеличением одной грудной железы, еѐ инфильтрацией. Пальпация сопровождается болезненностью. Затем гиперемия кожи над железой усиливается, появляется флюктуация. Выражены симптомы интоксикации. Из выводных протоков грудной железы при надавливании или спонтанно появляется гнойное отделяемое. Заболевание опасно метастатическими гнойносептическими осложнениями. Лабораторная диагностика включает микробиологическое исследование гнойного содержимого для идентификации возбудителя, клинический анализ крови. 14. Дифференциальный диагноз неонатальной инфекции кожи и подкожной клетчатки у новорожденных Заболевания: Признаки: Пузырчатка новорожденных (пемфигус) Эксфолиативный дерматит Риттера Везикуло- Псевдо- пустулѐз фурункулѐз Пузырьки, гнойнички; после их вскрытия – корочки, не оставляющие рубцов Плотные багровокрасного цвета узлы без стержня, может быть флюктуация Морфо-логический субстрат Вялые пузыри, после их Гиперемия, вялые вскрытия – эрозии, пузыри, эрозии эпителизация без корочек Окружающие ткани Инфильтри-рованное основание пузырей, венчик гиперемии по краю Пузыри на фоне яркой Венчик гиперемии эритемы и мокнутия, по краю везикул и трещины, обширные пустул эрозии кожи Узлы в коже и подкожной клетчатке без четкого отграничения Размер элемента от 0,5-1 см, до 2-3 см Разные 1–3 мм до 1-1,5 см Наиболее частая локализация Шея, паховая область, Начинается с кожи паховых складок, вокруг рта, пупка; в дальнейшем распространяется на всю кожу туловища, Волосистая часть Волосистая часть головы, бѐдра, головы, шея, спина, ягодицы ягодицы живот конечностей Симптом Никольского Интоксикация Повышение СОЭ, лейкоцитоз, нейтрофилез При доброкач. форме – Положительный отрицат.; при злокачественной – может быть положительный. Отрицат. Отрицат. При доброкач. форме - Выраженная Обычно незначительная, при (септический вариант отсутствует. злокач. - выраженная. пемфигуса). Выраженность зависит от количества элементов. Характерны Характерны Характерны Нет 15. Неонатальные инфекции кожи и подкожно-жировой клетчатки. Принципы лечения. Везикулопустулез и пузырчатка (доброкачественная форма) Местное лечение: обрабатывать пораженные участки кожи 4% водным р-ром хлоргексидина и просушивать стерильными марлевыми тампонами, пока пустулы/пузыри не исчезнут. Если у ребенка меньше 10 пустул/пузырей или они распространены менее чем на половину тела и отсутствуют признаки сепсиса, местная обработка элементов на протяжении 5 суток. Необходимо обеспечить ежедневное наблюдение за ребенком. Если пустулы/пузыри исчезают через 5 дней и отсутствуют другие причины для госпитализации, ребенка можно выписать домой. Антибактериальная терапия. 1. Если через 5 дней местной обработки элементов большинство пустул/пузырей еще остаются и у ребенка отсутствуют клинические признаки сепсиса, следует назначить цефуроксим перорально, в дозировке соответствующей возрасту и массе тела ребенка. 2. Если у ребенка 10 и больше пустул/пузырей, либо они занимают больше половины тела и у ребенка отсутствуют признаки сепсиса, необходимо продолжать местную обработку элементов и назначить цефуроксим внутримышечно в дозе соответствующей возрасту и массе тела. Обеспечить ежедневное наблюдение за ребенком. Исследовать бак.посев крови и общий анализ крови. Если пустулы /пузыри через 3 дня лечения антибиотиками не распространяются и подсыхают, продолжить лечение цефуроксимом до полных 5-ти суток терапии. 3. Если нет положительной динамики со стороны пустул/пузырей после 3 дней лечения цефуроксимом и получен положительный ответ на наличие возбудителя, следует изменить антибиотик с учетом чувствительности и использовать новый антибиотик на протяжении 5 дней. Если пустулы/пузыри сохраняются после 3 дней лечения антибиотиками и не удалось идентифицировать возбудитель, продолжать применять цефуроксим и назначить дополнительно гентамицин на протяжении 7 дней. 4. Если у ребенка с пустулами/пузырями присутствуют симптомы сепсиса (см. раздел лечение неонатального сепсиса). Псевдофурункулез Антибиотик в/м: цефалоспорины II поколения: цефуроксим; цефалоспорины III поколения: цефотаксим, цефтазидим. Иммуноглобулин человеческий, иммуноглобулин антистафилококковый. Местное лечение: после появления флюктуации показано хирургическое лечение. Пузырчатка новорожденных (злокачественная форма), эксфолиативный дерматит Риттера Местное лечение: пузыри проколоть, обработать 1 % (0,5 %) раствором перманганата калия, физиологическим раствором с добавлением 0,1 % нитрата серебра, 4 % водным раствором хлоргексидина; при обильных мокнутиях – присыпка с окисью цинка; Антибактериальная терапия, инфузионная терапия, специфическая иммунотерапия (см. лечение сепсиса). 16. Неонатальные инфекции. Омфалит: определение, этиология патогенез Омфалит – это воспаление дна пупочной ранки, пупочного кольца, подкожно-жировой клетчатки вокруг пупочного кольца, пупочных сосудов. Этиология. Выделяют грамположительные микроорганизмы (стафилококки, стрептококки), грамотрицательные (кишечная палочка, протей, синегнойная палочка и др.). Анаэробы являются причиной гангрены пупочного канатика. Патогенез. Возбудитель проникает в ткани, прилежащие к пупку, после хирургической обработки пуповинного остатка, вызывая продуктивное, гнойное или некротическое воспаление. Инфекция распространяется и фиксируется в пупочных сосудах. Катетеризация пупочной вены у новорожденных увеличивает частоту возникновения флебитов. Распространение воспаления приводит к развитию флегмоны в области пупка. При тромбофлебите пупочной вены инфекционный процесс по воротной вене может перейти во внутрипеченочные ее разветвления с образованием гнойных очагов по ходу вен, даже после заживления пупочной ранки. 17. Неонатальные инфекции. Омфалит. Клиническая картина. В зависимости от клинических проявлений выделяют: катаральный омфалит – наличие серозного или геморрагического отделяемого; гнойный омфалит – наличие гнойного отделяемого; гангренозный омфалит: некроз и отторжение тканей вокруг пуповинного остатка/ранки, с образованием большой язвы; поражение пупочных сосудов – флебит и артериит. Наиболее частая и прогностически благоприятная форма заболевания– катаральный омфалит (мокнущий пупок). На пупке возникает длительно не заживающая гранулирующая рана со скудным серозным отделяемым. Состояние ребенка удовлетворительное. Периодически ранка покрывается коркой; грануляции могут разрастаться избыточно (продуктивное воспаление), образуя выпячивания грибовидной формы (фунгус пупка). Через несколько дней на фоне мокнущего пупка возникает гнойное отделяемое из пупочной ранки, отек и гиперемия пупочного кольца (гнойный омфалит). Флегмонозный омфалит возникает в результате распространения воспалительного процесса на околопупочную область. Отмечается отек, инфильтрация тканей, гиперемия кожи, иногда расширение вен передней брюшной стенки. Состояние больного нарушено, ребенок вял, срыгивает. Снижена или отсутствует прибавка массы тела, кожа бледная или бледно-серая, температура повышена до фебрильных цифр. При тромбофлебите пупочной вены пальпируется эластичный тяж над пупком. При тромбоартериите пупочные артерии пальпируются ниже пупочного кольца радиально. Кожа над пораженными сосудами отечна и гиперемирована. При легких массирующих движениях от периферии пораженного сосуда к пупочному кольцу на дне пупочной ранки появляется гнойное отделяемое. Гангрена пупочного канатика (пуповинного остатка), развивается в первые дни жизни. Мумификация пуповинного остатка приостанавливается, он становится влажным, приобретает грязно-бурый оттенок и неприятный гнилостный запах. Как правило, отмечается развитие сепсиса. Местная инфекция пупочной ранки: пупок красный или припухший; покраснение и припухлость кожи распространяется меньше, чем на 1 см. за пределы пупка Тяжелая инфекция пупка: кожа вокруг пупка покраснела и припухла; покраснение и припухлость кожи распространяется более чем на 1 см. за пределы пупка; из пупка выделяется гной; неприятный запах из пупочной ранки; вздутие живота 18. Омфалит. Данные дополнительных методов обследования. В гемограмме при тяжелых формах омфалита определяется нейтрофилез со сдвигом лейкоцитарной формулы влево до юных форм, возможно повышение СОЭ. Бактериальное исследование крови и отделяемого из пупочной ранки позволяет уточнить этиологию, а проведение антибиотикограммы – назначить адекватную этиотропную терапию. Инструментальные исследования: при длительном мокнутии пупочной ранки проводят зондирование для исключения свищей. Флебит, тромбоартериит пупочных сосудов диагностируют с помощью УЗИ. 19. Омфалит: дифференциальный диагноз Симптомы Вид омфалита Катаральный (мокнущий пупок) Срок эпителизации пупочной ранки Поздний Гнойный Гангренозный (некротический) Поздний Поздний Вид пупочной ранки и Может быть легкая гиперемия и окружающих тканей инфильтрация пупочного кольца Гиперемия и отек пупочного кольца, инфильтрация подкожножировой клетчатки вокруг него Красно-цианотичный оттенок кожи вокруг пупка, некроз и отторжение тканей околопупочной области Отделяемое Гнойное Гнойное Флебит пупочной вены Нет Может быть Характерен Интоксикация Не характерна Характерна Выраженная Повышение СОЭ, лейкоцитоз, нейтрофилез Не характерны Характерны Значительные Серозное (серозногеморрагическое) 20. Омфалит. Принципы лечения Лечение местной инфекции: пуповинный остаток/ранку следует промывать антисептическим раствором (4% р-р хлоргексидина), высушивать стерильными марлевыми тампонами, 4 раза в день, пока пупок не подсохнет; при фунгусе – прижигание грануляций 5% р-ром нитрата серебра; если покраснение кожи распространяется больше, чем на 1 см. за пределы пупка, или через две недели от начала лечения местные проявления омфалита усилились, переходят к схеме лечения тяжелой инфекции пупка. Лечение тяжелой инфекции пупка: немедленная госпитализация; назначить оксациллин в комбинации с аминогликозидами или цефалоспоринами II поколения (Цефуроксим)+аминогликозид внутривенно; при флегмонозном омфалите и гангрене пупочного канатика показано хирургическое лечение; местное лечение пупочной ранки. НЕОНАТАЛЬНЫЕ ЖЕЛТУХИ 1. Гемолитическая болезнь новорождѐнных: определение, эпидемиология Гемолитическая болезнь новорождѐнных (ГБН) – это гемолитическая неонатальная желтуха, которая обусловлена иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам. По отношению к количеству родов частота гемолитической болезни новорожденных составляет от 1:150 до 1: 400. 2. ГБН: ЭТИОПАТОГЕНЕЗ ГБН чаще развивается по системе «резус» (Rh, D) или «АВ0». Причиной развития ГБН по резус-системе является резус-отрицательная мать и резусположительный плод, по системе АВО - мать с группой крови 0(I), плод – с группой крови А(II). К факторам, способствующим возникновению ГБН, относятся: аборты, выкидыши, последующие беременности и роды, гемотрансфузии, пересадка органов и тканей, проявление ГБН у предыдущих детей. При резус-несовместимости после 16-18 недель беременности эритроциты ребѐнка с антигеном (Rh-фактор) через плаценту попадают в организм матери, где к нему вырабатываются антитела. Образовавшиеся резус- антитела проходят через плаценту в организм плода, связываются с резус-рецепторами на мембране эритроцитов, что приводит к их гемолизу . В момент родов антитела поступают в кровь плода в большом количестве, так как резко нарушаются барьерные свойства плаценты. Основным повреждающим фактором при ГБН является токсическое действие непрямого (свободного, неконьюгированного) билирубина на различные органы. Ведущее клиническое значение имеет повреждение ядер основания мозга (гиппокампа, стриарного тела, мозжечка). При высоких уровнях билирубина происходит гибель клеток, и развивается «ядерная» желтуха – необратимое поражение нервной системы. Критический уровень билирубина для развития «ядерной» желтухи – более 320 мкмоль/л у доношенных, более 170 мкмоль/л у недоношенных. 3. КЛАССИФИКАЦИЯ ГБН 1. 1. врождѐнная (внутриутробная); постнатальная (у новорождѐнного). 1. 2. По виду серологического конфликта: ГБН, связанная с несовместимостью по резус-фактору. ГБН, связанная с несовместимостью по групповым факторам системы АВ0. ГБН, связанная с несовместимостью по другим факторам крови. 1. 3. По сроку возникновения: По клинической форме: анемическая; желтушная; отѐчная; внутриутробная смерть плода. 1. 4. По степени тяжести: лѐгкая; средне-тяжѐлая; тяжѐлая. 1. 5. Осложнения: «ядерная» желтуха; билирубиновая энцефалопатия; синдром холестаза; токсический гепатит; геморрагический синдром; миокардиодистрофия; надпочечниковая недостаточность. 4. КЛИНИЧЕСКАЯ КАРТИНА ГБН Желтушная форма ГБН 1. Синдром гемолиза: желтушное окрашивание кожных покровов и слизистых; бледность; спленомегалия. 2. Синдром билирубиновой интоксикации: вялость; снижение мышечного тонуса; снижение аппетита, вплоть до отказа от еды; срыгивания, рвота; ослабление рефлексов периода новорождѐнности; Отечная форма ГБН Крайне тяжелое состояние с момента рождения Резкая бледность (иногда с иктеричным оттенком). Общие отеки (периферические, полостные). Гепатоспленомегалия. Расширение границ сердца, глухость тонов. Анемическая форма ГБН Обычно проявляется на 1-3-й неделе жизни. Клинические симптомы: бледность кожных покровов и слизистых, увеличение печени, селезенки 5. ГБН: ДАННЫЕ ДОПОЛНИТЕЛЬНЫХ МЕТОДОВ ИССЛЕДОВАНИЯ При ГБН наблюдаются следующие отклонения в данных дополнительных методов обследования: - анемия; - ретикулоцитоз; - нормоцитоз, может быть эритробластоз; - непрямая гипербилирубинемия; - гипопротеинемия; положительная реакция Кумбса (еѐ модификация – «желатиновая» проба). Прямая реакция Кумбса выявляет антитела, фиксированные на поверхности эритроцитов, непрямая – в сыворотке крови. Формула для определения почасового прироста билирубина: Вn2 – Вn1 n Вn1- содержание билирубина при предыдущем исследовании Вn2- содержание билирубина при повторном исследовании n - количество часов между исследованиями Формула для определения почасового прироста билирубина (если не известен билирубин пуповинной крови): Вn-50,0 n «n» - число часов жизни; «Вn» - билирубин через «n» часов 50,0 - нормальные значения билирубина в пуповинной крови 6. СТЕПЕНИ ТЯЖЕСТИ ГБН Степени тяжести: Симптомы Нв (в первые часы после рождения), г/л: лёгкая Более 140 средне-тяжёлая 140-100 тяжёлая Менее 100 Билирубин (в пуповинной Менее 60 крови), мкмоль/л: Появление желтухи 60-85 Более 85 После 5 часов 1-х суток До 5 часов 1-х суток при При рождении или при резус-конфликте и резус-конфликте или до 11 отѐчная форма ГБН после 11 часов– при АВ0- часов при АВ0-конфликте конфликте 7. ГБН: ОСЛОЖНЕНИЯ При ГБН развиваются следующие осложнения: Билирубиновая энцефалопатия – острое (обратимое) поражение центральной 1. 1. нервной системы у новорождѐнных с желтухой. Обычно первые проявления диагностируются на 3-6-й день жизни: нарастают признаки билирубиновой интоксикации. 1. 2. «Ядерная» желтуха – хроническое (необратимое) поражение центральной нервной системы у новорожденных с желтухой. В развитии отмечается несколько периодов: 1)нарастание симптомов билирубиновой интоксикации (3-6 день жизни); 2)появление классических признаков «ядерной» желтухи (конец 1-й – начало 2-й недели): ü ригидность затылочных мышц, опистотонус; ü выбухание большого родничка; ü периодическое возбуждение ü резкий «мозговой» крик; ü положительные симптомы «заходящего солнца» и Грефе; ü исчезновение рефлекса Моро, сосательного рефлекса; ü прогрессирующее ухудшение неврологической симптоматики. 3)период мнимого благополучия (начиная с середины 2-й недели жизни), когда создаѐтся впечатление, что обратное развитие неврологической симптоматики может привести к почти полной реабилитации ребѐнка; 4)период формирования клинической картины неврологических осложнений начинается в конце периода новорождѐнности или на 3–5-м месяце жизни: ü атетоз, ü параличи, парезы; ü глухота; ü детский церебральный паралич; ü задержка психического развития; ü дизартрия и др. 3. Синдром холестаза («сгущения жѐлчи») – обтурация желчных протоков густой желчью у новорождѐнных с высоким уровнем билирубина. Клиническая картина: ü нарастание желтухи, ü гипохоличный стул, ü моча насыщенная, цвета пива, ü высокий уровень прямого билирубина в сыворотке крови, ü большое количество желчных пигментов в моче. 8. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА НЕОНАТАЛЬНЫХ ЖЕЛТУХ Физио-логическая Фетальный гепатит желтуха Атрезия жѐлчных протоков Конъюгационная желтуха Время появления С рождения, желтухи в 1-е сутки 2-3 сутки С рождения 2-3 сутки 2-3 сутки Динамика желтухи Исчезает к 14 дню у доношенных и к 21 дню у недоношенных Уменьшается на фоне лечения; может быть гибель больного от печѐночной комы Нарастает; без лечения дети погибают от цирроза печени Не исчезает к 14 дню у доношенных и к 21 дню у недоношенных Симптомы Есть билируби-новой интоксикации Нет Есть Есть Могут быть Печень, селезѐнка Увеличение селезенки Норма Гепатомегалия, Гепато-мегалия печень очень плотная, болезненная, с бугристой поверхностью и заострѐнными краями Норма Окраска кала и мочи Нормальные, при Норма синдроме холестаза – ахоличный кал, моча цвета пива Ахоличный кал, моча Ахоличный кал, цвета пива моча цвета пива Норма Билирубин Повышен за счѐт непрямой фракции Повышен за счѐт Повышен за счѐт непрямой фракции прямой фракции Повышен за счѐт прямой фракции Повышен за счѐт непрямой фракции Транс-аминазы Норма Норма Резко повышены Норма Норма Белок крови Может быть снижен Норма Норма Норма Норма Желчные пигменты Реакция отрицательная Реакция отрицательная Резко положительная Резко положительная Реакция отрицательная Прямая проба Кумбса Положительная. Отрицательная Отрицательная Отрица-тельная Симптомы ГБН (желтушная форма) Уменьшается на фоне терапии до полного исчезновения Отрицательная 9. ГБН: принципы лечения ПРИНЦИПЫ ЛЕЧЕНИЯ ГБН Диета. Обеспечить частоту кормления грудью не менее 8-12 раз в сутки, без ночного перерыва. В случае, если проводилось заменное переливание крови, кормить начинают через 6-8 часов сцеженным грудным молоком с частотой 8-12 раз в сутки. Лечение ГБН может быть консервативное и оперативное Консервативное лечение 1.Фототерапия. Является наиболее эффективным методом лечения желтушной форм ГБН. Проводится лампами синего, голубого, зеленого цвета с длиной волны 450-470 нм, что приводит к превращению в коже токсического изомера билирубина в его нетоксическую водорастворимую форму, которая выводится почками. Фототерапию начинают сразу после появлени желтухи и проводят непрерывно (за исключением кормления ребенка) в течение не менее 12-24 часов под контролем уровня билирубина в крови. При неэффективности фототерапии в течении 4-6 часов при нарастании почасового билирубина проводится заменное переливание крови (см. «Показания к заменному переливанию» ). 2.Стабилизация клеточных мембран (вит.А, Е, АТФ, 5% глюкоза). 3.Активация коньюгационной системы печени (фенобарбитал). 4.Желчегонные препараты (12,5% сернокислая магнезия) 5.Сорбенты (смекта, карболен) 6.Дезинтоксикационная терапия. Объем жидкости для инфузии рассчитывают с учетом возрастной потребности ребенка (в 1-е сутки 60-70 мл/кг, ежедневно увеличивают на 20 мл/кг до 150 мл/кг к 57 дню). Состав инфузионной терапии: 5-10% глюкоза, 5-10% альбумин (при его снижении в крови). 7.Очистительные клизмы в первые часы жизни (для выведения билирубина из кишечника) 8.Назначение препаратов рекомбинантного эритропоэтина (при сохранении анемии на 2-3 неделе жизни). Оперативное лечение ГБН - заменное переливание крови (ЗПК), плазмаферез, гемосорбция. Показания к заменному переливанию крови: отѐчная форма; анемия в первые сутки (Нв < 100 г/л, Нt < 35%); билирубин в пуповинной крови более 80 мкмоль/л; почасовой прирост билирубина более 7 мкмоль/л (несовместимость по резус-фактору), более 10 мкмоль/л (несовместимость по системе АВО) появление симптомов билирубиновой энцефалопатии Для заменного переливания крови используют кровь: - при резус-конфликте: группа крови ребѐнка, но Rh-отрицательную; - при АВ0-конфликте: эритромасса 0(I) группы, Rh-отрицательная, в плазме АВ (IV) группы; - обьем крови 160 мл/кг у доношенных, 180-190 мл/кг у недоношенных. 10. ГБН: профилактика 1. Определение в крови беременной жнщины резус- антител или аллогемаглютининов в динамике 2. Определение концентрации билирубиноподобных веществ в околоплодных водах (амниоцентез) при титре резус-антител в крови беременной 1:16 – 1:32 и более 3. УЗИ плода в динамике (диагностика отечной формы) 4. Предупреждение абортов 5. Проведение гемотрансфузий девочкам только по жизненным показаниям 6. Введение всем женщинам с резус-отрицательной принадлежностью крови в 1-й день после родов или аборта анти-D-глобулина (способствует быстрому выведению эритроцитов ребенка из кровотока матери, предотвращая синтез резус-антител) 7. Проведение беременным с высоким титром антирезус-антител неспецифического лечения (глюкоза, кокарбоксилаза, витамины), плазмафереза, родорезрешения на 37-39-й неделе путем кесарева сечения АСФИКСИЯ НОВОРОЖДЕННЫХ. ПЕРИНАТАЛЬНЫЕ ПОРАЖЕНИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ 1. Асфиксия новорожденных: определение, эпидемиология. Асфиксия при рождении (Приказ МЗ Украины № 194 от 2003 г.) – отдельная нозологическая форма, которая характеризуется клиническими проявлениями неврологической и кардиореспираторной депрессии с возможным развитием энцефалопатии и полиорганной недостаточности; лабораторными последствиями воздействия гипоксии на плод до или во время родов (ацидоз). Частота рождения детей в асфиксии 1-1,5%. 2. Этиопатогенез асфиксии новорожденных Основные причины возникновения асфиксии новорожденных: 1) недостаточная гемоперфузия материнской части плаценты (артериальная гипо- и гипертензия матери, чрезмерно активные схватки и т.д.); 2) гипоксемия и гипоксия матери (анемия беременных, заболевания легких и сердца и т.д.); 3) патология плаценты с нарушением в ней газообмена (предлежание, преждевременная отслойка плаценты и т.д.); 4) прерывание кровотока через пуповину (сдавление пуповины, обвитие пуповиной и т.д.); 5) патологические состояния плода, которые приводят к недостаточности дыхательных усилий: врожденные пороки ц.н.с., сердца, легких; внутриутробные инфекции; гемолитическая болезнь новорожденных; недоношенность; незрелость; родовые травмы и т.д. 6) наркомания, токсикомания, алкоголизм, табакокурение матери; Основные звенья патогенеза асфиксии: 1) Гипоксемия, гиперкапния, ацидоз, которые приводят к централизации кровообращения в пользу жизненно важных органов (сердце, мозг, надпочечники, диафрагма); 2) накопление недоокисленных продуктов обмена, прежде всего в ишемизированных тканях (легкие, печень, почки), что усугубляет ацидоз; 3) образование большого количества цитокинов, которым принадлежит ведущая роль в развитии нарушений гемодинамики, гемостаза, микроциркуляции; 4) активация каскада плазменных протеаз, что приводит к повреждению мембран клеток, повышению сосудистой проницаемости, формированию сладж–феномена и блокаде микроциркуляции, вплоть до ДВС-синдрома; 5) децентрализация кровообращения, гемодинамический коллапс, полиорганная недостаточность. 3. Классификация асфиксии новорожденных 1. Асфиксия средней тяжести (умеренная). 2. Асфиксия тяжелая. 4.Клиническая картина асфиксии новорожденных КЛИНИЧЕСКИЕ КРИТЕРИИ АСФИКСИИ НОВОРОЖДЕННЫХ Критерии Асфиксия тяжелая Асфиксия средней тяжести (умеренная) Оценка по шкале Апгар в течении первых 5 минут жизни < 4 б. Поражение ЦНС, возникшие в первые 72 часа жизни Тяжелое (энцефалопатия Умеренное (энцефалопатия 3 ст.) 1–2 ст.) 4 – 6 б. Поражение других органов (сердце, Хотя бы одного легкие и др.), возникшие в первые 72 часа жизни Хотя бы одного Оценка по шкале Апгар не может быть единственным критерием асфиксии. Диагноз асфиксии при рождении может быть установлен в течении первых 3-х дней жизни. ШКАЛА АПГАР Признак Баллы 0 1 2 Сердцебиение отсутствует менее 100 в мин. более 100 в мин. Дыхание отсутствует отдельные судорожные вздохи регулярное и спокойное дыхание атония полусогнутые руки и ноги (поза «лягушки») физиологическая поза новорождённого отсутствует легкая гримаса крик, чихание, Мышечный тонус Рефлекторная раздражимость кашель Цвет кожных покровов общая бледность или общий цианоз рук, ног, лица, цианоз розовое туловище весь ребёнок розовый Здоровый новорождѐнный имеет оценку по шкале Апгар 7-10 баллов. 5. Асфиксия новорожденных: данные дополнительных методов исследования ЛАБОРАТОРНЫЕ КРИТЕРИИ АСФИКСИИ НОВОРОЖДЕННЫХ Критерии Тяжелая Средней тяжести (умеренная) рН пуповинной крови рН < 7,0 рН < 7,15 Лабораторные: Неспецифические, отражают тяжелые нарушения со стороны органов и систем. Инструментальные: НСГ: гиперэхогенность подкоркових структур головного мозга, поражение паренхимы головного мозга, билатеральные кисты, перивентрикулярная лейкомаляция. КТ, МРТ: билатеральные кисты, признаки сопутствующих заболеваний. ЭЭГ: снижение фоновой биоэлектрической активности головного мозга. 6. Асфиксия новорожденных: дифференциальная диагностика Дифференциальную диагностику проводят с внутриутробной инфекцией, внутричерепной и спинальной родовой травмой, врожденными пороками сердца, острой надпочечниковой недостаточностью. 7. Принципы лечения асфиксии новорожденных 8. Профилактика асфиксии новорожденных Ранняя диагностика внутриутробной гипоксии плода. Лечение внутриутробной гипоксии плода (витамино-глюкозотерапия, средства, улучшающие маточно-плацентарный кровоток). 9. Родовые травмы: определение Родовые травмы – это механическое повреждение целостности тканей и органов во время родов. 10. Родовые травмы: этиопатогенез. Предрасполагающими факторами возникновения родовой травмы могут быть: несоответствие размеров костного таза матери и головы плода (малые размеры костного таза женщины, крупный плод: стремительные (менее 2 час.) или затяжные (более 12 час.) роды; неправильно выполняемые акушерские пособия; переношенность; ягодичное и другие аномальные предлежания плода. Родовая травма, внутриутробная гипоксия, асфиксия в родах часто сочетаются, при этом последние могут быть одним из патогенетических механизмов возникновения родовых травм. Так, для ребенка, перенесшего хроническую внутриутробную гипоксию, биомеханизм нормальных родов может оказаться травматическим, поэтому в таких случаях прибегают к родоразрешению путем кесарева сечения. 11. Классификация родовых травм у новорождённых: 1. 2. 3. 4. 5. родовая травма головного мозга; родовая травма спинного мозга; родовая травма черепных и периферических нервов; родовая травма мягких тканей и костей; родовая травма внутренних органов. Наиболее тяжелым проявлением родовых травм является родовая травма головного мозга. Родовая травма головного мозга (внутричерепная родовая травма) – это неонатальное поражение мозга, при котором ведущим этиологическим фактором является травма в родах. Внутричерепная родовая травма сопровождается внутричерепными кровоизлияниями. Классификация внутричерепных кровоизлияний (по локализации): 1. эпидуральные; 2. субдуральные: субтенториальные; супратенториальные; 1. 2. 3. 4. паренхиматозные (внутримозговые, геморрагический инфаркт); субарахноидальные; внутримозжечковые; внутрижелудочковые. Классификация поражений нервной системы у новорождённых Этиология (доминирующий фактор): 1. гипоксия; асфиксия; 2. 3. 4. 5. 6. 7. травма; инфекция; интоксикация; врождѐнные нарушения метаболизма; хромосомные абберации; неуточнѐнные состояния. Степени тяжести: 1. Лѐгкая; 2. Средней тяжести; 3. Тяжѐлая. Период болезни: - острый (до 10 дней); - подострый (ранний восстановительный) до 4 месяцев; - поздний восстановительный (4-12 месяцев, иногда до 2 лет); - период остаточных явлений (после 2-х лет). Клинические синдромы. 1. Острый период: - повышение нервно-рефлекторной возбудимости; - общего угнетения; - гипертензионный; - гидроцефальный; - судорожный; - коматозное состояние. 2. Восстановительный период: - астеноневротический; - вегето-висцеральных дисфункций; - двигательных нарушений; - эпилептический; - гидроцефальный; - задержка психомоторного развития. Возможные исходы: 1. выздоровление; 2. задержка психофизического и речевого развития; 3. энцефалопатия, проявляющаяся: - рассеянными очаговыми микросимптомами; - умеренной внутричерепной гипертензией; - гидроцефалией; - астеноневротическим синдромом, психопатическими и неврозоподобными состояниями; - грубые органические формы поражения с олигофренией и др. 12. Клиническая картина родовых травм нервной системы ЭПИДУРАЛЬНОЕ КРОВОИЗЛИЯНИЕ Характерна периодичность клинических симптомов: «светлый промежуток» - 3-6 часов; синдром сдавления мозга через 6-12 часов после рождения (судороги, расширение зрачка на стороне поражения, гемипарез на противоположной стороне); при нарастании гематомы может быть кома через 24-36 часов после рождения (патологическое дыхание, апноэ, брадикардия). СУБДУРАЛЬНОЕ КРОВОИЗЛИЯНИЕ Субдуральное кровоизлияние может быть: супратенториальным и субтенториальным. 1. Субдуральное супратенториальное кровоизлияние: может быть период «мнимого благополучия» (2-4 дня); гипертензионно-гидроцефальный синдром (беспокойство, выбухание родничка, ригидность мышц затылка, расхождение черепных швов, симптом Грефе, расширение зрачка на стороне гематомы, судороги); по мере нарастании гематомы может быть кома 1. Субдуральное субтенториальное кровоизлияние. С момента рождения состояние очень тяжелое. Нарастают симптомы сдавления ствола мозга: ригидность мышц затылка, анизокория, нистагм, плавающие движения глазных яблок, фиксированный взгляд, поза опистотонуса, прогрессирование дыхательных и сердечнососудистых нарушений, судороги. Чаще всего наступает летальный исход. СУБАРАХНОИДАЛЬНОЕ КРОВОИЗЛИЯНИЕ Клинические симптомы могут появляться сразу или через несколько дней после родов. Преобладают признаки общего возбуждения (беспокойство, «мозговой» крик, гиперестезия, усиление рефлексов периода новорожденности, повышение мышечного тонуса). Прогрессируют симптомы гипертензионно-гидроцефального синдрома. Родовые травмы спинного мозга ПАРАЛИЧ ДИАФРАГМАЛЬНОГО НЕРВА Травма спинного мозга на уровне СIII–СIV приводит к развитию синдрома дыхательных расстройств: одышка, приступы цианоза, аритмичное дыхание. При осмотре – асимметрия грудной клетки, парадоксальное дыхание. При аускультации – ослабление дыхания на стороне поражения. ПАРАЛИЧ ДЮШЕНА-ЭРБА (верхний, проксимальный) Травма спинного мозга на уровне СV–СVI приводит к снижению или отсутствию активных движений и мышечного тонуса в проксимальных отделах конечности, отсутствию рефлекса Моро. Движения в кисти сохранены, рефлекс Робинсона (хватательный) сохранен. ПАРАЛИЧ ДЕЖЕРИН-КЛЮМПКЕ (нижний, дистальный) Травма спинного мозга на уровне СVII–ThI приводит к снижению или отсутствию движений кисти и пальцев (вид «когтистой» или «тюленей» лапки). Рефлекс Робинсона отсутствует, рефлекс Моро снижен. ТОТАЛЬНЫЙ ПАРАЛИЧ ВЕРХНЕЙ КОНЕЧНОСТИ Присутствуют симптомы дистального и проксимального параличей, типичен симптом «шарфа». 13. Родовые травмы: данные дополнительных методов исследования При внутричерепных кровоизлияниях нейросонография малоинформативна. При компьютерной томографии выявляется высокой эхогенности образование в месте гематомы. При тотальном, проксимальном и дистальном параличах при электромиографии отсутствует спонтанная биоэлектрическая активность в пораженных мышцах. При параличе диафрагмального нерва рентгеноскопия грудной клетки выявляет высокое стояние и релаксацию купола диафрагмы на пораженной стороне. 14. Родовые травмы: дифференциальная диагностика Родовую травму головного мозга дифференцируют с пороками развития нервной системы, внутриутробными инфекциями, постнатальными нейроинфекциями. Дифференциальную диагностику параличей верхних конечностей проводят с переломом ключицы, остеомиелитом, пороками развития спинного мозга. 15. Принципы лечения родовых травм нервной системы ВСКАРМЛИВАНИЕ НОВОРОЖДЁННЫХ К временным противопоказаниям для прикладывания к груди относятся: асфиксия < 5 баллов; родовая черепно-мозговая травма. Эти дети получают парентеральное питание, минимальное трофическое питание. Если асфиксия ≥ 5 баллов: через 6 – 12 часов после рождения, дают сцеженное грудное молоко ложкой или пипеткой (после пробы с дистиллированной водой). Число кормлений: 7 – 8 раз в сутки. Прикладывание к груди производится не ранее 3 – 5-го дня, начиная с одного кормления. МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ Проводится посиндромная терапия. ЛЕЧЕНИЕ ТРАВМ СПИННОГО МОЗГА Основная цель – предупреждение контрактур (физиотерапия, упражнения с пассивными движениями). 16. Профилактика родовых травм - предупреждение преждевременных родов; - оптимальное ведение родов; - профилактика внутриутробной гипоксии плода; - профилактика респираторного дистресс-синдрома Рахит. Спазмофилия. Гипервитаминоз Д 1. Рахит. Определение. Рахит – заболевания детей раннего возраста, в основе которого лежат недостаточность витамина Д в организме, нарушения минерального и других видов обмена веществ, в результате чего имеют место расстройства формирования скелета, функций внутренних органов и систем. 2. Рахит. Этиопатогенез. Основной причиной у детей является гиповитаминоз витамина Д экзогенного или эндогенного происхождения. Экзогенные причины: недостаточное поступление витамина Д с пищей; недостаточное поступление кальция и фосфора в организм ребенка; недостаточное пребывание ребенка на свежем воздухе и недостаточная инсоляция. Эндогенные причины: нарушение всасывания витамина Д, кальция и фосфора в кишечнике (при синдроме мальабсорбции, обструкции желчевыводящих путей); нарушение преобразования витамина Д в активную форму (при заболеваниях печени и почек); нарушение всасывания соединений фосфора и кальция в кишечнике, их повышенное выведение с мочой и нарушение утилизации костной тканью; отсутствие и нарушение функциональной активности рецепторов к витамину Д. Дефицит витамина Д уменьшает реабсорбцию фосфора в канальцах почек, повышает выделение фосфора из организма, что приводит к уменьшению количества фосфора в крови (гипофосфатемии). Поэтому снижение фосфора в крови более ранний симптом, чем снижение кальция. Гипофосфатемия компенсаторно приводит к отщеплению фосфора из миелиновых оболочек нервной ткани и из АТФ мышечной ткани. Страдают миелиновые оболочки, из-за чего нарушаются процессы возбуждения, а затем и торможения. В мышечной ткани нарушается энергетический обмен, снижается тонус мышц. Клинически это проявляется возбуждением, потливостью, мышечной гипотонией. Дефицит витамина Д снижает синтез кальций-связывающего белка Вследствие этого уменьшается всасывание кальция в кишечнике, в крови возникает гипокальциемия, которая стимулирует гиперпродукцию паратгормона в паращитовидных железах. При дефиците витамина Д паратгормон стимулирует выведение неорганического кальция из кости, что приводит к остеомаляции. Такие кости легко искривляются под тяжестью тела. Вымывание кальция из кости приводит к остеопорозу. Нарушается образование матрицы кости, происходит дополнительное образование остеоидной ткани без отложения в ней фосфора и кальция – гиперплазия остеоидной ткани. Одновременно замедляется рост костей в длину – гипогенез (гипоплазия) костной ткани. Паратгормон нарушает всасывание фосфора и кальция в кишечнике, уменьшает реабсорбцию фосфора и аминокислот в канальцах почек. Это приводит к снижению уровня белка в крови – уменьшается щелочной резерв крови, развивается ацидоз, который вызывает расстройства микроциркуляции. Это приводит к нарушению обмена, функциональным, а затем и морфологическим изменениям внутренних органов. При ацидозе развивается дистония вегетативной нервной системы с преобладанием ваготонии. Недостаточность витамина Д уменьшает образование цитратов (т.е. лимонной кислоты из пировиноградной). Они улучшают переход кальция на границе кость – кровь. 3. Рахит. Классификация. Период Степень тяжести Течение Клинические варианты -начальный I (легкая) Острое Кальцийпенический -разгара II (средней тяжести) Подострое Фосфорпенический -реконвалесценции Без значительных отклонений содержания кальция и фосфора в крови III (тяжелая) Рецидивирующее -остаточных явлений 4. Рахит. Клинические проявления Признаки остеомаляции Размягчение краев родничка размягчение чешуи затылочной кости с последующим уплощением затылка. Краниотабес «Куриная грудь», «грудь сапожника» податливость и деформация грудной клетки с вдавливанием в нижней трети грудины или выбуханием Гаррисонова борозда втяжение по ходу прикрепления диафрагмы. Плоскорахитический таз искривление нижних конечностей под воздействием мышц сгибателей или разгибателей. X- и O-образные ноги Признаки остеоидной гиперплазии Гиперплазия лобных, теменных бугров «квадратная» голова «Рахитические четки» шарообразные утолщения на ребрах в месте перехода хрящевой ткани в костную. «Рахитические браслеты» утолщение в области лучезапястного сустава. «Нити жемчуга» утолщения в области межфаланговых суставов на руках. Признаки гипогенеза костной ткани Позднее закрытие родничков и швов Несвоевременное и неправильное прорезывание зубов в норме малый родничок закрывается к 3-м месяцам, а большой – к 1-1,5 годам. Замедление роста трубчатых костей Характеристика степеней тяжести рахита Рахит легкой степени тяжести Рахит средней степени тяжести Тяжелый рахит изменения со стороны костной системы. поражение костей в двух или даже в переломы по типу «зеленой трех отделах скелета, внутренних веточки» (поднадкостничный органов, изменения в анализе крови. перелом). - изменения вегетативной нервной системы слабо выражены: - изменения вегетативной системы - значительные нарушения нервной, умеренно выражены; костной и других систем: повышенная потливость, ухудшение заторможенность, задержка сна, раздражительность, - умеренные изменения развития статических беспокойство, снижение аппетита, костной системы: реберные функций, выраженные костные деформации, выраженное снижение возможны диспепсические явления. "четки", гарисонова борозда, деформация грудины, расширение мышечного тонуса, разболтанность нижней апертуры грудной клетки, суставов, увеличение печени, - изменения со стороны костной искривления позвоночника - кифоз селезенки, нарушения со стороны системы слабо сколиоз, "О ", "Х" - образные нижние сердечно-сосудистой, дыхательной, выражены: краниотабес, конечности, снижение двигательной пищеварительной, кровеносной деформация костей черепа активности, систем - умеренные изменения мышечной, кровеносной, сердечно-сосудистой, пищеварительной систем: умеренное увеличение печени, селезенки, гипотония мышц, связочного аппарата, разболтанность суставов, увеличение живота, наличие анемии. Характеристика периодов рахита: Начальный: имеются признаки поражения нервной и мышечной систем, уровень кальция в сыворотке крови в норме, фосфор снижен. Разгара: признаки поражения костной системы, внутренних органов, крови, кальций и фосфор снижены. Реконвалесценции: восстанавливаются функции пораженных систем, уровень кальция в сыворотке снижен, уровень фосфора нормальный. Остаточных явлений: могут быть костные деформации, увеличение печени, селезенки, анемия. Уровни кальция и фосфора в сыворотке крови - в норме. Обычно этот период наблюдается в 2-3 года. Характеристика течения рахита: Острое шестой месяцы жизни. Подострое – преобладают симптомы гиперплазии остеоидной ткани. Чаще всего отмечается со второго полугодия жизни. Рецидивирующее – после периода реконвалесценции появляются симптомы начального периода. – преобладают симптомы остеомаляции. Чаще всего отмечается со второго по 5. Рахит. Данные дополнительных методов обследования. снижение содержания общего кальция, неорганического фосфора, повышение активности щелочной фосфатазы в сыворотке крови; повышение уровня паратгормона, снижение уровня кальцитонина и содержания транспортной формы витамина Д3 в сыворотке крови; на рентгенограмме трубчатых костей – расширение метафизов, остеопороз, особенно в зоне энхондрального окостенения, эпифиз по типу блюдца или чашки. снижение уровня гемоглобина в клиническом анализе крови; 6. Рахит. Принципы лечения. Медикаментозные Дополнительные Препараты витамина Д Препараты кальция, магния, оротовой кислоты, карнитина хлорида, АТФ, витамины (Е, гр. В,С) Соблюдение режима дня и санитарно-гигиенического режима. Естественное вскармливание, при невозможности адаптированные смеси. Через 2 недели от начала медикаментозного лечения назначить ванны: солевые (для детей малоподвижных, пастозных), хвойные (преимущественно возбудимым детям), травяные, общий массаж, лечебная гимнастика Лечебное назначение витамина Д3 Степень тяжести Рахит I Начало приема вит. Д3 Суточная доза Длительность приема витамина Д3 С момента заболевания 2000 МЕ В течение 30-45 дней. В дальнейшем для предупреждения обострений и рецидивов болезни по 2000 МЕ в течение 30 дней 2-3 раза в год с интервалами между ними не менее 3 месяцев до 3-5 летнего возраста. Рахит II 4000 МЕ Рахит III 5000 МЕ 7. Рахит. Профилактика. Начало приема вит. Д3 Суточная доза Длительность приема витамина Д3 Антенатальная профилактика Здоровые беременные С 28-32 нед. беременности Беременные из группы риска С 28-32 нед. беременности Ежедневно в течение 6-8 нед. 500 МЕ 1000-2000 МЕ Ежедневно в течение 8 нед. Постнатальная профилактика Здоровые доношенные С 1 месячного возраста 500 МЕ Ежедневно на протяжении 3-х лет (курсовая доза на год 180000 МЕ), дети (на 2-м месяце) Недоношенные дети С 2–3 нед. жизни исключают весенне-летние месяцы. 500-1000 МЕ (I ст. недоношенности) -“- 1000-2000 МЕ (II-III ст. недоношенности) 8. Спазмофилия. Определение. Спазмофилия - заболевание, характеризующееся склонностью ребенка первых 6-18 месяцев жизни к судорогам и спастическим состояниям, которые патогенетически связаны с рахитом. Наблюдается чаще весной при повышенной инсоляции. 9. Спазмофилия. Этиопатогенез. Причинами данной патологии чаще всего является длительное нахождение ребенка с открытыми участками тела на весеннем солнце или при одномоментном приеме большой дозы витамина Д (более редкая причина). В коже образуется или через желудочно-кишечный тракт поступает большое количество витамина Д. Быстро, почти внезапно увеличивается выработка активных метаболитов витамина Д. Это подавляет функцию паращитовидных желез, усиливает всасывание кальция и фосфора в кишечнике и реабсорбцию их и аминокислот в почечных канальцах. Из-за этого повышается щелочной резерв крови и развивается алкалоз, гипофосфатемия, которая была при рахите, сменяется гиперфосфатемией. Основная функция активных метаболитов витамина Д – перевести кальций из крови в кость. Кальций начинает усиленно откладываться в костях и его уровень в крови падает до критического. Гипокальциемия, алкалоз повышают судорожную готовность ребенка и возбудимость его нервной и мышечной систем. Спровоцировать спазм или клонико-тонические судороги могут сильные эмоции, испуг, длительный плач, смех, высокая температура, рвота, присоединение сопутствующего заболевания. 10. Спазмофилия. Классификация. 1. Явная форма: ларингоспазм; карпопедальный спазм; эклампсия. 1. Латентная (скрытая) форма. 11. Спазмофилия. Клиническая картина. Ларингоспазм – остро наступающее сужение голосовой щели, сопровождается бледностью, затрудненным дыханием или хриплым вдохом с последующим шумным дыханием. При полном закрытии головой щели ребенок синеет, пугается, «ловит воздух ртом», покрывается холодным потом. Возможна потеря сознания на короткое время. Через несколько секунд слышен шумный вдох, постепенно дыхание восстанавливается. Карпопедальный спазм - тоническое сокращение мышц кистей и стоп. Конечности согнуты в крупных суставах, плечи прижаты к туловищу, кисти опущены, пальцы собраны в кулак или в виде «руки акушера». Стопы в положении подошвенного сгибания, пальцы поджаты («конская стопа»). Эклампсия - проявляется приступом клонико-тонических судорог, охватывающих всю произвольную и непроизвольную мускулатуру. Приступ начинается подергиванием мимических мышц лица, затем присоединяются судороги конечностей, ригидность мышц затылка, возникают ларингоспазм и расстройства дыхания, появляется общий цианоз. Сознание утрачивается, появляется пена на губах, непроизвольные мочеиспускания и дефекация. Латентная (скрытая) форма. Латентная спазмофилия имеет место гораздо чаще явной и обычно предшествует ей. Внимание врача должны привлекать повышенная активность ребенка, периодический тремор подбородка и конечностей, подергивание отдельных групп мышц. При наличии данных признаков необходимо проверить следующие симптомы: 1. симптом Хвостека – при поколачивании пальцем или молоточком по скуловой дуге (в местах выхода лицевого нерва) происходит подергивание угла глаза и угла рта. 2. симптом Труссо – появление «руки акушера» при сдавливании в области сосудистонервного пучка на плече у двуглавой мышцы. 3. симптом Люста – подошвенное сгибание стопы и отведение ее в сторону при поколачивании в месте выхода малоберцового нерва у головки малоберцовой кости. 4. симптом Маслова - кратковременная остановка дыхания во время укола (например, при инъекции). 12. Спазмофилия. Данные дополнительных методов обследования. электролиты крови: гипокальциемия, гиперфосфатемия КОС крови - алкалоз. 13. Спазмофилия. Принципы лечения. 1. Препараты кальция вначале в/в, затем внутрь. 2. Противосудорожные: седуксен в/м, аминазин в/м, ГОМК в/в – при появлении судорожного синдрома. 3. Витамин Д3 – через 5-7 дней! 14. Спазмофилия. Профилактика. Первичная профилактика включает предупреждение, раннюю диагностику и адекватное лечение рахита. Вторичная профилактика направлена на своевременное выявление и лечение скрытых форм болезни, 15. Гипервитаминоз Д. Определение. Гипервитаминоз Д – заболевание, обусловленное гиперкальциемией, токсическими изменениями и/или кальцинозом в органах и тканях вследствие передозировки витамином Д или индивидуальной повышенной чувствительностью к нему. 16. Гипервитаминоз Д. Этиопатогенез. Повышается всасывание витамина Д в кишечнике и развивается гиперкальциемия и гиперкальциурия. Кальций откладывается в стенках сосудов, в первую очередь – почек и сердца, и развивается необратимый кальциноз внутренних органов. Повышается реабсорбция фосфора в проксимальных канальцах почек под воздействием и развивается гиперфосфатемия. Позднее развивается поражение почек и нарушается функция канальцев почек. 17. Гипервитаминоз Д. Классификация. Течение Степень тяжести Острое Период Начальный Хроническое Легкая Средней тяжести Разгар Реконвалесценции (остаточных явлений) Тяжелая 18. Гипервитаминоз Д. Клиническая картина. Острое течение развивается чаще у детей первого полугодия жизни при 1. 1. массивном приѐме витамина Д в течение относительно короткого времени (2-10 нед.) или проявляется почти с самого начала введения препарата в дозах, близких к физиологическим (при непереносимость витамина Д). При остром течении появляются признаки кишечного токсикоза или нейротоксикоза: снижается аппетит, часто наблюдается рвота, возникает обезвоживание. Температура тела нередко поднимается до субфебрильных цифр. Ребенок становится вялым, сонливым, может потерять сознание. Кожа бледная, тургор снижен, мышечная гипотония. Стул может быть неустойчивым или жидким. Проба Сулковича положительная. 2. 2. Хроническое течение возникает на фоне длительного применения препарата (6-8 месяцев), в умеренных дозах, но превышающих физиологическую потребность организма ребѐнка (600000 – 1000000 ЕД) и характеризуется: симптомами хронической интоксикации: анорексия, повышение температуры тела, серый цвет кожи, жажда (поражение питьевого центра), запор; симптомы внутреннего кальциноза: - поражение ЦНС – беспокойство, судороги, параличи; поражение сердечно-сосудистой системы – приглушенность тонов сердца, расширение границ сердца, систолический шум; кальциноз коронарных сосудов; - поражение почек – изменения в моче; нефрокальциноз, уролитиаз; - поражение костной системы – краниостеноз. 19. Гипервитаминоз Д. Данные дополнительных методов исследования. анализ крови: гиперкальциемия; анализ мочи: проба Сулковича +++, ++++. 20. Гипервитаминоз Д. Принципы лечения. Диетотерапия. 1. Исключить продукты, богатые кальцием (творог), витамином Д (желток, печень). 2. Ограничить коровье молоко (каши на овощном отваре). Медикаментозная терапия. 1. Немедленное прекращение приема препаратов витамина Д3 и кальция! 2. Дезинтоксикационная терапия путем использования в/в капельной инфузии; 3. Преднизолон – в тяжелых случаях. 4. Гипокальциемические препараты. 21. Гипервитаминоз Д. Профилактика. Профилактика гипервитаминоза Д заключается в точном соблюдении правил и инструкций по применению лекарственных форм витамина Д; индивидуальном подходе к назначению этого препарата; контроле дозировок витамина Д (определение кальция в моче пробой Сулковича 1 раз в неделю). ЗАБОЛЕВАНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ У ДЕТЕЙ (ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА, МАЛЫЕ АНОМАЛИИ РАЗВИТИЯ СЕРДЦА) 1. Врожденные пороки сердца: определение, эпидемиология. Врожденный порок сердца – это патологическое состояние, характеризующееся аномалиями положения, морфологических структур сердца, магистральных сосудов, которые изменяют условия внутрисердечной гемодинамики и создают предпосылки для развития недостаточности кровообращения. По данным ВОЗ, распространенность врожденных пороков сердца среди новорожденных составляет от 0,7-1%. 2. Врожденные пороки сердца: этиопатогенез. Причины развития врожденных пороков сердца: – хромосомные нарушения; – мутация одного гена; – факторы внешней среды: алкоголизм родителей, табакокурение женщин во время беременности, влияние вирусных инфекций (краснуха у беременной женщины), воздействие лекарственных препаратов (амфетамины); – наследственная (полигенно-мультифакториальная предрасположенность). Факторы риска развития врожденных пороков сердца: – возраст родителей (мать старше 35 лет, отец старше 45 лет); – гестоз I триместра беременности, угроза прерывания беременности; – мертворождения в анамнезе; – наличие в семье других детей с врожденными пороками развития и др. Патогенез В результате воздействия вышеуказанных причин на плод в период 2-8 недели беременности развиваются нарушения эмбриогенеза – формируются аномалии клапанного аппарата, перегородок, стенок сердца и/или магистральных сосудов. Эти структурные нарушения могут изменять условия внутрисердечной гемодинамики и приводить к развитию недостаточности кровообращения. 3. Врожденные пороки сердца: классификация. КЛАССИФИКАЦИЯ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА У ДЕТЕЙ (по характеру нарушения гемодинамики) Нарушение гемодинамики Без цианоза С обогащением малого круга кровообращения Открытый артериальный проток, С обеднением малого круга кровообращения Изолированный стеноз легочной артерии дефект межпредсердной перегородки, дефект межжелудочковой перегородки С цианозом Комплекс Эйзенменгера, транспозиция магистральных сосудов Болезнь Фалло, атрезия трехстворчатого клапана С обеднением большого круга кровообращения Коарктация аорты Без нарушения гемодинамики Декстрокардия Изолированный аортальный стеноз Болезнь Толочинова-Роже 4. Открытый артериальный проток: гемодинамика. Артериальный (боталлов) проток – физиологический кровеносный сосуд, который соединяет начальную часть нисходящей дуги аорты с легочной артерией в месте ее бифуркации и функционирует внутриутробно. У большинства новорожденных открытый артериальный проток прекращает функционировать в первые часы или дни после рождения. Анатомическая облитерация протока заканчивается к 6-8 неделе внеутробной жизни. Открытый артериальный проток считается врожденным пороком сердца, если он продолжает функционировать более 3-4-й недели после рождения ребенка. Гемодинамика порока зависит от разницы давления в аорте и легочной артерии. После рождения, после первого вдоха легочное сопротивление падает и поднимается давление в аорте, что способствует возникновению левоправого (артериовенозного) сброса из аорты в легочную артерию. Поэтому порок «белый», без цианоза. Сброс происходит и во время систолы и во время диастолы, т.к. в обе эти фазы давление в аорте превышает давление в легочной артерии. Этот сброс крови приводит к переполнению малого круга кровообращения. Увеличенный объем крови через легочные вены попадает в левое предсердие, затем в левый желудочек, вызывая их дилатацию и гипертрофию. Осложнения порока: в области протока может развиться инфекционный эндокардит («боталлит»), аневризма, кальциноз. 5. Открытый артериальный проток: клиническая картина. Обследование Симптомы Жалобы Одышка, быстрая утомляемость, плохая переносимость физических нагрузок. Анамнез Повторные бронхиты, пневмонии. Пальпация Систоло-диастолическое дрожание во II межреберье слева у грудины. Артериальное давление Высокое пульсовое давление (систолическое повышено, диастолическое снижено). Перкуссия Расширение границ сердца влево и вверх, расширение зоны Герхардта. Аускультация Тоны Акцент II тона на легочной артерии. Шум 2 межреберье слева у грудины, «машинный», систоло-диастолический, проводится в левую подключичную область, межлопаточное пространство. 6. Открытый артериальный проток: данные дополнительных методов обследования. Обследование Данные Рентгенограмма органов грудной клетки Расширение сердца влево и вверх, расширение сосудистого пучка, выбухание легочной артерии, усиление легочного рисунка ЭКГ Признаки гипертрофии левых отделов сердца. Допплер-ЭхоКГ Систолический поток в легочной артерии на 7. Открытый артериальный проток: дифференциальная диагностика. Дифференциальный диагноз проводится с дефектом межжелудочковой перегородки, дефектом межпредсердной перегородки, недостаточностью аортального клапана. 8. Открытый артериальный проток: лечение. Существует два метода лечения открытого артериального протока: 1) консервативный 2) оперативный 1) Консервативный (медикаментозный) метод. Применение ингибиторов синтеза простагландинов (индометадин внутривенно). Проводится в родильном доме в первые две недели жизни ребенка. Оперативный метод – основной. 2) Показание к операции: факт наличия порока у ребенка после 6-12 месяцев жизни. Можно оперировать в любом возрасте, оптимальный возраст 2-5 лет. Методы закрытия протока: - перевязка протока или пересечение с ушиванием обоих его концов; катетерная эндоваскулярная окклюзия (применение боталлоокклюзера(чрезкожным доступом через бедренную артерию). При наличии хронической сердечной недостаточности проводится ее лечение. 9. Дефект межпредсердной перегородки: гемодинамика. Дефекты межпредсердной перегородки – это группа врожденных пороков сердца, для которых характерно наличие аномального сообщения между двумя предсердными камерами. В зависимости от степени нарушения строения межпредсердной перегородки (отсутствия первичной, вторичной или обеих перегородок) выделяют: первичные, вторичные дефекты и полное отсутствие межпредсердной перегородки (общее предсердие) В основе гемодинамических нарушений при дефекте межпредсердцой перегородки лежит артериовенозный сброс крови из левого предсердия в правое. Это приводит к гиперволемии малого круга кровообращения и формированию легочной гипертензии, а также развитию дилатации и гипертрофии правых отделов сердца. 10. Дефект межпредсердной перегородки: клиническая картина. Проявления порока зависят от величины дефекта. Обследование Симптомы Жалобы Одышка, быстрая утомляемость, сердцебиение при физической нагрузке. Анамнез Повторные бронхиты, пневмонии. Пальпация Может быть систолическое дрожание справа от грудины Перкуссия Расширение границ сердца вправо. Аускультация: Тоны Акцент и раздвоение II-го тона на легочной артерии. Шум 2-3 межреберье слева у грудины, систолический, проводится в левую подключичную область. 11. Дефект межпредсердной перегородки: данные дополнительных методов обследования. Обследование Данные Рентгенограмма органов грудной клетки Расширение границ сердца вправо, выбухание дуги легочной артерии, усиление легочного рисунка. ЭКГ Признаки гипертрофии правых отделов сердца, блокада правой ножки пучка Гиса. Допплер-ЭхоКГ Визуализируется перерыв эхо- сигнала в месте дефекта межпредсердной перегородки, артерио-венозный сброс на уровне предсердий. 12. Дефект межпредсердной перегородки: дифференциальный диагноз. Проводится с дефектом межжелудочковой перегородки, открытым артериальным протоком. 13. Дефект межпредсердной перегородки: лечение. Основной метод лечения дефекта межпредсердной перегородки – хирургическая коррекция порока. Операция может проводиться в любом возрасте, оптимальный возраст 5-12 лет. Коррекция дефекта не проводится 1) детям без признаков нарушения гемодинамики 2) детям с выраженной легочной гипертензией (наличием веноартериального шунта). Хирургическая коррекция порока заключается в ушивании небольших дефектов или закрытии больших дефектов заплатой из биологической (аутоперикард) или синтетической ткани. 14. Дефект межжелудочковой перегородки: гемодинамика. Дефект межжелудочковой перегородки – это врожденное аномальное сообщение между желудочками сердца, возникшее вследствие недоразвития межжелудочковой перегородки на разных еѐ уровнях. В зависимости от этого дефекты могут возникать в области мембранозной части перегородки, в гладкомышечной и трабекулярной частях мышечной перегородки, а также в месте стыка различных еѐ частей. В основе нарушения гемодинамики при дефекте межжелудочковой перегородки лежит артериовенозный сброс крови из левого желудочка в правый. Это приводит к гиперволемии малого круга кровообращения и формированию легочной гипертензии, перегрузке левого предсердия, левого желудочка, правого желудочка, их дилатации и гипертрофии. Размер дефекта перегородки определяет величину лево-правого сброса крови. При больших дефектах развиваются фибросклеротические изменения стенок сосудов легких, высокая необратимая легочная гипертензия, изменяется направление сброса крови на право-левый, появляется цианоз (формируется вторичный комплекс Эйзенменгера). При небольших дефектах в мышечной части межжелудочковой перегородки сброс крови незначительный, нарушений гемодинамики не происходит. Малая величина отверстия в перегородке обусловливает основной клинический симптом порока – грубый, скребущий систолический шум в IV-V межреберье слева у грудины (болезнь Толочинова-Роже). 15. Дефект межжелудочковой перегородки: клиническая картина. Проявления порока зависят от величины дефекта. Обследование Симптомы Жалобы Одышка, быстрая утомляемость. Анамнез Повторные бронхиты, пневмонии. Осмотр Может быть центральный сердечный горб. Пальпация Систолическое дрожание, максимально выраженное в III-IV межреберье слева у грудины. Перкуссия Расширение границ сердца во все стороны. Аускультация: Тоны Акцент и расщепление II тона на легочной артерии. Шум 3-4 межреберье слева у грудины, систолический, проводится по всей предсердечной области и на спину. 16. Дефект межжелудочковой перегородки: дополнительные методы исследования. Обследование Данные Рентгенограмма органов грудной клетки Расширение сердца в поперечнике, выбухание дуги легочной артерии, усиление легочного рисунка. ЭКГ Признаки гипертрофия левых и правых отделов сердца. Допплер-ЭхоКГ Визуализируется эхо-свободное пространство в межжелудочковой перегородке, аномальный кровоток через дефект. 17. Дефект межжелудочковой перегородки: дифференциальный диагноз. Дифференциальный диагноз проводится с дефектом межпредсердной перегородки, открытым артериальным протоком. 18. Дефект межжелудочковой перегородки: лечение. Основной метод лечения – хирургическая коррекция порока. Можно оперировать в любом возрасте, оптимальный возраст 5-9 лет. Показания к операции: отсутствие тенденции к спонтанному закрытию малых пороков к 3-4 годам жизни; появление признаков легочной гипертензии; рефрактерная к терапии сердечная недостаточность; значительное отставание в физическом развитии, нарастание тяжести анемии; осложнение порока рефрактерным к терапии инфекционным эндокардитом. Хирургическая коррекция порока заключается в ушивании небольших дефектов или закрытии больших дефектов заплатой из биологической (аутоперикард) или синтетической ткани. При наличии недостаточности кровообращения проводится еѐ терапия. 19. Хроническая сердечная недостаточность: лечение. ДИЕТОТЕРАПИЯ до 1 года: Н0 - по возрасту. НI и НIIA суточный объем равен 2/3 нормы, число кормлений увеличивается на 1, кормить сцеженным грудным молоком НIIБ и НIII суточный объем равен 1/2 нормы, число кормлений увеличивается на 2, кормить сцеженным грудным молоком. после 1 года: НI – исключают продукты, богатые хлористым натрием; НIIA – ограничивают применение натрия хлорида до 2-4 г в сутки и количество жидкости до 600-800 мл в сутки; НIIБ и НIII - ограничивают применение натрия хлорида до 1-1,5 г в сутки (на 7 дней) и количество жидкости до 600-800мл в сутки; При всех степенях нарушения кровообращения увеличивают количество продуктов, богатых калием (изюм, курага, бананы, печеный картофель). ЛЕЧЕНИЕ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Препараты Н0 НI НIIA Ингибиторы ангиотензин превращающего фермента - - Каптоприл внутрь. Сердечные гликозиды - - Дигоксин внутривенно, внутрь Диуретики - - Фуросемид или Верошпирон внутрь Кардиометаболические препараты НIIБ НIII Лазикс внутривенно,внутрь + Верошпирон внутрь Кардонат, L-карнитина хлорид, милдронат, рибоксин, панангин, аспаркам, АТФ-лонг. ЗАБОЛЕВАНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ У ДЕТЕЙ (ОСТРАЯ РЕВМАТИЧЕСКАЯ ЛИХОРАДКА, НЕРЕВМАТИЧЕСКИЕ КАРДИТЫ, ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ) 1. Острая ревматическая лихорадка. Определение. Острая ревматическая лихорадка (ОРЛ) - системное воспалительное заболевание соединительной ткани с преимущественной локализацией процесса в сердечно-сосудистой системе, развивающееся в связи с острой стрептококковой инфекцией (стрептококк группы А) у предрасположенных к нему лиц. 2. Острая ревматическая лихорадка. Этиопатогенез. Этиологическим фактором ОРЛ является β-гемолитический стрептококк группы А. Заболевание развивается через 2-3 недели после перенесенной инфекции ЛОР-органов (ангины, скарлатины, фарингита). Наиболее часто болеют дети в возрасте 7-15 лет. Характеризуется наследственной предрасположенностью. Прямое токсическое действие стрептококковых экзотоксинов (стрептолизины О и S, гиалуронидаза, протеиназы, дезоксирибонуклеаза). Концепция молекулярной мимикрии образующиеся в ответ на антигены стрептококка антитела реагируют с аутоантигенами пациента: миозином, синовиальной оболочкой, мозговой оболочкой, кровеносных сосудов. Особое значение имеет наличие у стрептококка М-протеина, который обладает свойствами суперантигена, индуцирующего эффект гипериммунного аутоиммунитета. Воспалительный процесс при ОРЛ характеризуется поражением и дезорганизацией основного вещества соединительной ткани и сосудов микроциркуляторного русла. В большинстве случаев реакция носит неспецифический альтеративно-экссудативный характер. Это приводит к обратимым изменениям соединительной ткани в форме мукоидного набухания. При более глубоком поражении соединительной ткани в ней появляются уже необратимые очаги фибриноидного некроза. Вокруг очагов фибриноидного некроза возникает воспалительная реакция пролиферативного типа в виде специфических ревматических гранулем Ашоффа—Талалаева, которые через 4-6 месяцев склерозируются. Пролиферативный характер воспаления наблюдается главным образом в оболочках сердца, в результате чего развиваются порок сердца и миокардиосклероз. 3. Острая ревматическая лихорадка. Классификация. Классификация ревматической лихорадки (АРР, 2003) Клинические варианты Клинические проявления основные дополнительные Острая ревмати- Кардит Лихорадка ческая лихорадка Артрит Артралгии Хорея Повторная ревматическая лихорадка Стадия КСВ* NYHA** 0 0 I I IIA II без порока сердца *** IIБ III порок III IV Выздоровление Хроническая ревматическая болезнь Абдоминальный синдром сердца: Кольце-видная Серозиты эритема Ревмати-ческие Исход узелки сердца **** *** возможно наличие поствоспалительного краевого фиброза клапанных створок без регургитации, которые уточняется с помощью ЭхоКГ. **** при наличии впервые выявленного порока сердца необходимо, по возможности, исключить другие причины его формирования (инфекционный эндокардит, первичный антифосфолипидный синдром, кальциноз клапанов дегенеративного генеза и др.). Классификация и номенклатура ревматизма (Нестеров А.И., 1964). Клинико-анатомическая характеристика поражения Фаза Активная: I, II, III степени актив-ности сердца Неактив-ная других систем а) ревмокардит первичный без - полиартрит; порока - хорея; б) ревмокардит - ревмати-ческие возвратный с пороком узелки; в) ревматизм без явных сердечных изменений а) миокардиосклероз Течение острое; Н0 подострое; Н1 затяжное; Н2А непрерывно- анулярная эритема; рецидивирующее; - серозиты; латентное - пневмония и др. б) порок сердца 4. Острая ревматическая лихорадка. Клиническая картина. Диагностические критерии ОРЛ: Большие критерии: кардит; полиартрит; малая хорея; кольцевидная эритема; подкожные ревматические узелки. Малые критерии: клинические: ü предварительный ревматизм или ревматическая болезнь сердца; ü артралгии; ü лихорадка. параклинические: ü показатели острой фазы воспаления; Нед. кровообращ. Н2Б Н III ü скорость оседания эритроцитов; ü С-реактивный белок; ü лейкоцитоз; ü удлинение интервала P-R на ЭКГ. Данные, подтверждающие наличие стрептококковой инфекции: повышение титров антистрептококковых антител - антистрептолизина-О (АСЛ-О), антистрептокиназы, антистрептогиалуронидазы; o o обнаружение при посеве из зева стрептококков группы А; недавно перенесенная скарлатина. Наличие 2 больших критериев и признаков перенесенной стрептококковой инфекции или 1 большого, 2 малых и признаков предшествующей стрептококковой инфекции позволяет поставить диагноз острой ревматической лихорадки. Ревматическая атака развивается в течение месяца после начала ангины, скарлатины или фарингита. Обычно между окончанием инфекции и появлением первых признаков ревматизма наблюдается «светлый промежуток» продолжительностью 1-2 недели. Клиническая картина характеризуется появлением лихорадки и симптомов общей интоксикации. I. Ревмокардит представляет собой наиболее характерное, наряду с артритом, проявление ОРЛ. В подавляющем большинстве случаев клинические признаки ревмокардита возникают в течение 2-3 недель после развития артрита, а характер их зависит от степени поражения различных оболочек сердца. Наиболее часто встречается сочетание эндо- и миокардита. 1. 1. Ревматический миокардит (очаговый или диффузный): Жалобы: колющие, ноющие или ангинозные боли в области сердца, часто иррадиирующие в левую руку; перебои в работе сердца, одышка и сердцебиения при физической нагрузке; нередко субъективные проявления ревмокардита выявляются только при целенаправленном расспросе либо вообще отсутствуют; Физикальное обследование на ранней стадии заболевания: лабильность пульса и тахикардия, которая непропорциональна лихорадке, сохраняется во время сна и при улучшении общего состояния больного; o у некоторых больных может иметь место брадикардия; o при аускультации над верхушкой сердца нередко выслушиваются ослабление I тона, а также негромкий и негрубый систолический шум, отличающийся от систолического шума o при эндокардите; в случае выраженного миокардита может определяться расширение границ сердца. На ЭКГ: блокады (АВ блокада I, реже — II или III степени, синоатриальная, ножек пучка Гиса); миграция водителя ритма, эктопические предсердные или узловые ритмы; экстрасистолия и нарушения фазы реполяризации в виде уплощения или инверсии зубца Т в сочетании с депрессией сегмента S-Т; o удлинение интервала P-R. 1. 2. Эндокардит - может привести к формированию клапанного порока сердца. Ревматический эндокардит характеризуется воспалительным поражением главным образом митрального и аортального клапанов (ревматический вальвулит), что проявляется динамикой соответствующих сердечных шумов. Сам по себе изолированный эндокардит не сопровождается какими-либо субъективными кардиальными проявлениями. Чаще всего формируется недостаточность митрального клапана, второе место занимает комбинированный митральный порок, третье место изолированная аортальная недостаточность. При поражении митрального клапана - над верхушкой сердца довольно выраженный, продолжительный, дующий систолический шум митральной регургитации. Он занимает не менее 2/3 систолы, примыкает к I тону, убывающей формы. Шум проводится в подмышечную ямку и существенно не изменяется при дыхании, перемене положения тела, а после физической нагрузки он даже усиливается. В течение суток систолический шум митральной регургитации определяется как стойкий, однако при исследовании в динамике на ранней стадии заболевания его интенсивность, продолжительность и другие характеристики нарастают. При вовлечении в патологический процесс аортального клапана над аортой выявляется тихий, дующий протодиастолический шум аортальной регургитации, который может быть непостоянным и лучше выслушивается в третьем межреберье у левого края грудины (точка Боткина-Эрба), после глубокого выдоха и при наклоне больного вперед. 1. 3. Перикардит возникает лишь у отдельных больных ОРЛ, чаще всего у детей и главным образом при повторных атаках ревматизма. Встречается: сухой (фибринозный) пеникардит; экссудативный (серозно-фибринозный) перикардит. Проявляется он болями в области сердца или за грудиной, одышкой, шумом трения перикарда. Существенное значение для диагностики перикардита имеет ультразвуковое исследование сердца, которое позволяет выявить даже незначительный выпот в полости перикарда. Диагностические критерии перикардита при ОРЛ. Симптомы Фибринозный перикардит Жалобы Перкуссия Экссудативный перикардит Интенсивные боли в сердце, рвота, может быть боль в животе Границы сердца не меняются Расширение границ сердца в обе стороны Тоны сердца Звучные Глухие Шум Трения перикарда слышен сразу Трения перикарда появляется при рассасывании экссудата Рентген Границы сердца не меняются Расширение сердца в обе стороны, сердце имеет вид треугольника или трапеции, сердечно-диафрагмальные синусы заполнены Аускультация: ЭКГ Смещение интервала ST Особые симптомы - Общее снижение вольтажа Положение с наклоном вперед или коленно-локтевое. Симптомы переполнения верхней полой вены (отек лица). Симптомы переполнения нижней полой вены (отеки на голенях, увеличение печени). II. Ревматический артрит — наиболее частое проявление ревматизма, особенно при его первой атаке. Морфологический субстрат этого поражения связан с реактивным воспалением синовиальной оболочки сустава без вовлечения в патологический процесс суставного хряща и кости. В патологический процесс одновременно вовлекается несколько крупных и средних суставов нижних и, реже, верхних конечностей. Редко наблюдается моноартрит и поражение мелких суставов кистей и стоп. Воспалительные изменения в суставах развиваются быстро, в течение нескольких часов, и они ярко выражены: припухлость периартикулярных тканей суставов, кожа над ними гиперемирована, горячая на ощупь; пальпаторно над всей областью пораженных суставов определяется болезненность; признаки скопления выпота в суставной полости обычно отсутствуют; движения в пораженных суставах значительно ограничены из-за резкой артралгии, которая не изменяет своей интенсивности в течение суток, однако не сопровождается утренней скованностью; нередко отмечается «летучесть» ревматического артрита: в течение 1-3 суток в одних суставах явления воспаления полностью исчезают, а в других - появляются; у некоторых больных воспалительное поражение суставов характеризуется резко выраженной «летучей» полиартралгией без каких-либо других изменений в них; ревматический артрит, как правило, нестойкий. Воспалительные изменения в каждом суставе при отсутствии лечения сохраняются не более месяца, а после начала противовоспалительной терапии чаще всего уже через 1-2 недели явления артрита полностью исчезают. Даже после повторных атак ревматического артрита рентгенологические изменения в суставах отсутствуют. III. Малая хорея наблюдается главным образом у детей, чаще у девочек. Морфологический субстрат этого поражения связан с васкулитом и дистрофическими изменениями стриопалидарной системы головного мозга. Характеризуется клинически: гиперкинезами мышц; нарушением координации движения (ухудшается почерк, больные испытывают затруднения при застегивании пуговиц, завязывании шнурков, удерживании чашки при питье, вилки, ложки, нарушение походки); слабостью и гипотонией мышц (псевдопараличи); рассеянностью и эмоциональной лабильностью ребенка; проявлениями вегетативной дисфункции. Кольцевидная (аннулярная) эритема – бледно-розовые, неяркие высыпания в виде тонкого ободка с четким внешним и менее очерченным внутренним контуром, которые не возвышаются над поверхностью кожи и исчезают при надавливании. Элементы могут сливаться в причудливые формы на плечах, туловище, реже на лице, шее, ногах. Высыпания обычно носят нестойкий характер и не сопровождаются какими-либо субъективными ощущениями. Подкожные ревматические узелки – округлые, плотные, малоподвижные, безболезненные образования с локализацией в подкожной клетчатке, фасциях, апоневрозах, в суставных сумках, в области разгибательных поверхностей, коленных, локтевых, пястно-фаланговых суставов, над остистыми отростками позвонков, щиколотками. Узелки встречаются редко, при наиболее тяжелых вариантах заболевания и сохраняются от нескольких дней до 1-2 месяцев. 5. Острая ревматическая лихорадка. Данные дополнительных методов обследования. лейкоцитоз со сдвигом формулы влево, повышение уровня СОЭ, нередко анемия; увеличение показателей дефиниламиновой реакции, серомукоида, сиаловых кислот; диспротеинемия, повышение активности креатинфосфокиназы, лактатдегидрогеназы; определяется С-реактивный белок; повышение титров противострептококковых антител. 6. Острая ревматическая лихорадка. Принципы лечения. I этап : стационар; II этап: местный кардиоревматологический санаторий; III этап: диспансерное наблюдение в поликлинике. 1-й этап рекомендуется проводить в специализированном кардиоревматологическом отделении. Режим. Всем больным в активной фазе показана госпитализация. Режим - постельный в течение первых 3-5 недель. Диета - лечебный стол № 10 с включением продуктов с высоким содержанием витаминов и солей калия. При развитии застойной сердечной недостаточности ограничивается соль, жидкость, проводятся разгрузочные дни. Медикаментозная терапия. Этиотропная терапия: пенициллины на протяжении 10-14 суток с последующим переходом на использование бициллина-5 или бензатин бензилпенициллина. Бициллин-5 назначается 1 раз в 4 недели, а бензатин бензилпенициллин (Ретарпен) внутримышечно каждые 3-4 недели. В случаях аллергических реакций на препараты пенициллина показано назначение макролидов. Патогенетическое лечение: 1. Нестероидные противовоспалительные препараты (диклофенак натрия, аспирин, индометацин, нимесулид или др.); 2. внутрь; При высокой степени активности к медикаментозной терапии добавляют преднизолон 3. Кардиотрофические средства (карнитин, милдронат или др.); 4. При наличии недостаточности кровообращения – сердечные гликозиды; 5. При лечении хореи - покой, тишина, удлиненный сон (до 16-18 часов в сутки), противосудорожные (фенобарбитал), транквилизаторы. 7. Острая ревматическая лихорадка. Профилактика. Первичная профилактика Под первичной профилактикой понимают комплекс мероприятий, уменьшающих возможность стрептококкового инфицирования, а в случаях возникновения стрептококковой инфекции – своевременное ее лечение. Лечение стрептококковой инфекции проводят пенициллинами в течение 10 дней. При их непереносимости могут быть назначены другие антибиотики (макролиды). Вторичная профилактика. Представляет собой систему профилактических мероприятий, направленных на предупреждение рецидивов и прогрессирования болезни у лиц, перенесших ревматизм. Осуществляется в условиях диспансерного наблюдения путем регулярного введения пролонгированных пенициллинов - бициллина-5 или бензатин бензилпенициллина. Детям, перенесшим ревматизм без кардита, вторичная профилактика проводится до 18-летнего возраста, при наличии кардита - до 25 лет и более. При сформировавшемся пороке сердца - вторичная профилактика ревматизма проводится пожизненно. Если у больного есть аллергия на пенициллины, вторичная профилактика осуществляется макролидами циклами по 10 дней каждый месяц. Текущая профилактика. Проводится одновременно с осуществлением вторичной профилактики ОРЛ при присоединении острых респираторных инфекций, тонзиллита, фарингита, до и после тонзилэктомии и других оперативных вмешательств. При этом обязательно назначают препараты пенициллина или другие антибиотики с учетом переносимости. ЗАБОЛЕВАНИЯ ОРГАНОВ ПИЩЕВАРЕНИЯ У ДЕТЕЙ 1. Хронический гастрит. Определение, эпидемиология. Хронический гастрит – хроническое рецидивирующее заболевание слизистой оболочки желудка воспалительного характера, которое сопровождается клеточной инфильтрацией, нарушением физиологической регенерации со склонностью к прогрессу и постепенным развитием атрофии железистого аппарата, нарушениями секреции, моторики и инкреторной функции желудка. Заболевания органов пищеварения – наиболее частая патология у детей (60-65% всех болезней в детском возрасте). По современным данным заболевания желудка составляют 58-65% в структуре детской гастроэнтерологической патологи. 2. Хронический гастрит. Этиопатогенез. Многочисленные факторы, которые содействуют развитию хронического гастрита, можно условно разделить на группы. 1. Инфекционные: Helicobacter pylori (НР). 2. Алиментарные (нерегулярное питание, еда всухомятку, плохое пережевывание еды). 3. Пищевая аллергия. 4. Вегетативный дисбаланс (преобладает парасимпатический отдел вегетативной нервной системы). 5. Психоэмоциональные факторы. 6. Изменение микрофлоры кишечника в сторону повышения количества условно-патогенной флоры. 7. Наследственная предрасположенность. 8. Прием медикаментов (салицилаты). 9. Вредные привычки (алкоголь, курение). Важным пусковым моментом в патогенезе гастрита является дисбаланс между факторами агрессии и факторами защиты слизистой оболочки желудка. К факторам агрессии относят: наличие НР, гиперпродукцию соляной кислоты, нарушение гастродуоденальной моторики (дуоденогастральный рефлюкс), травмы слизистой оболочки желудка. К факторам защиты относят: секрецию желудочной слизи, продукцию бикарбонатов, регенерацию и кровоснабжение слизистой оболочки желудка, секрецию простагландинов. НР взаимодействует с клетками-мишенями в слизистой оболочке желудка (в антральном отделе пилорической части, поскольку там реакция слизи не кислая, а щелочная). При инфицировании НР этот микроорганизм начинает производить протеолитические ферменты и муциназу. Слизь становится жидкой, теряет свои защитные свойства. НР проникает через слизь к клеткам эпителия слизистой оболочки и прилипает к ним. НР с помощью уреазы (главного фермента НР) отщепляет от мочевины аммиак, который стимулирует G-клетки, производящие гастрин. Последний стимулирует выработку соляной кислоты. Повышается проницаемость слизистой оболочки для ионов водорода, который приводит к локальному тканевому ацидозу. Как следствие развивается воспаление, лимфоидная инфильтрация слизистой оболочки желудка, изменение желудочной секреции, нарушения процессов регенерации желудочного эпителия, который является основой для развития атрофического гастрита. НР стимулирует апоптоз и способствует хронизации процесса 3. Хронический гастрит. Классификация. По происхождению: первичный, вторичный. По этиологии: • инфекционный (Helicobacter pylori, другие бактерии, вирусы, грибы) • токсичный (реактивный): химический, медикаментозный и др. • алиментарный • аллергический (болезнь Крона, целиакия и др.). По топографии: • гастрит: антральный, фундальный, пангастрит; • дуоденит: бульбит, постбульбарный, пандуоденит; • гастродуоденит. По форме поражения желудка и двенадцатиперстной кишки: При эндоскопическом исследовании: 1. Эритематозный (экссудативный). 2. Нодулярный. 3. С эрозиями. 4. Геморрагический. 5. С атрофией. 6. Смешанный. По морфологии: • По глубине поражения: поверхностный, диффузный. • По характеру поражения: с оценкой степени (воспаления, активности, атрофии, кишечной метаплазии, H. pylori); без оценки степени (субатрофия, специфические, неспецифические); степени тяжести. По характеру кислотной продукции: повышенная, сниженная, сохраненная. По периодам заболевания: обострение, клиническая ремиссия (полная и неполная), клиникоендоскопески-морфологическая ремиссия. 4. Хронический гастрит. Клиника. Клинические проявления основываются на анализе жалоб и наличия основных синдромов: болевого, абдоминального, диспептического, неспецифической интоксикации. Хронический гастрит с повышенной или сохраненной кислотной продукцией желудка: 1. Болевой синдром: • Боли в животе, связанные с приемом еды: ü возникают натощак; ü ранние боли, появляются во время еды или сразу после приема пищи (характерные для фундального гастрита); ü поздние боли, которые возникают через 1-1,5 часы после еды (характерные для антрального гастрита); ü • возможно появление боли ночью. Болевой синдром интенсивный и длительный. • Нет четкой связи возникновения клинических симптомов с временами года. 2. Диспептический синдром: характерна отрыжка кислым или воздухом, изжога, тошнота, склонность к запорам. 3. Синдром неспецифической интоксикации: повышеная утомляемость, снижение работоспособности, головная боль. 4. Абдоминальный синдром – при пальпации определяется четкая болезненность в эпигастральной области, пилородуоденальной зоне. При хроническом гастрите с повышенной или сохраненной кислотообразующей функцией желудка болевой синдром преобладает над диспептическим. Синдром неспецифической интоксикации разной степени выраженности. Хронический гастрит со сниженной кислотной продукцией желудка: 1. Болевой синдром: ноющие боли в эпигастральной области, чаще возникают после еды, боли зависят от качества и объема еды, характерно ощущение давления и переполнения в верхней части живота. 2. Диспептический синдром: отрыжка едой, тошнота, ощущение горечи во рту, снижение аппетита, метеоризм, неустойчивый стул. 3. Синдром неспецифической интоксикации: повышенная утомляемость, снижение работоспособности, головная боль. 4. Абдоминальный синдром – при пальпации определяется незначительная болезненность в эпигастральной области, часто распространенная в проекции болевых точек других органов пищеварения. При хроническом гастрите со сниженной кислотообразующей функцией желудка диспептический синдром преобладает над болевым, синдром неспецифической интоксикации значительно выражен. У детей чаще развиваются антральные гастриты с яркой клиникой и повышенной кислотностью, которые сочетаются с дуоденитами. При фундальном гастрите клиника выраженная слабо и кислотность обычно сниженная. По характеру морфологических изменений: у детей чаще бывают поверхностные гастриты и гастриты с поражением желез без атрофии. Атрофические гастриты встречаются редко. 5. Хронический гастрит. Данные дополнительных методов исследования. Диагноз хронического гастрита устанавливают на основании совокупности клнико-анамнестических данных и результатов дополнительного обследования (фиброэзофагогастродуоденоскопия (ФЭГДС) с прицельной биопсией, внутрижелудочная рН-метрия). 1. Методы изучения морфологических особенностей желудка и двенадцатиперстной кишки: ФЭГДС – проводится для морфологического подтверждения хронического гастрита, определения его эндоскопических вариантов, распространенности и наличия инфекции НР; гистологического исследования биоптата слизистой оболочки желудка, оценки секретообразующей и кислотообразующей функций желудка. 2. Методы выявления Н.pylori: • Бактериоскопический (морфологический) – мазки-отпечатки биоптата с применением специальных красок, определяет степень обсеменения слизистой оболочки НР (слабая +, умеренная + +, высокая + + +, + + + +). • Бактериологический (биоптат сеют на специальные среды, выращивают колонии НР, окрашивают мазок за Граммом и определяют биохимические свойства бактерий и чувствительность к антибиотикам). • Уреазный тест (биохимический) – этот метод используют для экспресс-диагностики при ФЭГДС, основанный на определении в биоптате слизистой оболочки желудка фермента – уреазы, который ращепляет мочевину и производится НР в большом количестве. • Дыхательный (уреазный) тест – в выделенном воздухе определяют углекислый газ (как продукт разложения мочевины), меченый изотопами углерода. • Серологический (иммуноферментный анализ) – определяют антитела к НР (классу IgG). Антитела могут сохраняться в крови на протяжении года после эрадикации. • Полимеразно-цепная реакция – определяет фрагмент ДНК в биоптатах слизистой, желудочном соке, смывах ротовой полости, зубном налете, копрофильтратах. 3. Методы оценки кислотообразующей и секретообразующей функций желудка: • зондовые (внутрижелудочковая рН-метрия, фракционное желудочное зондирование с применением раздражителей (гистамина, пентагастрина) – менее информативное. • беззондовые (ацидотест и определение пепсиногена в моче. Дают приблизительную оценку). 4. УЗДГ органов желудочно-кишечного тракта (для выявления сопутствующей патологии). 6. Хронический гастрит. Дифференциальная диагностика. Дифференциальный диагноз проводится с язвенной болезнью двенадцатиперстной кишки и желудка, хроническим гастродуоденитом. 7. Хронический гастрит. Принципы лечения. Диета. Сохраненная кислотность стол № 5. Повышенная кислотность стол № 1 на 2-4 недели, потом стол № 5. Сниженная кислотность стол № 5 на 2-4 недели, потом стол № 2. Медикаментозная терапия. При гиперацидном хроническом гастрите: 1. Эрадикация НР инфекции. 2. Антисекреторные препараты: • блокаторы Н2-рецепторов гистамина 2-3 поколения (ранитидин или фамотидин) в течение 2-3 недель; • или ингибиторы Н+/К+-АТФазы (омепразол) в полной дозе – 7-10 дней, дальше еще 7 дней – в половинной дозе с постепенным переходом на антацид (маалокс, фосфалюгель) в течение 2 недель. 3. Прокинетики (домперидон или др.) 10-14 дней. 4. Цитопротекторы и репаранты (смектит, ликвиритон и др.) на 2-3 недели. 5. Спазмолитики (мебеверин, дротаверин) при выраженном болевом синдроме в течение 7-14 дней. При гипоацидном хроническом гастрите: 1. Эрадикация НР инфекции. 2. Стимуляторы желудочной секреции (сок капусты, подорожника, ацидин-пепсин, плантаглюцид) сроком на 2-4 недели. 3. Цитопротекторы и репаранты до 4-6 недель. При хроническом гастрите с сохраненной кислотностью: 1. Эрадикация НР инфекции. 2. Цитопротекторы и репаранты в течение 2-4 недель. 3. Спазмолитики в течение 1-2 недель. При всех формах хронического гастрита во время обострения назначают седативные препараты – на 7-10 дней. Современные схемы лечения (эрадикации) НР инфекции у детей: 1. Детям до 12 лет. Тройная терапия с препаратом висмута на 1 неделю: ü коллоидный субцитрат висмута (де-нол) + амоксицилин (рокситромицин) или кларитромицин (азитромицин) + нифурател (фуразолидон). 2. Детям старше 12 лет. Тройная терапия с блокаторами Н+/К+ – АТФазы – на 1 неделю: ü омепразол (пантопразол) + амоксицилин (рокситромицин) или кларитромицин (азитромицин) + нифурател (фуразолидон). Или ü омепразол (пантопразол) + амоксицилин (рокситромицин) или кларитромицин (азитромицин) + коллоидный субстрат висмута. Квадротерапия (терапия усиления 2-го звена) на 1 неделю: ü коллоидный субстрат висмута + омепразол (пантопразол) + амоксицилин (рокситромицин) или кларитромицин (азитромицин) + нифурател (фуразолидон) После проведения эрадикационной антихеликобактерной терапии продолжают комплексное лечение хронического гастрита в зависимости от характера кислотообразующей функции желудка. 8. Хронический гастродуоденит. Определение, эпидемиология. Хронический гастродуоденит – хроническое рецидивирующее заболевание воспалительного характера, которое сопровождается структурной перестройкой слизистой оболочки и железистого аппарата желудка и двенадцатиперстной кишки с нарушением секреции и моторики. При наличии у ребенка хронического гастродуоденита имеется высокий риск трансформации заболевания в язвенную болезнь. Чаще всего в детском возрасте встречается хронический гастродуоденит с гиперсекрецией и гиперацидностью. Распространенность заболеваний органов пищеварения в детском возрасте составляет примерно 80 на 1000 детей. В течение последних 10 лет среди детей заболеваемость хроническими гастродуоденитами выросла на 27 %. 9. Хронический гастродуоденит. Этиопатогенез. Многочисленные факторы, которые содействуют развитию хронического гастрита, можно условно разделить на группы. 1. Инфекционные: Helicobacter pylori (НР). 2. Алиментарные (нерегулярное питание, еда всухомятку, плохое пережевывание еды). 3. Пищевая аллергия. 4. Вегетативный дисбаланс (преобладает парасимпатический отдел вегетативной нервной системы). 5. Психоэмоциональные факторы. 6. Изменение микрофлоры кишечника в бок повышения количества условно патогенной флоры. 7. Наследственная предрасположенность. 8. Прием медикаментов (салицилаты). 9. Вредные привычки (алкоголь, курение). Важным пусковым моментом в патогенезе гастрита является дисбаланс между факторами агрессии и факторами защиты слизистой оболочки желудка. К факторам агрессии относят: Наличие НР, гиперпродукцию соляной кислоты, нарушение гастродуоденальной моторики (дуоденогастральный рефлюкс), травмы слизистой оболочки желудка. К факторам защиты относят: секрецию желудочной слизи, продукцию бикарбонатов, регенерацию и кровоснабжение слизистой оболочки желудка, секрецию простагландинов. Дуоденит развивается чаще всего на фоне хронического хеликобактерного гастрита и метаплазии эпителия двенадцатиперстной кишки в желудочный. НР взаимодействует с клетками-мишенями в слизистой оболочке желудка (в антральном отделе пилорической части, поскольку там реакция слизи не кислая, а щелочная). При инфицировании НР этот микроорганизм начинает производить протеолитические ферменты и муциназу. Слизь становится жидкой, теряет свои защитные свойства. НР проникает через слизь к клеткам эпителия слизистой оболочки и прилипает к ним. НР с помощью уреазы отщепляет от мочевины аммиак, который стимулирует G-клетки, производящие гастрин, стимулирующий выработку соляной кислоты. Повышается проницаемость слизистой оболочки для ионов водорода, что приводит к локальному тканевому ацидозу. Вследствие развивается воспаление, лимфоидная инфильтрация слизистой оболочки желудка, изменение желудочной секреции, нарушения процессов регенерации желудочного эпителия, что является основой для развития атрофического гастрита. НР стимулирует апоптоз и способствует хронизации процесса. 10. Хронический гастродуоденит. Классификация. По происхождению: первичный, вторичный. По этиологии: • инфекционный (Helicobacter pylori, другие бактерии, вирусы, грибы) • токсичный (реактивный): химический, медикаментозный и др. • алиментарный • аллергический (болезнь Крона, целиакия и др.). По топографии: • гастрит: антральный, фундальный, пангастрит; • дуоденит: бульбит, постбульбарный, пандуоденит; • гастродуоденит. По форме поражения желудка и двенадцатиперстной кишки: При эндоскопическом исследовании: 1. Эритематозный (экссудативный). 2. Нодулярный. 3. С эрозиями. 4. Геморрагический. 5. С атрофией. 6. Смешанный. По морфологии: 1. По глубине поражения: поверхностный, диффузный. 2. По характеру поражения: с оценкой степени (воспаления, активности, атрофии, кишечной метаплазии, H. pylori); без оценки степени (субатрофия, специфические, неспецифические); степени тяжести. По характеру кислотной продукции: повышенная, сниженная, сохраненная. По периодам заболевания: обострение, клиническая ремиссия (полная и неполная), клиникоендоскопески-морфологическая ремиссия. 11. Хронический гастродуоденит. Клиника. Клинические проявления основываются на анализе жалоб и наличия основных синдромов: болевого, абдоминального, диспептического, неспецифической интоксикации, астеновегетативного. 1. Болевой синдром: ноющие, длительные или острые боли в эпигастральном участке, правом подреберье, около пупка, возникающие утром натощак или через 1-1,5 часы после еды (при гиперацидном/нормоацидном хроническом гастродуодените) или сразу после еды (при гипоацидном хроническом гастродуодените). Боль усиливается после еды или физической нагрузки. 2. Диспептический синдром: частая отрыжка, длительная тошнота, ощущение горечи во рту, метеоризм, запоры, реже – неустойчивый стул. 3. Синдром неспецифической интоксикации: частые головные боли, слабость. 4.Абдоминальный синдром: разлитая болезненность в эпигастрии, пилородуденальной зоне, при эрозиях возможно локальное напряжение мышц. 5.Астено-вегетативний синдром: эмоциональная лабильность, раздражительность. 12. Хронический гастродуоденит. Данные дополнительных методов исследования. Диагноз хронического гастродуоденита устанавливают на основании совокупности клиникоанамнестических данных и результатов дополнительного обследования (фиброэзофагогастродуоденоскопии (ФЭГДС) с прицельной биопсией, внутрижелудочной рНметрией). 1. ФЭГДС: выделяют эндоскопические варианты хронического гастродуоденита, его распространенность. 2. Интрагастральная рН-метрия: определяют секретообразование и кислотообразование желудка. 3. Гистологическое исследование биоптатов: верификация хронического гастродуоденита, определение активности процесса, наличия атрофии, метаплазии и др. 4. УЗДГ органов брюшной полости: обнаружение сопутствующей патологии желудочнокишечного тракта. 13. Хронический гастродуоденит. Принципы лечения. Диета. Сохраненная кислотность стол № 5. Повышенная кислотность стол № 1 на 2-4 недели, потом стол № 5. Сниженая кислотность Медикаментозная терапия. стол № 5 на 2-4 недели, потом стол № 2. При гиперацидном хроническом гастродуодените: 1. Эрадикация НР инфекции. 2. Антисекреторные препараты • блокаторы Н2-рецепторов гистамина 2-3 поколения (ранитидин или фамотидин) в течение 2-3 недель; • или ингибиторы Н+/К+-АТФазы (омепразол) в полной дозе – 7-10 дней, дальше еще 7 дней – в половинной дозе с постепенным переходом на антацид (маалокс, фосфалюгель) в течение 2 недель. 3. Прокинетики (домперидон или др.) 10-14 дней. 4. Цитопротекторы и репаранты (смектит, ликвиритон и др.) на 2-3 недели. 5. Спазмолитики (мебеверин, дротаверин) при выраженном болевом синдроме (мебеверин, дротаверин) в течение 7-14 дней. При гипоацидном хроническом гастродуодените: 1. Эрадикация НР инфекции. 2. Стимуляторы желудочной секреции (сок капусты, подорожника, ацидин-пепсин, плантаглюцид) сроком на 2-4 недели. 3. Цитопротекторы и репаранты до 4-6 недель. При хроническом гастродуодените с сохраненной кислотностью: 1. Эрадикация НР инфекции. 2. Цитопротекторы и репаранты в течение 2-4 недель. 3. Спазмолитики в течение 1-2 недель. При всех формах хронического гастродуоденита во время обострения назначают седативные препараты – на 7-10 дней. 14. Язвенная болезнь желудка и двенадцатиперстной кишки. Определение, эпидемиология. Язвенная болезнь (ЯБ) – хроническое рецидивирующее полиэтиологическое заболевание, которое характеризуется формированием язвенного дефекта в желудке и/или двенадцатиперстной кишке, с возможным развитием осложнений. Язвенная болезнь желудка у детей встречается в 10-13 % случаев, двенадцатиперстной кишки – в 82-87 % случаев. В течение последних 10 лет среди детей заболеваемость язвенной болезнью выросла в 2,5 раза. 15. Язвенная болезнь желудка и двенадцатиперстной кишки. Этиопатогенез. Этиологические факторы делятся на две группы: 1. Предрасполагающие к развитию заболевания. 2. Реализующие возникновение и рецидивы ЯБ. К первой группе факторов относят наследственную предрасположенность: секреция соляной кислоты, содержание пепсиногена в сыворотке крови, высвобождение гастрина в ответ на стимуляцию пищей, определенный тип высшей нервной деятельности, нарушения процессов торможения и возбуждения и др. Наследственная предрасположенность реализуется лишь при действии ряда этиологических факторов. Ведущая роль в развитии ЯБ принадлежит инфекции НР, который обнаруживается при ЯБ желудка в 75% случаев, а при дуоденальных язвах – в 95%. Немаловажная роль отводится нервно-психическим перегрузкам. ЯБ возникает в результате нарушения равновесия между факторами «агрессии» желудочного сока и факторами «защиты» слизистой оболочки желудка и двенадцатиперстной кишки, которое регулируется нейроэндокринной системой. Влияние нервно-психических факторов отражено в кортико-висцеральной теории: отрицательные эмоции, умственное перенапряжение вызывают ослабление торможения в коре головного мозга и возбуждение (растормаживание) подкорки, в которой возникает очаг застойного возбуждения. Повышается тонус блуждающего нерва и симпатической нервной системы, что приводит к увеличению желудочной секреции, усилению моторики, спазму сосудов и трофическим изменениям слизистой, и в результате – к образованию язвы. НР имеет свойство вырабатывать протеолитические ферменты и муциназу. Слизь теряет свои защитные свойства. НР проникает через слизь к клеткам эпителия слизистой оболочки и возникает воспаление. В результате длительного контакта желудочного сока, имеющего повышенную кислотность и протеолитическую активность со слизистой оболочкой происходит ее разрушение и образуется язвенный дефект. 16. Язвенная болезнь желудка и двенадцатиперстной кишки. Классификация. Классификация язвенной болезни (Унифицирован клинический протокол медицинской помощи детям с язвенной болезнью, в 2013 г.) Локализация язвы В желудке: Клиническая фаза и эндоскопическая стадия Степень тяжести Обострение • медиагастральная I стадия (свежая язва) • пилороантральная II стадия (начало эпителизации) Осложнение Кровотечение Легкая Перфорация Средней тяжести В двенадцатиперстной кишке Начало ремиссии • в луковице III стадия (заживление язвы) • внелуковичная - без образования рубца; Пенетрация Тяжелая Стеноз - с формированием рубца; В желудке и двенадцатиперстной кишке - рубцово-язвенная Перивисцерит деформация Ремиссия ІV стадия (отсутствие признаков или стойкий рубец) Обязательно определять связь с хеликобактерной инфекцией и характер сопутствующего гастродуоденита (обязательный сопутствующий диагноз!). 18. Язвенная болезнь желудка и двенадцатиперстной кишки. Клиника. I. Болевой синдром. Основной жалобой является боль: • сезонная, постоянная, интенсивная; • ночные и голодные боли, которые уменьшаются после приема пищи; • для язвы желудка характерные ранние боли (что возникают через 20-30 минут после еды); • для язвы двенадцатиперстной кишки – поздние боли (через 2-3 часа после еды), появляется мойнигановский ритм боли: «голод – боль – прием пищи – облегчение» • боль локализуется в эпигастрии, пилородуоденальной зоне, часто иррадиирующий в спину, поясницу. II. Диспептический синдром: изжога (основной симптом), тошнота, отрыжка кислым, рвота, которая приносит облегчение, склонность к запорам, аппетит часто снижен (что приводит к дистрофизации). III. Синдром неспецифической интоксикации: головная боль, снижение работоспособности, повышенная утомляемость. IV. Астено-вегетативний синдром: эмоциональная лабильность, потливость. V. Абдоминальный синдром: выраженная болезненность в пилородуоденальной зоне (при язве двенадцатиперстной кишки), в эпигастрии (при язве желудка), наличие симптома Менделя (при перкуссии кончиками пальцев стенки живота возникает боль), локальное напряжение мышц в болевой зоне, иногда отмечается болезненность в точке Боаса (при пальпации слева от позвоночника на уровне X-XII грудных позвонков) и в точке Опенховского (при пальпации на уровне остистых отростков VIII-X грудных позвонков). V. Синдром дистрофизации (не обязательный): снижение массы тела. 19. Язвенная болезнь желудка и двенадцатиперстной кишки. Данные дополнительных методов исследования. 1. Основной метод – ФЭГДС с прицельной биопсией слизистой оболочки. На фоне выраженных воспалительных изменений слизистой оболочки желудка и двенадцатиперстной кишки – дефект (дефекты) округлой формы, окруженный воспалительным валом, выраженный отек, дно язвы – с наслоением фибрина. Гистологически в биоптате обнаруживают наличие НР и степень обсеменения слизистой оболочки (+, ++, +++), острое воспаление, атрофию. Для определения кислотности проводят внутрижелудочную рН-метрию. 2. Рентгенологически критерии язвы – синдром "ниши", наличие инфильтративного вала, конвергенция складок в месте расположения язвы (у детей встречаются редко). Обследование используется только в случае невозможности выполнения ФЭГДС. 20. Язвенная болезнь желудка и двенадцатиперстной кишки. Принципы лечения. Диета: постепенный переход от стола № 1а, № 1 к столу № 5. Медикаментозная терапия. 1. При НР-ассоциированной язвенной болезни лечение начинают с эрадикации НР: тройная или квадротерапия в течение 7 дней со следующим подтверждением эффективности эрадикации (через 4-6 недель по окончании антихеликобактерной терапии) любыми двумя методами верификации НР. 2. Параллельно или сразу по завершении эрадикационного лечения: антисекреторная терапия (селективные блокаторы Н2-гистаминовых рецепторов 2-3 поколений (группы ранитидина, фамотидина) или блокаторы Н+/К+-АТФазы (омепразол) от 3-4 до 6-8 недель. 3. После окончания антихеликобактерной терапии и снижения дозы антисекреторных препаратов на срок 3-4 недели назначают: • антацид (соединение алюминия, магния, кальция и др.) 2-4 недели; • цитопротекторы (смектит, сукральфат, препараты корня солодки) на 2-4 недели; • репаранты (масло облепихи, спирулина, препараты прополиса, алоэ) на 3-4 недели; • иммунокорректоры (растительного происхождения) на 3-4 недели. 4. При нарушении моторики (рефлюксы, дуоденостаз) – прокинетики (домперидон) на 2-3 недели. 5. Симптоматическое лечение: • седативные препараты (персен, ново-пасит, седасен но др.) 2-3 недели; • спазмолитики (мебеверин, папаверин, дротаверин). Средний курс медикаментозного лечения обострения язвенной болезни двенадцатиперстной кишки – 4-6 недель, язвенной болезни желудка – 6-8 недель. 22. Гастроэзофагеальная рефлюксная болезнь. Определение, эпидемиология. Гастроэзофагеальный рефлюкс – это заброс в пищевод желудочного или желудочно-кишечного содержимого. Гастроэзофагеальная рефлюксная болезнь (ГРБ) – это хроническое заболевание, обусловленное забросом желудочного или желудочно-кишечного содержания в пищевод, который может приводить к развитию эзофагита и рефлюкса. Гастроэзофагеальная рефлюксная болезнь является одним из наиболее распространенных заболеваний, поражающих пищевод. В последние годы большинство зарубежных и отечественных исследователей отмечают рост заболеваемости ГРБ и увеличение частоты выявления таких серьезных ее осложнений, как пищевод Баррета и аденокарцинома пищевода. Кроме того, в наше время и у детей нередко регистрируется желудочная и даже кишечная метаплазия слизистой оболочки пищевода. В связи со сказанным изучение распространенности ГРБ в детской популяции является актуальной проблемой гастроэнтерологии, сопровождаемой рядом трудностей. 23. Гастроэзофагеальная рефлюксная болезнь. Этиопатогенез. В основе этиопатогенеза гастроэзофагальной рефсюксной болезни лежит дисбаланс между факторами "агрессии" (гастроэзофагеальный рефлюкс, гиперсекреция соляной кислоты, влияние лизолецитина, желчных кислот, панкреатического сока) и факторами "защиты" (антирефлюксная функция кардии, своевременная эвакуация желудочного содержимого, эффективный клиренс, резистентность слизистой пищевода). Гастроэзофагеальный рефлюкс обусловлен нарушением моторно-эвакуаторной функции органов гастроэзофагальной зоны (снижение тонуса нижнего пищеводного сфинктера, замедления эвакуации желудочного содержания и др.). Основной фактор возникновения гастроэзофагеального рефлюкса – дисфункция вегетативной нервной системы. Повышение активности парасимпатического звена вегетативной нервной системы приводит к повышению секреции соляной кислоты и пепсина, а повышение тонуса симпатического отдела вегетативной нервной системы – к нарушению моторно-эвакуаторной функции желудка, двенадцатиперстной кишки и снижения тонуса нижнего пищеводного сфинктера. Длительный контакт слизистой оболочки пищевода с содержимым желудка и (или) двенадцатиперстной кишки приводит к формированию эзофагита, рефлюкса (воспалительных изменений в пищеводе, которые могут быть катаральные, эрозивно-язвенные). Гастроэзофагеальный рефлюкс служит фактором риска развития таких патологических состояний, как ларингомаляция, рецидивирующие ларинготрахеиты, хронический синусит, средний отит, отек гортани, гиперплазия лимфоидной ткани (через развитие фаринголарингеального или екстраэзофагеального рефлюкса). 24. Гастроэзофагеальная рефлюксная болезнь. Клиника. 1. Пищеводные симптомы: • изжога (за грудиной, которая чаще возникает после еды, при физическом напряжении; в положении лежа); • отрыжка (после еды, при физическом напряжении); может быть жидкостью в результате гиперсаливации; • дисфагия (во время еды или сразу после нее) • пищеводная рвота (регургитация) во время еды, ночью. 2. Внепищеводные симптомы: •бронхолегочные (стойкий надсадный кашель, покашливание, развитие пневмоний в результате микроаспираций, рефлекторный бронхоспазм); •отоларингологические (першение в горле, отит); •стоматологические (кариес, афтозний стоматит); боли в грудной клетке; •кардиальные (кардиалгии, дизритмии) •апноэ центрального и рефлекторного происхождения. 25. Гастроэзофагеальная рефлюксная болезнь. Данные дополнительных методов исследования. 1. Суточное рН-мониторирование пищевода: время контакта пищевода с кислым (рН < 4) желудочным содержимым (показатель кислотной экспозиции) превышает нормативные показатели больше, чем на 95%. 2. ФЭГДС: подтверждается наличие эзофагита, рефлюкса и оценивается степень его тяжести (может быть четыре степени). 3. Рентгеновские исследования: ретроградное попадание бария из желудка в пищевод в горизонтальном положении при гастроэзофагальном рефлюксе, неравенство рельефов слизистой пищевода, расширение его просвета при эзофагите. 26. Гастроэзофагеальная рефлюксная болезнь. Принципы лечения. Диета. № 5, частый прием еды небольшими порциями (последний – за 2-3 часа до сна). Режим: • избежание физических нагрузок, связанных с наклонами; • избежание ношения тугих поясов; • положение в постели – с поднятым головным концом кровати. Медикаментозная терапия: 1. Прокинетики (домперидон) в течение 2-3 недель. 2. Альгинати (гавискон) в течение 2-3 недель. 3. Антацид (соединения алюминия, кальция, магния) в течение 2-3 недель. 4. Могут применяться блокаторы Н2-гистаминовых рецепторов (фамотидин), ингибиторы протонной помпы (омепрозол) в течение 3-4 недель. 5. Физиотерапевтические методы (СМТ-форез с прокинетиками, электросон). 6. В стадии ремиссии – немедикаментозные методы лечения (фитотерапия, рефлексотерапия, бальнеотерапия). 28. Функциональная диспепсия. Определение, эпидемиология. Согласно Римским критериям III, «функциональная диспепсия определяется как наличие признаков диспепсии, которые происходят из гастродуоденальной области при отсутствии любых органических, системных или метаболических заболеваний, которые могли бы объяснить эти признаки». Таким образом, функциональная диспепсия – это самостоятельная нозологическая форма заболевания у детей старше 1 года, которая характеризуется постоянной или рецидивирующей болью или дискомфортом в верхней части живота, при которой в процессе обследования не удается обнаружить любое органическое заболевание. Функциональная диспепсия преобладает у детей в критические вековые периоды (4-7 и 12-15 лет). Функциональные нарушения желудочно-кишечного тракта занимают одно из первых мест в структуре патологи органов пищеварения у детей. Значительно распространены эти состояния в детском и дошкольном возрастах. Дети с функциональной патологией составляют приблизительно 30% всех госпитализованных больных с гастроэнтерологической патологией. 29. Функциональная диспепсия. Этиопатогенез. Этиология. • вегетативные дисфункции; • стрессовые факторы; • психоэмоциональные факторы. Патогенез функциональной диспепсии недостаточно изучен. Основные звенья патогенеза: • нарушение моторики желудка и двенадцатиперстной кишки; • повышенная чувствительность рецепторного аппарата желудка к растягиванию. Ведущая роль в возникновении функциональной диспепсии принадлежит повышенной возбудимости и быстрому истощению центральной и вегетативной нервной системы ребенка. Структуры желудочно-кишечного тракта богаты вегетативными окончаниями. Поэтому любой дисбаланс нервной системы приводит в первую очередь к функциональным изменениям моторной и секреторной функций желудочно-кишечного тракта. При этом, в формировании дисфункций гастродуоденальной зоны принимают участие как пробковые механизмы, так и висцеровисцеральные рефлексы. Функциональная диспепсия более чем в 30% случаев трансформируется в органическую патологию желудка и двенадцатиперстной кишки. 30. Функциональная диспепсия. Классификация функциональной диспепсии. Классификация функциональной диспепсии (III Римский консенсус, в 2006 г.) Клинические варианты (диагностические критерии) функциональной диспепсии: 1) Синдром эпигастральной боли. 2) Постпрандиальный дистрес-синдром. 31. Функциональная диспепсия. Клиника. 1. Синдром эпигастральной боли. Боли в эпигастрии могут быть жгучие, ноющие, возникать натощак, после приема еды, иногда возникают после приема пищи. Боли умеренной интенсивности, возникают периодически. Может быть также изжога в эпигастральном участке. После дефекации или отхождения газов улучшения не происходит. 2. Постпрандиальный дистрес-синдром. Постпрандиальные (индуктируемые едой) диспепсические симптомы: • быстрое насыщение (желудок переполняется сразу после начала еды независимо от объема принятой пищи); • переполнение (ощущение задержки еды в желудке); • вздутие (чувство распирания в эпигастрии), связанное или не связаное с приемом пищи или физическими упражнениями; • тошнота; • отрыжка. Римские критерии III диагностики функциональной диспепсии у детей Диагноз устанавливают при наличии всех признаков, отмеченных ниже: 1. Постоянная или рецидивирующая боль или дискомфорт в верхней части живота (выше пупка). 2. Боль не уменьшается после дефекации или связанный с изменением частоты или характера опорожнений. 3. Нет доказательств воспалительного, метаболического или неопластического процесса, анатомические изменения, способные объяснить обнаруженные признаки. Отмеченные признаки наблюдаются не менее 12 недель за последние 12 месяцев. Нужно помнить, что функциональная диспепсия не может сопровождаться такими симптомами, как: • дисфагия • рвота с кровью • кровь в кале • исхудание • лихорадка • изменения в клиническом анализе крови (анемия, лейкоцитоз, ускоренная СОЭ). 32. Функциональная диспепсия. Данные дополнительных методов исследования. Диагноз устанавливается методом исключения органической патологии. 1. Фиброэзофагастродуоденоскопия (ФЭГДС): отсутствие признаков воспалительнодеструктивных изменений слизистой оболочки желудка. 2. Гистологическое исследование биоптатов слизистой оболочки желудка: отсутствие признаков воспаления, атрофии. 3. Интрагастральна рН-метрия: снижение или повышение кислотообразующей функции желудка. 33. Функциональная диспепсия. Принципы лечения. Включает организацию режима, нормализацию ритмов отдыха, соблюдения принципов рационального питания, устранения стрессовых ситуаций, дозированные физические нагрузки. Диета – частое дробное питание 4-5 раз в день с учетом индивидуальной непереносимости продуктов. Медикаментозная терапия. 1. Прокинетики (домперидон) при постпрандиальных диспептических симптомах в течение 2-3 недель. 2. Миотропные спазмолитики (мебеверин): при проявлениях боли в течение 7-10 дней. 3. Антисекреторные препараты (ингибиторы протоновой помпы и блокаторы Н2-гистаминовых рецепторов) являются препаратами резерва для лечения болевого синдрома при неэффективности вышеупомянутой терапии (у детей с отягощенным анамнезом по язвенной болезни). ЗАБОЛЕВАНИЯ МОЧЕВОЙ СИСТЕМЫ У ДЕТЕЙ 1. Гломерулонефрит: определение Гломерулонефрит (ГН) – приобретенное полиэтиологическое заболевание почек, для которого характерно иммунное воспаление с преимущественным инициальным поражением клубочков и возможным вовлечением в патологический процесс любого компонента почечной ткани. ГН означает наличие двустороннего иммунопатологического процесса, главным образом, в гломерулах. В настоящее время принято выделение первичного ГН, развивающегося (через 1-3 недели) в результате воздействия на почечную ткань различных инфекционных, аллергических и других факторов, и системного (или вторичного) ГН, являющего одним из симптомов других заболеваний. 2. Гломерулонефрит: этиология Большинство случаев острого гломерулонефрита (ОГН) вызвано стрептококковой инфекцией. ОГН чаще развивается после инфекций верхних дыхательных путей – фарингита или тонзиллита, иногда стрептодермии. Этиологическая роль отводится нефритогенным штаммам bгемолитического стрептококка группы А нескольких типов М-протеиновой фракции, которые отличаются от этиологического фактора острой ревматической лихорадки. Причинными факторами ОГН также могут быть другие бактериальные, паразитарные инфекции и грибковые заболевания. Так, стафилококки (особенно золотистый) вызывают клиническую и морфологическую картину, идентичную постстрептококковому ГН. Эпидермальный стафилококк приводит к шунт-нефриту, морфологической картиной которого чаще всего является мембранопролиферативный (мезангиокапиллярный) ГН. Пневмококковые инфекции могут развивать как острый пролиферативный ГН, так и другие морфологические типы ГН. Идентичные острому постстрептококковому ГН клинико-лабораторные и морфологические изменения возникают при менингококковой, микоплазменной, клебсиелезной, сальмонеллезной и других инфекциях. К развитию иммунокомплексного поражения почек приводят различные вирусные инфекции – вирус простого герпеса, Эпштейн-Барра, гриппа, гепатита В, аденовирус, цитомегаловирус, энтеровирусы. Этиологический фактор удается установить у 80-90% больных ОГН и у 5-10% больных хроническим гломерулонефритом (ХГН). Как возможные этиологические факторы ОГН рассматриваются вакцинация, а также переохлаждение и травма почек. В качестве "причинного" могут выступать и другие внешние влияния такие, как инсоляция, непереносимость некоторых пищевых продуктов, химических веществ, лекарств. Нередко подобные внешние воздействия относят не столько к этиологическим, сколько к патогенетическим, т.к. они приводят к иммунным расстройствам. Предрасполагающими факторами к развитию ОГН являются генетическая предрасположенность, отягощенная наследственность в отношении иммунокомплексных заболеваний, повышенная семейная восприимчивость к стрептококковой инфекции, наличие хронических очагов инфекции, гиповитаминоза, гельминтозов. В детском возрасте имеют значение аномалии развития мочевой системы, дизэмбриогенез почечной ткани. 3. Гломерулонефрит:патогенез В настоящее время сложилось четкое представление о ведущей роли в развитии ГН иммунопатологических процессов. Выделены два основных вида иммунологических реакций, в результате которых повреждается почечная ткань: аутоиммунный или анти-гломерулярно-базально-мембранно-антительный механизм, при котором иммунные комплексы образованы из специфических антител к антигенам гломерулярной базальной мембраны (ГБМ). Встречается у 1-2% детей, больных ГН. Эта форма типична для быстропрогрессирующего ГН. иммунокомплексный, при котором в состав фиксирующихся в почечных клубочках иммунных комплексов входят внеклубочковые антигены и антитела к ним. Иммунные комплексы могут образовываться в циркулирующей крови, а также в клубочках в результате предшествующей фиксации антигенов в них и последующей реакции с циркулирующими антителами. Начало иммуновоспалительного процесса связано с активацией медиаторов тканевого повреждения, прежде всего обусловленной комплементом, активацией хемотаксических факторов, способствующих миграции лейкоцитов. Одновременно активируются факторы коагуляции, в результате чего образуются депозиты фибрина, в том числе участвующие в формировании полулуний. Наконец, активное образование и выброс факторов роста и цитокинов сопровождаются ответной реакцией co стороны гломерулярных клеток; в результате их взаимодействия с этими медиаторами возникает выраженная клеточная пролиферация с выделением активных радикалов и ферментов, накоплением и расширением мезангиального матрикса, что способствует нарушению функции почек и склеротическим изменениям. Указанные реакции сохраняют свое значение и в прогрессировании ХГН, хотя на этой стадии болезни добавляются неиммунные механизмы - повышение внутриклубочкового давления в сохранных нефронах из-за потери общей массы функционирующей фильтрующей поверхности, ишемия, возможно токсическое канальцевое действие фильтрующегося белка. В итоге нарастают гломерулосклероз и интерстициальный фиброз. Иммунные комплексы и антитела к ГБМ могут быть выявлены и идентифицированы в ткани почек при иммуногистохимическом исследовании. Почечный клубочек отвечает на иммунное повреждение двумя видами патологических реакций: пролиферацией клеток почечного клубочка (мезангиальных, эндотелиальных, эпителиальных) и выработкой этими клетками межклеточного вещества. Оба процесса стимулируют цитокины (в первую очередь интерлейкин-1, фактор некроза опухолей, тромбоцитарный фактор роста, трансформирующй фактор роста b), которые выделяются клетками, инфильтрирующими почечный клубочек. 4. Гломерулонефрит: патогенез основных клинических симптомов ГН. Олигурия возникает из-за уменьшения массы функционирующих нефронов, наличия «антидиуреза» (повышение дистальной реабсорбции воды). Патогенез гематурии недостаточно изучен, предполагается еѐ появление вследствие повышенной проницаемости клубочковых капилляров, возможных кровоизлияний в клубочки, в связи с разрывами капилляров, почечной внутрисосудистой коагуляции. В настоящее время большое значение в генезе гематурии отводится вовлечению в процесс мезангия. Протеинурия связана с повышением проницаемости ГБМ клубочков для белковых молекул, нарушением реабсорбции белка в канальцевом отделе нефрона. Генез отёков обусловлен следующими факторами: поражение клубочков со снижением фильтрации, уменьшением фильтрационного заряда натрия и повышение его реабсорбции с последующей задержкой жидкости гиперальдостеронизм увеличение секреции антидиуретического гормона либо повышение чувствительности к нему дистального отдела нефрона повышение проницаемости стенок капилляров с выходом жидкой части крови из кровяного русла. Ведущее значение в развитии нефритического варианта отеков имеет нарушение сосудистой проницаемости (из-за гистаминемии, активации системы кинин-калликреина, повышение муколитической активности), нефротических отеков - снижение онкотического давления из-за гипоальбуминемии. Результатом, как в первом, так и во втором случаях, является снижение объема циркулирующей крови, приводящее к активации антидиуретического гормона, усиленному выделению альдостерона. Последний увеличивает реабсорбцию натрия и, соответственно, воды. В генезе артериальной гипертензии (АГ) принимает участие ренин-ангиотензин-альдостероновая система. Повышение уровня ренина связано с уменьшением почечного кровотока, избытком натрия в просвете дистальных канальцев и активацией симпатоадреналовой системы. Это приводит к выработке ангиотензина II (мощного прессорного агента), действие которого заключается в констриктивном эффекте на сосуды артериол, стимуляции секреции альдостерона с задержкой натрия и воды, увеличением объема циркулирующей крови. 5. Гломерулонефрит: клиническая классификация По нозологии выделяют первичный ГН, как самостоятельное заболевание, и вторичный ГН (как проявление другого заболевания – системной красной волчанки, геморрагического васкулита, узелкового полиартериита, ревматической лихорадки, тромбоза почечных вен, криоглобулинемии и др). Клинические формы первичного ГН у детей отражены в классификации, принятой в 1976 г. на симпозиуме детских нефрологов. Формы ГН Активность ГН Почечные функции ОСТРЫЙ ГЛОМЕРУЛОНЕФРИТ - нефритический синдром - нефротический синдром - нефротический синдром, с гематурией и гипертензией - период начальных проявлений (3-4 - без нарушения функции почек нед.) - с нарушением функции почек - период обратного развития (6-8 - острая почечная недостатосность мес.) - переход в хронический - изолированный мочевой синдром гломерулонефрит (10-12 мес.) ХРОНИЧЕСКИЙ ГЛОМЕРУЛОНЕФРИТ - гематурическая форма - период обострения - без нарушения функции почек - нефротическая форма - период частичной ремиссии - с нарушением функции почек - смешанная форма - период полной клиниколабораторной ремиссии - хроническая почечная недостаточность Подострый (злокачественный) гломерулонефрит -с нарушением функции почек - хроническая почечная недостаточность 6. Клинические проявления форм ГН ОГН: Нефритический синдром - периферические отеки и/или артериальная гипертензия (АГ); гематурия (от макрогематурии до 10-15 эр в п/зр.); минимальная или умеренная протеинурия (не превышает 2,5 г/сут). Нефритический синдром чаще всего развивается при остром постстрептококковом ГН. Нефротический синдром - генерализованные отеки; значительная протеинурия (более 2,5 г/сут или более 50 мг/кг/сут); гиперхолестеринемия, гиперлипидемия; гипопротеинемия; гипоальбуминемия; гиперα2-глобулинемия. Нефротический синдром с гематурией и/или гипертензией – признаки нефротического синдрома в сочетании с гематурией и/или артериальная гипертензия (АГ). Изолированный мочевой синдром – мочевой синдром в виде протеинурии, эритроцитурии и цилиндрурии, отеки и АГ отсутствуют. Может быть проявлением острого постстрептококкового ГН, однако чаще является дебютом гематурической формы хронического ГН. Хронический ГН диагностируют при сохранении признаков активности ГН более одного года. По клиническим проявлениям выделяют гематурическую, нефротическую и смешанную форму заболевания. Гематурическая форма - гематурия различной степени выраженности, возможно с протеинурией (до 1 г/сут.). Нефротическая форма - клинико-лабораторные признаки являются аналогом нефротического синдрома. Смешанная форма – сочетание признаков нефротического синдрома с гематурией и/или АГ. Подострый (злокачественный) ГН характеризуется быстропрогрессирующим течением, высокой активностью нефритического или нефротического синдрома с АГ, гематурией, анемией, нарастанием симптомов почечной недостаточности в сроки от нескольких недель до 3 мес. 7. Осложнения ГН Осложнения ГН - ангиоспастическая энцефалопатия, острая сердечная недостаточность, острая почечная недостаточность, при нефротическом синдроме - тромбозы. При ангиоспастической энцефалопатии наблюдается быстро нарастающая АГ, достигающая высоких цифр, что приводит к гипертонической энцефалопатии (сильная головная боль, тошнота, рвота, возбуждение, нарушение зрения - мелькание мушек перед глазами, в тяжелых случаях обратимая потеря зрения, судороги). Состояние, называемое почечной эклампсией при ГН, предполагает наличие значительной АГ и отека мозга, приступы судорог при этом могут повторяться. Острая сердечная недостаточность по левожелудочковому типу (отек легких) может развиться в случае быстрого нарастания отечного синдрома. У ребенка появляется возбуждение, страх, он, как правило, принимает вынужденное положение - садиться. Возникают одышка, кашель, акроцианоз на фоне общей бледности. В тяжелых случаях появляется пенистая, иногда, розовая мокрота. В легких выслушивается большое количество разнокалиберных влажных хрипов. Рентгенологически - симметричные облаковидные тени, сливающиеся с корнями легких. Острая почечная недостаточность - внезапное нарушение функций почек, приводящее к олигурии с нарушением гомеостаза (водно-электролитные расстройства, изменение кислотноосновного состояния, азотемия и др.). 8. Гломерулонефрит: данные дополнительных методов обследования Перечень лабораторных и инструментальных методов обследования у детей с гломерулонефритом Объем обследования Перечень исследований Рекомендованный Общий анализ мочи, суточная протеинурия, общий белок сыворотки крови, протеинограмма, холестерин крови, креатинин крови, общий анализ крови, электролиты крови, кислотно-основное состояние крови, УЗИ почек Дополнительный Прижизненное морфологическое исследование почек УЗИ почек менее чем у половины пациентов выявляет увеличение их размеров с повышением эхогенности коркового слоя. В практической деятельности важно установить этиологический фактор ГН. В большинстве случаев ограничиваются уточнением инфекционных заболеваний или других возможных факторов, которые предшествовали развитию ГН, обнаружением в крови антител к инфекционным антигенам, а также быстрым исчезновением признаков острого ГН после ликвидации инфекции. Диагноз острого постстрептококкового ГН подтверждают снижение концентрации С3-компонента системы комплемента в крови (у 90% больных) при нормальной концентрации С4-компонента в первые 2 нед. от начала заболевания; повышенный титр АСЛО в крови у 50-80% больных; нарастание титра АСЛО в динамике (в течение 2-3 нед); обнаружение при бактериологических исследованиях мазка из зева β-гемолитического стрептококка группы А. Проведение чрескожной биопсии почек с последующим прижизненным морфологическим исследованием почечной ткани позволяет установить морфологический вариант ГН. Показания для проведения данного метода обследования: нефротический синдром с гематурией и/или АГ, гормонрезистентный нефротический синдром, нефротический синдром на первом году жизни, персистирующая протеинурия >1 г/сут., острый нефритический синдром с прогрессированием заболевания через 6-8 нед. от манифестации, длительная гематурия в сочетании с протеинурией >1 г/сут., быстропрогрессирующий ГН. В "Международной статистической классификации болезней и проблем, связанных со здоровьем" (МКБ-10) предусмотрены следующие морфологические варианты ГН: незначительные гломерулярные изменения, очаговые и сегментарные гломерулярные поражения, диффузный мембранозный ГН, диффузный мезангиальный пролиферативный ГН, диффузный эндокапиллярный пролиферативный ГН, диффузный мезангиокапиллярный ГН, болезнь плотных депозитов, диффузный полулунный ГН. В педиатрии наиболее часто встречающимся морфологическим типом является мезангиопролиферативный ГН. У детей с нефротическим синдромом - ГН с минимальными изменениями составляет 37,0%, фокальный сегментарный гломерулосклероз – 19,0%, мембранопролиферативный ГН – 23,0 %, другие причины – 21,0 %. 9. Дифференциальная диагностика ГН Дифференциальную диагностику ГН проводят с заболеваниями, протекающими с гематурией наследственным нефритом (синдромом Альпорта), IgA-нефропатией, дизметаболической нефропатией. Диагностические критерии наследственного нефрита - наличие 3 из 5 признаков, один из которых поражение почек: 1) гематурия или смерть от ХПН в семейном анамнезе; 2) гематурия или нефротический синдром у пациента; 3) изменения гломерулярной базальной мембраны по данным электронной микроскопии биоптата почки; 4) снижение слуха по данным аудиограммы; 5) врожденная патология глаз. Дифференциальная диагностика с IgA-нефропатией возможна только на основании изучения биоптатов почек с проведением иммунофлюоресцентного исследования и выявлением преимущественно гранулярного отложения депозитов IgA в мезангии. При дизметаболической нефропатии наблюдается эритроцитурия в сочетании с гиперкальциурией или другой кристаллурией у детей с наследственной отягощенностью по нефролитиазу. Дифференциальную диагностику проводят с вторичными ГН, развившимися на фоне системных заболеваний соединительной ткани (системная красная волчанка) и системных васкулитов (геморрагический васкулит, узелковый полиартериит, гранулематоз Вегенера). Для установления диагноза системной красной волчанки необходимо учитывать женский пол и пубертатный возраст больного, наличие в начальном периоде лихорадки, возможно суставного или кожного синдромов, изменений в картине крови, показано прижизненное морфологическое исследование почечной ткани. Для исключения системной патологии исследуют кровь на наличие маркеров: LE-клетки, антитела к нативной ДНК, антинуклеарный фактор, антинейтрофильные цитоплазматические антитела, антифосфолипидные и антикардиолипиновые антитела, криоглобулины крови. Вторичный ГН при геморрагическом васкулите сопровождают клинические проявления в виде симметричной папулезно-геморрагической сыпи преимущественно на голенях, стопах, ягодицах, разгибательной поверхности локтевых суставов, нередко в сочетании с абдоминальным и суставным синдромами. При ассоциации врождѐнного или инфантильного гормонрезистентного нефротического синдрома с аномалиями развития других органов (глаз, половой системы и др.) необходима консультация генетика для исключения наследственной патологии или генетического синдрома. 10. Гломерулонефрит: принципы лечения Терапевтическая тактика при ГН включает базисную терапию, патогенетические и симптоматические средства. Базисная терапия - режим, диета, антибиотики, антигистаминные препараты, витамины. Режим - больным с отеками и АГ рекомендуется строгий постельный режим. При улучшении самочувствия и нормализации АД режим постепенно расширяют. Диета зависит от выраженности отеков, АГ и функционального состояния почек. Необходимо исключить приѐм поваренной соли на период отечного синдрома. При олигурии, нарушении функции почек рекомендуется диета без соли и мяса. Количество жидкости рассчитывается 2 прибавлением 0,3-0,5 л или 0,25 л/м к величине предшествующего диуреза. При ликвидации экстраренальных проявлений и значительном улучшении мочевого синдрома постепенно добавляют соль. Антибактериальная терапия назначают на 7-14 дней. Предпочтение отдается «защищенным» пенициллинам, макролидам, цефалоспоринам ІІ поколения. Симптоматическая терапия при ГН включает гипотензивные и мочегонные средства. Патогенетическая терапия является строго индивидуальной с учетом формы заболевания. Из патогенетических средств рекомендуются антикоагулянты, дезагреганты, кортикостероиды, цитостатики. Показания для назначения антикоагулянтов (низкомолекулярные гепарины) - при остром ГН с нефритическим синдромом наличие гиперкреатининемии, азотемии, протеинурии более 1 г/сут., при нефротическом синдроме – выраженная гипоальбуминемия (менее 20 г/л), гиперфибриногенемия (выше 6 г/л). Основой патогенетического лечения нефротического синдрома является иммуносупрессивная терапия - неселективные препараты (глюкокортикоиды, цитостатики), селективные иммунодепрессанты (циклоспорин А, мофетила микофенолат) в зависимости от морфологического варианта ГН. 11. Гломерулонефрит: прогноз В типичных случаях острый постстрептококковый ГН протекает циклически и у большинства (85-90 %) детей заканчивается выздоровлением. Через 1-2 нед. после начала заболевания исчезают макрогематурия и отѐчный синдром, через 2-4 нед нормализуется АД и восстанавливаются функции почек. Через 3-6 мес. от начала заболевания у подавляющего большинства больных отсутствуют протеинурия и гематурия. Через год гематурия сохраняется лишь у 2% детей, протеинурия - у 1%. У детей с ХГН прогноз зависит от клинической формы заболевания, морфологического варианта ГН, функционального состояния почек и эффективности патогенетической терапии. При ХГН с изолированной гематурией в виде мезангиопролиферативного ГН, или гормончувствительном варианте НС без нарушения функций почек прогноз благоприятный. Для хронического ГН с гормонрезистентным вариантом НС характерно прогрессирующее течение заболевания с развитием хроническорй почечной недостаточности в течение 5-10 лет более чем у половины больных. У больных с фокально-сегментраным гломерулосклерозом период от появления протеинурии до развития ХПН составляет 6-8 лет. Факторами, указывающими на неблагоприятный прогноз ГН, считают АГ, стойкую протеинурию, снижение функций почек, наличие гломерулярных полулуний, гломерулосклероза, тубулярной атрофии, интерстициального фиброза. 12. Хроническая болезнь почек: определение и стадии Хроническая болезнь почек (ХБП) - поражение почки от 3 мес. и более, определяемое как структурные или функциональные нарушения, со снижением СКФ или без, проявляющееся патологическими нарушениями или маркерами почечного повреждения, включая нарушения в составе крови или мочи, или отклонениями тестов СКФ менее 60 мл/мин/1.73 м2 в течение 3 месяцев и более с наличием повреждения почек или без. Таким образом, если у ребенка имеется поражение почек любой этиологии длительностью от 3 месяцев и более, имеются те функциональные либо структурные нарушения, то у нас есть основания поставить пациенту диагноз «хроническая болезнь почек». Надо подчеркнуть, что это надназологическое понятие, и оно применяется вне зависимости от основного заболевания почек. Существует несколько маркеров заболевания почек: изменения в анализах крови - повышение мочевины, креатинина, электролитные нарушения; снижение скорости клубочковой фильтрации; изменения в анализах мочи (микроальбуминурия, альбуминурия, протеинурия, гематурия, лейкоцитурия); изменение структуры почек при визуализирующих методах (УЗИ, рентгеновские, радиоизотопные). 13. Хроническая болезнь почек: этиология Причины ХБП: Аномалии развития мочевой системы Вторичные гломерулонефриты (СКВ, геморрагический васкулит, узелковый полиартериит) Хронический интерстициальный нефрит Хронический пиелонефрит Специфические заболевания почек (туберкулез) Нефропатии, связанные с нарушением обмена веществ (цистиноз, гиперкальциурия, амилоидоз) Первичный гломерулонефрит Сосудистые заболевания почек (стеноз, дисплазия сосудов) Тубулопатии Наследственный нефрит Факторы риска развития ХБП: Семейный анамнез, отягощенный по нефропатии Размеры и объем почек ниже возрастных Низкая масса тела при рождении, недоношенность Сахарный диабет Артериальная гипертензия 14. Хроническая болезнь почек: патогенез Теория «гиперфильтрации» В.М. Бреннера: снижение количества функционирующих нефронов повышение внутриклубочкового давления и СКФ ускоренное склерозирование и дальнейшее уменьшение количества сохранных клубочков Основные нарушения при ХБП Нарушение фильтрации и экскреции азотистых шлаков. Нарушение водно-электролитного баланса. Нарушение кислотно-основного равновесия. Расстройство метаболизма витамина Dфосфорно-кальциевого обмена. Снижение образования в почках эритропоэтина, простагландинов, кининов. 15. Хроническая болезнь почек: классификация Заболевание классифицируется на 5 стадий, которые различаются по тактике ведения больного и риску развития терминальной почечной недостаточности и сердечно-сосудистых осложнений. Стадия ХБП Стадия ХПН СКФ, мл/мин/1,73м2 Креатинин крови, ммоль/л Макс. отн. плотность мочи I – ≥90 ≤0,104 >1,018 II I (тубулярная) ≥90 ≤0,104 ≤1,018 III I (компенсированная) 89-60 0,105-0,176 <1,018 II субкомпенсированная 59-30 0,177-0,351 <1,018 IV III декомпенсированная 29-15 0,352-0,440 V IV <15 >0,440 терминальная или диализная 16. Скорость клубочковой фильтрации, определение Скорость клубочковой фильтрации (СКФ) - это показатель, который отражает массу действующих нефронов, и на его основании можно более точно определить функцию почек, чем только по уровню креатинина крови, потому что формула расчета СКФ учитывают не только креатинин крови, но вес, возраст, пол пациента. В педиатрии используют формулу Шварца. Модифицированная формула расчета СКФ (формула Шварца): СКФ (мл/мин/1,73 м2) = 0,0484*× рост в см креатинин крови в ммоль/л, *- для мальчиков старше 13 лет – 0,0616. 17. ХПН, клинические проявления Симптомы интоксикации: вялость, сонливость, утомляемость тошнота Симптомы изменения объема жидкости: никтурия обезвоживание на фоне полиурии отеки при олигурии или анурии перикардит, плеврит, асцит, отек мозга Нарушения сердечно-сосудистой системы: артериальная гипотензия при полиурии и гипертензия при олигурии перикардит гипертрофия левого желудочка, кардиомиопатия миокардит сердечно-сосудистая недостаточность Скелетные аномалии: боль в костях скелетные деформации ренальная остеодистрофия остеопороз Эндокринные нарушения: задержка роста и полового развития гиперпаратиреоз гипотиреоз уменьшение массы тела инсулинорезистентность Неврологические симптомы: заторможенность, астения психозы полинейропатия судороги, тремор снижение памяти, внимания ступор, кома Желудочно-кишечные расстройства: анорексия тошнота, рвота метеоризм гастрит, язва панкреатит колит стоматит Гематологические нарушения: анемия геморрагический синдром Иммунодефицитное состояние: частые и длительные инфекции септические осложнения склонность к новообразованиям гепатиты ВИЧ 18. ХПН: данные дополнительных методов обследования Лабораторные критерии ХПН Эритропоэтинжелезодефицитная анемия (реже белково-,витаминодефицитная) Повышение уровня креатинина, мочевины крови Снижение скорости клубочковой фильтрации Гипо- и изостенурия Гипокалиемия при полиурии и гиперкалиемия при олигурии Метаболический ацидоз Гиперфосфатемия, гипокальциемия Повышение уровня паратгормона Повышение уровня электролитов (Mg, Al) 19. ХБП: тактика ведения Лечение ХПН: ренопротекция и заместительная терапия Ренопротекция предусматривает проведение лечения, которое способствует более длительному сохранению функции почек и предотвращает прогрессирование основного патологического процесса в почечной ткани Заместительная терапия – “препарат” вместо утраченной функции почки (диализ, трансплантация почки). Ренопротекция: Ликвидация протеинурии (ингибиторы АПФ) Коррекция артериальной гипертензии Контроль азотистых шлаков и фосфора Ликвидация анемии 20. ХПН: терапия Терапия ХПН 1. 1. Гипоазотемическая терапия Кетокислоты Энтеросорбенты 2. Коррекция анемии Препараты эритропоэтина Препараты железа Вит. В12 3. Коррекция гиперпаратиреоза Препараты кальция Активные метаболиты витамина Д Фосфат-биндеры 4. Гипотензивная терапия Основные задачи диетотерапии: Снижение азотистого напряжения Обеспечение незаменимыми аминокислотами Компенсация энергетических затрат Уменьшение содержания белка в диете, благодаря его регулирующему влиянию на перфузию клубочков, позволяет снизить гиперфильтрацию и замедлить развитие ХПН. Кетокислоты и их влияние Это оксо-предшественники аминокислот, превращаются в аминокислоты при трансаминировании. Обладают регуляторными воздействиями на метаболизм белков Могут влиять на контроль аппетита Уменьшают гиперфильтрацию клубочков Обладают благоприятным воздействием на: - метаболизм холестерина и липидов - почечную остеодистрофию (ПТГ i, сывороточный Р i) 21. Показания для начала диализной терапии: Показания для начала диализа: креатинин крови ≥ 0,440 ммоль/л или СКФ < 15 мл/мин гиперкалиемия > 6,5 - 7,0 ммоль/л осложнения, опасные для жизни: - отек легких; - злокачественная артериальная гипертензия с признаками застойной недостаточности кровообращения; - уремический перикардит; - отек мозга; - декомпенсированный метаболический ацидоз.