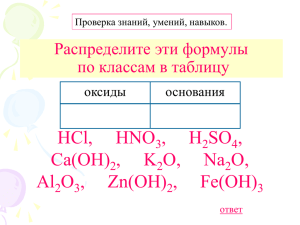
Справочная страница к уроку по теме «Кислоты» Общая формула кислот – Нm+R m–, где m – индекс при водороде, R – кислотный остаток, m– – заряд кислотного остатка (табл. 1). Таблица 1 Kлассификация кислот Признаки для классификации Группы кислот Примеры Наличие атомов кислорода в кислотном остатке 1. Бескислородные. HCl, HF, HBr, H2S. 2. Kислородные HNO2, H2SO4, H3PO4 Основность (число атомов водорода) 1. Одноосновные. 2. Двухосновные. 3. Трехосновные HNO3, HI. H2SO3, H2S. H3PO4 Степень электролитической диссоциации 1. Сильные ( > 30%). 2. Слабые ( < 3%) 1. Летучие. 2. Нелетучие HNO3, HCl, H2SO4. H2S, H2CO3 Летучесть HCl, H2S, HNO3. H2SO4, H2SiO3, H3PO4 Стабильность 1. Стабильные. HCl, H2SO4, H3PO4. 2. Нестабильные H2CO3, H2SO3 Растворимость в воде 1. Растворимые. HF, HNO2, H3PO4. 2. Нерастворимые H2SiO3 Номенклатура. Формулы кислот необходимо выучить наизусть, т.к. названия кислотных остатков пригодятся при изучении номенклатуры солей (табл. 2). Таблица 2 Формулы и названия кислот и кислотных остатков Формула Название Kислотный Название кислоты кислоты остаток кислотного остатка НNO2 Азотистая Нитрит Нитрат НNO3 Азотная H2SO3 Сернистая Сульфид Сульфит H2SO4 Серная Сульфат H2CO3 Угольная H2S Сероводородная S2– , Kарбонат, гидрокарбонат Фосфат, H3PO4 гидрофосфат, Фосфорная (Ортофосфорная) дигидрофосфат H2SiO3 HCl Силикат Kремниевая Хлороводородная (Соляная) Cl– Хлорид Важно знать некоторые принципы составления названий кислот. Название кислородной кислоты состоит из русского названия кислотообразующего элемента с добавлением одного из окончаний: ная, -овая, -евая (табл. 3). Таблица 3 Номенклатура кислот Окончание в названии кислоты Формулы и названия кислот в зависимости от номера группы в ПСХЭ и высшей степени окисления кислотообразующего элемента IIа, +3 IVа, +4 Vа, +5 VIа, +6 VIIа, +7 В, С, N, S, Сl, Н3ВО3 –борная кислота Н2СО3 – угольная кислота HNO3 – азотная кислота; H2SO4 – серная кислота HClO4 – хлорная кислота; Р, I, НРО3 – метафосфорная кислота, HIO4 – йодная кислота -ная -овая – Н3РО4 – ортофосфорная кислота As, Se, H3AsO4 – мышьяковая кислота H2SeO4 – селеновая кислота; – – Те, Н6ТеО6 – теллуровая кислота Si, -евая – H2SiO3 – метакремниевая кислота, – – – Н4SiO4 – ортокремниевая кислота Если неметалл образует ряд кислот, где степени окисления его различны, то в названиях кислот по мере убывания степени окисления используют суффиксы -н-, -оват-, -ист-, -оватист- с добавлением окончания -ая. Например: Названия кислот, в которых кислотообразующий элемент проявляет не высшую степень окисления, обычно содержат суффикс -ист-. Например: Номенклатура бескислородных кислот такова: к названию неметалла через соединительную гласную «о» прибавляется слово «водородная». Например: H2S – сероводородная кислота, HF – фтороводородная кислота. Многоосновные кислоты диссоциируют ступенчато. Например, молекула сернистой кислоты в первую очередь отщепляет один ион водорода: Отщепление второго иона водорода проходит по уравнению: Суммарное уравнение: При электролитической диссоциации молекулы кислоты НХ к полярным концам этой молекулы притягиваются молекулы воды: H2O•••HX•••H2O. Это первая стадия процесса диссоциации – гидратация. При расщеплении связей Н–Х образуются не свободные ионы водорода, а их гидраты – ионы гидроксония Н3О+. Например, при растворении в воде хлороводорода происходит химическая реакция, которую можно выразить уравнением: H2O + HCl = H3O+ + Cl–.